鸡血藤总黄酮对急性缺血性脑卒中大鼠肠道屏障功能、氧化应激及ERK基因表达与DNA甲基化的影响
2023-02-10马敏儿黄浩华吴丽霞罗珲
马敏儿, 黄浩华, 吴丽霞, 罗珲
(深圳市龙华区中心医院,广东深圳 518110)
急性缺血性脑卒中(acute ischemic stroke)是临床最为常见的脑类疾病,发病率和死亡率均较高,一直是研究的热点。脑卒中归属于中医学“中风病”范畴,痰瘀交阻,气机升降逆乱是其主要病机。中医药及其有效活性成分对脑血管疾病的防治具有广泛的应用前景。鸡血藤,为豆科植物密花豆Spatholobus suberectusDunn的干燥藤茎,味苦、甘,性温,归肝、肾经,具有活血补血、调经止痛、舒筋活络的功效,用于治疗月经不调、痛经、经闭、风湿痹痛、麻木瘫痪、血虚萎黄等病证。鸡血藤总黄酮是鸡血藤的重要活性成分之一,具有抗肿瘤、抗氧化、抗肠道病毒、保护心脑神经功能等作用[1-5]。既往研究[6]表明,鸡血藤总黄酮对大鼠实验性脑缺血具有一定的保护作用。因此,本研究以大脑中动脉闭塞(middle cerebral artery occlusion,MCAO)模型大鼠为研究对象,进一步观察鸡血藤总黄酮保护脑功能的作用及其机制,旨在为其临床治疗脑卒中提供应用基础,现将研究结果报道如下。
1 材料与方法
1.1 实验动物 65只SFP级SD大鼠,雌雄各半,4~6月龄,体质量150~210 g,购自济南朋悦实验动物繁育有限公司,动物生产许可证号:SCXK(鲁)20140012。所有操作严格按照实验动物伦理委员会动物管理指南批准执行。
1.2 药物、试剂与仪器 鸡血藤总黄酮(成都科程生物科技开发有限公司,批号:603305101);阿司匹林肠溶片(杭州赛诺菲医药有限公司,批号:8A433)。苏木素-伊红(HE)染色液(北京雷根生物技术有限公司,批号:1009A19);丙二醛(MDA)、超氧化物歧化酶(SOD)检测试剂盒(上海金穗生物科技有限公司);二胺氧化酶(DAO)酶联免疫吸附分析(ELISA)试剂盒、D-乳酸ELISA试剂盒(南京建成科技有限公司);反转录试剂盒和实时聚合酶链反应(PCR)试剂盒(南京诺唯赞生物科技股份有限公司)。ASP300型封闭式全自动组织脱水机、EG1140型分体式组织包埋机、RM2145型半自动轮转式切片机(德国徕卡微系统股份公司)。
1.3 模型建立 按照文献方法[7]采用Zea Longa线栓法加以改进制作大脑中动脉闭塞(MCAO)模型。方法:以10%戊巴比妥钠35 mg/kg腹腔注射麻醉大鼠后,切开颈中央分离颈动脉,将颈总动脉打结,在颈外动脉离心端1 cm处结扎颈外动脉、夹闭颈内动脉;颈外动脉行小型切口,把线栓插入后将颈外动脉阻断,线栓沿颈内动脉至颅方向进入,距颈总动脉分叉处约20 mm遇到阻力时暂停插入。阻断2 h后把线栓取出,打开颈总动脉结,使动脉贯通。待大鼠苏醒后提起大鼠尾巴,若大鼠左前肢屈曲、前行时向左侧划圈,则表示急性缺血性脑卒中模型成功建立。结果不符合建模标准的有3只大鼠,因感染死亡2只,剩余50只大鼠均建模成功。
1.4 分组与给药 按照随机数字表将60只大鼠分为正常组,模型组,中药低、中、高剂量组和阿司匹林组,每组10只。除正常组,其余各组大鼠构建MCAO模型。造模成功后,进行给药。大鼠给药剂量按成人与大鼠体表面积换算法[7]计算,设为中剂量。中药低、中、高剂量组分别给予鸡血藤总黄酮100、200、400 mg·kg-1·d-1灌胃,阿司匹林组给予阿司匹林100 mg·kg-1·d-1灌胃,正常组与模型组给予等体积生理盐水灌胃,给药体积均为0.01 mL·g-1。连续给药4周。
1.5 观察指标与方法
1.5.1 大鼠行为学检测[8-9]①悬尾实验(TST):末次给药1 h后,将单个大鼠尾端(在距尾尖部约2 cm处)采用医用胶布粘于悬尾箱(30 cm×30 cm×25 cm)上部支架上,使成倒挂状态,头部离箱底约5 cm。悬挂时间为6 min,记录后4 min内累计不动时间(不动状态即大鼠停止挣扎不动或无任何活动)。②强迫游泳实验(FST):将大鼠放入高20 cm、直径15 cm的玻璃箱内,放入约10 cm常温水,待大鼠入水后计时6 min,记录后4 min内大鼠在水中停止挣扎、呈漂浮状态或仅微肢体运动以保持头部浮于水面不动的时间。③旷野实验:将大鼠置于直径40 cm的圆形板内30 s,记录其在圈内停留时间。
1.5.2 ELISA法检测血清二胺氧化酶(DAO)、D-乳酸水平 经尾静脉取血,于4℃以3 000 r/min离心(离心半径10 cm)15 min,取上清。采用ELISA法检测血清中DAO、D-乳酸水平,操作步骤严格按照试剂盒说明书进行。
1.5.3 黄嘌呤氧化酶法检测血清超氧化物歧化酶(SOD)、硫代巴比妥酸法检测丙二醛(MDA)水平 取血清,按照试剂盒说明书,应用酶标仪于波长500 nm处检测光密度(OD)值,绘制曲线,计算SOD、MDA值。
1.5.4 HE染色法观察海马组织病理学变化 将大鼠处死后取海马组织,4%多聚甲醛溶液固定后石蜡包埋,制成5μm切片。二甲苯Ⅰ、Ⅱ脱蜡各10 min,梯度乙醇脱水各5 min,苏木素染色5 min,75%盐酸乙醇分化,自来水冲洗返蓝,伊红染色2 min,自来水冲洗,梯度乙醇脱水各30 s,二甲苯透明1 min,晾干,中性树脂封片,显微镜下观察。
1.5.5 实时聚合酶链反应(PCR)法检测大鼠海马组织ERK mRNA表达 采用TRIzol提取总RNA,采用分光光度计(Thermo Scientific NanoDrop 2000)测定RNA含量、纯度及浓度,应用2%琼脂糖凝胶分析总RNA完整性,用Bio-Rad iScriptTMcDNA Synthesis Kit试剂盒将RNA反转录成活性稳定的cDNA,采用TaKaRa宝生物工程有限公司设计合成的PCR引物进行PCR的扩增,反应结束后绘制PCR扩增后ERK和β-actin的标准曲线和确定PCR的特异性。最后采用2-△△CT(Livak)方法计算ERK mRNA相对表达量,由Bio-Rad CFX Manager system软件自动分析。ERK上游引物序列为5’-AGAGA AGAATGGTTGGCAGCA-3’,下游引物序列为5’-TTGGGTAGATGGTAAGGTAGAGA-3’,扩增片段长度为171 bp;β-actin上游引物序列为5’-CGCTACC AATAACGCTTGCAAA-3’,下游引物序列为5’-TAGGCCAGGGGATCCAGTAA-3’,扩增片段长度为99 bp。
1.5.6 采用Sequenom Mass Array飞行时间质谱法检测海马细胞外信号调节激酶(ERK)DNA甲基化水平 ERK基因序列号:NM00104356。提取大鼠海马组织ERK总DNA,-20℃保存。应用CpG Island Searcher软件判断ERK基因全序列,设计引物,ERK上游引物序列为5’-AGGAAGAGAGGTT ATAGGTAGGGGGTATAGGATGA-3’,下游引物序列为5’-CACTTAACCCAGTAATACTACTCTTTAAG ATCAAAACTCAACCCGGGAATTCT-3’,扩增片段长度为1 509 bp;β-actin上游引物序列为5’-CGT AAAGACCTCTATGCCAACA-3’,下游引物序列为5’-TAGGAGCCAGGGCAGTAATC-3’,扩增片段长度为92 bp。用Sequenom Mass Array飞行质谱甲基化检测平台软件获取数据。
1.6 统计方法 采用GraphPad Prism 8.0统计软件进行数据分析,计量资料以均数±标准差(±s)表示,符合方差齐及正态分布,多组间比较采用单因素方差分析,进一步两两比较采用SNK-q检测。以P<0.05为差异有统计学意义。
2 结果
2.1 各组大鼠行为学比较 表1结果显示:与正常组比较,模型组大鼠TST不动时间缩短,FST不动时间和圈内保留时间延长(P<0.05);与模型组比较,中药中、高剂量组及阿司匹林组大鼠TST不动时间延长、FST不动时间和圈内保留时间缩短(P<0.05);中药高剂量组各指标与阿司匹林组比较,差异均无统计学意义(P>0.05)。
表1 各组大鼠行为学比较Table 1 Comparison of the behaviors among various groups of rats (±s,s)

表1 各组大鼠行为学比较Table 1 Comparison of the behaviors among various groups of rats (±s,s)
注:①P<0.05,与正常组比较;②P<0.05,与模型组比较;③P<0.05,与阿司匹林组比较
组别正常组模型组中药低剂量组中药中剂量组中药高剂量组阿司匹林组F值P值鼠数/只10 10 10 10 10 10 TST不动时间/s 126.12±38.59 76.79±16.67①78.12±17.03①③87.85±23.56①②③102.67±29.78①②100.84±28.65①②3.711<0.001 FST不动时间/s 7.56±0.96 15.92±1.85①15.23±1.79①③12.63±1.50①②③9.58±1.19①②9.62±1.21①②12.680<0.001圈内保留时间/s 12.56±2.23 27.57±5.96①26.79±5.88①③21.58±4.67①②③17.74±2.96①②18.12±3.02①②7.454<0.001
2.2 各组大鼠血清中DAO、D-乳酸含量比较 表2结果显示:与正常组比较,模型组大鼠血清中DAO、D-乳酸含量较高(P<0.05);与模型组比较,中药中、高剂量组血清中DAO、D-乳酸含量降低(P<0.05),而阿司匹林组DAO、D-乳酸含量无显著性差异(P>0.05);与阿司匹林组比较,中药中、高剂量组血清中DAO、D-乳酸含量显著降低(P<0.05)。
表2 各组大鼠血清中二胺氧化酶(DAO)、D-乳酸含量比较Table 2 Comparison of serum levels of diamine oxidase(DAO)and D-lactate among various groups of rats (±s)

表2 各组大鼠血清中二胺氧化酶(DAO)、D-乳酸含量比较Table 2 Comparison of serum levels of diamine oxidase(DAO)and D-lactate among various groups of rats (±s)
注:①P<0.05,与正常组比较;②P<0.05,与模型组比较;③P<0.05,与阿司匹林组比较
组别正常组模型组中药低剂量组中药中剂量组中药高剂量组阿司匹林组F值P值鼠数/只10 10 10 10 10 10 DAO/(U·L-1)16.12±2.33 27.79±3.75①26.16±3.68①21.85±3.30①②③18.78±2.69①②③25.85±3.72①8.359<0.001 D-乳酸/(mg·L-1)7.11±0.75 15.92±1.85①15.76±1.79①12.85±1.25①②③9.87±0.98①②③15.79±1.80①13.960<0.001
2.3 各组大鼠海马组织病理学变化比较 图1结果显示:正常组大鼠脑皮质区域的神经细胞良好且胞体形态规则,排列稳定有序,神经细胞、胶质细胞及毛细血管与周围脑间质空间无扩增现象;模型组与中药低剂量组梗死灶皮质细胞排列紊乱,核固缩、核变形显著,血管及神经细胞与周围脑间质的间隔空隙较大;中药中剂量组皮质区仍可见神经细胞变性肿胀现象,仍有少量细胞萎缩和坏死现象;中药高剂量组与阿司匹林组梗死灶皮质细胞排列趋于整齐,周围脑间质空间缩小,核固缩和核变形显著改善,神经元结构趋于完整。

图1 各组大鼠海马组织病理学变化比较(HE染色,×400)Figure 1 Comparison of histopathological changes in the hippocampus tissue among various groups of rats(HE staining,×400)
2.4 各组大鼠海马组织中SOD、MDA水平比较表3结果显示:与正常组比较,模型组大鼠海马组织中SOD水平降低、MDA水平升高(P<0.05);与模型组比较,中药中、高剂量组及阿司匹林组大鼠海马组织中SOD水平升高、MDA水平降低(P<0.05);中药高剂量组各指标与阿司匹林组比较,差异均无统计学意义(P>0.05)。
表3 各组大鼠海马组织中SOD、MDA水平比较Table 3 Comparison of SOD and MDA levels among various groups of rats (±s,μmol·L-1)
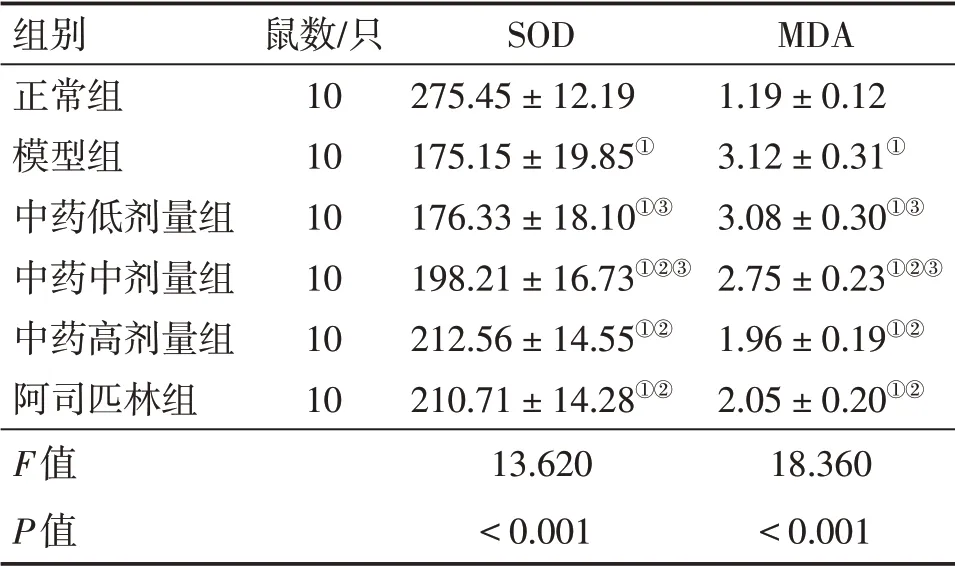
表3 各组大鼠海马组织中SOD、MDA水平比较Table 3 Comparison of SOD and MDA levels among various groups of rats (±s,μmol·L-1)
注:①P<0.05,与正常组比较;②P<0.05,与模型组比较;③P<0.05,与阿司匹林组比较
组别正常组模型组中药低剂量组中药中剂量组中药高剂量组阿司匹林组F值P值鼠数/只10 10 10 10 10 10 SOD 275.45±12.19 175.15±19.85①176.33±18.10①③198.21±16.73①②③212.56±14.55①②210.71±14.28①②13.620<0.001 MDA 1.19±0.12 3.12±0.31①3.08±0.30①③2.75±0.23①②③1.96±0.19①②2.05±0.20①②18.360<0.001
2.5 各组大鼠海马组织ERK mRNA表达及ERK DNA甲基化水平比较 表4结果显示:与正常组比较,模型组大鼠海马组织中ERK mRNA表达水平降低、ERK DNA甲基化水平升高(P<0.05);与模型组比较,中药中、高剂量组及阿司匹林组大鼠海马组织中ERK mRNA表达水平升高、ERK DNA甲基化水平降低(P<0.05);中药高剂量组各指标与阿司匹林组比较,差异均无统计学意义(P>0.05)。
3 讨论
脑卒中时可引起大脑皮质和纹状体梗死,造成皮质额顶部、感觉运动区及四肢远端运动协调功能、精细运动功能等产生障碍,而TST不动时间、FST不动时间和圈内保留时间等可在一定条件下反映脑损伤的程度[10-11]。本研究结果显示,中药组大鼠TST不动时间较模型组延长、FST不动时间和圈内保留时间较模型组缩短,并明显改善海马组织病理损伤,与阿司匹林组效果相当,表明脑卒中后由于运动神经元受损导致其对运动神经的掌控能力减退,伴随出现行为功能障碍、运动功能损伤,而鸡血藤总黄酮干预可有效改善急性缺血性脑卒中大鼠行为学症状,修复脑损伤,值得深入研究。
脑卒中患者肠道内致病细菌量升高,且肠道由于缺血缺氧可使炎症因子过度生成、菌群失调、肠动力及免疫障碍发生进而导致肠道屏障功能损伤[12]。肠道屏障功能与脑卒中预后密切相关[13]。DAO和D-乳酸作为肠道关键因子可在一定程度上反映出肠道屏障状态[14-15]。相关研究表明,改善脑卒中大鼠的肠吸收及肠内营养对修复肠黏膜屏障、恢复受损神经功能、增强机体免疫具有重要的意义[16]。本研究结果显示,中药组血清中DAO、D-乳酸含量较模型组明显下降,表明鸡血藤总黄酮可促进急性缺血性脑卒中大鼠肠黏膜损伤的恢复,提高肠道免疫机制,有维持肠道内环境的作用。其中,中药高剂量组降低效果显著优于阿司匹林组。考虑其原因可能是阿司匹林可直接刺激其胃肠功能,虽见效快但胃肠道副作用明显,相比之下鸡血藤总黄酮胃肠道副作用较小。
脑卒中发生时,由于脑部血供障碍导致体内自由基失衡,同时自由基的防御系统SOD酶活性的下降、氧化产物MDA的增加导致神经元膜以及相关微血管被攻击,进而引起脂质过氧化损伤并破坏血脑屏障,最终引起神经元损坏促进疾病进程[17]。本研究结果显示,中药组大鼠海马组织中SOD活性较模型组升高,MDA水平较模型组显著降低,中药高剂量组与阿司匹林组治疗效果相当。表明鸡血藤总黄酮可减轻急性缺血性脑卒中大鼠氧化应激反应,起到脑保护的作用。
表4各组大鼠海马组织ERK mRNA表达及ERK DNA甲基化水平比较Table 4 Comparison of mRNA expression of ERK and DNA methylation level of ERK in hippocampal tissue among various groups of rats (±s)

表4各组大鼠海马组织ERK mRNA表达及ERK DNA甲基化水平比较Table 4 Comparison of mRNA expression of ERK and DNA methylation level of ERK in hippocampal tissue among various groups of rats (±s)
注:①P<0.05,与正常组比较;②P<0.05,与模型组比较;③P<0.05,与阿司匹林组比较
组别正常组模型组中药低剂量组中药中剂量组中药高剂量组阿司匹林组F值P值鼠数/只10 10 10 10 10 10 ERK mRNA相对表达量1.95±0.19 0.15±0.02①0.17±0.03①③0.64±0.08①②③1.21±0.12①②1.15±0.10①②29.790<0.001 ERK DNA甲基化水平1.19±0.15 3.34±0.36①3.29±0.33①③2.49±0.28①②③1.85±0.21①②1.93±0.22①②17.430<0.001
ERK通路涉及中枢神经系统的发育以及神经细胞的增殖、生存、分化过程,该通路的激活对脑缺血损伤修复具有重要的作用[18-21]。缺血性损伤后DNA甲基化增加,引起大量基因的转录抑制,导致脑损伤增加[22],DNA甲基化抑制药物已经被证实可以改善大鼠缺血模型的神经学结果[23]。本研究结果显示,与模型组比较,中药高剂量组大鼠海马组织中ERK mRNA表达水平升高、ERK甲基化水平降低,并与阿司匹林组治疗效果相当。结果表明,鸡血藤总黄酮可促进急性缺血性脑卒中大鼠海马组织ERK mRNA表达、抑制ERK DNA甲基化,从而起到脑保护作用。
综上所述,鸡血藤总黄酮可改善急性缺血性脑卒中大鼠症状、修复脑损伤,其机制可能与调节肠道屏障功能、减轻海马组织氧化应激及促进海马组织ERK mRNA表达、抑制ERK甲基化DNA甲基化水平有关。
