基于高通量测序的连续传代富集土壤可培养菌菌群变化规律研究
2023-02-10文昌丽曹伟伟唐雪莲赵雯淑贾仲君
文昌丽,曹伟伟,唐雪莲,赵雯淑,贾仲君①,孟 磊②
(1.海南大学热带作物学院,海南 海口 570228;2.中国科学院南京土壤研究所土壤与农业可持续发展国家重点实验室,江苏 南京 210008;3.中国科学院大学,北京 100049)
经典的平板培养技术是微生物研究的里程碑,但由于理论和技术发展的滞后,上百年来其具体操作却更多处于一种定性描述过程,缺乏定量评估,特别是在连续传代富集培养并分离特定功能微生物的过程中,微生物多样性的演变规律鲜有报道。例如,牛肉膏蛋白胨固体培养基培养分离细菌的主要策略,包括将土壤悬液均匀涂在固体培养基上之后观测菌落的数量和形态特征,挑选平板上边界清晰的群落连续传代富集培养,直至获得纯菌株,进而通过测定菌落的生理生化指标,研究微生物的多样性组成和生态功能[1]。然而,这一经典的研究方法具有一定的内在局限性。首先,据估算,每克土壤中微生物数量高达10亿,这些海量微生物具有迥然不同的生理代谢特性,其底物偏好性、生长速率、平均代时和环境适应能力各不相同[2],很难通过统一的标准方法同时获得所有微生物,导致在传代富集培养过程中遗漏了相当一部分,甚至是大多数微生物。其次,培养基的营养组成影响可培养菌落生长[3]。最后,传统固体培养基富集分离过程依赖于单个菌落的挑选和传代纯化。然而,如前所述,这些单个菌落的筛选具有极大的随机性,一些肉眼不可见的菌落极可能被遗漏,很难实现特定生态功能菌群的培养分离,如植物促生菌和病原微生物拮抗菌[4],特别是在数量上占弱势的一部分功能菌群。因此,固体和液体培养基在连续传代富集培养过程中,因传代次数、培养时间及培养基组分的影响极可能导致特定类群的偏好性生长,进而遗漏一些在环境中发挥重要功能的微生物,因而无法全面准确评估土壤环境中微生物群落组成全貌。所以,研究固体和液体可培养菌多样性变化规律不具有现实操作性。
在固体和液体培养基富集分离过程中,微生物的营养获取和氧气利用具有极大差异,在可培养菌连续传代培养过程中可能产生显著差异。固体培养基表层的细胞菌落需要通过下层细胞或细胞间隙获取营养,而液体培养基从上到下逐渐形成缺氧环境,可能限制细胞生长。已有研究表明,一定时间内的微生物连续传代培养过程中,固体和液体培养基中的优势菌和稀有菌的比例保持相对稳定,但随着代际的增加,丰度低的稀有菌被易生长的优势菌所淘汰[5]。据此,一定时间内优势菌和稀有菌可能会共存,但随着时间的增加和由于营养资源短缺等因素,稀有菌在竞争资源方面的能力较弱,可能会逐渐消失,继而导致整个可培养微生物区系被优势菌所主导。高通量测序技术的快速发展,则为系统评价连续传代过程中土壤可培养菌群变化规律提供重要技术支撑[6]。20世纪90年代,Carl Woese提出的核糖体16S rRNA 基因分类系统逐渐得到学术界的广泛认可,从根本上改变了冗繁的传统微生物生理和形态分类鉴定策略[7]。比如对于土壤中所有微生物的基因组DNA,直接测定其中的16S rRNA 基因序列并将其与已知纯菌株的16S rRNA序列进行系统发育同源性分析,根据基因序列相似度即可推断环境中栖息的微生物系统发育分类地位。近年来,高通量测序技术呈爆发式增长态势,已经成为一种常规实验技术。因此,在固体和液体培养基连续传代富集过程中,通过收集固体平板或液体培养基中所有菌落并提取DNA,即可利用16S rRNA基因高通量测序技术研究不同代际的微生物多样性,明确传统培养分离过程中可能遗漏的微生物类群。
微生物是地球环境中最大的分解者,也是维系陆地生态系统地上-地下相互作用的纽带。水稻是亚洲主要的粮食作物,我国水稻种植历史悠久,但高强度氮肥施用引发土壤养分及微生物群落结构失衡[8],进而改变微生物群落功能并导致土壤生态系统退化[9]。研究表明:由低营养培养基可能获得更多数量和种类的可培养微生物,且可显著提高土壤环境中变形杆菌、放线菌和嗜酸性菌的可培养性[10-11]。但是,与本底土壤微生物多样性相比,连续传代富集过程中,不同营养基可能用于选择特定的微生物类群,特别是有关第一代富集的微生物菌落,但在传代过程中随机出现或者是稳定连续生长方面的报道,似乎尚鲜见。据此,选择牛肉膏蛋白胨培养基对水稻土微生物进行连续传代富集培养,通过设置固体/液体培养状态,并对每种培养基设置常规营养和1/10营养处理获得可培养菌群,然后直接提取土壤DNA和不同传代过程的可培养菌群DNA,研究连续传代富集培养过程中可培养微生物群落的变化规律,定量评估可培养优势菌和稀有菌占水稻土本底微生物的比例,为优化传统可培养技术并深入挖掘微生物资源提供依据。
1 材料与方法
1.1 供试水稻土
典型水稻土样品采自海南白沙黎族自治县革新村附近(19°06′35″ N,109°42′52″ E)。该地区水稻土发育于砂页岩。土壤理化性质:pH为5.44,w(NH4+-N)为17.3 mg·kg-1,w(NO3--N)为7.82 mg·kg-1,w(全氮)为1.46 g·kg-1,w(全碳)为13.2 g·kg-1,土壤碳氮比为9.04。采集0~20 cm土壤后,去除可见根系和碎石,磨碎、过2 mm孔径筛后置于4 ℃冰箱中保存。
1.2 培养基配制
常规蛋白胨培养基:牛肉膏3 g,蛋白胨10 g,氯化钠5 g,用去离子无菌水定容至1 000 mL容量瓶中,配制1 000 mL溶液得到常规营养液体(以下简称NB)培养基。常规营养固体(以下简称NA)培养基额外添加15 g·L-1琼脂,利用氢氧化钠溶液调节pH为7.4~7.6。将培养基配制完成后用高压灭菌锅在121 ℃、20 min条件下高温灭菌。同时,设置减量的牛肉膏蛋白胨培养基,即常规蛋白胨量的1/10培养基(以下简称1/10 NA或1/10 NB):牛肉膏3 g,蛋白胨1 g,氯化钠5 g。其他操作同上。
1.3 试验方法
称取土壤样品1 g,悬于90 mL无菌水中后,以200 r·min-1转速振荡0.5 h制成土壤悬液作为接种液,吸取100 μL土壤悬液并均匀涂布于固体培养基表面,将平板倒置于28 ℃培养箱中培养3 d后,将平板正置并利用10 mL无菌水反复冲洗培养基表面菌群,获得菌悬液并保存于50 mL无菌离心管中制成第1代富集菌液;进一步吸取100 μL第1代富集液作为接种液,采用相同方法获得第2代富集菌液;随后,每1代均以100 μL菌液传代,共计获得10代富集菌液。所有培养操作步骤均为无菌操作并设置3次生物学重复。
液体培养:吸取100 μL土壤悬液接种至装有100 mL液体培养基的250 mL三角瓶中培养,置于28 ℃培养箱中,静置培养3 d后摇匀收集得到第一代菌液,将100 mL第1代富集菌液离心(4 000 r·min-1,8 min)后,弃上清,加入10 mL无菌水,振荡混匀后浓缩为10 mL富集菌液后取1 mL提取DNA。同时,吸取100 μL富集菌液接种至新100 mL液体培养基中,传代培养3 d后,采用相同方法浓缩为10 mL第2代富集菌液,随后,每1代均以100 μL菌液传代,共计获得10代富集菌液。取1 mL提取DNA并保存于-20 ℃条件下。针对固体和液体培养基第1、3、5、7、10代富集物,分别取1 mL富集菌液用于提取DNA并保存于-20 ℃条件下。
1.4 水稻土微生物总DNA和可培养菌总DNA提取
土壤DNA提取采用FastDNA Spin Kit for Soil(MP Bio)试剂盒,称取0.5 g土壤样品置于2.0 mL离心管中,加入磷酸钠缓冲溶液(SPB)和MT缓冲液后,利用Fast Prep 核酸提取仪以6.0 m·s-1振荡45 s,14 000 r·min-1条件下离心15 min后,转移上清液至新的2.0 mL离心管中,采用沉淀蛋白溶液 (PPS),通过Binding Matrix 结合 DNA,利用盐乙醇(SEWS-M)洗涤过滤后,将DNA溶解于50 μL DNA洗脱液超纯水(DES)缓冲液中。利用微量紫外分光光度计(NanoDrop ND-1000)测定DNA质量和浓度,水稻土总DNA质量浓度为45.6~58.4 ng·μL-1,纯度A260/280约为1.54~1.58,A260/230约为1.48~1.94。此外,利用12 g·L-1琼脂糖凝胶电泳检测DNA完整性。
可培养微生物总DNA提取,取第1、3、5、7、10代的10 mL富集菌液,采用Omega公司E.Z.N.A.© Bacterial DNA Kit 试剂盒提取DNA。将1.0 mL富集菌液按4 000 r·min-1离心 10 min,吸除上清液,加入100 μL乙二胺四乙酸缓冲液(TE)重悬,利用 Lysozyme、Proteinase K Solution 和 RNase A裂解细胞,去除蛋白质和RNA,用100% DNA Wash Buffer洗涤过滤后,加入50 μL Elution Buffer,过滤收集DNA。如前所述,利用微量紫外分光光度计测定DNA质量和浓度。DNA 质量浓度为 73.4~86.9 ng·μL-1,纯度A260/280为1.78~1.89,A260/230为1.58~1.96。
1.5 微生物数量的实时荧光定量PCR分析
采用Bio-Rad CFX96 实时荧光定量PCR仪,针对水稻土微生物总DNA、固体和液体可培养微生物DNA(第1、3、5、7、10代),定量分析其中16S rRNA基因拷贝数,研究水稻土本底土著微生物数量和可培养微生物数量。采用515F/907R通用引物[12],PCR聚合酶链式反应体系:10 μL SYBR Premix Ex Taq(Takara),正反向引物各0.5 μL,DNA模板1 μL,8 μL DNase/RNase-free H2O。PCR扩增程序:95 ℃ 10 min,94 ℃ 1 min,55 ℃ 30 s,72 ℃ 1 min,39个循环。标准曲线制作:计算含有16S rRNA目标基因片段质粒的物质的量,然后依次稀释7个浓度梯度,以初始模板DNA拷贝数(C)对数为纵坐标,以Ct值为横坐标,获得标准曲线:lgC=-0.293Ct+11.8(R2=0.994)。根据待测样品Ct值,利用标准曲线推测16S rRNA基因拷贝数。
1.6 高通量测序及序列分析
对于土壤和牛肉膏蛋白胨固体培养基(NA,1/10 NA)、液体培养基(NB,1/10 NB)第1、3、5、7、10代富集菌液DNA进行高通量测序,每个处理3个重复共63个样品。利用北京诺禾致源科技股份有限公司的Illumina NovaSeq平台进行测序分析。采用QIIME (quantitative insights into microbial ecology,version 1.9.1)软件进行序列分析。首先,开展高通量原始测序数据的质量控制和样本拆分,并采用usearch软件去除嵌合体,并以97%的一致性(identity)将序列聚类为操作分类单元(operational taxonomic units,OTUs)。其中,测得水稻土本底土著微生物高质量16S rRNA序列共计92 975条,利用固体培养基得到104 301条高质量序列,其中,常规营养NA处理高质量序列104 066条,1/10 NA处理104 536条;利用液体培养基得到高质量16S rRNA基因序列共计95 261条,其中,常规营养NB处理96 347条,1/10 NB处理94 175条。
最后,通过与Greengenes的16S rRNA基因数据库比对,分别在微生物门、纲、目、科、属水平获得物种分类信息及相对丰度。OTUs聚类基础数据用于Alpha多样性指数Chao1指数和Simpson指数计算以及主成分PCA聚类分析。
1.7 水稻土可培养微生物的比例及富集率计算
水稻土可培养微生物比例由固体或液体培养基中富集物物种数量除以土壤中所有微生物物种数量得到。水稻土本底所有微生物物种数量统计基于16S rRNA分类,包括微生物门、纲、目、科、属水平的物种分类信息。可培养微生物物种数量是固、液体培养基富集物第1、3、5、7、10代所有菌落富集的物种分类信息。
可培养微生物富集率计算方法:首先,获得土壤DNA中所有细菌属的相对丰度;其次,获得固体和液体培养基富集物菌落DNA中所有细菌属的相对丰度;用后者除以前者,即可计算得到特定细菌在培养基中的富集率。富集率>1表示该菌属在培养中得到富集。
1.8 数据分析与制图
利用IBM SPSS statistics 23对水稻土可培养菌数量在不同代际的基因拷贝数进行单因素方差分析(one-way ANOVA)。采用Origin 2021制作柱状图和箱线图,采用Raphpad prism 8制作火山图并完成差异分析。
2 结果与分析
2.1 水稻土本底及连续传代过程中可培养微生物数量变化规律
培养基营养状况和连续培养代数均可能对可培养细菌数量产生显著影响。图1显示,可培养细菌数量显著高于背景土壤中微生物数量。实时荧光定量PCR分析表明,水稻土本底土壤(以干重计)微生物拷贝数为1.53×1010copies·g-1,而固体和液体连续培养10代过程中,可培养菌数量范围为1.86×1010~26.70×1010copies·mL-1。常规营养NA培养基中微生物16S rRNA基因拷贝数是1/10 NA营养处理的1.17~1.56倍,而常规营养NB培养基处理则是1/10 NB营养处理的1.20~1.58倍(图1)。

1st、3rd、5th、7th和10th分别指第1、3、5、7和10代富集液;固体牛肉膏蛋白胨简称NA(常规蛋白胨简称NA,1/10常规蛋白胨简称1/10 NA);液体牛肉膏蛋白胨简称NB(常规蛋白胨简称NB,1/10常规蛋白胨简称1/10 NB)。(b)和(c)分图中同一组直方柱上方英文小写字母不同表示代际间基因拷贝数差异显著(P<0.05)。所有处理均设置3个生物学重复。
连续传代富集过程中,液体培养基比固体培养基更容易促进微生物生长。例如,常规营养NA培养基中可培养细菌连续传代10次的16S rRNA基因数量变化范围为2.90×1010~3.86×1010copies·mL-1〔图1(b)〕,而常规营养NB液体培养基中约为8.99×1010~26.70×1010copies·mL-1〔图1(c)〕。将牛肉膏蛋白胨量降低为1/10后,固体和液体培养基中可培养菌数量差异更加明显,前者为1.86×1010~3.30×1010copies·mL-1,后者显著增加为7.50×1010~16.90×1010copies·mL-1。值得注意的是,在常规营养NB营养基传代富集过程中,第7和10代细菌数量较高,分别为2.67×1011和2.31×1011copies·mL-1,均显著高于第1、3、5代。但1/10 NB培养下则未观测到类似现象。
2.2 水稻土本底及连续传代过程中可培养微生物多样性变化规律
水稻土细菌群落的Alpha多样性采用Chao指数和Simpson指数表征。基于物种OTUs水平的分析结果表明,水稻土背景土壤细菌多样性指数显著高于固体和液体可培养菌;传代培养10次过程中,常规营养条件下固体和液体可培养菌多样性指数均表现出一致性的规律,即呈先增加后减少;然而,低营养条件下可培养菌多样性指数则表现出不一致的规律,1/10 NA培养基表现出逐渐增加趋势并在第10代多样性指数最高,但1/10 NB可培养菌多样性整体规律则呈现先增加后减少趋势。
水稻土背景土壤Chao指数为4 806,连续传代培养10次过程中,常规营养NA和低营养1/10 NA处理可培养菌Chao指数平均值分别为62.1和90.9,后者是前者的 1.5倍〔图2(a)〕。常规营养NA可培养菌第1代Chao指数为49.7,最低值为49.7,最高值为77.3,平均值为62.1;低营养1/10 NA 可培养菌第1代Chao指数为75.1,最低值为75.1,最高值为117.7,平均值为90.9。类似地,常规营养NB和低营养1/10 NB连续传代10次过程中,可培养菌Chao指数平均值分别为767.0和774.0,后者是前者的 1.0倍〔图2(b)〕。常规营养NB可培养菌第1代Chao指数为142.0,最低值为136.7,最高值为1 502.7,平均值为767.0;低营养1/10 NB可培养菌第1代Chao指数为531.0,最低值为468.9,最高值为1 279.6,平均值为774.0。

(a)水稻土本底土著微生物及氮素胁迫下固体培养基连续传代培养10代过程中可培养菌Chao指数;(b)氮素胁迫下液体培养基连续传代培养10代过程中可培养菌Chao指数;(c)水稻土本底土著微生物及氮素胁迫下固体培养基连续传代培养10代过程中可培养菌Simpson指数;(d)氮素胁迫下液体培养基连续传代培养10代过程中可培养菌Simpson指数;(e)水稻土本底土著微生物和固液培养基可培养菌的PCA主成分聚类分析;(f)不同氮素水平下固液培养基可培养菌的PCA主成分聚类分析。NA、1/10 NA、NB和1/10 NB含义见图1。(a)~(d)分图中同一组直方柱上方英文小写字母不同表示代际间某指标差异显著(P<0.05)。所有处理均设置3个生物学重复。
采用Simpson指数表征细菌多样性也得到类似规律。水稻土背景土壤Simpson指数为1,连续传代培养10次过程中,常规营养NA和低营养1/10 NA可培养菌Simpson指数平均值分别为0.07和0.21,后者是前者的3倍〔图2(c)〕。常规营养NA可培养菌第1代Simpson指数为0.06,最低值为0.05,最高值为0.08,平均值为0.07。低营养1/10 NA可培养菌第1代Simpson指数为0.14,最低值为0.11,最高值为0.52,平均值为0.21。类似地,常规营养NB和低营养1/10 NB连续传代10次过程中,可培养菌Simpson指数平均值分别为0.69和0.45,前者是后者的1.5倍〔(图2(d)〕。常规营养NB可培养菌第1代Simpson指数为0.66,最低值为0.66,最高值为0.71,平均值为0.69。低营养1/10 NB可培养菌第1代Simpson指数为0.79,最低值为0.30,最高值为0.79,平均值为0.45。
采用PCA主成分聚类分析,在OTUs水平上研究连续传代过程中微生物群落结构的变化。与水稻土本底土著微生物相比,连续传代培养过程中,固体培养基、液体培养基可培养菌群落结构发生明显分异,表明固体和液体培养基可培养菌发生特异性分异〔图2(e)〕。此外,针对所有可培养菌进行分析,发现固体和液体培养是微生物群落结构分异的主要控制因子,同时,1/10营养状况下不同培养代数微生物群落也发生明显分异〔图2( f )〕。
2.3 水稻土本底及连续传代过程中可培养微生物物种共现规律
针对背景水稻土、固体培养基和液体培养基,开展共有和特有物种共现规律的维恩图分析〔图3(a)〕。在微生物门水平上,采用高通量测序技术共检测到水稻土本底土著微生物54门,连续传代培养过程中共计获得可培养菌48门,连续10次传代富集的可培养菌门占所有微生物门的比例为88.9%。所有可培养48门中,固体和液体培养基分别获得可培养菌9门和47门,可培养菌门比例分别为16.7%和87.0%〔图3(a)〕。其中,固体培养基独有门1个,液体培养基独有门39个,两者共有门8个。固体培养基的9个微生物门包括常规营养独有门3个,低营养1/10 NA独有门2个,两者共有门4个〔图3(b)〕。液体培养基的47个微生物门包括常规营养独有门3个,低营养1/10 NB独有门3个,两者共有门41个〔图3(b)〕。
进一步针对固体可培养的9个微生物门分析发现,连续传代第1、3、5、7和10次培养过程中,常规营养处理分别获得5、3、4、5和3门,低营养1/10 NA处理则分别获得3、3、6、3和4门,无论常规营养处理还是低营养处理,连续10次传代过程中稳定出现的有3个微生物门〔图3(c)〕。

(a)和(b)分别为水稻土和可培养菌在微生物门和属水平的物种共现维恩图;(c)和(d)分别为土壤可培养细菌第1、3、5、7、10代的门和属水平的物种共现维恩图。NA、1/10 NA、NB和1/10 NB含义见图1。
类似地,针对液体可培养的47个微生物门分析发现,连续第1、3、5、7和10次传代培养过程中,常规营养处理分别获得5、3、43、39和27门,低营养 1/10 NB处理则分别获得32、41、37、28和27门;然而,连续10次传代过程中,常规营养处理仅发现3个共有微生物门稳定出现,低营养处理则发现23个共有微生物门。
在微生物属水平上,水稻土本底土著微生物共有713属,连续10次传代富集培养过程中,固体和液体常规培养基分别检测到52和600属,可培养菌占比分别为7.3%和84.2%。低营养1/10培养条件下,固体和液体培养基分别检测到62和597属,可培养菌占比分别为8.7%和83.7%〔图3(b)〕。其中,固体培养基独有属6个,液体培养基独有属594个,两者共有属68个。固体培养基的74个微生物属包括常规营养独有属12个,低营养1/10 NA独有属22个,两者共有属40个。液体培养基的662个微生物属包括常规营养独有属65个,低营养1/10 NB独有属62个,两者共有属535个。
进一步针对连续传代固体可培养微生物74属的分析发现,常规营养NA处理分别获得31、23、23、30和27属,低营养1/10 NA处理分别获得38、32、34、32和33属〔图3(d)〕。然而,连续10次传代培养过程中,常规营养处理仅发现9个共有属,而低营养1/10 NA处理则发现21个共有属。类似地,针对液体可培养662个微生物属的分析发现,连续第1、3、5、7和10次传代培养过程中,常规营养NB处理分别获得44、29、501、441和317属,低营养1/10 NB处理则分别获得271、485、420、287和258属。值得注意的是,连续10次传代过程中,常规营养处理仅发现17个共有微生物属稳定出现,但低营养处理则发现159个共有微生物属稳定出现〔图3(d)〕。
2.4 水稻土本底及连续传代过程中可培养微生物的物种组成变化
在微生物门分类水平上〔图4(a)〕,本底水稻土中相对丰度>1%的优势门由高到低依次为变形菌门(Proteobacteria)、放线菌门(Actinobacteria)、酸杆菌门(Acidobacteria)、厚壁菌门(Firmicutes)和绿弯菌门(Chloroflexi),上述菌门相对丰度分别为(31.04±2.46)%、(15.94±0.77)%、(13.35±0.32)%、(9.57±0.86)%和(9.14±1.03)%。常规营养NA培养基连续10次传代过程中,变形菌门成为绝对的优势类群,其相对丰度变化范围为(97.91±0.14)%~(99.59±0.15)%,而绿湾菌门在第5、7代最高相对丰度分别仅为(1.18±0.81)%和(2.08±0.15)%。低营养1/10 NA培养条件下也得到了类似结果,变形菌门相对丰度变化范围为(98.16±0.22)%~(99.00±0.55)%;而所有传代过程中均发现绿湾菌门,其相对丰度则略有增加,变化范围为(0.51±0.31)%~(1.83±0.22)%。常规营养NB培养基连续10次传代过程中,变形菌门和厚壁菌门是绝对的优势类群,前者相对丰度变化范围为(46.79±6.60)%~(57.13±6.78)%,后者为(38.91±6.78)%~(51.68±8.00)%;值得注意的是,低营养1/10 NB培养条件下,厚壁菌门相对丰度随着传代次数增加而显著降低,其变化范围为(14.43±3.80)%~(67.23±7.35)%;此外,与固体培养基相比,液体培养基中均未检测到绿湾菌门。
在微生物属分类水平上〔图4(b)〕,本底水稻土中相对丰度较高的优势属依次为梭菌属(Clostridium)、杆菌属(Bacillus)、假单胞菌属(Pseudomonas)、赖氨酸芽孢杆菌属(Lysinibacillus)和类芽孢杆菌属(Paenibacillus),上述菌属相对丰度分别为(3.25±0.11)%、(1.74±0.25)%、(1.33±0.18)%、(0.51±0.41)%和(0.49±0.06)%。常规营养NA培养基连续10次传代过程中,假单胞菌属成为绝对的优势类群,其相对丰度变化范围为(97.70±0.61)%~(99.47±0.05)%。此外,也检测到梭菌属和杆菌属,但两个菌属相对丰度极低,仅为(1.24±0.40)%和(0.35±0.05)%。低营养1/10 NA 培养条件下假单胞菌属仍是绝对优势类群,但其相对丰度略有下降,变化范围为(66.38±7.12)%~(96.29±0.95)%。同时,随着传代次数的增加,杆菌属和代尔夫特菌属(Delftia)成为优势类群,特别在第10代两者相对丰度分别高达(18.07±4.40)%和(13.82±3.01)%,而在第1~7代两个菌属相对丰度范围仅为(0.81±0.41)%~(2.16±0.39)%和(1.17±0.34)%~(2.73±2.12)%。常规营养NB连续10次传代过程中,与固体培养基相比,假单胞菌属相对丰度略有下降,但仍占据绝对优势,其相对丰度为(45.48±6.62)%~(55.99±6.79)%。其他优势类群则包括梭菌属、杆菌属和类芽孢杆菌属,上述菌属相对丰度分别为(23.58±3.02)%~(42.40±11.70)%、(0.50±0.13)%~(5.90±0.62)%和(0.95±0.43)%~(3.52±0.98)%。此外,第1、3代检测到的赖氨酸芽孢杆菌属占比小,但在第5、7、10代其相对丰度增至(1.46±1.21)%~(6.74±1.53)%。值得注意的是,低营养1/10 NB培养条件下,梭菌属和赖氨酸芽孢杆菌属随着培养代数增加而急剧降低,假单胞菌属成为绝对优势菌,而类芽孢杆菌属则呈现随着传代次数增加而增加的趋势。
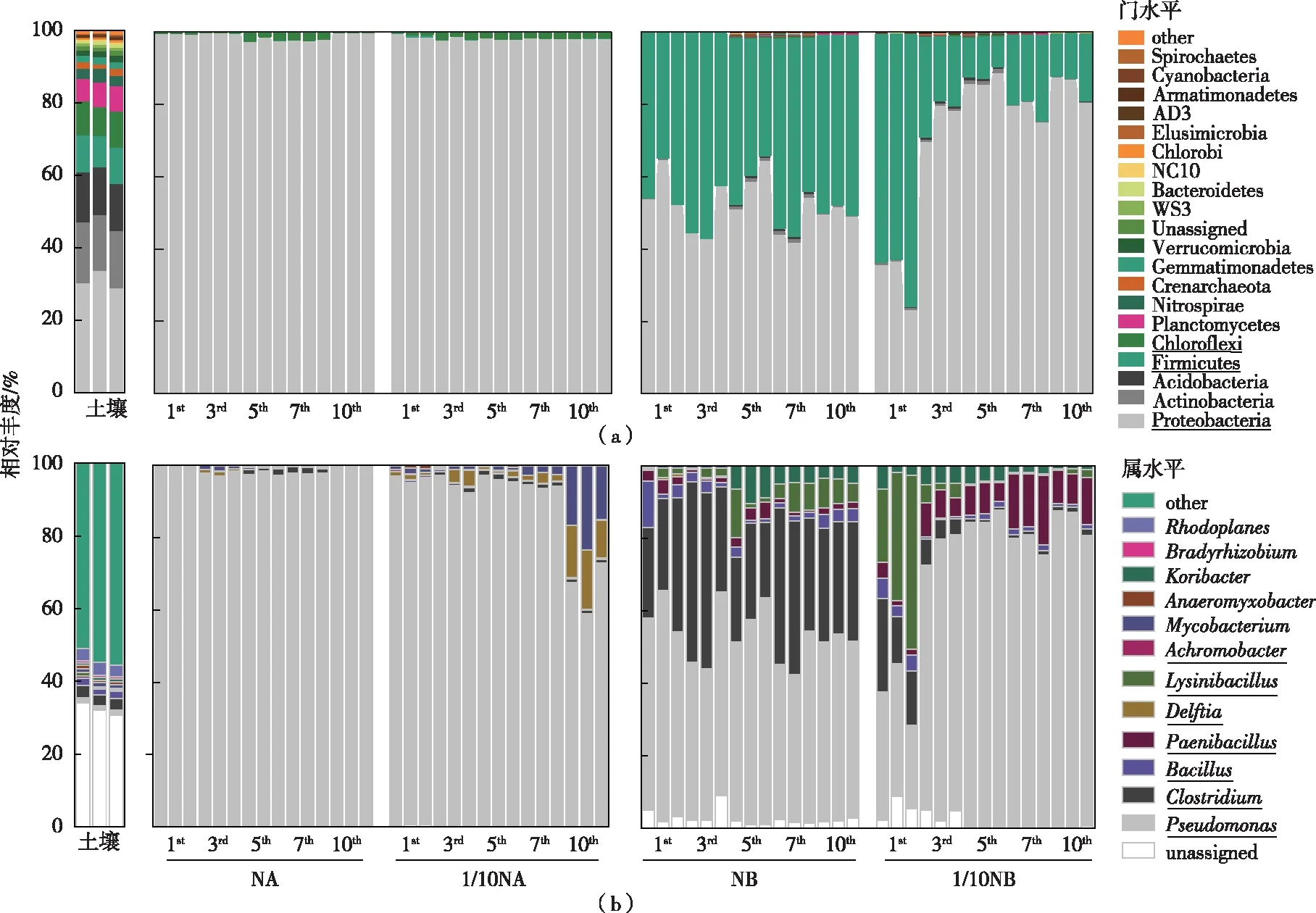
下划线的分类群表示这些分类群序列显示出高度的相似性,也表示固体培养基中所有优势门/属,其余无下划线标记的分类群表示本底土壤、液体培养基中所有门/属的分类群,两者分类群图例一致。(a) 水稻土和可培养菌在微生物门水平的物种组成;(b)水稻土和可培养菌在微生物属水平的物种组成。NA、1/10 NA、NB和1/10 NB含义见图1。所有处理均设置3个生物学重复。
2.5 水稻土连续传代培养过程中可培养菌的变化规律
微生物在属水平的组成差异火山图见图5。与水稻土背景微生物类群相比,固体培养基有43个优势属相对丰度显著降低,14个属未发生显著变化,仅假单胞菌属显著增加,其在本底土壤中的相对丰度仅为1.33%,而在固体可培养菌群落中占比高达93.90%,为本底土壤的70.6倍〔图5(a)〕。液体培养基中可培养微生物也存在类似规律,相较于水稻土背景微生物类群,共计643属相对丰度显著降低,而69个属未发生明显变化,仅假单胞菌属显著增加,占比高达44.70%,为本底土壤的33.6倍〔图5(b)〕。
进一步针对固体和液体培养基中相对丰度最高的10个可培养微生物属,计算其相对于本底土壤的富集率〔图5(c)〕。结果表明,固体可培养微生物选择性地富集了假单胞菌属、代尔夫特菌属和无色杆菌属(Achromobacter)微生物类群,3个菌属在本底土壤的相对丰度分别为(1.33±0.18)%、(0.02±0.01)%和(0.001±0.00)%,在传代过程中的最高相对丰度分别为(99.47±0.05)%、(15.56±3.00)%和(0.19±0.02)%,最高富集率分别为75倍、778倍和190倍,而且在常规营养和低营养条件下没有明显差异〔图5(c)〕。然而,常规营养NB液体培养基主要富集假单胞菌属、梭菌属、杆菌属、类芽孢杆菌属、代尔夫特菌属和赖氨酸芽孢杆菌属优势物种,在传代过程中的最高相对丰度为(85.22±1.97)%、(17.92±1.85)%、(4.38±1.33)%、(16.35±6.55)%、(1.04±0.52)%和(34.55±14.07)%,最高富集率分别为64倍、6倍、3倍、33倍、52倍和68倍。低营养1/10 NB培养条件下,主要富集假单胞菌属、类芽孢杆菌属和赖氨酸芽孢杆菌属,其在本底土壤的相对丰度分别为(1.33±0.18)%、(0.49±0.06)%和(0.51±0.41)%,在传代过程中的最高相对丰度分别为(55.99±6.79)%、(3.52±0.98)%和(6.74±1.53)%,最高富集率分别为42倍、7倍和13倍〔图5(c)〕。

图5 连续10代培养过程中水稻土可培养微生物属的富集增长规律
3 讨论
采用高通量测序技术分析水稻土本底微生物多样性,通过与连续传代过程中可培养细菌进行比较,发现培养后的微生物多样性远低于原始土壤多样性,第1代可培养细菌多样性最低,仅为本底土壤多样性的1%~5%,并且不同传代过程中微生物多样性基本稳定,但低营养连续传代富集在一定程度上可提高微生物多样性。一般认为,由于实验室采用牛肉膏蛋白胨培养基培养细菌,且此类培养基含有丰富的营养物质,而原始自然环境中大多为贫营养状态;因此,在传统微生物富集培养过程中,由于环境条件的剧烈变化,一些微生物不能适应而死亡,另一些微生物则可能产生孢子进入休眠状态,或者通过改变细胞形态进入维持一定代谢活性但不生长繁殖的“活的非可培养状态”[13]。另一方面,可培养细菌初期获取养分大量繁殖会产生“活性氧化物”破坏细胞内膜结构,从而加速部分细胞死亡,最终降低细菌可培养性[14]。笔者研究结果表明,传统平板涂布培养无法代表土壤微生物群落全貌,应结合分子生态学技术和传统可培养策略,利用两种技术的互补优势,更好地挖掘可培养微生物资源。
笔者研究选择牛肉膏蛋白胨培养基连续传代培养10次,分别取第1、3、5、7、10代进行实时荧光定量PCR和高通量测序。基于16S rRNA基因的系统发育分类结果表明,常规营养NA和NB培养基具有可培养稳定性,随着传代次数的增加,水稻土优势可培养微生物类群稳定连续出现,而低营养1/10 NA 和1/10 NB条件下,随着传代次数增加,第1代出现的微生物菌群逐渐被某些优势菌替代。微生物的群落丰富度和均匀度是反映微生物物种多样性的重要指标,且一般情况下物种丰富度越低,其均匀度就越高[15]。在连续传代培养过程中,虽然物种丰富度有所下降,但其均匀度升高,致使物种多样性变化不大。在相同的常规营养NA或者NB培养条件下,不同传代次数的选择压力并未发生本质变化,各存活物种的数量和生存权重之和越来越接近,可能是导致物种均匀度升高而趋于稳定的原因。此外,水稻土本底土著微生物多样性较高,在连续传代培养过程中,被淘汰微生物的生态位易被群落内其他微生物替代,以维持生态系统的稳定与平衡[16]。微生物群落结构受各种环境因子的影响,不同的因子能够触发微生物群落产生不同的演替方向[17]。笔者研究中本底土壤微生物群落与传代富集物群落结构有显著差异,主要原因可能是培养基营养元素(碳、氮)、状态(固液体)等因素的选择性富集驱动压力所致。例如,微生物生长底物和生态位方面的选择可能与微生物进化适应策略紧密相关[18]。研究表明采用经典的可培养法分析微生物群落的高复杂性可能是由初始土壤内在的高丰度和随机性微生物输入引起的[19]。例如,研究表明烃类物质越难降解,微生物间的协同作用就越强,且微生物群落的合作强度随氮素胁迫的增强而增加[20]。因此,在持续选择压力作用下,连续传代培养阶段微生物群落不断演化并适应该选择压力,且各物种协同作用可能不断优化,逐渐形成了相对稳定的菌群[21]。
培养基成分显著影响可培养细菌群落,笔者研究结果表明液体培养相比于固体培养可获得更多的细菌类群。液体可培养细菌占土壤微生物的比例高达92.8%,而固体培养基仅为10.4%,表明液体培养基策略优于固体培养。在微生物属的分类水平上,16S rRNA基因分析结果表明,固体培养基选择性地富集了假单胞菌属、杆菌属、代尔夫特菌属,而液体培养基选择富集了假单胞菌属、梭菌属、杆菌属、类芽孢杆菌属和赖氨酸芽孢杆菌属。氧气浓度差异可能是导致固液培养基选择不同微生物的重要原因。例如,空气中氧气体积分数高达19%,而液体培养基中溶解氧浓度可能低于1 g·L-1。固体培养基中菌落易与空气接触,假单胞菌属专性好氧,在固体培养基中更易生长,而液体培养基中仅有液体表面微生物接触氧气,这可能是液体培养基假单胞菌属相对丰度低的重要原因。也有研究表明类芽孢杆菌属和梭菌属适应氧气胁迫能力更强,而杆菌属是一类好氧和兼性厌氧菌。此外,尽管理论上琼脂不容易被微生物代谢吸收利用,但也有研究发现在中性或碱性条件下,磷酸盐和琼脂混合经高温灭菌后会产生 H2O2[22],而液体培养基中磷酸盐单独加热则不会产生 H2O2,H2O2对微生物生长有明显抑制作用[23],这也可能是造成固体培养与液体培养之间微生物富集物具有较大差异的重要原因。
笔者研究结果表明土壤中可培养菌比例极有可能被低估。经典的“99%难培养”概念,事实上缺乏可信的实验证据。笔者前期的分析表明,“99%难培养”是“平板计数异常”的同义词。通过显微计数和培养基平板计数,GRAY[24]分析了草地土壤和农田土壤中微生物数量,发现基于固体平板菌落的稀释平板计数法所得微生物数量,仅占显微计数所得微生物数量的0.09%~0.74%,提出了“平板计数异常”的现象和名词。最近,MARTINY[25]对来自6个不同生境的样品进行16S rRNA测序分析发现,可培养微生物比例为52%~74%,在一定程度上表明土壤中微生物多样性的定量化分析仍需开展更多研究。笔者研究中固体平板培养的微生物多样性远低于液体培养,采用高通量测序技术共检测到水稻土本底土著微生物713属,连续传代培养过程中共获得可培养菌668属,连续10次传代富集培养过程中,固体和液体常规培养基分别检测到52属和600属,可培养菌占比分别为7.3%和84.2%。低营养1/10培养条件下,固体和液体培养基分别检测到62属和597属,可培养菌占比分别为8.7%和83.7%。如前所述,造成固体和液体可培养菌比例差异的原因可能包括氧气、琼脂、附着物环境差异[26],特别是固体和液体培养基的环境特征差异较大。固体平板表面为微生物提供了附着物,更利于可培养微生物群落形成由胞外多聚基质联合的微生物被膜,导致其微生境形成后极难发生显著改变,进而刺激了特定的微生物群落快速生长,遗漏了大多数微生物[27]。在液体培养基中,可能随着细菌的生长,其生态位一直处于动态变化过程中,包括细菌群落之间的群体感应过程,进而可能影响细菌及其共生微生物的生理行为及生态位,刺激更多微生物生长并提升可培养菌比例[28]。然而,已有研究大多针对纯菌株的生理生化和遗传学研究[26],未来仍需针对复杂的混合菌群深入开展相关机理分析,笔者研究结果则为定量化研究复杂土壤中可培养微生物提供了依据。
不同营养状况也可能显著影响原位土壤微生物区系组成和可培养菌。例如,有研究表明,施氮量显著影响土壤微生物群落的数量、丰度及多样性[15-16]。经典的可培养方法使用高浓度营养基质,可能抑制一部分微生物生长,若适当降低营养基质浓度则可能减弱不利影响。研究发现低浓度基质培养条件下,可培养细菌在数量和种类上显著多于高浓度基质培养基[10]。尽管笔者研究中高营养和低营养处理效果在固体和液体之间的差异较大,但与已有研究结论基本一致。例如,在固体培养基中,与常规营养NA相比,低营养1/10 NA能够获得更多可培养微生物类群,如Chao指数〔图2(a)〕,群落多样性高,如Simpson指数〔图2(c)〕,但在数量上却呈降低趋势〔图1(b)〕;其中可能的原因是笔者试验中添加的蛋白胨量过低。有研究表明营养浓度过低时,可培养微生物数量反而下降[11],但笔者研究结果表明物种多样性反而增加,更有利于富集分离土壤中的重要功能微生物。氮素浓度也可能影响特定的微生物富集。例如,笔者研究中液体可培养微生物中,常规营养NB主要富集假单胞菌属、类芽孢杆菌属、赖氨酸芽孢杆菌属,其中,赖氨酸芽孢杆菌属优势物种属在连续传代过程中保持相对增长趋势,说明赖氨酸芽孢杆菌属喜好富氮环境,而低营养1/10 NB培养条件下,则额外富集了梭菌属、杆菌属、代尔夫特菌属优势物种,特别是这些物种在传代富集过程中,随代际增加而增加,表明这几类微生物可能更喜低氮环境。已有研究表明,高氮供应使土壤微生物DNA/RNA复制、蛋白代谢提高,有益于杆菌等富营养型微生物生长[16],而缺氮胁迫会激发更多种类的寡营养型微生物生长,并刺激其利用难降解碳源的能力,使其相对丰度增加[4]。笔者研究结果与上述报道基本一致,表明相对于富营养型微生物,氮素胁迫下更多的不同营养利用类型微生物更具竞争优势,这可能是低氮土壤环境中微生物多样性较高的重要原因。整体而言,笔者研究结果表明土壤可培养微生物的主要决定因素是固体和液体条件,适当增加培养代数并降低营养含量,有可能获得更多可培养微生物。
4 结论
土壤可培养微生物受到培养基形态、培养基成分和传代次数的影响。基于16S rRNA 基因的系统发育分类结果表明,通过高通量测序分析可获得更多的微生物分类信息,规避了传统培养的内在缺陷;随着传代次数的增加,常规营养固体和液体牛肉膏蛋白胨培养基中土壤可培养细菌优势类群假单胞菌属、梭菌属、杆菌属、类芽孢杆菌属稳定连续出现,而营养降低为1/10之后,随着传代次数增加,第1代出现的部分微生物菌群逐渐被某些优势菌替代,如代尔夫特菌属。同时,连续10次传代富集培养过程中,固体和液体常规培养基可培养菌占比分别为7.3%和84.2%。低营养1/10培养条件下,固体和液体培养基可培养菌占比分别为8.7%和83.7%,仅有7个属相对丰度显著增加;固体和液体培养基具有极强的选择性,分别富集了假单胞菌属和杆菌属优势属,而液体相比于固体能富集更多优势微生物类群,其中1/10低营养培养也表现出类似规律,且杆菌属、类芽孢杆菌属和代尔夫特菌属等不同营养水平微生物,在连续传代培养过程中随代际增加而增加。这些研究结果表明,适当减少培养基的营养元素含量,合理增加传代次数,有可能获得更多可培养微生物资源,未来应深入研究可培养微生物功能网络互作机制及其农业环境意义,为定向发掘重要微生物资源及功能提供参考。
