水稻不育系湘陵628S不同组合感光性差异的遗传解析
2023-02-10陈赛华尤仪雯张路遥杨远柱万建民
陈赛华 彭 盛 尤仪雯 张路遥 王 凯 薛 明,* 杨远柱,* 万建民
水稻不育系湘陵628S不同组合感光性差异的遗传解析
陈赛华1彭 盛1尤仪雯1张路遥1王 凯3薛 明1,*杨远柱3,*万建民2
1江苏省作物基因组学和分子育种重点实验室 / 植物功能基因组学教育部重点实验室 / 江苏省作物遗传生理重点实验室, 扬州大学农学院, 江苏扬州 225009;2南京农业大学 / 作物遗传与种质创新国家重点实验室 / 江苏省植物基因工程技术研究中心, 江苏南京 210095;3袁隆平农业高科技股份有限公司 / 农业农村部南方水稻品种创制重点实验室 / 抗病虫水稻育种湖南省工程实验室, 湖南长沙 410128
湘陵628S是优质矮秆抗倒两系早稻不育系, 所配组合米质优, 且适宜轻简化、规模化和机械化种植, 目前已有40个“陵两优”系列品种通过国家或省级审定, 并大面积推广应用。测配中发现, 湘陵628S与绝大多数中晚稻亲本配组感光性强, 在长江流域不能正常抽穗, 限制了其育种应用。为了探究湘陵628S及不同杂交组合感光性差异的遗传机制, 本研究结合等位性测验与基因型分析, 对湘陵628S及恢复系的关键感光基因进行分析。结果发现, 湘陵628S携带有隐性等位基因e和Se-1, 显性等位基因Hd5E、E和EF-1, 总体表现出弱感光性。恢复系携带的E()基因决定了不同组合的感光性强弱, 所携带的()和()基因与感光性没有直接相关性。据此, 我们开发了2个分子标记用于恢复系E、等位基因型的分子鉴定, 以加快弱/不感光杂交组合的选育。本研究为湘陵628S及其他不育系在杂交育种上的利用提供了重要的理论和技术指导。
水稻; 不育系; 感光性; 基因; 分子标记
发展杂交水稻对于促进粮食增产, 保障粮食安全具有举足轻重的作用。由于杂种优势效应的存在, 杂交水稻品种有时会表现出超亲晚熟的现象。适当延长熟期(或称抽穗期)可以在不影响轮作的前提下有效促进杂交种的产量。然而, 过度的超亲晚熟现象则会降低品种的广适性, 这成为杂交品种选育中的障碍之一[1]。株1S是国内应用最广的早籼不育系, 针对株1S植株偏高易倒伏的问题, 采用体细胞无性系诱变方法对株1S株高进行了改良, 育成了优质矮秆抗倒两用核不育系湘陵628S, 该不育系最大限度保留了株1S优良特性和高配合力, 且株高仅62 cm, 茎基部节间短, 所配组合植株矮壮, 耐肥抗倒, 很好的解决了杂交早稻生产问题[2]。但是, 不同于亲本株1S, 湘陵628S与绝大多数中晚稻父本配组都呈现出强感光性, 在长江流域不能正常抽穗, 这限制了湘陵628S的育种应用。
水稻抽穗期(heading date, HD)由基本营养生长性、感光性和感温性3个因素共同决定, 其中感光性是反映水稻品种地区和季节适应性的一项重要指标。早期研究表明, 水稻的感光性受到复杂的遗传调控, 包括主效感光基因E、和微效感光基因、和等[3-4]。这些感光基因位点的功能基因大多已经被克隆并进行了深入的研究, 其中包括E位点的基因[5]、位点的基因[6]、位点的[7-8]、位点的[9-10]和位点的[11]等。与其他感光基因不同,表现出短日照下促进、长日照下延迟抽穗的现象[6]。的这种双重功能可能与它和、/或形成互作复合物有关[12-16]。自然界中存在感光基因的不同单倍型, 这些单倍型的组合引起丰富的感光性变化, 从而使得水稻品种在不同光周期环境下呈现出抽穗期的变化。、和的不同组合与水稻品种在不同光周期条件下的抽穗期与产量显著相关, 因此被认为是关键的感光基因[12,17-19]。然而, 湘陵628S不同杂交组合的感光性差异是否与这些感光基因或基因组合有关仍不清楚。
本研究以湘陵628S及其不同感光性的“陵两优”组合为研究对象, 首先通过等位性测验对湘陵628S的感光基因基因型进行测定。并对湘陵628S和不同强、弱感光杂交组合中的父本进行和的基因型测定, 分析感光性强弱与不同基因型或基因型组合之间的相互关系。本研究不仅可以为湘陵628S在育种上的利用提供指导, 也为如何破除其他杂交稻品种选育过程中出现的超亲晚熟现象提供育种改良策略。
1 材料与方法
1.1 试验材料
、E、E、E、和是水稻中已报道的关键的抽穗期调控基因位点, 其中影响基本营养生长性, 其余均可通过影响感光性来调控抽穗。为了评估湘陵628S中各等位基因的作用强弱, 本研究选用11个测验系材料, 它们可以相互组配成7对含有单一等位基因差异的测验系组合, 对6个基因座位上的等位基因(其中与等位)进行等位基因效应测定(表1)。本研究测定的F1材料均以湘陵628S (简称S)为母本, 测验系材料为父本杂交获得。本研究待测定的不同杂交组合亲本材料包括两系不育系湘陵628S、株1S; 陵两优强感光组合的恢复系亲本蜀恢527、恩恢58、辐恢838、R182、先恢207和R1377, 陵两优弱感光组合的恢复系亲本HY032、H421、H211、ZR02、华恢1063和华恢564。
1.2 田间试验
供试材料包括湘陵628S、7对测验系材料及组配的F1。夏季播种于江苏省南京市长日照条件下, 播种日期为5月12日, 移栽日期为6月12日。每个材料种植2行, 株距为13.3 cm, 行距26.3 cm, 每行10株。水肥管理按照水稻常规栽培条件实施。
1.3 抽穗期调查
为了精确调查材料的表型, 分单株调查抽穗期。以每株植株的主穗抽出剑叶1~2 cm作为当天抽穗的标准, 记录下抽穗日期。计算抽穗日期距离播种日期的天数(d), 记为抽穗期。每个材料分单株调查2行。抽穗期的调查数据以平均值±标准差来表示, 其中每组样品不少于10个重复。

表1 试验采用的7对测验系材料的基因型
*: 大写字母代表显性等位基因型, 小写字母代表隐性等位基因型, 上标表示强弱不同的等位基因型。Nip为日本晴Nipponbare的缩写。
*: uppercase letters represent dominant alleles, lowercase letters represent recessive alleles, and superscripts represent alleles with different intensity. Nip is the abbreviation of Nipponbare.
1.4 数据分析
等位测验法是根据前人研究的基础稍作修改[20]。分别调查了7对测验系的抽穗期差异, 比较湘陵628S与各测验系杂交后F1的抽穗期差异。基因的效应分析是通过比较杂交前后的抽穗期差异来确定的。如湘陵628S中带有显性等位基因, 则在杂交后可以完全或部分掩盖原成对测验系中的基因效应差异, 表现为不同杂交组合F1之间抽穗期差异缩短, 反之则杂交F1之间与测验系之间的抽穗期差异保持一致。本研究中涉及的材料之间的两两比较, 均采用T测验检测差异显著性,<0.05为显著,<0.01为极显著。
1.5 基因克隆与测序
将不同杂交组合中的恢复系材料种植在光照培养箱中(30℃ 16 h光照/25℃ 8 h黑夜), 培养到感光期(~30 d), 采用CTAB法提取DNA。同步采用TRIzol试剂盒提取RNA, 随即利用TaKaRa公司的反转录酶将RNA反转录成cDNA。以DNA为模板, 采用Ghd7-exon1和Ghd7-exon2引物对扩增的基因组外显子序列。以cDNA为模板, 采用Hd1- FLcDNA引物扩增基因的全长cDNA序列。以cDNA为模板, 采用DTH8-FLcDNA引物扩增基因的全长cDNA序列。引物序列见表2。PCR扩增产物送南京擎科生物有限公司进行测序, 测序结果采用Contig软件进行拼接与比对分析。E1D与SeI引物是用于检测与等位基因型的分子标记(表2)。
2 结果与分析
2.1 湘陵628S所配组合呈现感光性的分化
湘陵628S与不同类型父本配组, 所配组合呈现出明显的感光性分化(表3), 与中晚稻父本所配组合在长江中下游长日照条件下不能正常抽穗。我们推测, 在不同“陵两优”组合中, 湘陵628S与不同恢复系之间的感光性遗传差异可能是导致这一现象的根本原因。

表2 本研究采用的引物序列

表3 部分“陵两优”早稻组合(已审定)和强感光组合
2.2 湘陵628S呈现出较弱的感光性
为了探究不同“陵两优”组合的感光性差异, 我们首先对湘陵628S自身的光周期敏感性进行了分析。在海南陵水自然短日照条件下(natural short day, NSD), 2016—2019年湘陵628S的平均抽穗期为(81.2±2.64) d (图1-A)。在江苏南京自然长日照条件下(natural long day, NLD), 2016—2019年湘陵628S的平均抽穗期为(81.75±2.20) d; 相比于NSD条件下, NLD下湘陵628S的抽穗期未出现延迟的现象, 甚至个别年份稍有提前, 这说明湘陵628S本身具有较弱的光周期敏感性。

图1 湘陵628S的感光性表现及等位性测验结果
A: 湘陵628S在自然长、短日照下的抽穗期; B~H: 不同测验系及其与湘陵628S杂交F1的抽穗期。横坐标代表不同测验系材料及其与湘陵628S杂交的F1, 其中测验系名称同表1, 纵坐标代表抽穗期。S表示湘陵628S, S/测验系表示湘陵628S与测验系的F1材料。**表示成对测验系之间或成对F1之间存在极显著差异,< 0.01。
A: heading date (HD) of Xiangling 628S under natural long-day and short-day conditions. B–H: heading date of different test lines and their hybrids with Xiangling 628S. The abscissa represents different test lines (the same as test lines in Table 1) and their hybrids with Xiangling 628S, the vertical coordinate represents the days of heading date. S means Xiangling 628S, S/test line means F1derived from Xiangling 628S crossed with each test line. ** indicates significant differences between each pair of test lines or each pair of F1lines at< 0.01.
2.3 湘陵628S的感光性遗传解析
为了进一步分析湘陵628S弱感光性的形成机制, 我们利用含有E、E、E、和不同等位基因的测验系对湘陵628S进行感光性遗传解析(表4和图1-B~H)。
2.3.1 湘陵628S携带隐性E和等位基因 感光性为复杂的数量性状, 由众多感光基因参与调节。到目前为止,E和是公认的主效感光基因, 是影响水稻感光性的主要决定因子。在E基因位点主要存在3类复等位基因, 即显性基因E、弱显性E和隐性非感光基因e。测验系EG1 (EESe-1Se- 1Ef-1Ef-1)和EG0 (eeSe-1Se-1Ef-1Ef-1)仅存在E等位基因间的差异, 前者较后者延迟抽穗约20 d, 这说明显性E在长日照下能显著延迟抽穗。当湘陵628S与EG1、EG0分别杂交后, F1代抽穗期仍存在极显著差异, 相差近33 d (图1-B), 这说明湘陵628S携带有隐性的等位基因e。基因位点主要存在3类复等位基因, 即显性感光基因Se-1和Se-1和隐性非感光基因Se-1, 感光性Se-1>Se-1>Se-1。测验系LR (EESe-1Se-1Ef-1Ef-1)和ER (EESe-1Se- 1Ef-1Ef-1)仅存在等位基因间的差异, 携带Se-1的LR抽穗期较携带Se-1的ER延迟22 d (图1-C)。组合LR/S较ER/S延迟约13 d, 说明湘陵628S含有隐性的等位基因, 基因型可能为Se-1或Se-1。已知与等位, 我们采用的近等基因系Nipponbare (EESe-1Se-1Ef-1Ef-1)与NIL () (EESe-1Se- 1Ef-1Ef-1)进一步证实湘陵628S中等位基因的效应。Nipponbare (Nip)和NIL ()抽穗期相差约7 d,当湘陵628S与Nip和NIL ()分别杂交后, F1抽穗期仍相差9 d (图1-D), 这说明湘陵628S含有隐性等位基因。综合这2组测验系, 可以判断湘陵628S含有隐性等位基因Se-1, 感光性弱。
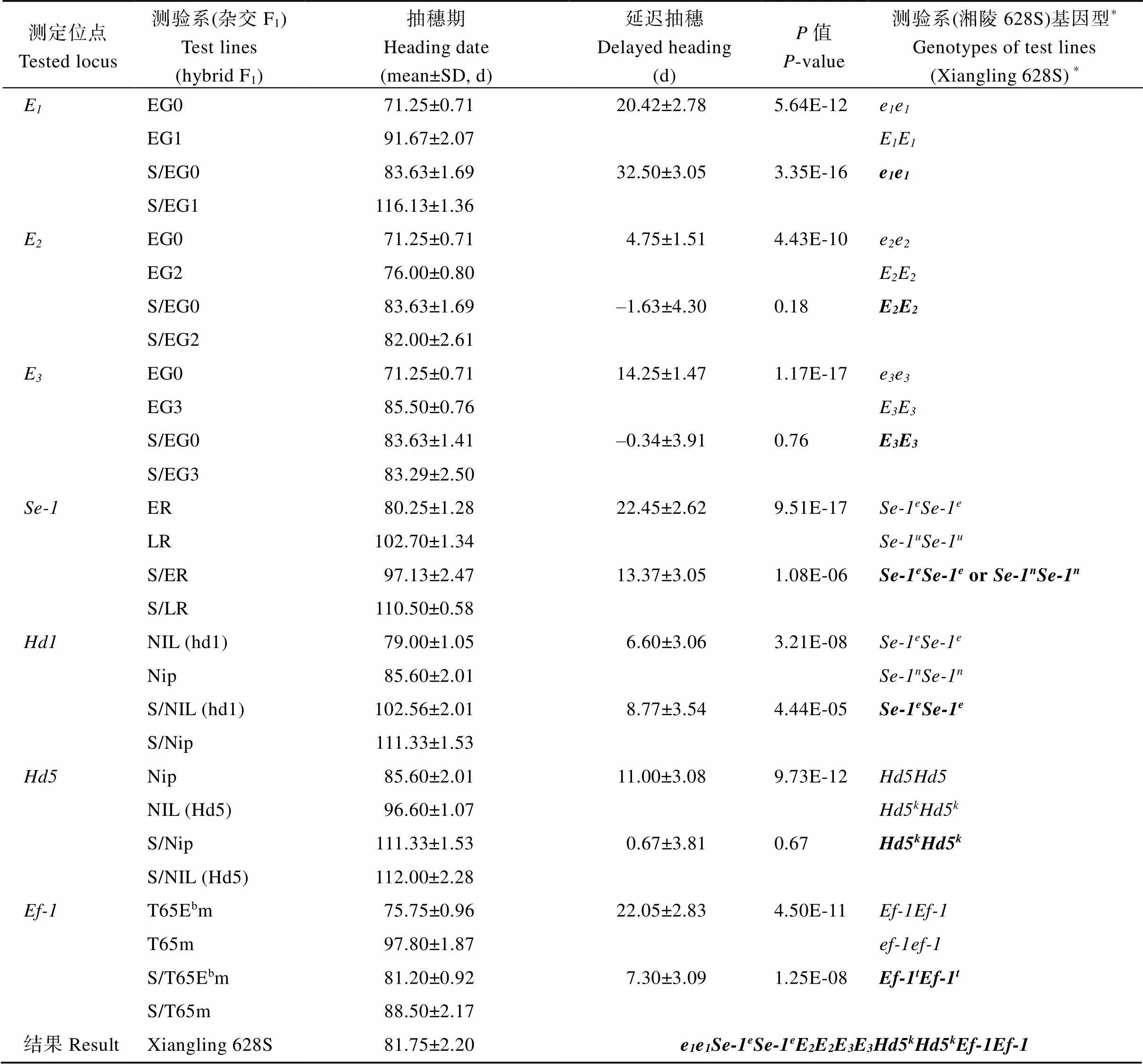
表4 测验系及其与湘陵628S的杂交F1抽穗期和基因型测定结果
*本研究测定的湘陵628S基因型采用粗体突出表示。测验系材料同表1。
*:the genotypes of Xiangling 628S tested in this study are highlighted in bold. The test lines are the same as those given in Table 1.
2.3.2 湘陵628S携带显性E、E和等位基因 测验系EG2 (eeEEeeSe-1Se-1Ef-1Ef-1)和EG3 (eeeeEESe-1Se-1Ef-1Ef-1)相比于EG0 (eeSe-1Se-1Ef-1Ef-1)分别携带显性的E和E等位基因, 它们在长日照下可分别延迟开花5 d和14 d左右。组合S/EG2、S/EG3与S/EG0的抽穗期均无显著差异, 并且杂交F1的抽穗期均与湘陵628S相当,这说明湘陵628S携带有E,E显性等位基因(图1-F~G)。基因主要存在3种基因型,Hd5、和5, 其中Hd5与均为显性感光等位基因, 前者感光性更甚, 而为隐性等位基因, 感光性弱。Nipponbare携带显性等位基因, 而NIL ()则携带强等位基因Hd5。当分别与湘陵628S杂交后, F1代无差异, 说明湘陵628S携带强显性等位基因Hd5(图1-H)
2.3.3 湘陵628S携带有弱显性等位基因Ef-1Ef-1显性早熟基因因子在长日照、短日照下均可提早抽穗, 是通过影响基本营养生长性而影响抽穗期的主要基因。已知在基因主要存在3种复等位基因, 即显性基因Ef-1和隐性基因, 早熟效应为Ef-1>Ef-1>ef-1。测验系T65Ebm (eeSe- 1Se-1Ef-1Ef-1)携带有显性等位基因, T65m(eeSe-1Se-1ef-1ef-1)携带有隐性等位基因, 前者较后者抽穗期提前约21 d。组合S/T65Ebm相比于S/T65m仍显著提前, 但差距缩减至7 d左右(图1-E), 由于S/T65Ebm (HD~81.2 d)相比于T65Ebm (HD~ 75.75 d)出现了抽穗的延迟, 推测湘陵628S携带有弱显性等位基因Ef-1,Ef-1Ef-1效应弱于, 因此表现出抽穗的延迟。当湘陵628S与含有隐性基因的T65m (eeSe-1Se-1ef-1ef-1)杂交后, S/T65m (HD~88 d,Ef-1ef-1)较湘陵628S (HD~81 d,Ef-1Ef-1)延迟抽穗约7 d左右, 这说明Ef-1可能存在一定的剂量效应。由此推断, 杂交配组时恢复系若含有隐性基因, 则可能会引起杂交种的基本营养生长性减弱, 表现为抽穗期稍有延迟, 但不影响感光性。
2.4 湘陵628S不同组合感光性强弱分化与感光基因的相关分析
由于628S携带有隐性的主效感光基因e与Se-1, 测配父本如果包含有显性的E或等位基因, 则有可能引起杂交组合的抽穗期延迟, 表现出强的光周期敏感性, 反之则不然。为了证实我们的猜想, 我们对湘陵628S及其不同“陵两优”组合中恢复系的和基因(分别对应于E和)进行了测序, 并分析不同基因型与杂交组合感光性强弱的相关性。
2.4.1 湘陵628S不同组合感光性强弱与E等位基因紧密相关 对湘陵628S的不育供体株1S、湘陵628S和不同“陵两优”组合的恢复系进行基因的扩增时发现, 包括株1S和湘陵628S在内的部分材料无法有效扩增出基因, 推测这些材料中可能存在基因的缺失。为了进一步对结果进行验证, 在基因区设计了6对引物M1~M6。以起始密码子ATG为基因起始, 终止密码子TAA为基因终止, M1位于基因上游约5.7 kb, M5、M6分别位于基因下游约1.0 kb和8.3 kb, M2~M4覆盖整个基因区域(图2-A)。经扩增检测后发现, 在株1S、湘陵628S、HY032、H421、H211、ZR02和华恢1063中均无法有效扩增出M2~M5的相应片段, 说明这些材料中基因缺失(图2-C)。以上结果与我们的重测序结果相一致, 凡是不能有效扩增基因的材料, 在基因区域均无测序结果覆盖。对蜀恢527等含有基因的6个恢复系进行基因组测序后发现, 这些材料中仅存在2种单倍型(Haplotype, 以下简称Hap)。除R1377含有Hap2以外, 其他材料中含有一致的Hap1 (图2-B)。相比于日本晴而言, Hap1有4处氨基酸的替换, Hap2有5处氨基酸的替换, 两者均没有产生移码突变。已知日本晴中携带显性的E()等位基因, 因此, 我们推测以上6个恢复系中均含有完整功能的基因。比较不同“陵两优”组合的感光性发现, 所有强感光的组合的恢复系都含有完整基因, 而所有弱/不感光的组合中恢复系都缺失基因, 这说明不同“陵两优”组合的感光性差异与基因密切关联, 恢复系中显性的会显著增强杂交组合的感光性, 最终表现出杂交组合在长日照下抽穗期的显著延迟。
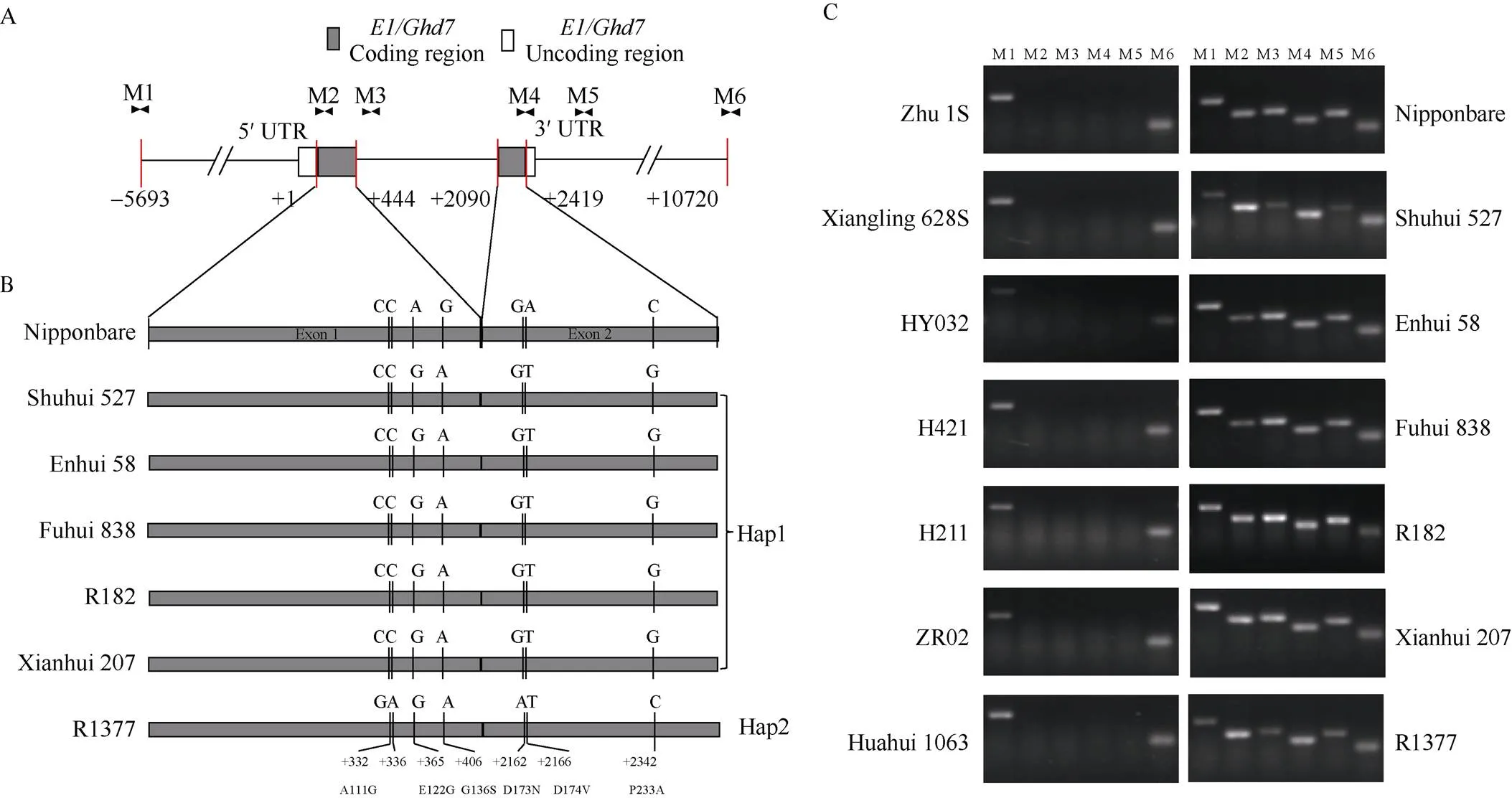
图2 不同“陵两优”组合亲本Ghd7的测定
A:基因的结构示意图。白色框为非翻译区, 灰色框为外显子区(外显子1为1~444 bp、外显子2为2090~2419 bp), 横线为基因上、下游区和内含子区。M1~M6代表用于扩增片段的标记位置。B:基因不同单倍型, 参考基因组为日本晴, 其中突出碱基为差异碱基, 最下方标注差异碱基引起的氨基酸变化。恢复系材料同表3, 其中蜀恢527、恩恢58、辐恢838、R182和先恢207均为Hap1; R1377为Hap2。C: M1~M6标记的扩增产物电泳检测结果。
A: the structural diagram ofgene. The white box represents the untranslated region, the gray box represents the exon region (exon 1 is from 1 to 444 bp and exon 2 is from 2090 to 2419 bp), and the lines represent the upstream, downstream or intron regions. M1–M6 represents the positions of markers. B: the different haplotypes ofgene. The reference sequence is Nipponbare. Each base varied among these materials was highlighted. Their locations corresponding to the reference genome and the resulting amino acid changes were indicated at the bottom. Restorer lines are the same as in Table 3. Shuhui 527, Enhui 58, Fuhui 838, R182, and Xianhui 207 belonged to Hap1, and R1377 belonged to Hap2. C: the electrophoresis detection results of M1–M6 products.
2.4.2 湘陵628S不同组合感光性强弱与和不直接相关 对湘陵628S的不育供体株1S、湘陵628S和不同杂交组合中的恢复系材料也进行了基因的扩增。结果表明, 相比于参考基因组日本晴的序列, 湘陵628S存在36 bp的片段插入与一个G-A的单碱基差异, 造成12个氨基酸的增加与一个氨基酸的替换(图3-A)。根据等位性测验结果可知, 湘陵628S中含有隐性等位基因Se-1(图1-C, D; 表4), 感光性低甚至感光功能丧失。湘陵628S的()基因型与不育供体株1S中完全一致, 说明湘陵628S保留了株1S的弱感光性()等位基因。在所有检测的恢复系中一共存在4种单倍型。其中Hap1与湘陵628S一致, Hap2在湘陵628S的基础上增加了C-G的变异; Hap3在Hap2的基础上增加了4 bp的缺失; Hap4同样包含36 bp的插入与一个G-A的单碱基差异, 还包括多处错义突变、插入突变与移码突变。无论何种单倍型, 由于都存在与湘陵628S相同的突变, 推测这些杂交组合父本均携带不感光的等位基因。表2中弱/不感光组合恢复系中存在Hap1、Hap2、Hap3, 强感光组合的恢复系中存在Hap2、Hap3、Hap4, 不同单倍型在强弱组合中随机分布, 据此推测, 不同“陵两优”感光性的差异与恢复系的基因型无直接相关。考虑到、与三个基因形成的复合物对于感光性起到决定性作用, 我们同步也测定了基因的单倍型(图3-B)。相比于日本晴的, 湘陵628S的存在一处3 bp的插入、一处9 bp的缺失和7个氨基酸的替换, 没有发生移码, 这与测定的湘陵628S含有强Hd5等位基因的结论相吻合。有意思的是, 作为湘陵628S的不育供体, 株1S含有与湘陵628S显著差异的等位基因。株1S携带有Hap2单倍型, 该单倍型相比于湘陵628S存在1 bp的缺失, 会造成移码突变。相比于湘陵628S, 株1S配组时无明显感光性特性, 对父本选择的限制低。据此我们推测, 湘陵628S选育的过程中,的功能获得型导入(来源于系谱亲本ZR02)可能是其配组F1感光性增强的原因之一。
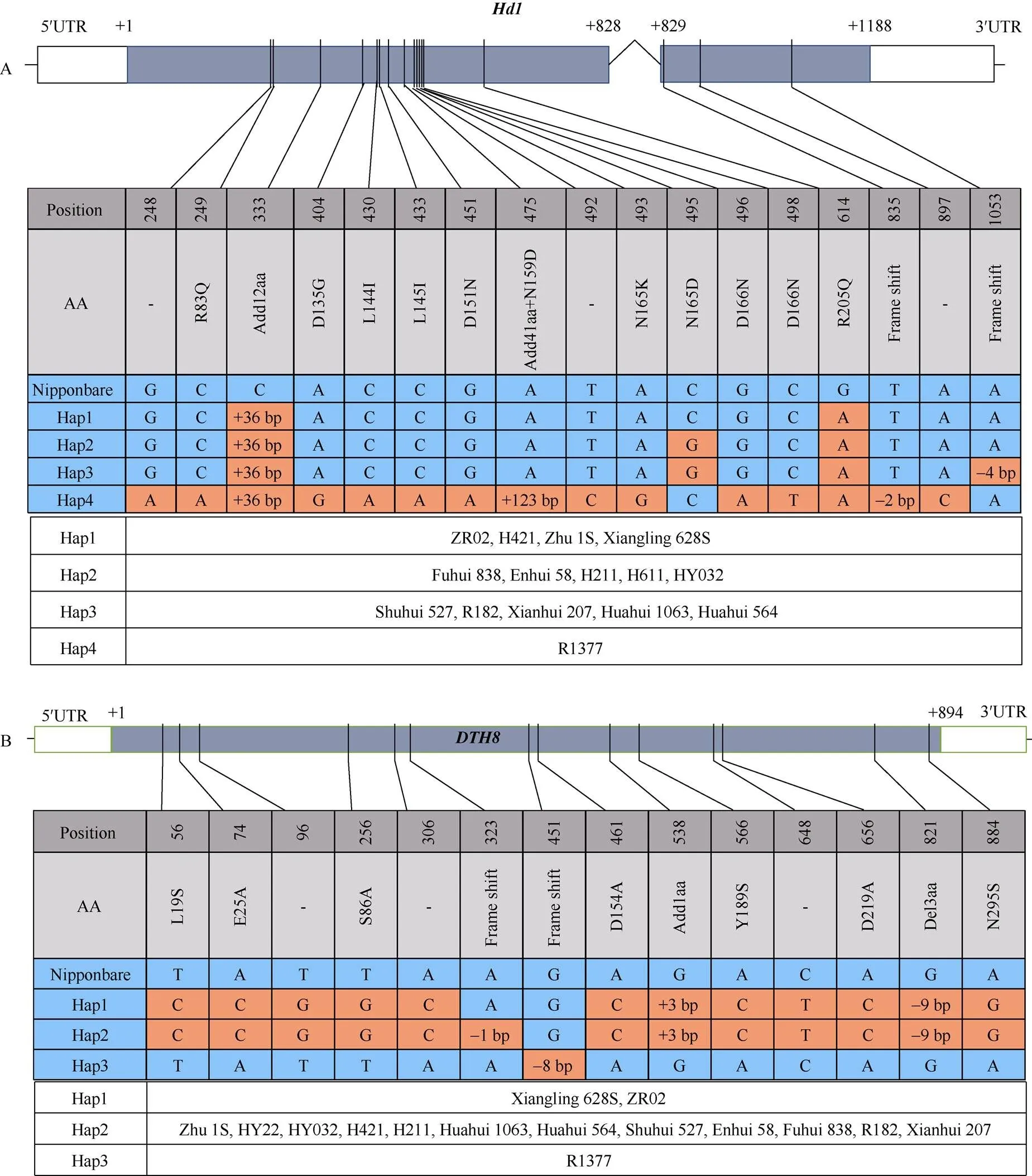
图3 不同“陵两优”组合亲本Hd1和DTH8的测定
A:基因的结构与单倍型分析; B:基因的结构与单倍型分析; 白色框为非翻译区, 灰色框为外显子区(的外显子1为1~828 bp、外显子2为829~1188 bp;含1个1~894 bp的外显子), 折线为内含子区。数字代表对应于日本晴cDNA的位置。AA为相比于日本晴产生的氨基酸变化。Frame shift表示引起移码突变。蓝色和橙色分别标注不同单倍型与日本晴相同和不同之处。当基因型被分成不同单倍型时, 强感光组合中的父本采用粗体进行突出表示。
A: the structure and haplotype analysis ofgene; B: the structure and haplotype analysis ofgene. The white boxes represent the untranslated regions, the gray boxes represent the exon regions (has two exons, exon 1 is 1–828 bp, exon 2 is 829–1188 bp;has an 894 bp exon), and the broken line indicates the intron region. The numbers mean the positions corresponding to the Nipponbare cDNA. AA shows the changes in amino acids. Frame Shift means a frameshift caused by the insertions or deletions. The same or different sequences of HAP1-4 compared to Nipponbare are highlighted in blue or in orange. The parents within the strong photosensitive hybrids are highlighted in bold when the genotypes are classified into different haplotypes.
2.5 用于快速选育弱/不感光“陵两优”组合的分子标记开发
为了精准高效选配非感光或弱感光“陵两优”系列早籼或晚籼品种, 我们基于E()和()基因序列开发了2个功能分子标记, 用于鉴定筛选含有这2个隐性等位基因的恢复系。其中标记E1D用于检测, 凡是不能够有效扩增2573 bp左右大小DNA片段的材料均为缺失型, 反之则为存在完整的类型(图4-A)。E1D标记可以快速筛选缺失型的水稻恢复系, 而对于包含完整基因区域的材料, 可以通过扩增产物的测序来进一步确定的基因型。标记SeI用于检测的36 bp插入, 凡是恢复系中含有该插入片段的, 其扩增产物长度相比于对照日本晴多36 bp, 为不感光型等位基因(图4-B)。以上标记可以用于选择弱感光性恢复系, 高效培育生育期适宜的“陵两优”组合。

图4 功能分子标记的开发与鉴定
A: E1D标记用于鉴定E()基因的缺失, M表示DNA ladder; B: SeI标记用于鉴定()基因存在的36 bp插入。图中Zhu 1S为Xiangling 628S的不育供体株, 恢复系材料同表3。
A: E1D marker can be used to identify the deletion atE() locus, M: DNA ladder; B: SeI marker can be used to identify the 36 bp insertion at the() locus. Zhu 1S is the sterile donor of Xiangling 628S and the restorer lines are the same as those given in Table 3.
3 讨论
3.1 恢复系的E1 (Ghd7)是决定不同“陵两优”组合感光性强弱的关键基因
湘陵628S与不同测验系配组, S/EG1 (HD, 116)表现出明显的超亲晚熟现象, 而S/EG0 (HD, 84)则抽穗期与湘陵628S相当, 这说明杂交父本中若含有显性的E等位基因, 则会显著提高杂交组合的感光性, 表现出抽穗期的延迟。这一推论在其他杂交组合中也同样可以观察到。测验系ER和LR、NIL (hd1)与Nip、Nip与NIL (Hd5)均携带有显性的E等位基因, 在湘陵628S与这些测验系杂交时, 杂交F1的抽穗期从97 d (S/ER)到112 d (S/NIL (Hd5))不等, 均相比于湘陵628S感光性增强, 抽穗延迟。测序分析表明, 凡父本恢复系中携带有显性E()等位基因, 则杂交组合的感光性强, 而父本中携带隐性e()等位基因的杂交组合为弱感光性, 这进一步证实, 父本的E()基因是决定不同杂交组合感光性强弱的关键。
3.2 恢复系的Se-1 (Hd1)是影响不同组合感光性强弱的潜在基因
等位性测验结果显示,湘陵628S携带有弱感光等位基因Se-1, 一旦父本中含有强感光性的等位基因, 则杂交F1的感光性会显著增强。然而, 在湘陵628S与含有Se-1的EG0、EG2和EG3杂交后, S/EG0 (HD~84 d)、S/EG2 (HD~82)和S/EG3 (HD~83)均没有显著的延迟抽穗, 推测可能与这些测验系中均含有隐性等位基因e有关, 这与前人报道的()的感光性依赖于E相一致[14]。在对不同杂交组合恢复系的()等位基因测序后发现, 所有恢复系都包含与湘陵628S相同的序列特征(36 bp的插入与G-A的单碱基变异), 并且不同的单倍型在强、弱感光组合中随机分布, 这说明父本中不同的单倍型都可能是弱感光型, 不同“陵两优”组合的感光性差异与基因不直接相关。即便如此, 当杂种F1的E被有功能的等位基因互补后, 感光性强的等位基因仍可能延迟杂交F1的抽穗期, 因此, 恢复系()是影响不同组合感光性强弱的潜在基因, 应避免与含有Se-1强等位基因型的恢复系杂交。
已有研究表明湘陵628S携带有功能的等位基因[21]。本研究利用等位性测验证实湘陵628S携带弱感光的Se-1等位基因, 尽管湘陵628S中的相比于日本晴的没有发生移码突变, 但我们仍推断其携带的单倍型, 包括36 bp插入与G-A单碱基变异, 是属于弱感光性型, 其内在的机制仍值得进一步深入研究。
3.3 不育系的Hd5 (DTH8)可作为湘陵628S改良的候选基因,而恢复系的Ef-1、E2、E3在决定不同组合感光性强弱中不起主要作用
等位性测验结果表明, 湘陵628S携带强感光等位基因, 理论上无论与何种等位基因配对, 均对感光性变化不起作用。然而, 由于()基因被报道在形成感光复合物//中不可或缺, 因此它对于E()基因发挥功能至关重要。经测序后发现, 在3个测定的感光基因中, 株1S仅基因与湘陵628S存在差异。株1S携带隐性的基因, 由于1 bp的缺失, 其编码的DTH8蛋白会发生移码, 蛋白功能丧失。已知在感光性方面, 不育供体株1S相比于湘陵628S对父本的选择限制低, 两者之间的差异可能与基因的功能有关。因此,可以作为湘陵628S改良的候选基因。通过CRISPR等现代技术手段可以定点突变湘陵628S中的基因, 从而改善感光性在杂交配组中的影响。
测验系EG2 (HD, 76 d)和EG3 (HD, 86 d)比EG0 (HD, 71 d)分别延迟抽穗5 d和15 d, 说明E和E的感光性较E弱。当湘陵628S与EG2, EG3杂交时, S/EG2、S/EG3的抽穗期分别82 d和83 d, 与湘陵628S (HD, 81 d)相当。由此推测, 湘陵628S本身携带有显性的E、E等位基因, 当它与其他材料杂交时, 父本中的显性的E、E不会增强杂交组合的感光性。
显性可以显著促进抽穗。当湘陵628S与携带隐性的T65m (eeSe-1Se-1ef-1ef-1)杂交后, S/T65m (HD~89 d)比湘陵628S (HD~81 d)延迟抽穗8 d, 这说明父本中携带的隐性会引起基本营养生长性的改变, 导致抽穗延迟, 但是总体对杂种F1的影响较小。
抽穗期由遗传因素与外界共同协调起作用, 含有Se-1Se-1或ee的材料由于较弱的感光性, 生育期短, 因此在人工驯化中被保留下来作为早稻, 而相比之下, 晚稻中该2个基因之一极有可能为显性, 因此, 湘陵628S与一些晚稻组配群体时出现晚熟的现象主要是受E与基因的影响。在组合选育中, 如何高效选择具有适宜感光特性的恢复系进行杂交是亟待解决的问题。我们针对E和基因开发了2个功能性分子标记, 其中E1D可用于筛选含有()基因缺失的材料, SeI用于筛选含有隐性()等位基因的材料(图4-B)。通过这2个分子标记快速鉴定恢复系, 能够对湘陵628S杂交组合的感光性强弱进行预评估。如果存在性状优良但含有显性或的恢复系材料, 我们也可以通过对进行基因编辑敲除或回交选育来改良湘陵628S, 从而拓宽其父本的选择范围。
4 结论
湘陵628S携带有隐性的E和等位基因和显性的Hd5E、E和EF-1等位基因, 其E()基因存在缺失,()为弱感光性单倍型,()基因为强感光性单倍型。不同“陵两优”组合的感光性强弱与其恢复系中的E()基因密切相关, 而与()、()基因无直接相关。所有强感光组合的恢复系材料均含有完整的基因, 而所有弱感光的组合的恢复系材料均缺失基因。湘陵628S与其不育供体株1S的E()和()基因型一致, 但()基因存在显著差异, 其中湘陵628S携带强感光等位基因, 而株1S携带有功能缺失的等位基因。
[1] 万建民. 水稻籼粳交杂种优势利用研究. 杂交水稻, 2010, (增刊1): 3–6.
Wan J M. Utilization of strong heterosis betweenandvarieties in rice., 2010, (S1): 3–6 (in Chinese).
[2] 符辰建, 秦鹏, 胡小淳, 杨远柱. 矮秆抗倒水稻温敏核不育系湘陵628S的选育. 杂交水稻, 2010, (增刊1): 177–181.
Fu C J, Qin P, Hu X C, Yang Y Z. Breeding of lodging-resistant dwarf thermo-sensitive genic male sterile line Xiangling 628S in rice., 2010, (S1): 177–181 (in Chinese).
[3] Yano M, Kojima S, Takahashi Y, Lin H, Sasaki T. Genetic control of flowering time in rice, a short-day plant., 2001, 127: 1425–1429.
[4] Saito H, Okumoto Y, Tsukiyama T, Xu C, Teraishi M, Tanisaka T. Allelic differentiation at the/locus has allowed expansion of rice cultivation area.(Basel), 2019, 8: 550.
[5] Xue W Y, Xing Y Z, Weng X Y, Zhao Y, Tang W J, Wang L, Zhou H J, Yu S B, Xu C G, Li X H, Zhang Q F. Natural variation inis an important regulator of heading date and yield potential in rice., 2008, 40: 761–767.
[6] Yano M, Katayose Y, Ashikari M, Yamanouchi U, Monna L, Fuse T, Baba T, Yamamoto K, Umehara Y, Nagamura Y, Sasaki T., a major photoperiod sensitivity quantitative trait locus in rice, is closely related to theflowering time gene CONSTANS., 2000, 12: 2473–2484.
[7] Gao H, Jin M N, Zheng X M, Chen J, Yuan D Y, Xin Y Y, Wang M Q, Huang D Y, Zhang Z, Zhou K N, Sheng P K, Ma J, Ma W W, Deng H F, Jiang L, Liu S J, Wang H Y, Wu C Y, Yuan L P, Wan J M. Days to heading 7, a major quantitative locus determining photoperiod sensitivity and regional adaptation in rice., 2014, 111: 16337–16342.
[8] Yan W H, Liu H Y, Zhou X C, Li Q P, Zhang J, Lu L, Liu T M, Liu H J, Zhang C J, Zhang Z Y, Shen G J, Yao W, Chen H X, Yu S B, Xie W B, Xing Y Z. Natural variation inplays an important role in grain yield and adaptation in rice., 2013, 23: 969–971.
[9] Yan W H, Wang P, Chen H X, Zhou H J, Li Q P, Wang C R, Ding Z H, Zhang Y S, Yu S B, Xing Y Z, Zhang Q F. A major QTL,, plays pleiotropic roles in regulating grain productivity, plant height, and heading date in rice., 2011, 4: 319–330.
[10] Wei X J, Xu J F, Guo H N, Jiang L, Chen S H, Yu C Y, Zhou Z L, Hu P S, Zhai H Q, Wan J M.suppresses flowering in rice, influencing plant height and yield potential simultaneously., 2010, 153: 1747–1758.
[11] Bian X F, Liu X, Zhao Z G, Jiang L, Gao H, Zhang Y H, Zheng M, Chen L M, Liu S J, Zhai H Q, Wan J M. Heading date gene,controlled late flowering inSteud. by down-regulating., 2011, 30: 2243–2254.
[12] Zong W B, Ren D, Huang M H, Sun K L, Feng J L, Zhao J, Xiao D D, Xie W H, Liu S Q, Zhang H, Qiu R, Tang W J, Yang R Q, Chen H Y, Xie X R, Chen L T, Liu Y G, Guo J X. Strong photoperiod sensitivity is controlled by cooperation and competition among,andin rice heading., 2021, 229: 1635–1649.
[13] Fujino K, Yamanouchi U, Nonoue Y, Obara M, Yano M. Switching genetic effects of the flowering time genein LD conditions byandin rice., 2019, 69: 127–132.
[14] Zhang Z Y, Hu W, Shen G J, Liu H Y, Hu Y, Zhou X C, Liu T M, Xing Y Z. Alternative functions ofin repressing or promoting heading are determined bystatus under long-day conditions., 2017, 7: 5388.
[15] Nemoto Y, Nonoue Y, Yano M, Izawa T., a CONSTANS ortholog in rice, functions as anrepressor through interaction with monocot-specific CCT-domain protein Ghd7., 2016, 86: 221–233.
[16] Du A P, Tian W, Wei M H, Yan W, He H, Zhou D, Huang X, Li S G, Ou-Yang X H. The DTH8-Hd1 module mediates day-length- dependent regulation of rice flowering., 2017, 10: 948–961.
[17] Zhou X C, Nong C X, Wu B, Zhou T H, Zhang B, Liu X S, Gao G J, Mi J M, Zhang Q L, Liu H Y, Liu S S, Li Z X, He Y Q, Mou T M, Guo S B, Li S Q, Yang Y Z, Zhang Q F, Xing Y Z. Combinations of,, anddetermine strong heterosis of commercial rice hybrids in diverse ecological regions., 2021, 72: 6963–6976.
[18] Zhang B, Liu H Y, Qi F X, Zhang Z Y, Li Q P, Han Z M, Xing Y Z. Genetic interactions among,,andcontribute to large variation in heading date in rice.(New York), 2019, 12(1): 48.
[19] Zhang J, Zhou X C, Yan W H, Zhang Z Y, Lu L, Han Z M, Zhao H, Liu H Y, Song P, Hu Y, Shen G J, He Q, Guo S B, Gao G Q, Wang G W, Xing Y Z. Combinations of the,andgenes largely define the ecogeographical adaptation and yield potential of cultivated rice., 2015, 208: 1056–1066.
[20] Wei X J, Jiang L, Xu J F, Lu G W, Wan J M. Genetic analyses of heading date ofrice cultivars from northern China., 2008, 107: 147–154.
[21] Zhou X C, Nong C X, Wu B, Zhou T H, Zhang B, Liu X S, Gao G J, Mi J M, Zhang Q L, Liu H Y, Liu S S, Li Z X, He Y Q, Mou T M, Guo S B, Li S Q, Yang Y Z, Zhang Q F, Xing Y Z. Combinations of,, anddetermine strong heterosis of commercial rice hybrids in diverse ecological regions., 2021, 72: 6963–6976.
Genetic analysis of photosensitivity divergence among hybrids derived from rice sterile line Xiangling 628S
CHEN Sai-Hua1, PENG Sheng1, YOU Yi-Wen1, ZHANG Lu-Yao1, WANG Kai3, XUE Ming1,*, YANG Yuan-Zhu3,*, and WAN Jian-Min2
1Jiangsu Key Laboratory of Crop Genomics and Molecular Breeding / Key Laboratory of Plant Functional Genomics of the Ministry of Education / Jiangsu Key Laboratory of Crop Genetics and Physiology, Agricultural College of Yangzhou University, Yangzhou 225009, Jiangsu, China;2State Key Laboratory for Crop Genetics and Germplasm Enhancement / Jiangsu Plant Gene Engineering Research Center / Nanjing Agricultural University, Nanjing 210095, Jiangsu, China;3Key Laboratory of Southern Rice Innovation & Improvement, Ministry of Agriculture and Rural Affairs / Hunan Engineering Laboratory of Disease and Pest Resistant Rice Breeding / Yuan Longping High-Tech Agriculture Co., Ltd., Changsha 410128, Hunan, China
Xiangling 628S is a high quality thermosensitive male sterile line of two-line hybrid rice, whose hybrids have high-quality rice and is suit for light-cultivation, large-scale, and mechanized planting, and 40 new hybrid rice varieties have been approved and widely used. However, its hybrids had strong photosensitivity when it crossed with a large majority of mid-late cultivars, and headed late or even not heading under long-day (LD) conditions, which limited its application in the Yangtze River area. To explore the genetic mechanism of photosensitivity divergence among different hybrids, several key photosensitive loci in Xiangling 628S and its restorer lines were analyzed by allelism tests combined with sequence analysis. The results showed that Xiangling 628S had recessiveee,Se-1Se-1and dominantHd5Hd5,EE,EE, andEF-1EF-1, showing weak photosensitivity. The photosensitivity divergence in different hybrids was closely correlated withE() locus in restorer lines, but not with() and(). Finally, we developed two functional molecular markers for genetic identification ofEandloci in restorer lines, which would speed up the selection of weak/non-sensitive hybrids of Xiangling 628S. Our study provides important theoretical guidance and technical supports for the utilization of Xiangling 628S in breeding, as well as hybrid breeding with other sterile lines.
rice; sterile line; photosensitive; genes; molecular marker
10.3724/SP.J.1006.2023.22015
本研究由江苏省农业自主创新基金项目(基于qTT12的水稻耐高温种质资源创制) (CX(21)3100)和湖南省科技创新计划项目(2021NK1001)资助。
This study was supported by the Jiangsu Agricultural Science and Technology Innovation Fund “Development of Rice Germplasms with Heat-tolerance Based on qTT12 (CX(21)3100)” and Science and Technology Innovation Program of Hunan Province (2021NK1001).
薛明, E-mail: 007747@yzu.edu.cn; 杨远柱, E-mail: yangyuanzhu@lpht.com.cn
E-mail: chensaihua@yzu.edu.cn
2022-03-12;
2022-05-05;
2022-05-13.
URL: https://kns.cnki.net/kcms/detail/11.1809.S.20220512.1510.006.html
This is an open access article under the CC BY-NC-ND license (http://creativecommons.org/licenses/by-nc-nd/4.0/)
