间作西瓜对甘蔗产量效益和根际土壤理化性质及微生态的影响
2023-02-10韦星璇杨尚东谭宏伟
肖 健 韦星璇 杨尚东 卢 文 谭宏伟
间作西瓜对甘蔗产量效益和根际土壤理化性质及微生态的影响
肖 健1韦星璇1杨尚东1卢 文3,*谭宏伟2,*
1广西大学农学院, 广西南宁 530004;2广西壮族自治区农业科学院 / 广西甘蔗遗传改良重点实验室, 广西南宁 530007;3广西扶绥县农业科学研究所, 广西扶绥 532199
分析甘蔗间作西瓜对甘蔗产量、总经济效益、根际土壤生态及理化性质的影响, 旨在探究甘蔗间作西瓜模式的生态效应, 为进一步推广及应用甘蔗间作西瓜模式提供理论依据和技术支撑。基于传统和现代高通量测序技术, 分析间作和单作甘蔗产量、总经济效益、根际土壤理化性质及根际土壤细菌群落结构变化。与甘蔗单作(CK)相比, 甘蔗间作西瓜(TM)具有提高甘蔗产量和总经济效益的效果; 对甘蔗根际土壤有机质、全氮、全磷、全钾、碱解氮、速效磷和速效钾含量无显著影响; 同时, 甘蔗间作西瓜对甘蔗根际土壤细菌多样性和丰富度亦无显著影响。另一方面, 门分类水平, 甘蔗间作西瓜虽然增加了放线菌门(Actinobacteria)和其他(others)门类优势细菌的相对丰度占比, 但亦缺失了浮霉菌门(Planctomycetes)和拟杆菌门(Bacteroidetes)等门类优势细菌的富集; 属分类水平, 热酸菌属()、慢生根瘤菌属()、、、链霉菌属()、、、酸杆菌属()和则是甘蔗单作(CK)模式下甘蔗根际土壤中特有的优势细菌属; 与之相比, 小单孢菌属()、、、、、、卢得曼氏菌属()、、、、和则是甘蔗间作西瓜(TM)模式下, 甘蔗根际土壤中特有的优势细菌属。基因功能预测结果显示, 甘蔗间作西瓜并没有显著改变甘蔗植株根际土壤细菌的主体功能。与甘蔗单作相比, 甘蔗间作西瓜具有提高甘蔗产量和总经济效益的效果; 虽然没有显著改变甘蔗根际土壤理化性质, 同时亦没有显著提升甘蔗根际土壤细菌多样性、丰富度以及细菌主体功能, 仅改变了部分甘蔗根际土壤细菌的群落组成, 富集了诸如小单孢菌属()等特有的优势细菌属。综上所述, 甘蔗间作西瓜有助于提高甘蔗产量和总经济效益, 虽不能显著提升甘蔗根际土壤肥力, 但亦没有造成甘蔗根际土壤细菌生态功能失衡或劣化, 只是改变了部分甘蔗根际土壤细菌群落组成, 但间套作西瓜富集的特有优势细菌属, 诸如小单孢菌属()属细菌是具有增强甘蔗植株抗性功能的有益细菌属。
间作; 甘蔗; 西瓜; 土壤细菌; 高通量测序
甘蔗(spp. Hybrids)是一种重要的糖料作物和可再生生物能源作物[1]。中国是世界第三大甘蔗生产国, 自1993年以来, 广西一直是中国最大的甘蔗生产和制糖省区[2]。然而, 由于现阶段甘蔗机械化程度偏低、国际糖价低迷等因素导致甘蔗生产成本升高, 种植效益降低, 严重影响蔗农种植积极性。开展甘蔗间套作栽培是增加蔗农种植效益的重要途径[3-5]。甘蔗种植行距宽、植株高大、生长期长, 适合与生长快速、生育期短的矮秆作物间作[3], 充分利用同一块地的空间、时间和土壤养分, 提高土地利用率, 增加蔗农收入[6]。
西瓜()是蔓生作物, 在热带地区种植具有很高的经济效益[7]。适合与甘蔗进行高矮搭配间作种植。甘蔗间作西瓜, 不仅可以有效利用光、温、水、热及土地资源[3], 还能增加产量[8]和经济效益[9], 有助于蔗糖产业的可持续发展。
甘蔗间套种西瓜是现阶段广西蔗农广泛应用的一种间套作栽培模式。虽然至今国内外涉及甘蔗间套作的研究较多, 但间套种作物主要包括甘蔗/豆科作物(大豆、豌豆、绿豆、花生)、甘蔗/禾本科(玉米、小麦)、甘蔗/蔬菜(马铃薯、芥菜、洋葱、大蒜)等[1,3]方面, 且研究内容多聚焦于间作对甘蔗产量、品质、经济效益、土壤肥力以及病虫草害等领域的影响方面[3,8-10]。研究表明[8-9], 甘蔗套种西瓜模式的平均西瓜产量达24,090 kg hm–2, 新增产值达38,544元 hm–2, 总产值达78,504元 hm–2; 此外, 与甘蔗单作相比, 增收大豆12,000~13,200元 hm–2, 甘蔗平均增产36.15 t hm–2, 增收8400~10,500元 hm–2, 总效益增加16,500~25,500元 hm–2。甘蔗间作西瓜虽然能提高产量和经济效益等, 但该生产模式是否会对土壤肥力或健康产生不利影响?目前, 甘蔗间作西瓜模式对甘蔗根际土壤肥力及微生态环境影响方面仍鲜见报道。
因此, 本文分析甘蔗间作西瓜模式下甘蔗产量、总经济效益、根际土壤理化性质及细菌群落结构特征, 旨在探究甘蔗间作西瓜对甘蔗产量、总经济效益、根际土壤肥力及微生态的影响, 为优化栽培管理措施及构建可持续发展的甘蔗间套作技术体系提供理论依据和技术支撑。
1 材料与方法
1.1 试验地概况
试验地为广西壮族自治区崇左市扶绥县农业科学研究所生产基地(22°38′06″N, 107°54′14″E)。前茬作物均为甘蔗。土壤理化性质如下: pH 4.9, 有机质含量20.3 g kg–1, 全氮含量0.41 g kg–1, 全磷含量0.45 g kg–1, 全钾含量9.2 g kg–1, 碱解氮含量37 mg kg–1, 速效磷含量13 mg kg–1, 速效钾含量79 mg kg–1。
1.2 试验设计
试验开始于2016年, 以甘蔗品种‘新台糖22号’为试验材料, 西瓜品种为‘黑美人’; 采用随机区组设计, 以甘蔗单作(CK)作为对照, 以甘蔗/西瓜间作(TM)为处理进行田间试验。每个处理设3个重复, 共6个小区, 每个小区5行, 行长7 m, 甘蔗栽培行距1.8 m, 小区面积63 m2。试验地用大型拖拉机犁耙整地开行后于每年2月中下旬种植, 所有种植模式均按相同田间管理。同时, 每年5月中下旬完成西瓜采收, 采收完成后于6月前完成甘蔗封行前的培土工作。同时, 收获时按区惠平等[11]和李停锋等[12]的测定方法分别对2016—2018年甘蔗间作西瓜模式下的甘蔗和西瓜进行称重测产, 按照市场收购价(甘蔗收购价500 元 t–1, 西瓜收购价1000元 t–1)计算总经济效益。
1.3 样品采集
于2018年6月上旬随机采集当年新植蔗根际土壤样品。采集方法参照Yang等[13]的方法, 具体操作简述如下: 用75%乙醇喷洒铁铲进行消毒, 并于每种种植模式下, 随机选取6株长势一致的甘蔗植株, 然后以蔗茎为中心(直径约60 cm)挖深度约40 cm, 形成疏松、环形的根际圈。然后手握植株茎基部用力将整个植株连根带土拔起, 抖掉附着在根部的土壤, 每6株相同处理所取的根际土壤样品混合为1个生物学土壤重复样本, 共进行3次生物学重复, 分别标记后装入无菌密封袋放入放置有冰袋的冰盒带回实验室。
1.4 土壤理化性状分析
采用电位法(土∶水=1∶2.5, 质量体积比)测定土壤pH; 采用重铬酸钾-硫酸氧化法测定有机质(soil organic matter, SOM); 采用全自动凯氏定氮仪测定全氮(total nitrogen, TN); 采用硫酸-高氯酸消煮后分别用钼锑抗比色法和火焰光度计法测定全磷(total phosphorus, TP)和全钾(total potassium, TK);
以硫酸亚铁为还原剂, 采用碱解氮扩散法测定碱解氮(available nitrogen, AN); 采用碳酸氢钠浸提-钼锑抗比色法测定速效磷(available phosphorus, AP); 采用乙酸铵交换-火焰光度计法测定速效钾(available potassium, AK)。具体分析方法详见《土壤农业化学分析方法》[14]。
1.5 土壤细菌多样性分析
由上海美吉生物医药科技有限公司完成根际土壤样品总DNA提取、PCR扩增和序列的测定。具体测序流程简述如下[15-16]。
DNA抽提和PCR扩增: 根据FastDNA Spin Kit for Soil试剂盒(MP Biomedicals, 美国)说明书进行总DNA抽提, 使用NanoDrop2000分光光度计(Thermo Fisher Scientific, 美国)检测DNA浓度和纯度, 即DNA提取质量利用1%琼脂糖凝胶电泳进行检测, 并以提取的土壤微生物DNA为模板, 选择338F (5′-ACTCCTACGGGAGGCAGCAG-3′)和806R (5′-GGACTACHVGGGTWTCTAAT-3′)为引物对细菌V3~V4可变区进行PCR扩增。PCR扩增在ABI GeneAmp 9700 (ABI, 美国)上进行。
Illumina Miseq测序: 将同一样本的PCR产物混合后使用2%琼脂糖凝胶回收PCR产物, 利用AxyPrep DNA Gel Extraction Kit (Axygen Biosciences, 美国)进行回收产物纯化, 2%琼脂糖凝胶电泳检测, 并用Quantus Fluorometer (Promega, 美国)对回收产物进行检测定量。使用NEXTFLEX Rapid DNA-Seq Kit进行建库。利用Illumina公司的MiseqPE300平台进行测序(上海美吉生物医药科技有限公司)。参照的肖健等[1]的研究方法对测序数据进行处理和分析。
1.6 统计分析
使用Mothur (v.1.30.2, https://mothur.org/wiki/ calculators/)软件计算细菌群落的Alpha多样性。选择相似度为97%的OTU表, 并使用R语言(v.3.3.1)工具进行细菌群落组成分析和Venn分析, 并进行统计和绘图。使用LEfSe (http://huttenhower.sph.harvard. edu/galaxy/root?tool_id=lefse_upload)软件对样品按照基于分类学组成的不同分组条件进行线性判别分析(LDA), 以确定对样品划分有明显差异影响的群组。使用BugBase (https://bugbase.cs.umn.edu/index. html)软件对微生物组进行表型预测。使用PICRUSt (v.1.1.0, http://picrust.github.io/picrust/)对OTU丰度表进行标准化, 根据KEGG数据库(Kyoto Encyclo-pedia of Genes and Genomes, 京都基因和基因组百科全书, http://www.genome.jp/kegg/)计算各功能类别的丰度。使用R语言(v.3.3.1) (pheatmap package)工具进行土壤细菌与土壤理化性质相关性分析并进行统计和绘图。
采用Microsoft Excel 2019统计数据, 采用IBM SPSS Statistics 21统计软件进行方差分析, 采用独立样本检验和秩和检验进行显著性检验(<0.05), 并利用上海美吉生物医药科技有限公司的生信云数据分析平台进行在线数据分析。平均数据以“平均数±标准差(S.D.)”表示。
2 结果与分析
2.1 甘蔗间作西瓜模式下甘蔗和西瓜产量及总经济效益
由表1可知, 2016年, 甘蔗单作(CK)模式下甘蔗产量为80.63 t hm–2, 总经济效益为40,316.67元 hm–2; 甘蔗间作西瓜(TM)模式下甘蔗产量为80.33 t hm–2、西瓜产量为13.30 t hm–2, 总经济效益为53,366.76元 hm–2, 虽然甘蔗产量略低于甘蔗单作(CK), 总经济效益高于甘蔗单作(CK), 但均无显著差异(>0.05); 2017年和2018年, 甘蔗间作西瓜(TM)模式下甘蔗产量和总经济效益同样高于甘蔗单作(CK), 但均无显著差异(>0.05)。这一结果不仅与前人研究结果[8-9]一致, 而且表明甘蔗间作西瓜(TM)有助于提高甘蔗产量和总经济效益的效果。
2.2 甘蔗间作西瓜模式下甘蔗根际土壤理化性质
由表2可知, 与甘蔗单作(CK)相比, 甘蔗间作西瓜(TM)模式下, 甘蔗根际土壤有机质、全氮、全磷、全钾、碱解氮、速效磷和速效钾含量均无显著变化, 表明甘蔗间作西瓜对甘蔗根际土壤理化性质无显著影响。
2.3 甘蔗间作西瓜模式下甘蔗根际土壤细菌Alpha多样性
基于云平台分析甘蔗间作西瓜模式下, 甘蔗根际土壤细菌的丰富度和多样性指数。其中, 以Shannon[17]和Simpson指数[18]指示内生细菌的多样性, Chao1[19]和Ace指数[17]指示内生细菌的丰富度。Chao1、Ace和Shannon指数越大, Simpson指数越小, 说明样品的物种丰富度和多样性越高。
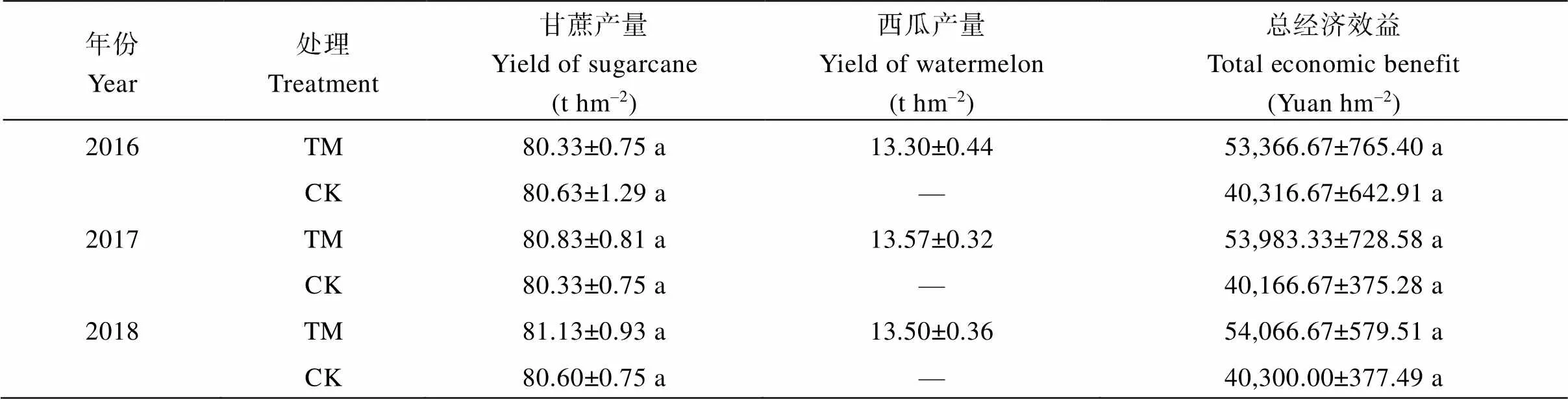
表1 甘蔗间作西瓜模式下甘蔗和西瓜产量及总经济效益
TM: 甘蔗间作西瓜; CK: 甘蔗单作。表中数据为平均值±标准差; 数据后不同小写字母表示甘蔗不同种植模式之间差异显著(< 0.05)。
TM: sugarcane intercropping watermelon; CK: sugarcane monoculture. Data in the table are means ± SDs; Values followed by different lowercase letters mean significant difference at< 0.05 between different planting patterns of sugarcane.
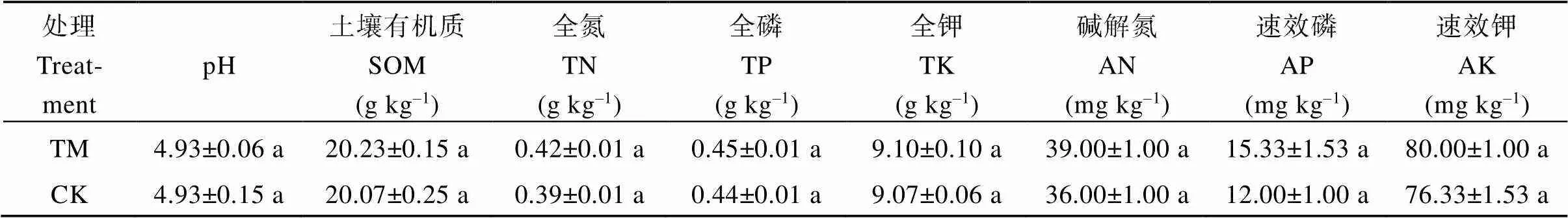
表2 甘蔗间作西瓜模式下甘蔗根际土壤理化性质
TM: 甘蔗间作西瓜; CK: 甘蔗单作。表中数据为平均值±标准差; 数据后不同小写字母表示甘蔗不同种植模式之间差异显著(< 0.05)。
SOM: soil organic matter; TN: total nitrogen; TP: total phosphorus; TK: total potassium; AN: the available nitrogen; AP: the available phosphorus; AK: the available potassium; TM: sugarcane intercropping watermelon; CK: sugarcane monoculture. Data in the table are means ± SDs; Values followed by different lowercase letters mean significant difference at< 0.05 between different planting patterns of sugarcane.
由表3可知, 甘蔗间作西瓜模式下, 指示细菌丰富度的Ace指数和Chao1指数, 以及指示细菌多样性的Shannon和Simpson指数均与甘蔗单作(CK)之间无显著差异(>0.05)。表明甘蔗间作西瓜对甘蔗根际土壤细菌多样性和丰富度亦无显著影响。
2.4 群落组成分析
2.4.1 甘蔗间作西瓜模式下甘蔗根际土壤细菌优势群落门分类水平 门分类水平, 甘蔗间作西瓜和单作模式下甘蔗根际土壤中, 相对丰度占比大于1%的优势土壤细菌门分类水平数量分别为7个和9个(图1)。
甘蔗单作(CK)模式下,甘蔗根际土壤优势细菌门相对丰度占比大小顺序依次分别为: 变形菌门(Proteobacteria, 28.73%), 放线菌门(Actinobacteria, 26.03%), 绿弯菌门(Chloroflexi, 15.75%), 酸杆菌门(Acidobacteria, 12.61%), 厚壁菌门(Firmicutes, 6.02%), 芽单胞菌门(Gemmatimonadetes, 2.74%), 硝化螺旋菌门(Nitrospirae, 2.55%), 浮霉菌门(Planctomycetes, 1.38%), 拟杆菌门(Bacteroidetes, 1.12%)和其他(Others)门类占比3.09%。
与之相比, 甘蔗间作西瓜(TM)模式下, 甘蔗根际土壤优势细菌门相对丰度占比大小顺序依次分别为: 放线菌门(Actinobacteria, 38.05%), 变形菌门(Proteobacteria, 21.12%), 绿弯菌门(Chloroflexi, 15.03%), 酸杆菌门(Acidobacteria, 9.36%), 厚壁菌门(Firmicutes, 5.67%), 硝化螺旋菌门(Nitrospirae, 3.90%), 芽单胞菌门(Gemmatimonadetes, 1.72%)和其他(others)门类占比3.40%。
与CK相比, 甘蔗间作西瓜增加了放线菌门(Actinobacteria)和其他(others)门类细菌的相对丰度占比, 但同时亦导致浮霉菌门(Planctomycetes)和拟杆菌门(Bacteroidetes)细菌缺失(图1)。
2.4.2 甘蔗间作西瓜模式下甘蔗根际土壤细菌优势群落属分类水平 属分类水平, 甘蔗间作西瓜和单作模式下甘蔗根际土壤中相对丰度占比大于1%的优势细菌属的数量及丰度占比如图2所示。其中, 甘蔗间作西瓜和甘蔗单作模式中, 优势细菌属的数量分别为26个和23个。
其中, 甘蔗单作(CK)根际土壤细菌优势菌属占比大小顺序依次分别为:(5.60%)、(5.54%)、(4.52%)、芽孢杆菌属(, 3.92%)、(3.67%)、热酸菌属(, 2.78%)、(2.67%)、硝化螺旋菌属(, 2.55%)、(2.25%)、慢生根瘤菌属(, 2.02%)、(1.99%)、光合玫瑰菌属(, 1.91%)、(1.84%)、鞘氨醇单胞菌属(, 1.84%)、(1.83%)、(1.75%)、(1.45%)、(1.38%)、(1.30%)、酸杆菌属(r, 1.12%)、(1.09%)、链霉菌属(, 1.00%)、(1.02%)及其他(Others)占比为37.41%。

表3 甘蔗间作西瓜模式下甘蔗根际土壤细菌Alpha多样性
TM: 甘蔗间作西瓜; CK: 甘蔗单作。表中数据为平均值 ± 标准差; 数据后不同小写字母表示甘蔗不同种植模式之间差异显著(< 0.05)。
TM: sugarcane intercropping watermelon; CK: sugarcane monoculture. Data in the table are mean ± SD; Values followed by different lowercase letters mean significant difference at< 0.05 between different planting patterns of sugarcane.
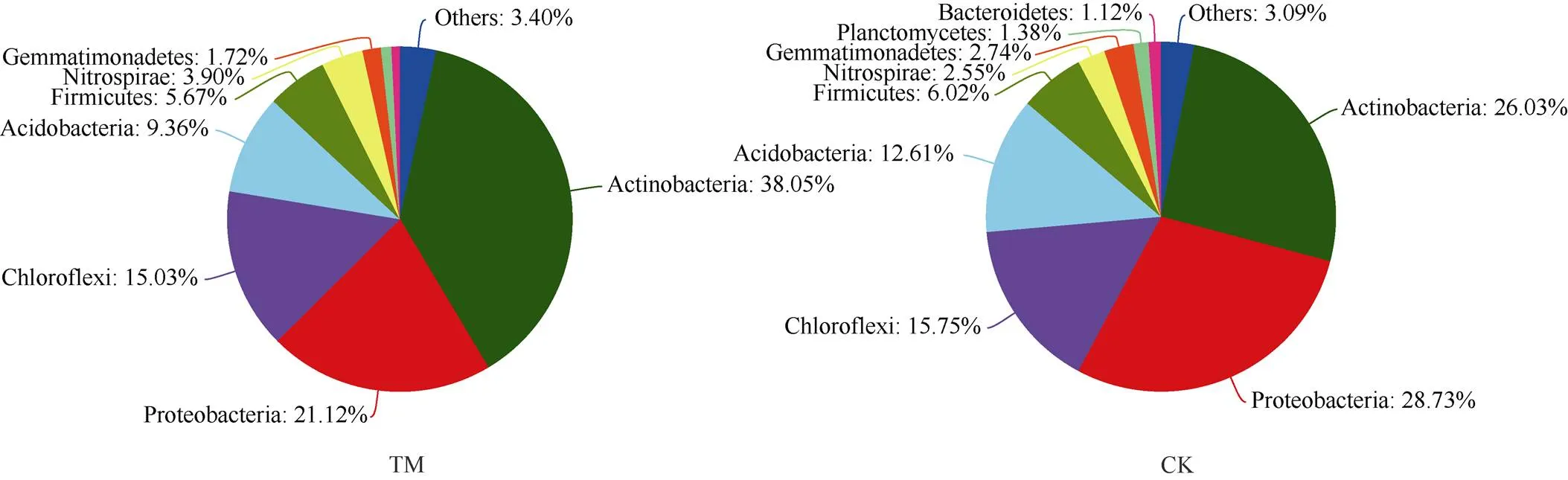
图1 甘蔗间作西瓜模式下甘蔗根际土壤细菌门分类水平组成
TM: 甘蔗间作西瓜; CK: 甘蔗单作。TM: sugarcane intercropping watermelon; CK: sugarcane monoculture.
甘蔗间作西瓜(TM)模式下, 甘蔗根际土壤细菌优势菌属占比大小顺序依次分别为:a (6.36%)、小单孢菌属(, 4.85%)、(4.10%)、硝化螺旋菌属(, 3.90%)、(3.49%)、光合玫瑰菌属(, 3.28%)、芽孢杆菌属(, 3.03%)、(2.62%)、(2.49%)、(2.34%)、(2.26%)、(2.23%)、(2.12%)、(1.83%)、(1.63%)、(1.54%)、(1.50%)、(1.40%)、(1.40%)、(1.39%)、(1.22%)、鞘氨醇单胞菌属(, 1.20%)、(1.09%)、卢得曼氏菌属(, 1.06%)、(1.06%)、(1.02%); 及其他(Others)占比为35.71%。
其中, 热酸菌属()、慢生根瘤菌属()、、、链霉菌属()、、、酸杆菌属()和则是甘蔗单作(CK)根际土壤中特有的优势细菌属。
小单孢菌属()、、、、、、卢得曼氏菌属()、、、、和则是甘蔗间作西瓜(TM)模式下, 甘蔗根际土壤中特有的优势细菌属(图2)。
2.5 甘蔗间作西瓜对甘蔗根际土壤细菌群落结构的影响
物种进化分支图(图3-Cladogram)从内圈到外圈依次展示了样本群落中从门到属的所有等级关系, 以及各分类单元在不同模式间的差异情况。通过LDA值分布柱状图(图3-LEfSe Bar, 筛选标准为<0.05, LDA score>3.5)可以发现不同栽培模式下主要的细菌类群。
由图3可知, 门分类水平, 放线菌门(Actinobacteria)细菌是甘蔗间作西瓜根际土壤中的优势细菌门类; 而变形杆菌门(Proteobacteria)和芽单胞菌门(Gemmatimonadetes)细菌是单作甘蔗根际土壤中的优势细菌门类; 属分类水平, 小单孢菌属()、、、、、、、和是间作甘蔗根际土壤中的优势细菌属; 而、、、、、、、和是单作甘蔗根际土壤中的优势细菌属。
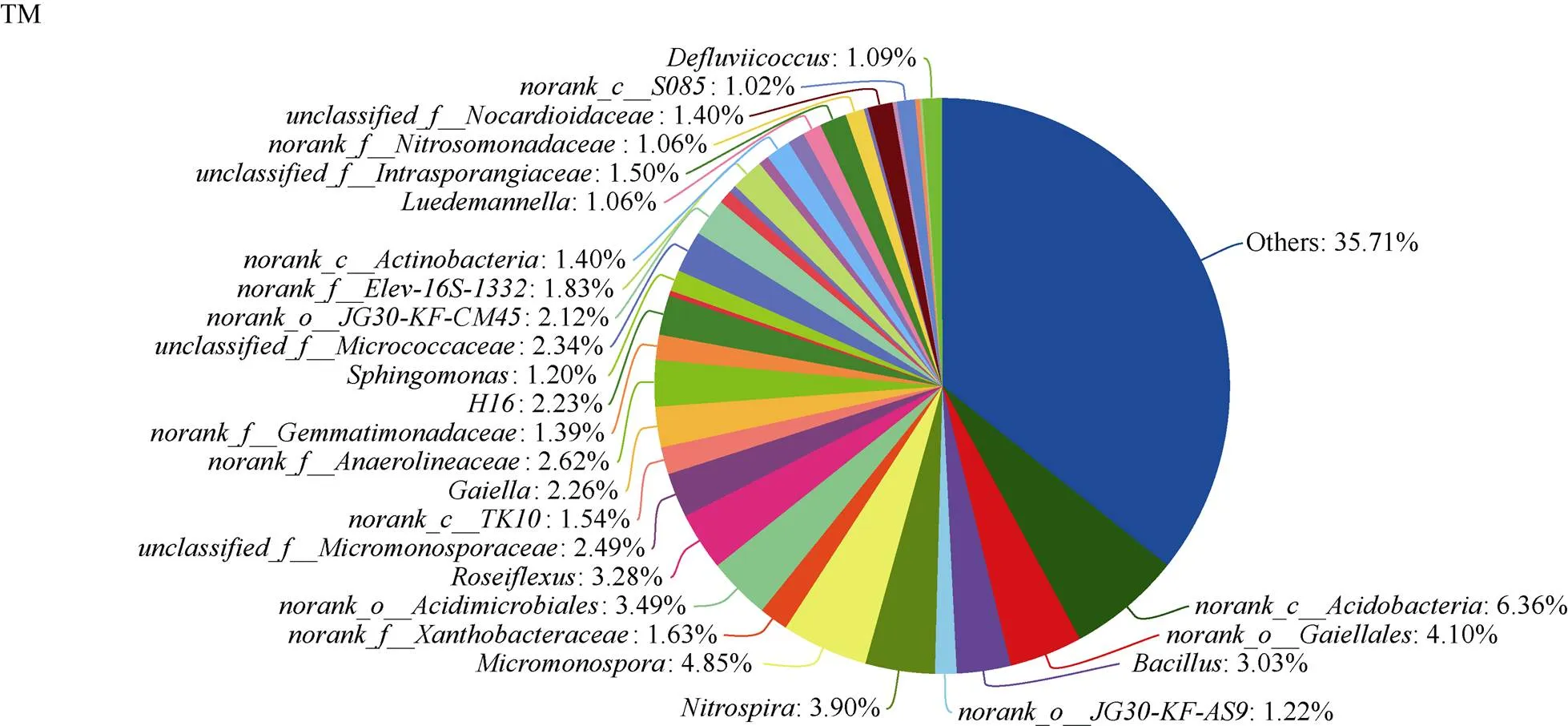
(图2)
TM: 甘蔗间作西瓜; CK: 甘蔗单作。TM: sugarcane intercropping watermelon; CK: sugarcane monoculture.
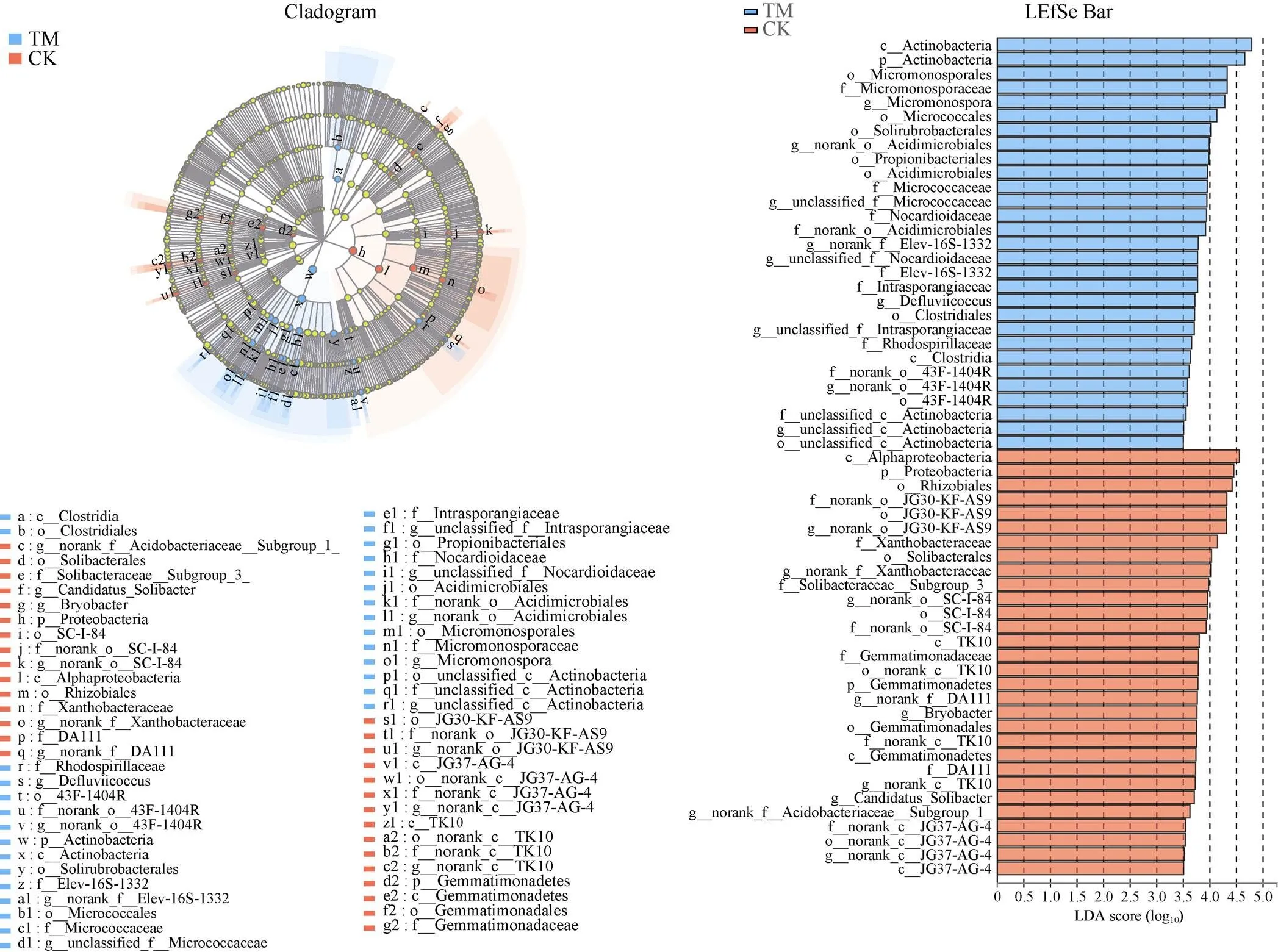
图3 甘蔗间作西瓜模式下甘蔗根际土壤细菌的LEfSe分析结果(LDA阈值为3.5)
TM: 甘蔗间作西瓜; CK: 甘蔗单作。TM: sugarcane intercropping watermelon; CK: sugarcane monoculture.
2.6 物种Venn分析
由图4可知, 甘蔗间作西瓜(TM)和甘蔗单作(CK)处理中, 甘蔗根际土壤细菌属分类水平数量分别为497个和492个; 其中, 共有细菌属的数量为433个, 而甘蔗间作西瓜(TM)和甘蔗单作(CK)甘蔗根际土壤中特有的细菌属数量分别为64个和59个。表明, 甘蔗间作西瓜(TM)不仅有助于提高甘蔗根际土壤细菌属分类水平数量, 而且有利于增加甘蔗根际土壤特有细菌属分类水平数量。
2.7 功能预测分析
BugBase是一个可以识别微生物组样本中存在的高水平表型, 并能够进行表型预测的微生物组分析工具。基于BugBase分析发现, 甘蔗间作西瓜(TM)和甘蔗单作根际土壤中, 细菌表型包括: 兼性厌氧性(Facultatively_Anaerobic)、厌氧性(Anaerobic)、形成生物膜(Forms_Biofilms)、移动元件(Contains_ Mobile_Elements)、革兰氏阳性(Gram_Positive)、潜在致病性(Potentially_Pathogenic)、需氧性(Aerobic)、革兰氏阴性(Gram_Negative)和胁迫耐受(Stress_ Tolerant)九大类(图5)。
与甘蔗单作相比, 甘蔗间作西瓜(TM)模式下, 革兰氏阳性(Gram_Positive)和胁迫耐受型(Stress_ Tolerant)细菌丰度占比显著高于相应的甘蔗单作(CK)模式; 甘蔗单作(CK)根际土壤中, 兼性厌氧性(Facultatively_Anaerobic)细菌丰度占比则显著高于相应的甘蔗间作西瓜(TM)模式。
另一方面, 比对KEGG数据库发现, 甘蔗间作西瓜(TM)和甘蔗单作(CK)甘蔗根际土壤中, 细菌的一级功能层共有6类生物代谢通路, 分别为细胞过程(cellular processes)、环境信息处理(environmental information processing)、遗传信息处理(genetic information processing)、人类疾病(human diseases)、代谢(metabolism)和有机系统(organismal systems)。与甘蔗单作(CK)相比, 6类代谢通路丰度在两者间均无显著差异(图6-A)。

图4 甘蔗间作西瓜模式下甘蔗根际土壤细菌属分类水平Venn图
TM: 甘蔗间作西瓜; CK: 甘蔗单作。
TM: sugarcane intercropping watermelon; CK: sugarcane monoculture.
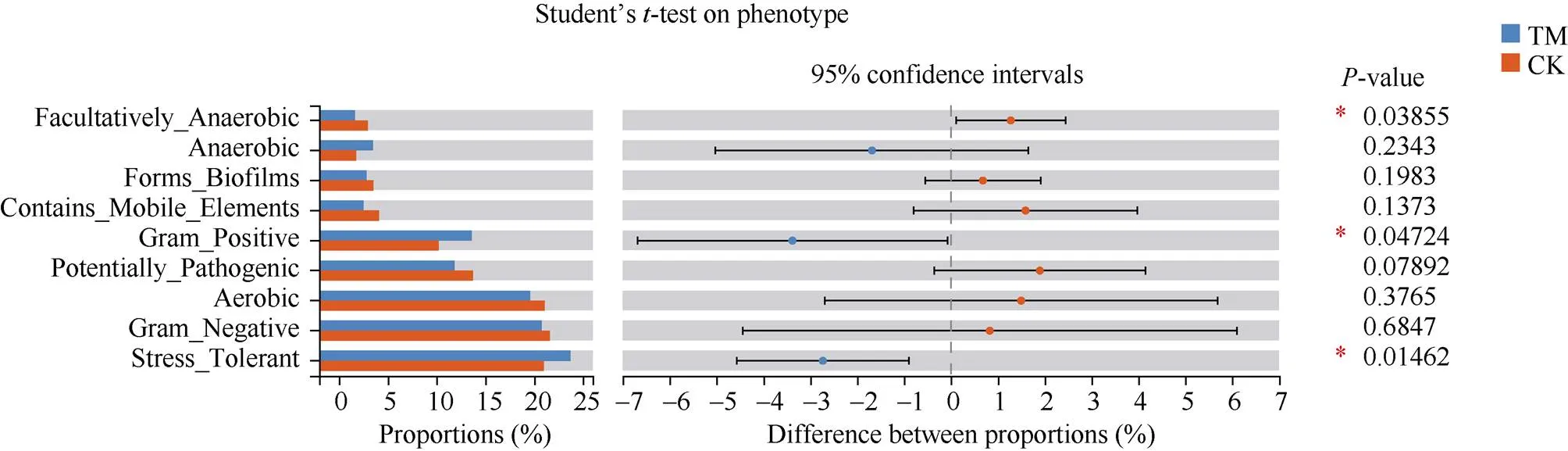
图5 细菌BugBase表型预测
TM: 甘蔗间作西瓜; CK: 甘蔗单作。*表示在0.05水平差异显著。
TM: sugarcane intercropping watermelon; CK: sugarcane monoculture.* mean significant difference at the 0.05 probability level.
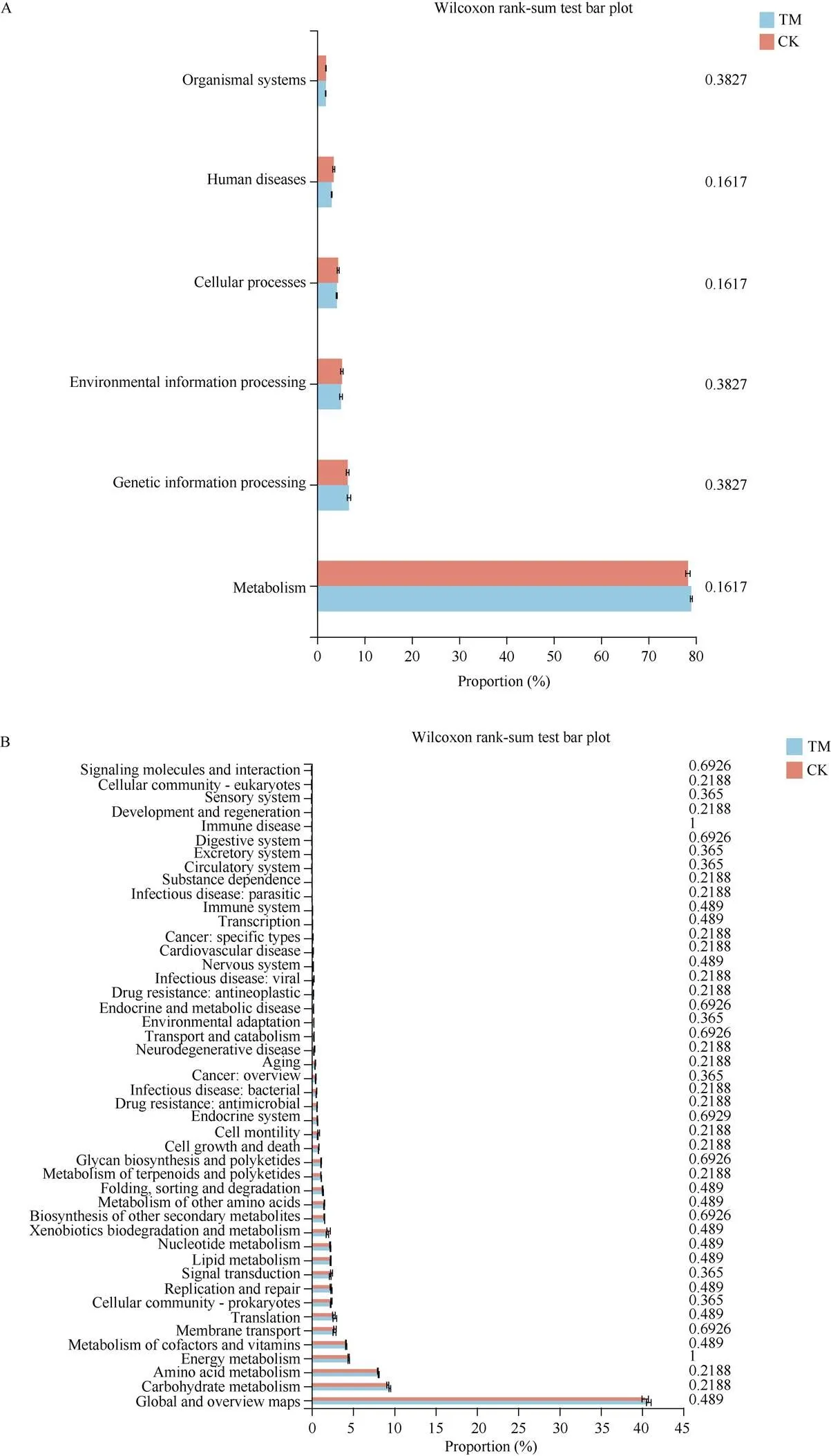
图6 间作和单作甘蔗根际土壤细菌一级(A)和二级功能层(B)预测功能基因的相对丰度
TM: 甘蔗间作西瓜; CK: 甘蔗单作。TM: sugarcane intercropping watermelon; CK: sugarcane monoculture.
此外, 甘蔗间作西瓜(TM)和甘蔗单作(CK)甘蔗根际土壤细菌基因二级功能层主要由发育(development)、细胞群落—真核生物(cellular community—eukaryotes)、信号分子与相互作用(signaling molecules and interaction)、细胞活性(cell motility)和核苷酸代谢(nucleotide metabolism)等46个子功能组成。与甘蔗单作(CK)相比, 46类代谢通路丰度在两者间亦均无显著差异(图6-B)。表明虽然甘蔗间作西瓜一定程度上改变了甘蔗根际土壤细菌的功能, 但并没有导致甘蔗植株根际土壤细菌主体功能发生显著变化。
2.8 根际土壤细菌与土壤理化性质相关性分析
相关性heat map图通过相关性数值可视化展示样本中不同物种与环境变量之间的关系, 评估微生物分类与环境变量之间的相关性。选用Spearman系数计算细菌类群与环境因子之间相关性。
由图7可知, 门分类水平, 放线菌门(Actinobacteria)细菌与AK、AN、TN、AP呈显著正相关; 拟杆菌门(Bacteroidetes)细菌与pH呈显著负相关; 浮霉菌门(Planctomycetes)细菌与TN和AP呈显著负相关; 变形菌门(Proteobacteria)细菌与AN呈极显著负相关;芽单胞菌门(Gemmatimonadetes)细菌与AK呈极极显著负相关, 与AN呈显著负相关。
3 讨论
微生物是生态系统中功能活跃, 开发潜力最大、最宝贵、最丰富的生物资源库[20]。土壤微生物作为评价农田微生态环境的生物指标, 在作物残体降解、腐殖质形成、物质循环及能量转化中发挥着重要作用[21]。另一方面, 根际微生物与作物健康密切相关, 其群落结构的变化将直接影响到作物的生长[22]。至今的研究发现, 微生物群落结构丰富, 物种越均匀, 多样性越丰富时, 对抗病原菌的综合能力就越强[22-24]。
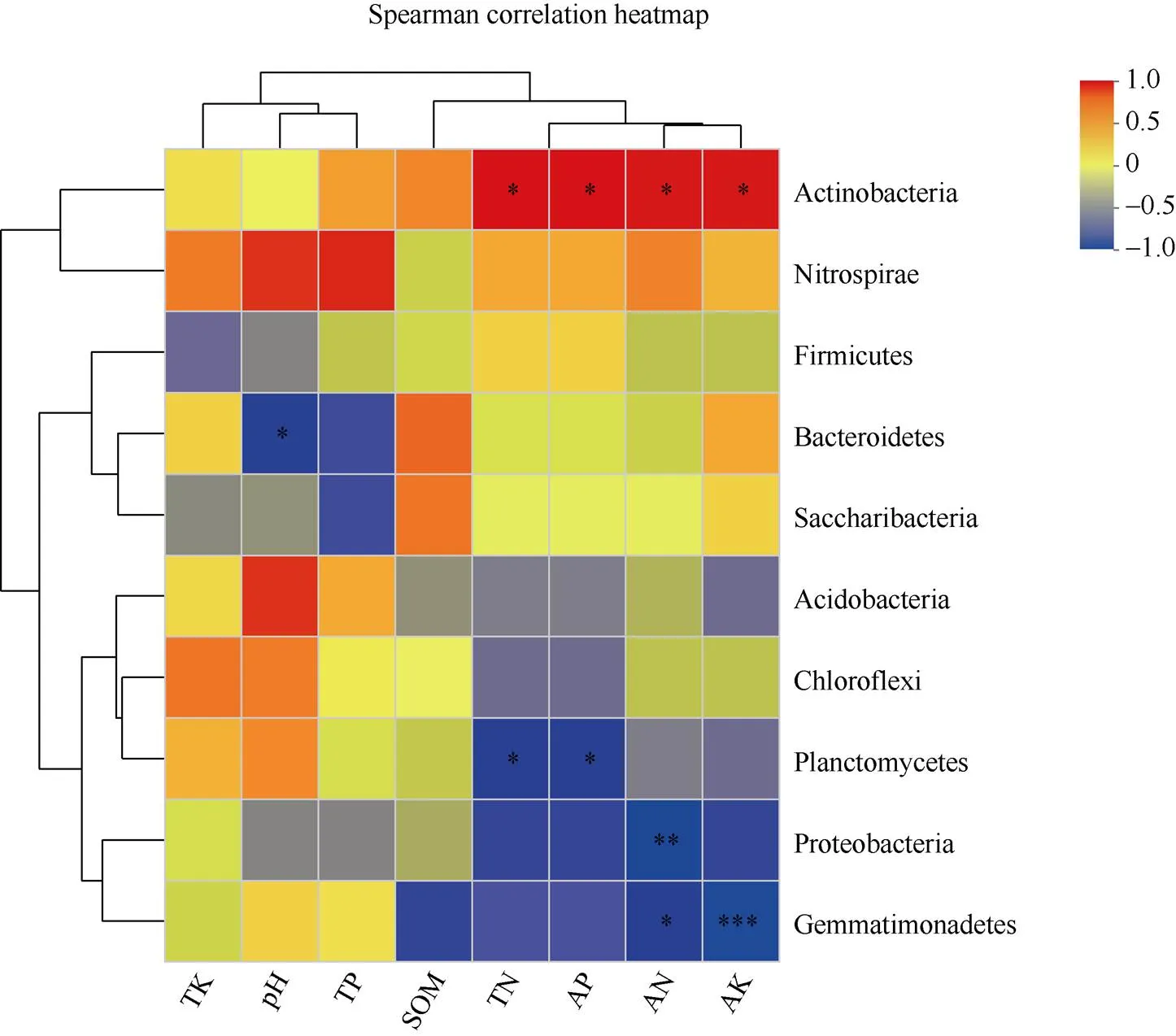
图7 丰度前10个土壤细菌门和土壤理化性质相关性热图
TK: 全钾; pH: pH值; TP: 全磷; SOM: 有机质; TN: 全氮; AP: 速效磷; AN: 碱解氮; AK: 速效钾; TM: 甘蔗间作西瓜; CK: 甘蔗单作。X轴和Y轴分别为环境因子和门, 通过计算获得相关性值和值。值在图中以不同颜色展示, 右侧图例是不同值的颜色区间; *、**、***分别表示在0.05、0.01、0.001水平差异显著。
TK: total potassium; pH: pH value; TP: total phosphorus; SOM: soil organic matter; TN: total nitrogen; AP: the available phosphorus; AN: the available nitrogen; AK: the available potassium; TM: sugarcane intercropping watermelon; CK: sugarcane monoculture. X and Y axis are environmental factors and phyla, correlationand-values are obtained by calculation.in different colors to show, the right side of the legend is the color range of different-values; *, **, and *** mean significant difference at the 0.05, 0.01, and 0.001 probability levels, respectively.
Yang等[26]和唐秀梅等[3]研究发现, 甘蔗间作黄豆、绿豆和花生等豆科作物均有利于提高甘蔗根际土壤细菌多样性和丰富度, 但Wang等[25]的研究发现, 小麦间作豆科植物并不显著影响小麦根际土壤微生物的群落结构。刘丽等[27]研究发现, 生长时间和栽培模式会显著影响柴胡根际微生物的多样性和丰富度。本研究发现, 甘蔗间作西瓜(TM)对甘蔗根际土壤细菌多样性和丰富度并不存在显著影响, 但甘蔗间作西瓜(TM)改变了甘蔗根际土壤细菌门、属分类水平的组成, 同时增加了特有的细菌属分类数量。由此推论: 甘蔗植株根际土壤细菌群落组成极易受间套作等栽培模式的影响, 但细菌多样性还受到间套作作物种类、间作时间长短和采样时间的影响。
毛莲英等[28]研究发现, 甘蔗间作猫豆和甘蔗单作种植模式下, 甘蔗根际土壤中优势细菌门类主要有变形菌门、放线菌门、绿弯菌门和酸杆菌门。本研究发现, 变形菌门、放线菌门、绿弯菌门和酸杆菌门细菌是甘蔗间作西瓜和甘蔗单作种植模式下甘蔗根际土壤的优势细菌门类。其中, 甘蔗单作(CK)模式中, 酸杆菌门(Acidobacteria)和绿弯菌门(Chloroflexi)细菌的相对丰度高于相应的甘蔗间作西瓜(TM)模式;研究已证实绿弯菌门、酸杆菌门细菌属于寡营养性细菌, 具有缓慢生长特性[29-30], 一般生存于营养贫瘠的低肥力土壤[31-34]。表明甘蔗间作西瓜(TM)有助于提升甘蔗根际微环境土壤肥力。与甘蔗单作(CK)相比, 本研究中甘蔗间作西瓜(TM)虽然没有显著提高表征甘蔗根际土壤肥力的理化性状指标, 但甘蔗间作西瓜(TM)还是介导敏感反映土壤肥力与健康变化的生物性状指标——土壤细菌群落组成发生了变化。换言之, 富营养性细菌群落丰度占比增加, 寡营养性细菌群落丰度占比下降, 这一结论与钟菊新等[35]的研究结果一致。同时亦说明根际土壤肥力虽未发生显著变化, 但甘蔗间作西瓜(TM)有助于富集有益细菌改善甘蔗根际微生态, 进而有助于提高甘蔗产量。
与甘蔗单作(CK)相比, 甘蔗间作西瓜(TM)显著增加了甘蔗根际土壤中放线菌门(Actinobacteria)细菌的相对丰度。研究发现, 放线菌门细菌具有产生多种代谢物(如抗生素等)及分解难降解物质(如纤维素和几丁质等)转化为有机物的功能[36], 是土壤养分供给的重要来源之一[21]。研究还发现, 小单胞菌属()细菌是革兰氏阳性稀有放线菌, 其代谢产物具有较高的抗菌抑菌活性[37]。而小单孢菌属细菌是甘蔗间作西瓜(TM)模式下, 甘蔗根际土壤中特有的优势细菌属。由此推测, 甘蔗间作西瓜(TM)可能有助于提高甘蔗植株的抗病能力。此外, 硝化螺旋菌属()细菌在土壤中作为一种好氧化能自养的亚硝酸盐氧化菌[38], 在土壤氮循环中发挥着关键作用[39-40]。本文发现, 甘蔗间作西瓜(TM)提高了硝化螺旋菌属细菌的相对丰度占比。研究已证实, 土壤中氮素的丰缺及供给直接影响到作物的生长和产量[41]。由此推测, 甘蔗间作西瓜(TM)有助于提高硝化螺旋菌属等硝化细菌的相对丰度, 进而改善甘蔗根际土壤微环境的氮素营养水平和微生态环境, 从而有助于提高甘蔗产量。
基于BugBase表型预测, 甘蔗间作西瓜(TM)模式下, 甘蔗根际土壤中革兰氏阳性(Gram_Positive)和胁迫耐受(Stress_Tolerant)细菌的丰度占比显著高于相应的甘蔗单作(CK); 同时, 甘蔗单作(CK)根际土壤中, 兼性厌氧性(Facultatively_Anaerobic)细菌丰度占比则显著高于相应的甘蔗间作西瓜(TM)模式。由此推断: 甘蔗间作西瓜不仅有助于改善甘蔗根际土壤环境的同期状况, 而且有利于维护甘蔗根际土壤健康与提升甘蔗的抗逆能力。
此外, 甘蔗间作西瓜(TM)根际土壤中, 细菌基因一级功能层和二级功能层代谢通路与甘蔗单作(CK)之间均无显著差异。表明: 甘蔗间作西瓜(TM)并没有显著改变甘蔗植株根际土壤细菌的主体功能,仅改变了部分甘蔗根际土壤细菌的群落组成。
4 结论
与甘蔗单作(CK)相比, 甘蔗间作西瓜(TM)具有提高甘蔗产量和总经济效益的效果; 虽然没有显著提高甘蔗根际土壤理化性质和甘蔗根际土壤细菌多样性、丰富度以及细菌主体功能, 但改变了部分甘蔗根际土壤细菌的群落组成, 富集了诸如小单孢菌属()等特有的优势细菌属。综上所述,甘蔗间作西瓜(TM)有助于提高甘蔗产量和总经济效益, 虽不能显著提升甘蔗根际土壤理化性质, 但亦没有造成甘蔗根际土壤微环境中细菌生态功能失衡或劣化。甘蔗间作西瓜改变了甘蔗根际土壤细菌群落组成, 有助于改善甘蔗根际土壤微生态、增强甘蔗抗性的作用。
[1] 肖健, 陈思宇, 孙妍, 杨尚东, 谭宏伟. 甘蔗间作不同豆科作物对甘蔗植株内生细菌多样性的影响. 热带作物学报, 2021, 42: 3188–3198.
Xiao J, Chen S Y, Sun Y, Yang S D, Tan H W. Effect of intercropping with different legume crops on endophytic bacterial diversity of sugarcanes., 2021, 42: 3188–3198 (in Chinese with English abstract).
[2] 肖健, 陈思宇, 孙妍, 杨尚东, 谭宏伟. 不同施肥水平下甘蔗植株根系内生细菌群落结构特征. 作物学报, 2022, 48: 1222–1234.
Xiao J, Chen S Y, Sun Y, Yang S D, Tan H W. Characteristics of endophytic bacterial community structure in roots of sugarcane under different fertilizer applications., 2022, 48: 1222–1234 (in Chinese with English abstract).
[3] 唐秀梅, 蒙秀珍, 蒋菁, 黄志鹏, 吴海宁, 刘菁, 贺梁琼, 熊发前, 钟瑞春, 韩柱强, 何龙飞, 唐荣华. 甘蔗间作花生对不同耕层土壤微生态的影响. 中国油料作物学报, 2020, 42: 713–722.
Tang X M, Meng X Z, Jiang J, Huang Z P, Wu H N, Liu J, He L Q, Xiong F Q, Zhong R C, Han Z Q, He L F, Tang H R. Effects of sugarcane/peanut intercropping on soil microenvironment in different plough layer., 2020, 42: 713–722 (in Chinese with English abstract).
[4] 彭东海, 杨建波, 李健, 邢永秀, 覃刘东, 杨丽涛, 李杨瑞. 间作大豆对甘蔗根际土壤细菌及固氮菌多样性的影响. 植物生态学报, 2014, 38: 959–969.
Peng D H, Yang J B, Li J, Xing Y X, Qin L D, Yang L T, Li Y R. Effects of intercropping with soybean on bacterial and nitrogen-fixing bacterial diversity in the rhizosphere of sugarcane., 2014, 38: 959–969 (in Chinese with English abstract).
[5] 李志贤, 冯远娇, 杨文亭, 王建武. 甘蔗间作种植研究进展. 中国生态农业学报, 2010, 18: 884–888.
Li Z X, Feng Y J, Yang W T, Wang J W. The progress of research on sugarcane intercropping., 2010, 18: 884–888 (in Chinese with English abstract).
[6] 车江旅, 吴建明, 宋焕忠. 甘蔗间套种大豆研究进展. 南方农业学报, 2011, 42: 898–900.
Che J L, Wu J M, Song H Z. A review on the researches on sugarcane-soybean intercropping system., 2011, 42: 898–900 (in Chinese with English abstract).
[7] de Araújo H S, Branco R B F, de Moraes C C, Calori A H, Rós A B, Purquerio L F V. Watermelon cultivation in regeneration areas of a sugarcane field under different soil managements., 2019, 54: e00039.
[8] 陈燕丽, 苏天明, 苏利荣, 李琴, 秦芳, 何铁光.甘蔗套种西瓜、大豆的效益. 江苏农业科学, 2017, 45(7): 133–135.
Chen Y L, Su T M, Su L R, Li Q, Qin F, He T G. Benefit of interplanting sugarcane with watermelon and soybean., 2017, 45(7): 133–135 (in Chinese with English abstract).
[9] 朱秋珍, 刘晓燕. 甘蔗套种春西瓜的效益及其配套栽培技术. 中国糖料, 2012, (4): 40–42.
Zhu Q Z, Liu X Y. Benefit of sugarcane interplanting spring watermelon cultivation technology., 2012, (4): 40–42 (in Chinese with English abstract).
[10] 李锦莲. 扶绥县甘蔗间种西瓜生产发展策略探讨. 广西农业科学, 2010, 41: 1022–1024.
Li J L. Development strategies for sugarcane interplanting watermelon in Fusui county., 2010, 41: 1022–1024 (in Chinese with English abstract).
[11] 区惠平, 周柳强, 黄金生, 曾艳, 朱晓晖, 谢如林, 谭宏伟, 黄碧燕. 长期不同施肥对甘蔗产量稳定性、肥料贡献率及养分流失的影响. 中国农业科学, 2018, 51: 1931–1939.
Qu H P, Zhou L Q, Huang J S, Zeng Y, Zhu X H, Xie R L, Tan H W, Huang B Y. Effects of long-term different fertilization on sugarcane yield stability, fertilizer contribution rate and nutrition loss., 2018, 51: 1931–1939 (in Chinese with English abstract).
[12] 李停锋, 李雯, 郭君钰, 顾欣. 土壤调理剂配施菌剂对连作压砂田土壤养分及西瓜生长、产量的影响. 核农学报, 2021, 35: 1923–1930.
Li T F, Li W, Guo J Y, Gu X. Effects of soil conditioners combined with microbial agent on soil nutrient andgrowth and yield in continuous cropping gravel mulch field., 2021, 35: 1923–1930 (in Chinese with English abstract).
[13] Yang S D, Xiao J, Liang T, Liang T, He W Z, Tan H W. Response of soil biological properties and bacterial diversity to different levels of nitrogen application in sugarcane fields., 2021, 11: 172.
[14] 鲁如坤. 土壤农业化学分析方法. 北京: 中国农业科技出版社, 2000. pp 146–195.
Lu R K. Soil Agrochemical Analysis Method. Beijing: China Agricultural Science and Technology Press, 2000. pp 146–195 (in Chinese).
[15] Lundberg D S, Lebeis S L, Paredes S H, Yourstone S, Gehring J, Malfatti S, Tremblay J, Engelbrektson A, Kunin V, Del R T G, Edgar R C, Eickhorst T, Ley R E, Hugenholtz P, Tringe S G, Dangl J L. Defining the core Arabidopsis thaliana root microbiome., 2012, 488: 86–90.
[16] Bulgarelli D, Garrido-Oter R, Münch P C, Weiman A, Dröge J, Pan Y, McHardy A C, Schulze-Lefert P. Structure and function of the bacterial root microbiota in wild and domesticated barley., 2015, 17: 392–403.
[17] Grice E A, Kong H H, Conlan S, Deming C B, Davis J, Young A C, Bouffard G G, Blakesley R W, Murray P R, Green E D, Turner M L, Segre J A. Topographical and temporal diversity of the human skin microbiome., 2009, 324: 1190–1192.
[18] Simpson E H. The measurement of diversity., 1949, 163: 688.
[19] Chao A, Wang W H, Chen Y C, Kuo C Y. Estimating the number of shared species in two communities., 2000, 10: 227–246.
[20] 肖健, 孙妍, 陈思宇, 任奎瑜, 杨尚东, 唐小付. 南方果园蚁巢土壤微生物群落结构特征分析. 南方农业学报, 2021, 52: 1604–1614.
Xiao J, Sun Y, Chen S Y, Ren K Y, Yang S D, Tang X F. Characteristics of soil microbial community structure in ant nests in orchards in southern China., 2021, 52: 1604–1614 (in Chinese with English abstract).
[21] van der Heijden M G A, Wagg C. Soil microbial diversity and agro-ecosystem functioning., 2013, 363: 1–5.
[22] 肖健, 黄小丹, 林刚云, 吴银秀, 杨尚东, 屈达才. 青枯病易感和钝感桑树根际土壤生物学性状及细菌群落结构比较. 蚕业科学, 2021, 47(2): 138–146.
Xiao J, Huang X D, Lin G Y, Wu Y X, Yang S D, Qu D C. Comparison on soil biological properties and bacterial community structures in rhizospheres between sensitive and insensitive mulberry varieties to bacterial wilt., 2021, 47(2): 138–146 (in Chinese with English abstract).
[23] 肖健, 吴银秀, 杨尚东, 屈达才. 秸秆覆盖还田对桑园土壤真菌群落结构组成的影响. 西南农业学报, 2021, 34: 2707–2713.
Xiao J, Wu Y X, Yang S D, Qu D C. Effects of straw mulching on soil fungal community structure in mulberry plantation., 2021, 34: 2707–2713 (in Chinese with English abstract).
[24] 杨尚东, 郭霜, 任奎喻, 庞师婵, 张传进, 王帅帅, 谭宏伟.甘蔗宿根矮化病感病与非感病株根际土壤生物学性状及细菌群落结构特征. 植物营养与肥料学报, 2019, 25: 910–916.
Yang S D, Guo S, Ren K Y, Pang S C, Zhang C J, Wang S S, Tan H W. Soil biological properties and bacterial community structures in rhizosphere soil of canes infected and non-infected by ratoon stunting disease., 2019, 25: 910–916 (in Chinese with English abstract).
[25] Wang Y, Marschner P, Zhang F. Phosphorus pools and other soil properties in the rhizosphere of wheat and legumes growing in three soils in monoculture or as a mixture of wheat and legume., 2012, 354: 283–298.
[26] Yang S D, Xiao J, Huang Z Y, Qin R L, He W Z, Liu L M, Liu H J, Li A M, Tan H W. Comparison of soil biological properties and bacterial diversity in sugarcane, soybean, mung bean and peanut intercropping systems., 2021, 13: 54–68.
[27] 刘丽, 范娅, 冯海洋, 杜衎, 高德民. 生长时间和栽培模式对柴胡根际微生物群落结构的影响. 西南农业学报, 2022, 35: 50–57.
Liu L, Fan Y, Feng H Y, Du K, Gao D M. Effects of growing time and cultivation pattern on microbial community structure in rhizosphere ofDC., 2022, 35: 50–57 (in Chinese with English abstract).
[28] 毛莲英, 李海碧, 桂意云, 张荣华, 杨荣仲, 周会, 韦金菊, 刘昔辉. 基于高通量测序分析间作猫豆对甘蔗根际土壤微生物的影响, 南方农业学报, 2021, 52: 332–340.
Mao L Y, Li H B, Gui Y Y, Zhang R H, Yang R Z, Zhou H, Wei J J, Liu X H. Effects of intercropping withvar. utilis on sugarcane rhizosphere microbe based on high throughput sequencing., 2021, 52: 332–340 (in Chinese with English abstract).
[29] Barberan A, Bates S T, Casamayor E O, Fierer N. Using network analysis to explore co-occurrence patterns in soil microbial communities., 2012, 6: 343–351.
[30] Davis K E R, Sangwan P, Janssen P H. Acidobacteria, Rubrobacteridae and Chloroflexi are abundant among very slow-growing and mini-colony-forming soil bacteria., 2011, 13: 798–805.
[31] Janssen P H. Identifying the dominant soil bacterial taxa in libraries of 16S rRNA and 16S rRNA genes., 2006, 72: 1719–1728.
[32] Will C, Thurmer A, Wollherr A, Nacke H, Herold N, Schrumpf M, Gutknecht J, Wubet T, Buscot F, Daniel R. Horizon-specific bacterial community composition of German grassland soils, as revealed by pyrosequencing-based analysis of 16s rRNA genes., 2010, 76: 6751–6759.
[33] Fierer N, Lauber C L, Ramirez K S, Zaneveld J, Bradford M A, Knight R. Comparative metagenomic, phylogenetic and physiological analyses of soil microbial communities across nitrogen gradients., 2012, 6: 1007–1017.
[34] Ai C, Zhang S, Zhang X, Guo D, Zhou W, Huang S. Distinct responses of soil bacterial and fungal communities to changes in fertilization regime and crop rotation., 2018, 319: 156–166.
[35] 钟菊新, 唐红琴, 李忠义, 董文斌, 韦彩会, 李强, 何铁光. 绿肥配施化肥对岩溶区水稻土壤细菌群落结构的影响. 植物营养与肥料学报, 2021, 27: 1746–1756.
Zhong J X, Tang H Q, Li Z Y, Dong W B, Wei C H, Li Q, He T G. Effects of combining green manure with chemical fertilizer on the bacterial community structure in karst paddy soil., 2021, 27: 1746–1756 (in Chinese with English abstract).
[36] 罗俊, 林兆里, 李诗燕, 阙友雄, 张才芳, 杨仔奇, 姚坤存, 冯景芳, 陈建峰, 张华. 不同土壤改良措施对机械压实酸化蔗地土壤理化性质及微生物群落结构的影响. 作物学报, 2020, 46: 596–613.
Luo J, Lin Z L, Li S Y, Que Y X, Zhang C F, Yang Z Q, Yao K C, Feng J F, Chen J F, Zhang H. Effects of different soil improvement measures on soil physicochemical properties and microbial community structures in mechanically compacted acidified sugarcane field., 2020, 46: 596–613 (in Chinese with English abstract).
[37] 杨星鹏, 张志斌, 朱笃. 小单胞菌属次级代谢产物及其生物活性研究进展. 天然产物研究与开发, 2019, 31: 908–915.
Yang X P, Zhang Z B, Zhu D. Review on secondary metabolites and its biological activities from genus., 2019, 31: 908–915 (in Chinese with English abstract).
[38] Han S, Luo X S, Liao H, Nie H L, Chen W L, Huang Q Y.are more sensitive than Nitrobacter to land management in acid, fertilized soils of a rapeseed-rice rotation field trial., 2017, 599/600: 135–144.
[39] Daims H, Wagner M.., 2018, 26: 462–463.
[40] Daims H, Lebedeva E V, Pjevac P, Han P, Herbold C, Albertsen M, Jehmlich N, Palatinszky M, Vierheilig J, Bulaev A, Kirkegaard R H, Von Bergen M, Rattei T, Bendinger B, Nielsen P H, Wagner M. Complete nitrification bybacteria., 2015, 528: 504–509.
[41] 庞党伟, 陈金, 唐玉海, 尹燕枰, 杨东清, 崔正勇, 郑孟静, 李勇, 王振林. 玉米秸秆还田方式和氮肥处理对土壤理化性质及冬小麦产量的影响. 作物学报, 2016, 42: 1689–1699.
Pang D W, Chen J, Tang Y H, Yin Y P, Yang D Q, Cui Z Y, Zheng M J, Li Y, Wang Z L. Effect of returning methods of maize straw and nitrogen treatments on soil physicochemical property and yield of winter wheat., 2016, 42: 1689–1699 (in Chinese with English abstract).
Effects of intercropping with watermelons on cane yields, soil physicochemical properties and micro-ecology in rhizospheres of sugarcanes
XIAO Jian1, WEI Xing-Xuan1, YANG Shang-Dong1, LU Wen3,*, and TAN Hong-Wei2,*
1Agricultural College, Guangxi University, Nanning 530004, Guangxi, China;2Guangxi Key Laboratory of Sugarcane Genetic Improvement, Guangxi Academy of Agricultural Sciences, Nanning 530007, Guangxi, China;3Institute of Agricultural Science, Fusui 532199, Guangxi, China
To provide theoretical basis for developing sugarcane intercropping cultivation system, cane yields, total economic benefit, soil physicochemical properties and bacterial community structure in rhizospheres of sugarcane intercropping with watermelon were analyzed. Based on traditional and modern high-throughput sequencing techniques, cane yields, total economic benefit, soil physicochemical properties and bacterial community structure in rhizosphere of sugarcanes between monoculture (CK) and sugarcane intercropping with watermelons (TM) were analyzed. Compared with CK, the contents of soil organic matter (SOM), total nitrogen (TN), phosphorus (TP) and potassium (TK), and the contents of available nitrogen (AN), phosphorus (AP) and potassium (AK) were all not significantly altered in sugarcane intercropping with watermelons system. Meanwhile, soil bacterial diversity, richness and soil bacterial functions were also not significantly changed in sugarcane intercropping with watermelons system. In addition, although some soil dominant bacterial phyla, such as Actinobacteria and other could be enriched, but Planctomycetes and Bacteroidetes also lost in rhizospheres of sugarcanes in TM treatments also lost. Meanwhile,,,,,,,,andwere the unique soil dominant bacterial genera in rhizospheres of sugarcanes in CK. By contrast,,,,,,,,,,,andwere the specific soil dominant bacterial genera in rhizospheres sugarcanes in TM treatment. Moreover, there were no significantly different in the functions of soil bacteria in rhizospheres of sugarcanes between TM and CK treatments, suggesting that soil bacterial functions in rhizospheres of sugarcanes did not significantly alter by intercropping with watermelons. In comparison with sugarcane monoculture, cane yields and total economic benefit all could be improved. In addition, soil physicochemical properties and soil bacterial diversity, richness and functions in rhizospheres of sugarcanes could not be significantly improved by intercropping with watermelons. However, the compositions of soil bacterial communities were altered, such as, enriched as the unique soil dominant bacterial genera in rhizospheres of sugarcanes intercropping with watermelons. All the above results showed that not only cane yields and total economic benefit could be improved but also soil physicochemical properties were not decreased. Furthermore, soil bacterial functions also were not significantly deteriorated, just the compositions of soil bacterial communities were partly altered by intercropping with watermelons. The stress resistanceproperties of sugarcanes could be improved by intercropping with watermelons for some benefit bacteria, such asenriched in rhizospheres of sugarcanes under sugarcane/watermelon intercropping systems.
intercropping; sugarcane; watermelon; soil bacteria; high-throughput sequencing
10.3724/SP.J.1006.2023.24050
本研究由国家重点研发计划项目(2020YFD1000600), 广西学位与研究生教育改革专项课题(JGY2021013)和国家现代农业产业技术体系建设专项(糖料, CARS170206)资助。
This study was supported by the National Key Research and Development Program of China (2020YFD1000600), the Guangxi Academic Degree and Postgraduate Education Reform Special Project (JGY2021013), and the China Agriculture Research System (Sugar, CARS170206).
卢文, E-mail: 271155431@qq.com; 谭宏伟, E-mail: hongwei_tan@163.com
E-mail: 1318513279@qq.com
2022-03-08;
2022-07-21;
2022-08-22.
URL: https://kns.cnki.net/kcms/detail/11.1809.S.20220819.1515.012.html
This is an open access article under the CC BY-NC-ND license (http://creativecommons.org/licenses/by-nc-nd/4.0/)
