阿魏酸对黄嘌呤氧化酶的抑制机理
2023-02-09张南海金雨楠陈怡冉周靖萱张列兵
张南海,金雨楠,陈怡冉,周靖萱,赵 亮,张列兵,吴 薇,周 峰,*
(1.中国农业大学 食品科学与营养工程学院/植物源功能食品北京市重点实验室, 北京 100083;2.北京工商大学 北京市食品添加剂工程技术研究中心, 北京 100048;3.中国农业大学 工学院, 北京 100083)
全球范围内高尿酸血症的患病率逐年增长,已成为我国常见的代谢疾病和需要迅速解决的公共卫生问题之一[1-2]。高尿酸血症是由于嘌呤代谢紊乱使体内尿酸生成过多和(或)尿酸排泄障碍从而导致体内尿酸水平超过正常范围(男性≥420 μmol/L,女性≥360 μmol/L)而引起的疾病,抑制尿酸生成从而降低体内尿酸水平是当前主要的治疗高尿酸血症的手段[3]。黄嘌呤氧化酶(xanthine oxidase,XO)是人体嘌呤代谢过程关键的限速酶,主要分布于哺乳动物肝脏和肠道中,能催化次黄嘌呤氧化成黄嘌呤,并进一步氧化成尿酸[4]。抑制XO活性进而减少尿酸生成是当前临床上控制高尿酸血症和痛风的一线治疗手段[5-6]。
膳食多酚已被广泛证明可通过抑制XO活性减少尿酸合成、抑制肾脏尿酸重吸收和促进尿酸分泌,改善高尿酸血症,而且已有报道通过酶动力学、光谱学和分子模拟等技术研究黄酮类化合物和XO的构效关系及相互作用机理[7-9]。但作为多酚重要组分之一的酚酸类化合物与XO的相互作用研究相对较少。阿魏酸是一种酚酸类化合物,广泛存在于水果、谷物和蔬菜中,具有良好的抗氧化、抗炎等功效,能改善代谢综合征、高尿酸血症、糖尿病、心血管疾病、癌症等[10-11]。实验室前期评价了16种黄酮和酚酸类化合物对代谢综合征大鼠的改善作用,发现阿魏酸降尿酸的效果最佳[12-13]。Li等[14]研究表明,阿魏酸可抑制氧嗪酸钾和次黄嘌呤诱导的高尿酸血症大鼠肝脏XO活性。但对于阿魏酸如何抑制XO活性的研究不系统并存在一定争议。例如:Nile等[15]从玉米中提取的阿魏酸可抑制XO活性,对XO的半抑制浓度(IC50)为(8.2±0.3)μmol/L,相互作用属于混合竞争性抑制。Chang等[16]发现阿魏酸与XO相互作用属于竞争性抑制。Lin等[17]从薏仁麸皮中鉴定出的阿魏酸与XO相互作用属于可逆的混合竞争性抑制,并能改变XO的三级结构。而阿魏酸对XO的荧光猝灭机理、结合主要驱动力及对XO二级结构的影响等方面少有报道。
本研究通过酶学及光谱学方法系统地解析阿魏酸对XO的抑制机理,包括抑制可逆性、抑制类型、结合常数、结合位点、结合力及XO结构的变化等,通过分子模拟预测阿魏酸与XO的结合构象及区域,综合探究阿魏酸抑制XO活性的分子机制。
1 材料与方法
1.1 材料与试剂
阿魏酸、咖啡酸、绿原酸、对香豆酸、没食子酸,纯度≥99%,上海麦克林生化科技有限公司;XO (Grade I),美国Sigma公司;黄嘌呤(纯度≥99%),上海阿拉丁生化科技股份有限公司;Tris,北京索莱宝科技有限公司;其余试剂均为国产分析纯。
1.2 仪器与设备
DK- 80型数显恒温水浴锅,常州迈科诺仪器有限公司;SpectraMax M2e型多功能酶标仪,美国Molecular Devices公司;F- 7000型荧光分光光度计,日本Hitachi公司;Chirascan Plus型圆二色光谱仪,英国Applied Photophysics公司。
1.3 实验方法
1.3.1不同酚酸对XO的抑制率测定
控制反应体系为2 mL,以Tris- HCl (pH值7.4,50 mmol/L)为缓冲体系,将不同浓度的酚酸溶液与XO溶液(终浓度为0.075 μmol/L)于离心管中充分混合,在37 ℃恒温水浴锅中孵育30 min,再加入黄嘌呤溶液(终浓度为50 μmol/L),混合均匀后,立即使用酶标仪每隔5 s检测反应体系在290 nm处的吸光度,共检测2 min,按照式(1)计算XO的相对活性,以浓度(μmol/L)为横坐标,相对活性(%)为纵坐标绘图,采用GraphPad Prism 8.0计算半抑制浓度IC50。
相对活性=v/v0×100%。
(1)
式(1)中,v为酚酸存在时的反应速率,v0为无酚酸存在时的反应速率。
1.3.2阿魏酸对XO的抑制可逆性测定
控制反应体系为2 mL,以Tris- HCl (pH值7.4,50 mmol/L)为缓冲体系,将不同浓度的阿魏酸溶液(0、120、160、180 μmol/L)分别与不同浓度的XO溶液(终浓度分别为0.025、0.050、0.075、0.100、0.125 μmol/L)于离心管中充分混合,在37 ℃恒温水浴锅中孵育30 min,再加入黄嘌呤溶液(终浓度为50 μmol/L),混合均匀后,立即使用酶标仪每隔5 s检测反应体系在290 nm处的吸光度,共检测2 min,以XO浓度(μmol/L)为横坐标,反应速率ν(min-1)为纵坐标绘图,通过相关性判断阿魏酸对XO的抑制可逆性。
1.3.3阿魏酸对XO的抑制动力学测定
控制反应体系为2 mL,以Tris- HCl (pH值7.4,50 mmol/L)为缓冲体系,将不同浓度的阿魏酸溶液(140、160、180、200 μmol/L)与XO溶液(终浓度为0.075 μmol/L)于离心管中充分混合,在37 ℃恒温水浴锅中孵育30 min,再分别加入不同浓度黄嘌呤溶液(终浓度分别为25、40、50、100 μmol/L),混合均匀后,立即使用酶标仪每隔5 s检测反应体系在290 nm处的吸光度,共检测2 min,以黄嘌呤浓度的倒数1/[S] (L/μmol)为横坐标,反应速率1/[ν](min)为纵坐标,根据Lineweaver- Burk双倒数方程,绘制关系曲线,判断阿魏酸对XO的抑制类型。
1.3.4荧光滴定实验
以Tris- HCl (pH值7.4,50 mmol/L)为缓冲体系,取2.5 mL XO溶液(0.700 μmol/L)于1 cm石英比色皿中,向其中每5 μL滴加阿魏酸溶液(4 mmol/L),每次滴加混匀后静置5 min,分别在不同温度(298、304、310 K)下,使用荧光分光光度计扫描290~500 nm荧光光谱,设定激发波长为280 nm,激发和发射狭缝宽度为5 nm。
由于阿魏酸在280 nm (XO的激发波长)和330 nm(XO的发射波长)处有紫外吸收,会产生内滤效应,影响XO的荧光强度,因此荧光滴定实验结果使用式(2)进行校准[18]。
Fc=Fme(A1+A2)/2。
(2)
式(2)中,Fm和Fc为校准前后荧光强度,A1和A2为阿魏酸在280 nm和330 nm处吸光度。
1.3.5同步荧光光谱测定
反应体系配制同1.3.4,在298 K条件下,设置发射和激发波长间隔(Δλ)分别为15 nm和60 nm,使用荧光分光光度计扫描200~350 nm同步荧光光谱,激发和发射狭缝宽度为5 nm,按照式(3)计算同步荧光猝灭比率(RSFQ)。
RSFQ=(1-F/F0)×100%。
(3)
式(3)中,F0和F分别代表未加和加入阿魏酸后XO的荧光强度。
1.3.6圆二色谱测定
以Tris- HCl (pH值7.4,50 mmol/L)为缓冲体系,配制阿魏酸与XO摩尔比为0∶1、10∶1、20∶1的反应体系,并固定XO浓度为1 μmol/L,在持续氦气流和60 nm/min扫描速度的条件下,使用圆二色光谱仪扫描190~250 nm远紫外区的圆二色谱,取3次连续扫描的平均值,以Tris- HCl (pH值7.4,50 mmol/L)为空白,采用CDNN软件计算XO二级结构(α-螺旋、β-折叠、β-转角和无规则卷曲)含量的变化。
1.3.7分子模拟分析
采用AutoDock 4.2软件模拟阿魏酸与XO可能的结合方式。从PubChem数据库(https:∥pubchem.ncbi.nlm.nih.gov/)中获取阿魏酸的3D结构,采用Sybyl X 2.0软件Tripos力场进行结构优化,从蛋白质数据库(http:∥www.rcsb.org/pdb)中获取XO (PDB ID:1FIQ)的晶体结构,采用PyMOL 2.5软件进行去水、加氢和加Gasteiger电荷处理。设置XO活性中心的网格为60 Å×60 Å×60 Å,网格间距为0.375 Å,运行次数为100次,选择Lamarckian genetic algorithm (LGA)算法,其余参数默认,将处理后的XO与配体分子阿魏酸进行对接,选择结合能最低且对接次数最多的构象用于进一步分析。
1.4 数据处理
实验结果采用Excel软件处理,以平均值±标准偏差表示,采用Origin 2021软件绘图。
2 结果与分析
2.1 酚酸对XO的抑制作用分析
不同酚酸对XO活性的影响见图1。从图1可以看出,5种酚酸均能在一定程度上抑制XO活性,且呈浓度依赖性。随着酚酸浓度的增加,咖啡酸和对香豆酸造成XO活性呈先趋于平缓后迅速降低的趋势,其余酚酸对XO活性的影响呈逐渐降低的趋势,当酚酸达到一定浓度时,在阿魏酸、对香豆酸和绿原酸作用下,XO活性接近完全被抑制。不同酚酸对XO的抑制能力见表1。由表1可知,5种酚酸对XO的抑制能力由强到弱依次为阿魏酸、绿原酸、对香豆酸、咖啡酸、没食子酸,对XO的IC50分别为116.2、144.2、175.7、193.5、194.6 μmol/L。可以发现羟基肉桂酸类化合物(对香豆酸、咖啡酸、阿魏酸、绿原酸)对XO活性的抑制作用普遍强于羟基苯甲酸类化合物(没食子酸),可能与苯甲酸结构相比,肉桂酸结构更有利于与XO发生相互作用,从而抑制XO活性,咖啡酸的酚羟基甲基化(生成阿魏酸)或羧基酯化(生成绿原酸)均能提高对XO活性的抑制能力,Lin等[17]和Huo等[19]也发现了此现象。而且对香豆酸的苯环甲氧基化(生成阿魏酸)可以增强对XO活性的抑制作用,但是增加羟基(生成咖啡酸)会降低对XO活性的抑制作用,其中阿魏酸对XO的抑制能力最强,可能与结构中含有甲氧基有关,Lin等[17]也发现薏仁麸皮游离酚类化合物中含有甲氧基的羟基肉桂酸类化合物具有更强的XO抑制能力。因此,本研究选择阿魏酸作为主要研究对象,进一步探究其对XO抑制作用的机理。

图1 不同酚酸对XO活性的影响Fig.1 Effect of different phenolic acids on XO activity

表1 酚酸结构式及其对XO的抑制能力Tab.1 Structures of phenolic acids and their inhibiting abilities on XO
2.2 阿魏酸对XO的抑制可逆性分析
为了判断阿魏酸对XO的抑制类型,建立了不同阿魏酸浓度下反应速率v与XO浓度的关系(图2)。所有拟合直线均经过原点且具有良好的线性关系,随着阿魏酸浓度的增加,拟合直线的斜率逐渐下降,表明阿魏酸对XO的抑制作用是可逆的,与Lin等[17]结果一致,且其分子间相互作用是非共价的,阿魏酸对XO的抑制可能是由于XO活性的降低,而不是XO有效量的减少[5]。
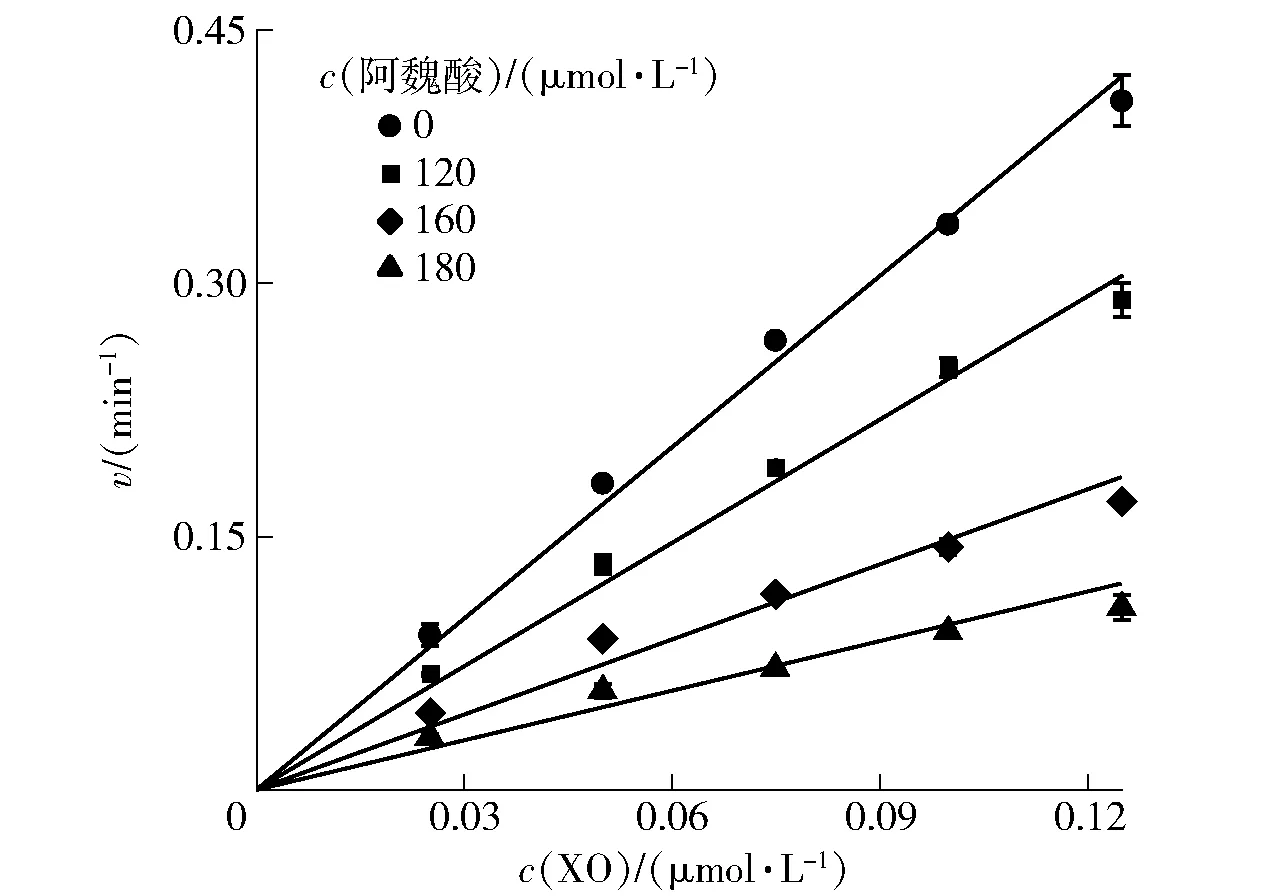
图2 阿魏酸对XO的抑制可逆性Fig.2 Inhibitory reversibility of ferulic acid on XO
2.3 阿魏酸对XO的抑制动力学分析
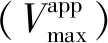
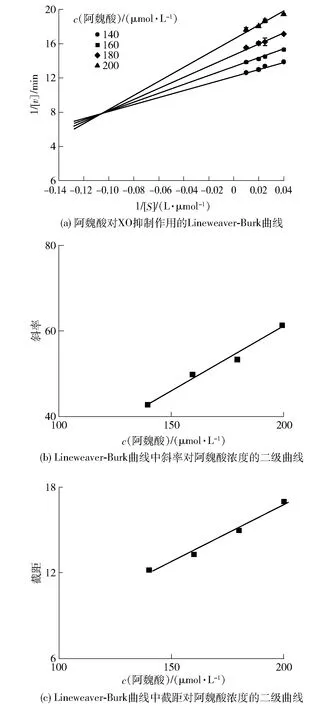
图3 阿魏酸对XO的抑制类型Fig.3 Inhibitory type of ferulic acid on XO
混合竞争性抑制的动力学双倒数方程见式(4)~式(6)[8]:
(4)
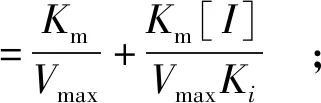
(5)
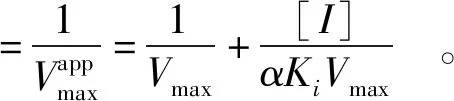
(6)
根据式(5)和式(6),以斜率和截距分别对阿魏酸浓度绘图,由图3(b)、(c)可以看出二级方程曲线具有良好的线性拟合关系,表明阿魏酸与XO存在一个或一类结合位点[4],并求得Ki为4.5 μmol/L,α为1.8,αKi大于Ki,表明阿魏酸可能与游离XO的亲和力强于与XO-黄嘌呤复合物的亲和力[5]。
2.4 阿魏酸对XO的荧光猝灭分析
本研究探讨了阿魏酸对XO的抑制类型后,进一步探究了阿魏酸对XO的抑制机理。内源荧光猝灭是蛋白质研究中必不可少的工具,能在分子水平提供蛋白质构象的变化和小分子与大分子结合的信息,如结合机理、结合模式、结合常数、分子间距等[21-22]。图4显示了298 K下阿魏酸对XO的荧光光谱。由于内源荧光氨基酸残基(色氨酸和酪氨酸)的存在,XO在330 nm附近产生较强的荧光发射峰;而在同等条件下,阿魏酸没有产生发射峰,因此不会对结果产生影响。随着阿魏酸浓度的升高,330 nm处荧光强度逐渐降低,当阿魏酸浓度为80 μmol/L时,74.9%的XO荧光被猝灭,最大发射波长产生10 nm的红移,表明阿魏酸与XO发生了相互作用使得XO发色团周围的微环境发生改变。荧光猝灭机理分为动态猝灭、静态猝灭和动态静态混合猝灭,通过Stern- Volmer方程[见式(7)]进一步探究阿魏酸与XO的相互作用机理[23]。

1~11表示阿魏酸浓度为0、8、16、24、32、40、48、56、64、72、80 μmol/L时的荧光光谱;0表示仅阿魏酸存在下的荧光光谱,实验温度为298 K。图4 阿魏酸对XO荧光光谱的影响Fig.4 Effect of ferulic acid on fluorescence spectra of XO
F0/Fc=1+Kqτ0[I]=1+KSV[I]。
(7)
式(7)中,F0和Fc分别代表未加和加入阿魏酸后XO的荧光强度,[I]为阿魏酸浓度,KSV为猝灭常数,Kq为生物分子猝灭速率常数(Kq=KSV/τ0),τ0为无抑制剂情况下荧光团平均寿命(2.8×10-9s)。
以F0/F对[I]绘图,如图5。由图5(a)可知,在一定阿魏酸浓度范围内,阿魏酸对XO荧光猝灭的Stern- Volmer曲线明显偏离了线性关系(向上弯曲),表明阿魏酸与XO的相互作用机理是动态静态混合猝灭,应采用修正的Stern- Volmer方程[见式(8)]进行阿魏酸对XO的荧光猝灭分析[24]。
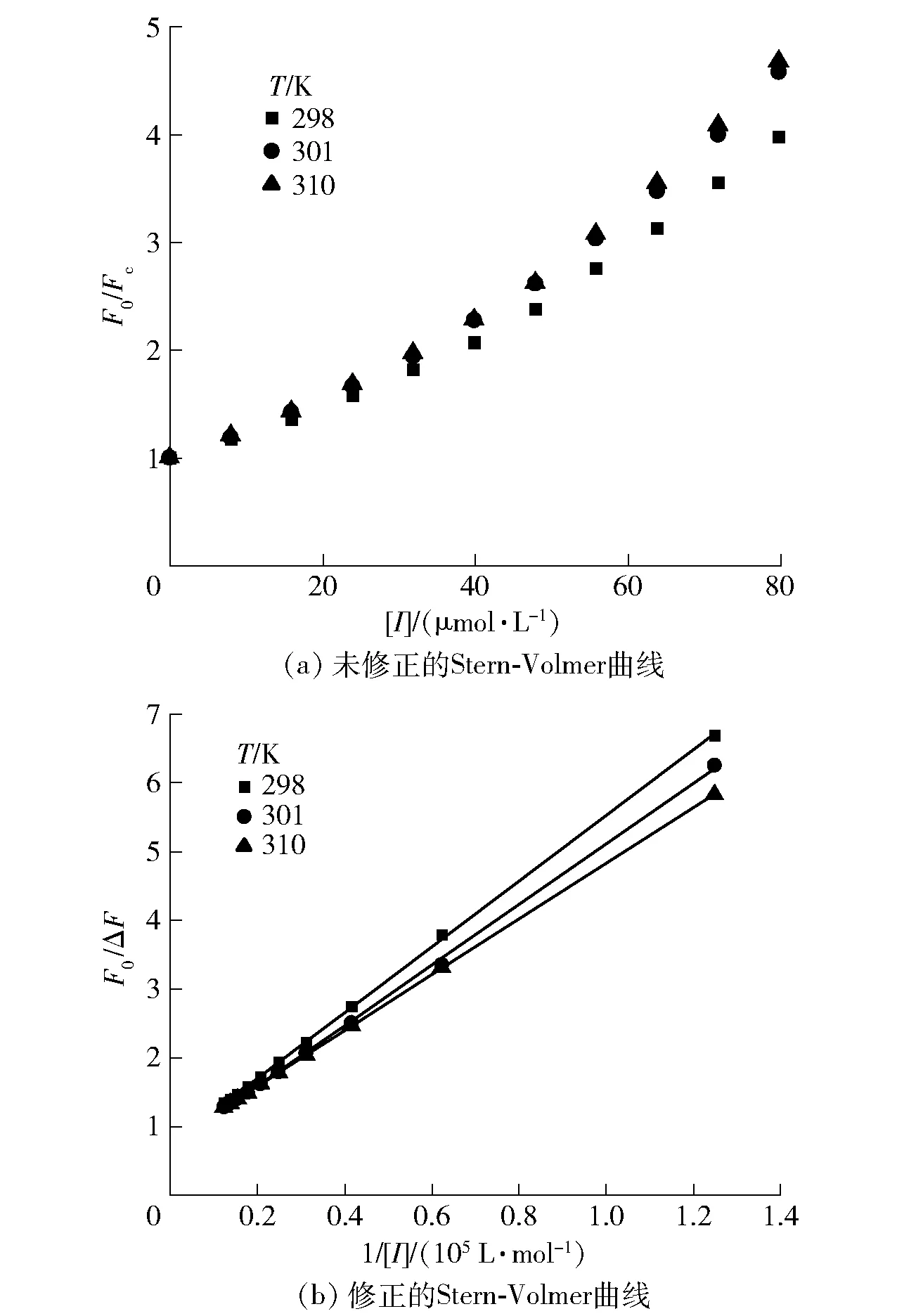
图5 阿魏酸对XO荧光猝灭的Stern- Volmer曲线Fig.5 Stern- Volmer plots for fluorescence quenching of ferulic acid on XO
(8)
式(8)中,ΔF=F0-Fc,f为接近猝灭剂的分数。以F0/ΔF对[I]绘图并拟合直线,如图5(b)。通过截距与斜率的比值求得不同温度下阿魏酸与XO的KSV(表2),分别为1.53×104L/mol (298 K)、1.57×104L/mol (304 K)、1.88×104L/mol (310 K)。随着温度的升高,KSV值逐渐升高,表明阿魏酸与XO的强亲和力,温度越高,阿魏酸- XO复合物稳定性越低[10]。同时求得Kq分别为5.47×1012L/(mol·s) (298 K)、5.62×1012L/(mol·s) (304 K)、6.71×1012L/(mol·s) (310 K),远远大于生物分子的最大散射碰撞猝灭常数[2.0×1010L/(mol·s)],表明阿魏酸- XO复合物形成引起的静态猝灭在XO的荧光猝灭中起主导作用[25-27]。
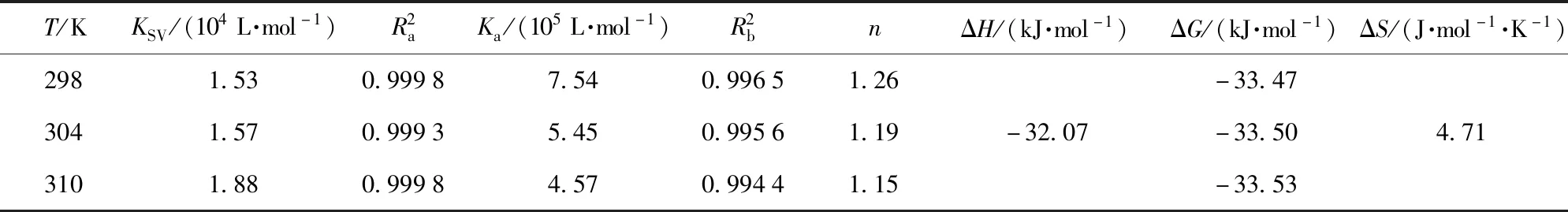
表2 不同温度下阿魏酸- XO体系的有效猝灭常数、结合常数、结合位点数和热力学参数Tab.2 Effective quenching constant, binging constants, number of binding sites, and thermodynamic parameters for ferulic acid-XO system at different temperatures
阿魏酸- XO复合物的结合常数(Ka)和结合位点数(n)可通过式(9)计算[10]。
(9)

为了探究阿魏酸与XO相互作用的主要作用力,通过van’t Hoff方程[式(10)和式(11)]计算在不同温度下阿魏酸- XO复合物形成过程中的热力学参数,如焓变(ΔH)、熵变(ΔS)和吉布斯自由能(ΔG)等[10]。
lnKa=-ΔH/RT+ΔS/R;
(10)
ΔG=ΔH-TΔS。
(11)
式(10)、式(11)中,R为气体常数,8.314 J/(mol·K);T为温度,298、304、310 K。由表2可知,ΔG<0,表明阿魏酸与XO之间的结合反应是自发的;而ΔH<0和ΔS>0,说明阿魏酸与XO的结合反应是焓熵双驱动的放热反应,且其中主要驱动力为氢键和疏水作用力[29]。
2.5 阿魏酸与XO的分子对接分析
为了探明阿魏酸与XO的结合位点及参与的氨基酸残基,采用分子模拟技术预测阿魏酸与XO复合物的结构,见图6。分子模拟技术能获得小分子与生物大分子的结合姿态、结合能等信息[30-31]。图6(a)展示了结合能最低且结合次数最多的阿魏酸与XO的结合姿态,发现阿魏酸进入了XO中黄素腺嘌呤二核苷酸(FAD)的异咯嗪环活性区域,即分子氧被还原生成超氧阴离子(O2-)或H2O2的区域,可与Glu263、Ile358、Asp360、Arg426和Lys433相互作用,阻碍了O2-的扩散,导致电子从FADH2转移到O2-,进一步生成H2O2,从而减少了分子氧的还原,最终使尿酸生成减少[32]。阿魏酸与槲皮素、黄芩素、黄芩苷和非瑟酮等多酚类化合物作用方式一致,结合于XO的FAD区域,抑制尿酸的生成[5,29,33]。分子对接获得的阿魏酸与XO的结合能为-23.73 kJ/mol,略高于298 K条件下热力学分析的ΔG(-33.47 kJ/mol),可能由于实验是溶剂中获得的ΔG,而分子对接在真空环境下进行,缺少去溶剂化能[23]。由图6(b)可知,阿魏酸分子中酚羟基与氨基酸残基Glu263形成键长为2.56 Å的氢键,羧基与氨基酸残基Asp360和Lys433形成了键长为2.95、2.74 Å的氢键,可增强阿魏酸与XO复合物的稳定性,同时分布着Ile358和Arg426等疏水性氨基酸,表明氢键和疏水性作用是阿魏酸与XO相互作用的主要驱动力,与热力学分析结果一致。
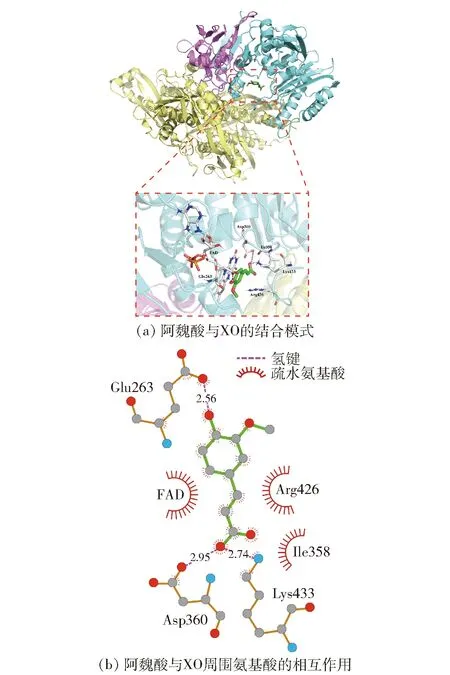
图6 阿魏酸与XO的分子对接结果Fig.6 Molecular docking results of ferulic acid binding with XO
2.6 阿魏酸对XO色氨酸和酪氨酸微环境的影响
阿魏酸对XO同步荧光光谱的影响见图7。同步荧光光谱被用来反映XO发色团(色氨酸和酪氨酸)周围微环境极性的变化,当Δλ设置为15 nm和60 nm时,同步荧光分别提供了酪氨酸和色氨酸的光谱行为[34]。由图7(a)和图7(b)可知,随着阿魏酸浓度的增加,酪氨酸和色氨酸残基的荧光强度均逐渐降低,当阿魏酸浓度为80 μmol/L时,酪氨酸和色氨酸残基的最大发射峰均发生了4 nm的红移,表明阿魏酸的添加增大了XO分子中酪氨酸和色氨酸残基周围极性,使其疏水性降低[35]。RSFQ被用来评估酪氨酸和色氨酸残基对蛋白荧光猝灭的影响,在同一抑制剂浓度下,对应RSFQ越高的氨基酸残基对蛋白荧光猝灭的贡献更大[5]。从图7(c)可以看出,在同等阿魏酸浓度条件下,Δλ=60 nm处的RSFQ高于Δλ=15 nm处的RSFQ,表明色氨酸残基对XO内源荧光猝灭的贡献更大,阿魏酸与XO的结合位点更接近色氨酸。
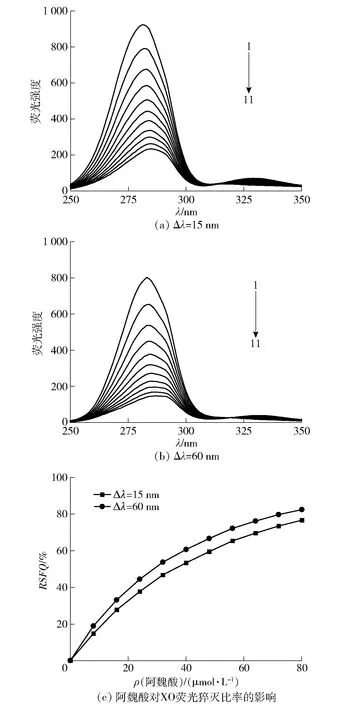
1~11表示阿魏酸浓度为0、8、16、24、32、40、48、56、64、72、80 μmol/L。图7 阿魏酸对XO同步荧光光谱的影响Fig.7 Effect of ferulic acid on synchronous fluorescence spectra of XO
2.7 阿魏酸对XO二级结构的影响
通过测定阿魏酸添加后反应体系的圆二色光谱来分析XO二级结构的变化,见图8。从图8可以看出,阿魏酸-XO体系在210~220 nm有一个负峰,这是蛋白质β-折叠的特征峰,与其他人研究结果一致[4, 36]。采用CDNN软件计算XO与阿魏酸作用前后二级结构的变化,结果如表3。随着阿魏酸与XO摩尔比的升高,α-螺旋含量逐渐提高,β-折叠含量逐渐减少,β-转角和无规则卷曲含量均逐渐降低。当阿魏酸与XO摩尔比为20∶1时,α-螺旋含量从21.37%增加至29.47%,β-折叠含量从26.57%减小到20.10%,β-转角和无规则卷曲含量分别从19.20%和44.57%下降到17.30%和38.80%,表明阿魏酸能引起XO二级结构的改变。有研究表明:β-链(β-折叠和β-转角)和无规则卷曲含量升高会增加底物黄嘌呤结合到XO活性中心的机会[4],α-螺旋含量的减少会使得部分蛋白质发生去折叠[37],因此本研究结果中α-螺旋含量的增加会使得XO结构的紧密性更强,不利于活性中心的形成,β-链和无规则卷曲含量的降低会阻止底物黄嘌呤进入XO活性中心,从而减弱了XO的催化活性,该结果与多种多酚类化合物(红陪酚、槲皮素、黄芩素、黄芩苷和高良姜素等)对XO二级结构的影响一致[4,23,26,34]。
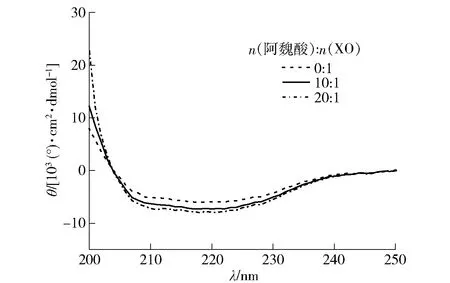
图8 阿魏酸对XO圆二色光谱的影响Fig.8 Effect of ferulic acid on CD spectra of XO

表3 XO和阿魏酸- XO体系的二级结构含量Tab.3 Contents of secondary structures of XO and ferulic acid-XO systems
3 结 论
通过对比常见的5种酚酸(对香豆酸、咖啡酸、阿魏酸、绿原酸和没食子酸)对XO活性的影响发现,阿魏酸对XO活性的抑制效果较佳,因而选择阿魏酸进一步全面探究其对XO的抑制机理。目前针对阿魏酸抑制XO的机理研究主要集中在抑制可逆性、抑制类型、猝灭常数、结合常数、结合位点数及同步荧光等方面。Dumitrascu等[10]研究了阿魏酸与热处理XO的结合性质,而没有针对未经处理的XO进行研究。Nile等[15]与Chang等[16]仅对阿魏酸与XO的抑制类型进行了研究,本研究表明阿魏酸对XO的抑制类型为混合竞争性抑制,与Nile等[15]的结果一致,但与Chang等[16]的结果不一致。Lin等[17]研究了阿魏酸与XO的抑制可逆性、抑制类型、猝灭常数、结合常数、结合位点数及对XO同步荧光的影响,与本研究有相同的抑制可逆性和抑制类型结果,结合位点数和同步荧光光谱也与本研究结果接近。而阿魏酸对XO的荧光猝灭机理、结合主要作用力及对XO二级结构的影响报道较少。因此,本研究在与前人相同的研究内容基础上,进一步在这3方面进行研究,并通过分子模拟技术预测可能的结合姿态及参与的氨基酸残基,在验证前人结果的基础上,获得了更系统全面的研究结果。
通过酶学、光谱学、分子模拟技术研究发现,阿魏酸采用可逆的混合竞争性抑制方式抑制了XO活性,在氢键和疏水作用力驱动下阿魏酸自发地结合到XO的FAD活性区域,形成阿魏酸- XO复合物,阻碍了O2-扩散,导致尿酸合成减少。阿魏酸结合XO的位点更靠近色氨酸残基,增强了色氨酸残基周围的极性,同时降低了其疏水性,采用动态静态混合方式使XO的内源荧光发生猝灭,以静态猝灭为主导,并且影响了XO的二级结构(α-螺旋含量升高,β-折叠、β-转角和无规则卷曲含量降低),提高了XO结构的紧密性。研究结果旨在为预防高尿酸血症功能食品的开发等方面提供一定的理论依据,且阿魏酸来源广泛,具有良好的开发和应用前景。但阿魏酸会存在一定的性质不稳定性,后期将采用包埋等技术提高阿魏酸的稳定性,进而拓宽阿魏酸的应用范围;不同酚酸与XO之间是否存在一定构效关系也将是后期研究的内容。
