SARS-CoV-2感染引发下尿路症状及机制研究进展
2023-02-08段良斌
段良斌, 陈 忠, 钟 鹏, 杨 东
自2019年末,新型冠状病毒感染(COVID-19)进入了全球大流行状态,虽然当前COVID-19在全球大多数地区已经得到一定程度的控制,但其蔓延的危险仍然没有消失。COVID-19的典型症状包括发烧、咳嗽、喉咙痛、乏力、咯痰、呼吸急促和头痛等[1]。然而,已有许多研究报道COVID-19还有其他非呼吸系统的表现,这可能是新型冠状病毒(SARS-CoV-2)直接侵犯肺部以外器官的表现,也可能是细胞因子风暴扩散所致。作为泌尿外科医师,我们对COVID-19的非呼吸系统表现尤其需要关注的有:下尿路症状(LUTS)[2]、急性肾损伤[3]、睾丸炎或附睾炎[2]。这些症状的新发或者加重可能暗示患者感染SARS-CoV-2。在本文中,我们将LUTS作为主要讨论对象,汇总SARS-CoV-2感染导致新发LUTS或原有LUTS加重的报道,并分析SARS-CoV-2感染累及下尿路的机制,为处理相关情况的泌尿外科医师和感染科医师提供资料,并为该主题后续深入的研究提供线索。
1 COVID-19患者的下尿路症状
Mumm等[4]首先发现急诊科1例患者出现发热、寒战、腰痛、尿急和尿频症状,初步诊断为尿路感染,但患者的尿常规和尿培养结果显示没有感染迹象,患者行院外口服抗生素治疗。但随后的常规检查发现该患者SARS-CoV-2 RNA检测为阳性,故重新确诊为COVID-19并收入感染科。随后,患者症状加重,出现发热、疲劳和呼吸相关性胸痛。这个病例警示了泌尿外科医师LUTS可能是COVID-19患者的首发症状,并引发了后续多个回顾性或前瞻性的对SARS-CoV-2感染与LUTS关联的研究。
截止目前,共有6项研究报道了SARS-CoV-2感染与LUTS关联(见表1)。具体来讲,在4项研究[4-7]中,通过对总共103例COVID-19患者病史的回顾发现,有43例出现新发LUTS(包括尿频、尿急、夜尿增加和急迫性尿失禁),7例原有LUTS加重,3例血尿加重。这些研究排除了补液治疗引起的尿频,且患者尿细菌培养均为阴性。Kaya等[8]通过国际前列腺症状评分(IPSS)表和泌尿症状评分表分别对已出院的19例男性和27例女性COVID-19患者进行了回访,发现男性患者的储尿期IPSS和女性患者的压力性尿失禁和膀胱过度活动评分在感染期间增加。另外,Can等[9]对94例正处于住院期间的COVID-19男性患者的前瞻性研究得出结论:50岁以上患者LUTS评分在罹患COVID-19后显著增高。这些研究提示了SARS-CoV-2感染可能累及下尿路,新发LUTS或原有LUTS的恶化是常见的下尿路受累的表现。在另一项对63例40岁以上男性COVID-19患者的研究中[10],虽然没有直接报道COVID-19发病与LUTS变化的关联,但是发现LUTS严重的患者住院时间更长,需要重症监护的次数更多,死亡率也更高。结合上文,推测对于男性、储尿期LUTS可能是COVID-19的早期症状之一,且对于老年男性COVID-19患者,下尿路受到的影响会更为严重,且IPSS越高,COVID-19患者的预后越差。
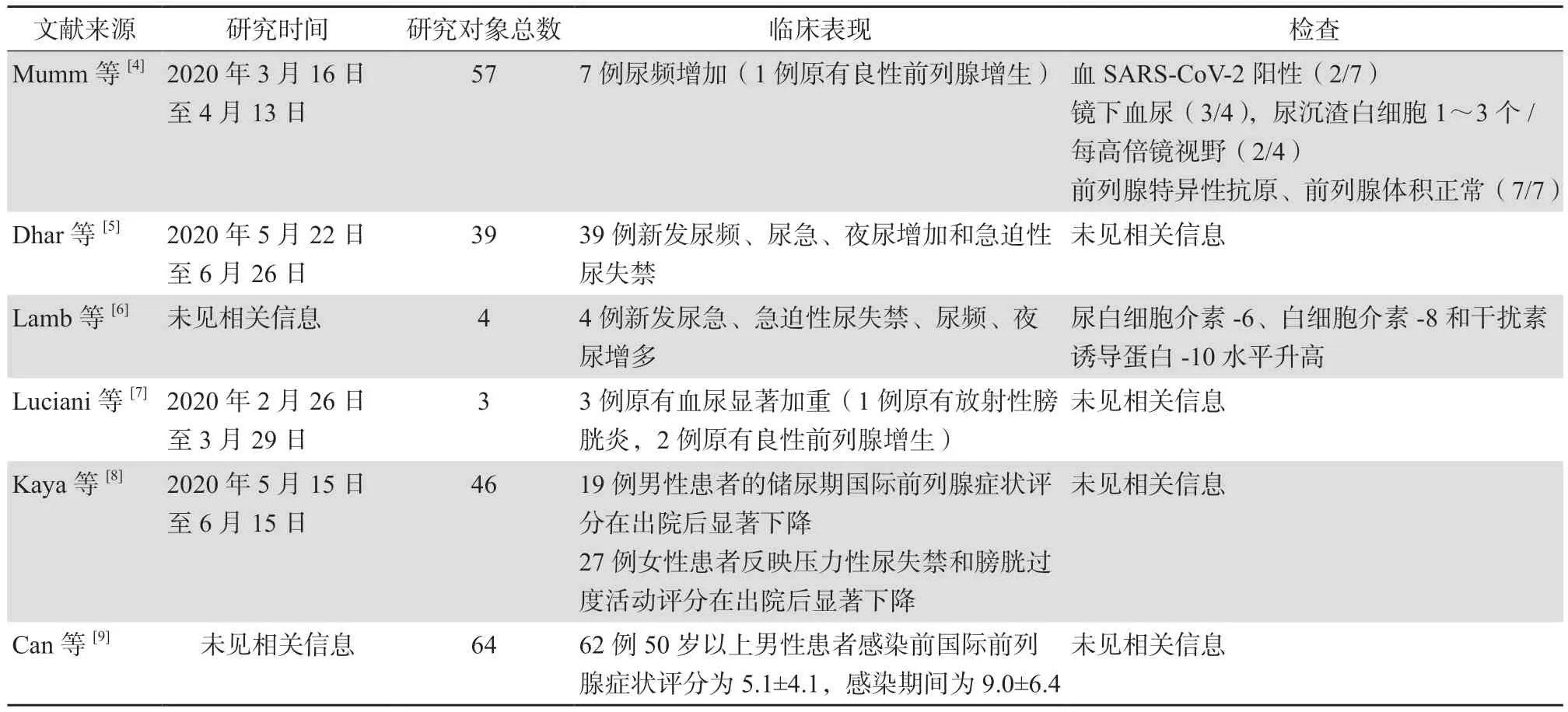
表1 COVID-19患者出现下尿路症状研究汇总
2 SARS-CoV-2感染累及下尿路的机制
目前COVID-19患者出现LUTS的机制还没有确定的结论,理论上,SARS-CoV-2可以从血液途径或者尿液途径侵犯膀胱上皮细胞(图1),后者已被证实存在血管紧张素转化酶2(ACE2)。SARS-CoV-2感染宿主细胞的过程为(图2):首先宿主细胞的跨膜丝氨酸蛋白酶2(TMPRSS2)切割并启动SARS-CoV-2的刺突蛋白,然后激活后的刺突蛋白通过结合宿主细胞膜上的ACE2感染宿主细胞[11]。Zou等[12]分析来自人类主要生理系统的单细胞RNA测序数据集(膀胱数据来自GSE129845样本GSM3723358),发现膀胱尿路上皮细胞的ACE2阳性率是2.4%,属SARS-CoV-2感染高风险的细胞类型。在Mumm等[4]的报道中,1例尿频加重的COVID-19患者的血样本中检出SARS-CoV-2 RNA阳性,这为病毒通过血液途径侵犯尿路上皮提供了证据。另一方面,已有许多研究报道了从患者尿液样本中检出SARS-CoV-2 RNA[13-14],这从侧面反映了有可能存在尿液感染途径。但是,Kashi等[13]对39项研究(总共包括533例患者的尿样)进行系统评价后发现,仅14项研究报告了24例患者的尿样中存在SARSCoV-2 RNA,尿样的病毒总检出率为4.5%,且进一步荟萃分析表明检出率约为1.18%(95%置信区间:0.14%~2.87%)。综上可见,不管是尿液还是血液中,SARS-CoV-2 RNA的检出率都十分低,很难解释相对更普遍的COVID-19患者下尿路受累的表现。
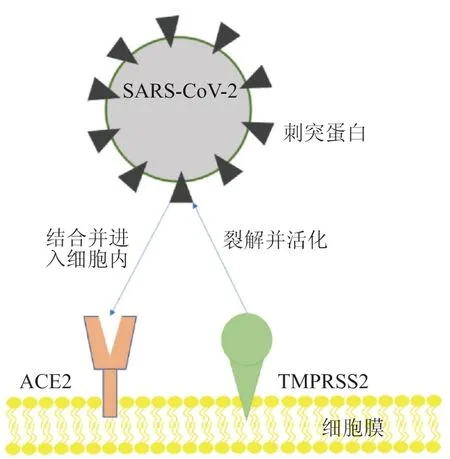
图2 SARS-CoV-2侵犯细胞的过程
SARS-CoV-2与引发非典型肺炎的SARS-CoV一样,会引发全身性的细胞因子风暴。细胞因子风暴是指循环中白细胞介素(IL)-6、IL-1、肿瘤坏死因子α(TNF-α)和干扰素等多种促炎性细胞因子水平突然急剧升高,导致各种免疫细胞(如巨噬细胞、中性粒细胞和T淋巴细胞)从循环进入感染部位,对人体组织产生破坏性影响,导致内皮细胞相互作用不稳定、血管屏障受损、毛细血管损伤、弥漫性肺泡损伤、多器官功能衰竭,并导致最终死亡[15]。而下尿路局部的细胞因子增加,导致下尿路的炎症反应,并引发LUTS,这是COVID-19患者LUTS表现的另一种推论(图1)。Lamb等[6]报道4例合并LUTS的COVID-19患者相比于正常人尿液中炎性细胞因子IL-6、IL-8和干扰素诱导蛋白-10(IP-10)水平升高,并推测过度的炎性细胞因子进入尿液,破坏和刺激膀胱黏膜引发LUTS。

图1 SARS-CoV-2感染引发下尿路症状的可能途径
3 男性对COVID-19合并LUTS的易感性及抗雄治疗的讨论
COVID-19具有性别差异,男性相比于女性更高危。流行病学数据表明SARS-CoV-2感染者男性多于女性,且男性患者的死亡率更高[16]。McCoy等[17]进行前瞻性研究发现雄激素受体基因的变异与男性COVID-19患者的疾病严重程度有关,且位于雄激素受体基因中的多谷氨酰胺重复序列越长,COVID-19的病情越严重。同时,雄激素受体活性一直被认为是TMPRSS2基因转录的必要条件(图3),遗传多态性(雄激素受体和ACE2基因位点在X染色体上)的X连锁遗传可能进一步增强男性对SARS-CoV-2的易感性[18]。
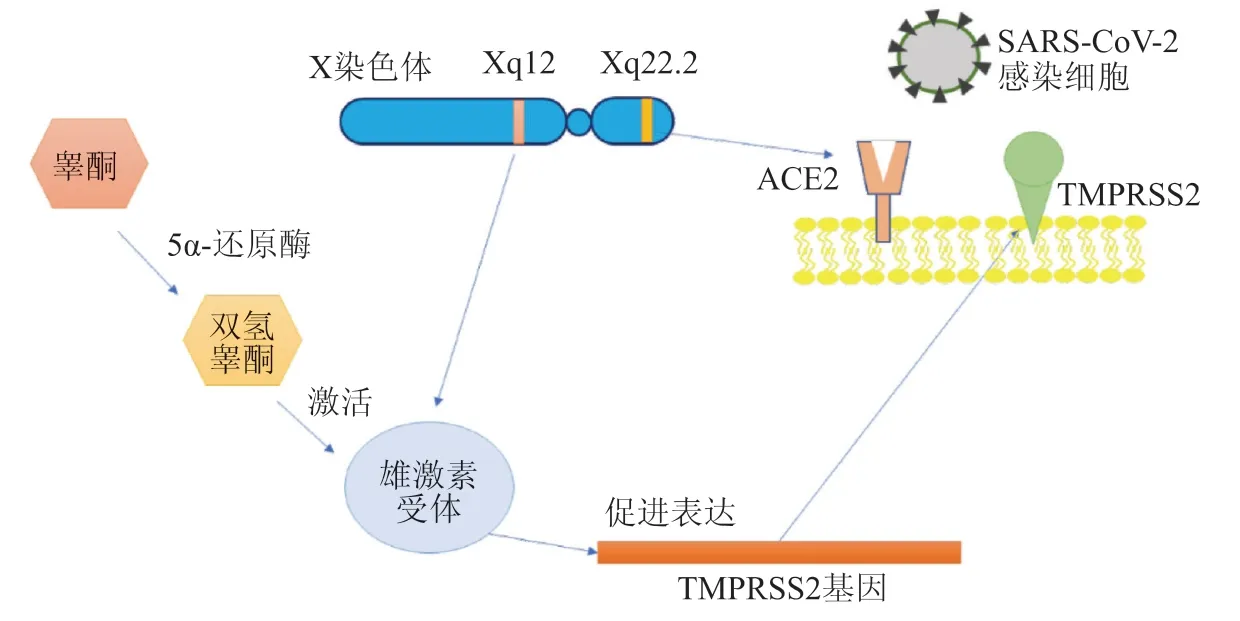
图3 雄激素信号与SARS-CoV-2感染细胞的关系
另一方面,男性随着年龄增长,良性前列腺增生症(BPH)的发病率也会增长,BPH正是男性非神经源性LUTS的最主要原因。Song等[19]研究发现TMPRSS2在人类前列腺上皮细胞中高度表达,且小部分前列腺棒状上皮细胞和丘状上皮细胞共表达TMPRSS2和ACE2。这进一步证明了男性,尤其是老年男性更容易受到SARS-CoV-2感染所致的LUTS的打击。
已有研究证明IPSS可以反映老年男性COVID-19患者预后[10],因此尤其要注意对这类患者LUTS的治疗。目前应用于BPH/LUTS的一线药物有α受体阻滞剂和5α还原酶抑制剂,前者主要舒张膀胱颈和前列腺平滑肌,而后者抑制睾酮转化为双氢睾酮,对雄激素依赖的前列腺具有缩小其体积的作用。而作为抗雄疗法的5α还原酶抑制剂的使用,需要注意雄激素对COVID-19影响的矛盾性。研究报道[16,20],雄激素水平降低与呼吸肌活动减弱和促炎细胞因子增加有关,而补充雄激素对肺功能有积极影响,还会降低IL-1β、IL-6和TNF-α活性;不利的是,雄激素升高会增加雄激素受体活化,而后者是TMPRSS2基因转录所必需的。综上,抗雄有利于改善BPH/LUTS,并可能通过减少雄激素受体的激活而阻止SARSCoV-2对男性下尿路及前列腺的侵犯,但也可能减弱患者的呼吸功能或上调促炎细胞因子。临床医师在选择疗法的时候需要考虑到所有可能的积极和消极的后果。
4 总结
COVID-19患者合并LUTS是较为普遍的现象,可能是SARS-CoV-2通过血液或尿液途径直接侵犯膀胱上皮,也可能是细胞因子风暴累及下尿路。COVID-19患者可能会以新发或加重的LUTS为首发症状,LUTS对SARS-CoV-2感染者的预后有一定的影响。因此在LUTS的诊治过程中,要警惕SARS-CoV-2感染的可能性。特别是中老年男性常合并有BPH等基础疾病,男性本身对SARS-CoV-2更为易感,更应给予更多的关注和处理。
