红芪多糖对糖尿病胃轻瘫大鼠氧化应激的影响
2023-02-07郭倩李雅琪万生芳魏昭晖杨蕤李荣科张磊舒畅李亚玲杨雅丽
郭倩,李雅琪,万生芳,魏昭晖,杨蕤,李荣科,张磊,舒畅,李亚玲,杨雅丽
1.甘肃中医药大学,甘肃 兰州 730000;2.中国药科大学,江苏 南京211298
糖尿病胃轻瘫(diabetic gastroparesis,DGP)是糖尿病常见的慢性消化道并发症之一,随着糖尿病发病率不断提高,DGP发病率占比达60%以上[1]。其主要表现是胃动力障碍、胃排空延迟、无机械性阻塞,并伴有餐后饱腹、恶心、呕吐等症状[2]。DGP发病机制复杂多变,与自主神经病变、胃肠激素紊乱、胃组织病变、氧化应激、高血糖等密切相关[3]。目前研究大多关注高血糖、自主神经病变等,从氧化应激方面研究DGP较少。氧化应激失衡是导致DGP的重要机制,多种植物多糖能改善氧化损伤,恢复氧化平衡[4]。红芪是甘肃道地药材,其主要活性成分红芪多糖(hedysarum polybotrys polysacchcaide)具有调节细胞免疫、抗氧化、抗炎、防治糖尿病等作用[5-8]。研究表明,红芪多糖能清除氧自由基,激活核因子E2相关因子(Nrf2)信号通路,促进抗氧化酶超氧化物歧化酶(SOD)生成,减少诱导型一氧化氮合酶含量[6]。本课题组前期研究发现,红芪多糖能降低DGP大鼠血糖,提高胃肠动力,修复胃肠黏膜,抑制胃窦组织平滑肌细胞凋亡[6,9]。本实验观察红芪多糖对DGP大鼠胃排空率、小肠推进率的影响,并检测血清和小肠组织氧化应激相关指标变化,进一步探讨红芪多糖改善DGP的作用机制,为治疗DGP提供实验依据。
1 实验材料
1.1 动物
72 只SPF 级6 周龄雄性Wistar 大鼠,体质量(180±20)g,北京斯贝福生物科技有限公司提供,动物许可证号SCXK(京)2019-0010。饲养于甘肃中医药大学动物房,温度23 ℃,相对湿度50%。本实验经甘肃中医药大学实验动物中心动物伦理委员会审批(2020-041)。
1.2 药物
红芪多糖,宝鸡市方晟生物开发公司,纯度72.4%,批号20200315。临用前用纯净水溶解,制成浓度分别为20、10、5 mg/mL溶液。枸橼酸莫沙必利分散片,成都康弘药业集团股份有限公司,5 mg/片,批号190614。将药品粉碎,用纯净水溶解,制成浓度为0.35 mg/mL溶液。
1.3 主要试剂与仪器
水合氯醛(天津市大茂化学试剂厂,批号20190504),血糖试纸(罗氏血糖健康医护公司,批号478696),链脲佐菌素(STZ,德国VETEC公司,批号WXBD4971V),活性氧(ROS)试剂盒(江苏酶标生物,批号MB-6608A),SOD、谷胱甘肽过氧化物酶(GSH-Px)、8-羟基脱氧鸟苷酸(8-OHdG)、丙二醛(MDA)试剂盒(上海酶联生物,批号分别为ml059387、ml097316、ml028318、ml077384),PCR试剂盒(武汉赛维尔生物科技有限公司,批号G3321),中性树胶(北京索莱宝科技有限公司,批号G8590),伊红(北京索莱宝科技有限公司,批号G1100),苏木素(北京索莱宝科技有限公司,批号G1080),4%组织细胞固定液(北京索莱宝科技有限公司,批号P1110),谷胱甘肽转移酶(GST)、醌氧化还原酶1(NQO1)抗体(英国Abcam公司,批号分别为ab13849、ab80588),RIPA裂解液(北京索莱宝科技有限公司,批号R0010-100),Super ECL Plus超敏发光液(北京普利莱基因科技有限公司,批号P10100)。Accu-Chek Performa血糖仪(罗氏卓越金采),XYJ80-2电动离心机(常州市金坛恒丰仪器厂),Infinite M200 Pro多功能酶标仪(瑞士Tecan),Varioskan Lux型实时定量PCR 仪(美国Thermo 公司),RM2016 切片机(德国LEICA),SHA-C 水浴锅(江苏荣华公司),IX51显微镜(日本OLYMPUS),ML408生物电放大器(上海ADInstruments),PL3508生理信号采集系统(上海ADInstruments),AUW220D 半微量电子天平(日本岛津公司),FRESCO 21高速冷冻离心机(美国Thermo Fisher Scientific公司)。
1.4 造模、分组及给药
将STZ溶于0.1 mmol/L柠檬酸钠缓冲液(pH 4.2~4.5),配制成1%STZ溶液。72只大鼠适应性饲养1周后,随机分为空白组12只和造模组60只,禁食24 h,禁水2 h,造模组按50 mg/kg一次性腹腔注射STZ溶液,空白组注射等体积0.1 mmol/L柠檬酸钠缓冲液。72 h后尾静脉采血,测定随机血糖≥16.7 mmol/L为糖尿病大鼠。造模组大鼠继续以高糖高脂饲料不规则喂养(单日上午进食,双日下午进食)4周,测定血糖≥16.7 mmol/L,并伴有饮水量增加、腹部胀大、体质量明显减轻等表现,随机抽取空白组与造模组大鼠各2只检测小肠肌电活动,造模组大鼠小肠自主收缩频率显著降低提示DGP大鼠造模成功。根据实际成模大鼠数量并综合考虑模型大鼠死亡率,最终模型组8只,阳性药组和红芪多糖高、中、低剂量组各9只。根据体表面积法及红芪多糖纯度计算等效剂量,阳性药组灌胃枸橼酸莫沙必利溶液3.5 mg/kg,红芪多糖高、中、低剂量组分别按200、100、50 mg/kg灌胃红芪多糖溶液,空白组和模型组予纯净水灌胃,灌胃体积均为2 mL,每日1次,连续8周。给药期间空白组予普通饲料喂养,其余各组继续高糖高脂饲料喂养。
1.5 检测指标
1.5.1 一般状况
观察大鼠精神状态、活动状况、毛色等,记录大鼠每日饮食量、饮水量变化,每2周测量体质量及尾静脉采血检测随机血糖。
1.5.2 胃排空率检测
检测前大鼠禁食24 h,禁水2 h,予50 mg/dL酚红溶液2 mL 灌胃,20 min 后10%水合氯醛腹腔注射(0.33 mL/100 g)麻醉,剖腹,结扎贲门和幽门,取出完整胃体,沿胃大弯剪开,用生理盐水冲洗胃内容物,定容至20 mL。加入0.5 mol/L氢氧化钠20 mL搅拌均匀,室温静置1 h,取上清液5 mL,加入20%三氯乙酸溶液0.5 mL去除蛋白,3 500 r/min离心15 min,取上清液。另取酚红溶液2 mL,依次加入生理盐水18 mL、20%氢氧化钠20 mL、三氯乙酸溶液4 mL搅拌均匀,作为酚红标准品。多功能酶标仪波长560 nm 处测定OD值,计算胃排空率。胃排空率(%)=(酚红标准品OD值-样品OD值)×100%。
1.5.3 小肠推进率检测
从幽门处分离小肠,平铺于冰面,于酚红染色末端剪一小口,滴加少量氢氧化钠,若变紫蓝色则为酚红到达部位,并在此区域前后分别滴加氢氧化钠以判断酚红实际到达位置,测量幽门至酚红到达部位长度及小肠全长(幽门至回盲瓣),计算小肠推进率。小肠推进率(%)=幽门至酚红到达部位长度÷小肠全长×100%。
1.5.4 ELISA检测
心脏采血后常温静置2 h,4 ℃、4 000 r/min离心15 min,吸取上层血清,采用ELISA 检测血清ROS、SOD、GSH-Px、MDA、8-OHdG含量。
1.5.5 HE染色
取小肠组织,放入固定液中固定,脱水,透明,常规石蜡包埋,切片(厚度5 μm),二甲苯Ⅰ、Ⅱ、Ⅲ各15 min 脱蜡,100%乙醇Ⅰ、Ⅱ各5 min,95%、90%、85%、75%乙醇各2 min复水,自来水冲洗,蒸馏水浸泡5 min,苏木素染色5 min,流水冲洗2 min,1%盐酸乙醇分化2 s,水洗返蓝,0.5%伊红染色1 min,水洗2 min,75%、85%、90%、95%乙醇各5 s,100%乙醇Ⅰ、Ⅱ、Ⅲ各5 s,二甲苯Ⅰ、Ⅱ、Ⅲ各30 s。中性树胶封片,显微镜下观察。
1.5.6 qRT-PCR检测
称取大鼠小肠组织0.1 g置于无酶EP管中,加入1 mL Trizol,于冰上匀浆裂解,静置10 min,4 ℃、12 000 r/min离心8 min,将上清液转移至新的EP管中,加入0.2 mL 氯仿震荡摇匀,冰上静置3 min,4 ℃、12 000 r/min离心15 min;吸取上清液,加入0.5 mL异丙醇,冰上静置10 min,4 ℃、12 000 r/min离心15 min;弃上清液,沉淀加1 mL 75%乙醇溶解,充分混匀,4 ℃、7 500 r/min离心5 min;弃上清液,沉淀即为总RNA,核酸定量分析仪测定RNA浓度。以RNA为模板反转录合成cDNA。RT-PCR 条件:95 ℃预变性30 s,95 ℃变性0.05 s,60 ℃退火34 s,共40个循环。95 ℃延伸15 s,60 ℃、1 h,95 ℃、15 s。以β-actin为内参,2-ΔΔCt法计算目的基因相对表达量。引物由碧云天生物工程(上海)有限公司合成,引物序列见表1。

表1 各基因PCR引物序列
1.5.7 Western blot检测
取小肠组织约100 mg,加入1 mL RIPA 裂解液,冰上充分研磨,4 ℃、12 000 r/min离心15 min,取上清液,BCA法测定蛋白浓度;加入5×上样缓冲液充分混匀,100 ℃水浴加热10 min;蛋白上样,SDS-PAGE分离蛋白,冰浴、200 mA 转膜60 min,将蛋白转至PVDF膜,5%脱脂奶粉封闭2 h,TBST洗涤3次,滴加GST、NQO1一抗(1∶1 000),4 ℃孵育过夜;取出条带,TBST清洗3次,滴加二抗(1∶5 000),室温孵育2 h,ECL发光液显影,凝胶成像分析仪摄取图像,采用Image J 1.4.8软件分析蛋白灰度值,以目的蛋白与内参蛋白(β-actin)灰度值比值计算蛋白相对表达量。
1.6 统计学方法
采用GraphPad Prism 5.0软件进行统计分析。实验数据以表示,多组间比较采用单因素方差分析,组间两两比较用t检验。P<0.05表示差异有统计学意义。
2 结果
2.1 红芪多糖对模型大鼠一般状况的影响
空白组大鼠饮食、饮水正常,精神状态佳,毛色光泽,反应敏捷;模型组大鼠造模初期出现多饮、多食、多尿,随机血糖升高,继而出现反应迟缓、毛色黯淡、精神萎靡、多饮多尿、进食量减少、腹部胀大。
与空白组比较,模型组大鼠各时点随机血糖显著升高(P<0.01);与模型组比较,红芪多糖各剂量组和阳性药组大鼠给药6、8 周随机血糖显著降低(P<0.01)。见表2。
表2 各组大鼠随机血糖比较(,mmol/L)
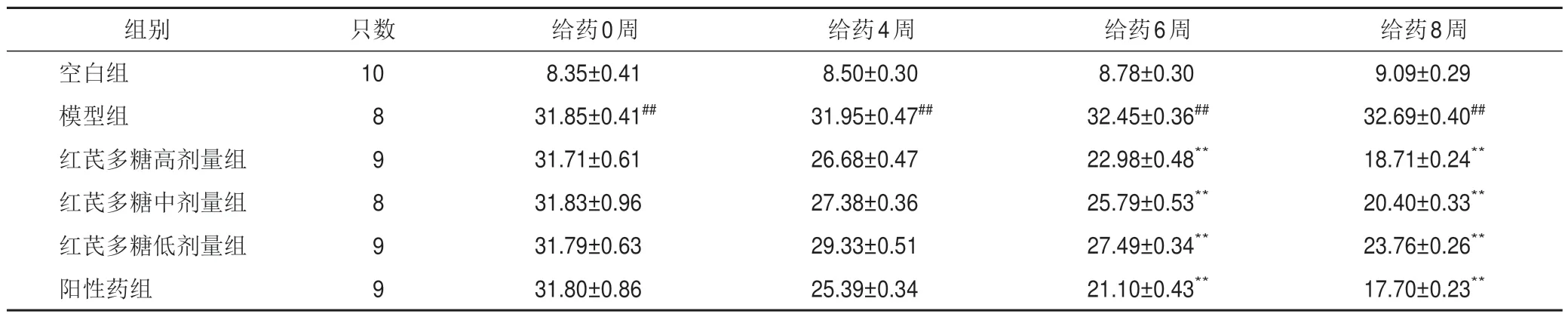
表2 各组大鼠随机血糖比较(,mmol/L)
注:与空白组比较,##P<0.01;与模型组比较,**P<0.01
与空白组比较,模型组大鼠各时点体质量显著降低(P<0.01);与模型组比较,给药4周后,红芪多糖高、中剂量组和阳性药组大鼠体质量显著升高(P<0.01),给药6、8周后,红芪多糖各剂量组和阳性药组大鼠体质量显著升高(P<0.01)。见表3。
表3 各组大鼠体质量比较(,g)
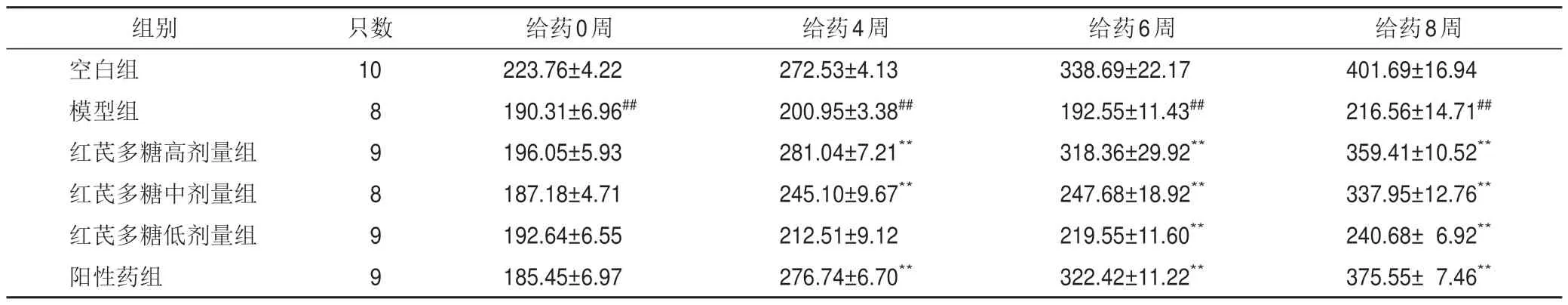
表3 各组大鼠体质量比较(,g)
注:与空白组比较,##P<0.01;与模型组比较,**P<0.01
2.2 红芪多糖对模型大鼠胃排空率及小肠推进率的影响
与空白组比较,模型组大鼠胃排空率和小肠推进率显著降低(P<0.01);与模型组比较,红芪多糖高、中剂量组和阳性药组大鼠胃排空率和小肠推进率显著升高(P<0.01);与阳性药组比较,红芪多糖中、低剂量组大鼠胃排空率和小肠推进率显著降低(P<0.01)。见表4。
表4 各组大鼠胃排空率及小肠推进率比较(,%)

表4 各组大鼠胃排空率及小肠推进率比较(,%)
注:与空白组比较,##P<0.01;与模型组比较,**P<0.01;与阳性药组比较,△△P<0.01
2.3 红芪多糖对模型大鼠血清活性氧、超氧化物歧化酶、谷胱甘肽过氧化物酶、丙二醛和8-羟基脱氧鸟苷酸含量影响
与空白组比较,模型组大鼠血清ROS、MDA、8-OHdG含量显著增加(P<0.05,P<0.01),SOD含量显著减少(P<0.01);与模型组比较,红芪多糖高剂量组和阳性药组大鼠血清ROS、MDA、8-OHdG含量显著减少(P<0.05,P<0.01),SOD 含量显著增加(P<0.05,P<0.01)。各组大鼠血清GSH-Px含量差异无统计学意义(P>0.05)。见表5。
表5 各组大鼠血清ROS、SOD、GSH-Px、MDA、8-OHdG含量比较()

表5 各组大鼠血清ROS、SOD、GSH-Px、MDA、8-OHdG含量比较()
注:与空白组比较,#P<0.05,##P<0.01;与模型组比较,*P<0.05,**P<0.01
2.4 红芪多糖对模型大鼠小肠组织病理变化的影响
空白组大鼠小肠组织结构完整,肠黏膜正常,腺体结构清晰,无炎性细胞浸润;模型组大鼠小肠组织结构模糊,腺体结构被破坏,黏膜消失,有大量炎性细胞浸润;各给药组大鼠小肠组织损伤情况有所好转,炎性细胞浸润减少,以红芪多糖高剂量组作用更明显。结果见图1。

图1 各组大鼠小肠组织形态(HE染色,标尺=100 μm)
2.5 红芪多糖对模型大鼠小肠组织Kelch样环氧氯丙烷相关蛋白-1、核因子E2 相关因子、血红素加氧酶-1和硫氧还蛋白mRNA表达的影响
与空白组比较,模型组大鼠小肠组织Keap1 mRNA表达显著升高,Nrf2、HO-1、Trx mRNA表达显著降低,差异有统计学意义(P<0.01);与模型组比较,红芪多糖高剂量组和阳性药组大鼠小肠组织Keap1 mRNA表达显著降低,Nrf2、HO-1、Trx mRNA表达显著升高,差异有统计学意义(P<0.05,P<0.01)。见表6。
表6 各组大鼠小肠组织Keap1、Nrf2、HO-1、Trx mRNA表达比较()
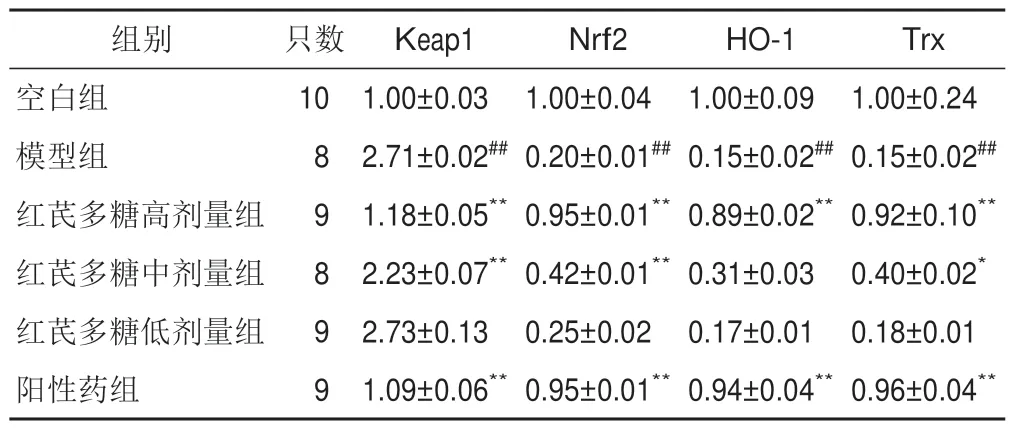
表6 各组大鼠小肠组织Keap1、Nrf2、HO-1、Trx mRNA表达比较()
注:与空白组比较,##P<0.01;与模型组比较,*P<0.05,**P<0.01
2.6 红芪多糖模型大鼠小肠组织GST 和NQO1 蛋白表达的影响
与空白组比较,模型组大鼠小肠组织GST 和NQO1蛋白表达显著降低(P<0.01);与模型组比较,红芪多糖高剂量组和阳性药组大鼠小肠组织GST 和NQO1蛋白表达显著升高(P<0.01)。见表7、图2。

图2 各组大鼠小肠组织GST和NQO1蛋白免疫印迹
表7 各组大鼠小肠组织GST、NQO1蛋白表达比较()

表7 各组大鼠小肠组织GST、NQO1蛋白表达比较()
注:与空白组比较,##P<0.01;与模型组比较,**P<0.01
3 讨论
Keap1/Nrf2信号通路是抗氧化应激的经典通路,Keap1是氧化还原反应的传感器,正常情况下,Keap1主要与Nrf2结合,以非活性状态存在于胞浆中,当受到ROS等刺激后,通过使构象发生改变从而与Nrf2解偶联,使Nrf2转入细胞核内与Maf蛋白结合成异质二聚体后与抗氧化反应元件结合,激活Ⅱ相代谢酶、抗氧化酶或药物转运体的转录活性,发挥抗氧化损伤作用,恢复细胞内稳态[10]。Keap1/Nrf2信号通路被激活后,进一步启动下游关键靶标如HO-1、Trx、NQO1、GST、SOD、GSH-Px、8-OHdG等,增强机体氧化应激反应,维持氧化平衡。
Keap1是氧化应激的关键蛋白,能提高机体对心肌微血管内皮细胞的保护作用,协调氧化应激,缓解机体氧化损伤[11]。GST是体内二相代谢酶,能促进氧化应激产物与还原型谷胱甘肽结合,维持氧化还原动态平衡,是抗氧化系统的重要组成部分,参与脂肪蛋白的生物合成,保护细胞免受化学和代谢损伤及氧化应激反应,调节脂质、能量代谢[12-13]。研究表明,GST含量变化是引起氧化应激、胰岛素抵抗等内环境紊乱的关键因素,更是导致2型糖尿病及其并发症的关键因素[14]。NQO1是细胞质中调节氧化还原反应的蛋白酶,能解除自由基和化合物毒性,是Nrf2下游重要的抗氧化因子,通过清除ROS催化体内还原反应,保护细胞免受氧化应激损伤[15]。研究发现,增强Nrf2、HO-1、NQO1蛋白表达可改善氧化应激,从而达到改善糖尿病并发症的目的[16]。
本实验中模型组大鼠小肠组织Keap1 mRNA表达显著升高,Nrf2、HO-1、Trx mRNA 表达显著降低,血清ROS、MDA、8-OHdG含量显著增加,SOD含量显著减少,胃排空率和小肠推进率显著降低,提示模型大鼠出现氧化应激损伤。经药物干预后,阳性药组和红芪多糖高、中剂量组大鼠小肠组织Keap1 mRNA表达显著降低,Nrf2、HO-1、Trx mRNA表达显著升高,血清ROS、MDA、8-OHdG含量显著减少,SOD含量显著增加,胃排空率和小肠推进率显著升高,提示机体抗氧化应激能力明显改善。
综上所述,红芪多糖干预能改善DGP大鼠一般状况,提高胃排空率和小肠推进率,调节血清ROS、MDA、8-OHdG、SOD含量,改善小肠组织病理损伤,其机制与下调小肠组织Keap1 mRNA表达,上调Nrf2、HO-1、Trx mRNA及GST、NQO1蛋白表达有关。本研究从抗氧化应激角度揭示了红芪多糖改善DGP的作用机制,可为相关临床研究提供实验依据。
