AACO方调控TGF-β1/Smad3信号通路保护慢性心力衰竭小鼠心肌纤维化的作用机制研究
2023-02-07王新婷鲁成宋磊钟逸航刘永明
王新婷,鲁成,宋磊,钟逸航,刘永明
1.上海中医药大学附属曙光医院,上海 201203;2.国家中医心血管临床医学研究中心分中心,上海 201203;3.上海中医药大学附属第七人民医院,上海 200137;4.六安市中医院,安徽 六安237000
2021年欧洲心脏病学会指南定义心力衰竭(heart failure,HF)不是单一的病理诊断,是以呼吸困难、踝关节肿胀、疲乏等为主要症状的复杂临床综合征,可能伴有颈静脉压升高、外周水肿等体征[1]。全球约6 430万人患有HF[2],而25%~40%的患者在HF一年后死于慢性心力衰竭(chronic heart failure,CHF)[3-4]。HF是导致全球2 400多万人死亡的主要原因[5]。我国HF患者人数约450万例,患病率为0.9%,病死率为12.3%,住院病死率为4.1%[6-7]。CHF患病率高、再住院率高、病死率高,已成为全球最主要的公共卫生问题[8]。
HF伴随心肌纤维化的病理改变,研究表明,心肌纤维化程度可以预测主要心血管不良事件及死亡,是判断HF 治疗有效性的重要指标[9-10]。TGF-β1/Smad3信号通路是纤维化形成的主要途径之一,在小鼠主动脉弓缩窄(TAC)诱导心肌肥厚的反应性纤维化和心肌梗死后的修复性纤维化中起主要作用[11]。中药可通过抑制TGF-β1/Smad3信号通路活性显著改善CHF心肌纤维化[12]。
CHF病机为心阳受损导致心肾阳气互资障碍,课题组前期运用均匀设计模型通过体内外实验筛选出附子、麦冬、黄芪、莪术按照4∶4∶2∶1质量配比,命名为AACO方[13]。方中附子、黄芪益气温阳,以温振心肾阳气,改善阳气互资;莪术行气活血,麦冬滋阴,助阴平阳秘。本研究通过TAC术建立诱导CHF小鼠模型,观察AACO 方对CHF 心肌纤维化的影响,基于TGF-β1/Smad3信号通路探讨其可能作用机制。
1 材料与方法
1.1 动物
6 周龄SPF 级雄性C57BL/6J 小鼠40 只,体质量(20±2)g,上海灵畅生物科技有限公司提供,动物生产许可证号SCXK(沪)2018-0003。饲养于上海中医药大学实验动物中心SPF级环境。本研究经上海中医药大学实验动物福利与伦理委员会审批(PZSHUTCM210730007)。
1.2 药物
AACO方(附子、麦冬、黄芪、莪术),免煎颗粒购自上海中医药大学附属曙光医院中药房,与饮片换算比例分别为附子1∶6、麦冬3∶10、黄芪3∶10、莪术1∶20。按中药饮片4∶4∶2∶1质量配比,加入双蒸水溶解,制备成原药材浓度为0.113 g/mL混悬液,密封、4 ℃避光保存。卡维地洛片,齐鲁制药有限公司,10 mg/片,批号2C0094D26,制成浓度为0.2 mg/mL混悬液,密封、4 ℃避光保存。
1.3 主要试剂与仪器
Ⅰ型胶原(ColⅠ,货号91144S),美国CST 公司;兔抗小鼠转化生长因子β1(TGF-β1,货号3709)、Smad3(货号9523)、p-Smad3(货号9523)、α-平滑肌肌动蛋白(α-SMA,货号19245)一抗,美国CST公司;辣根过氧化物酶标记山羊抗兔IgG(货号A208),上海碧云天;HiScript ⅡQ RT SuperMix for qPCR(货号R223-01)、AceQTMUniversal SYBR qPCR Master Mix(货号Q511-02/03),南京诺唯赞。超高分辨率小动物超声仪(型号Vevo2100,美国Visualsonics 公司),RT-qPCR 仪(型号Quanstudio 6 Flex,美国Applied Biosystems公司),电泳仪(型号LM61-PowerPac Universal,美国Bio-Rad公司),电泳槽(型号DYC-Mini4,北京东方瑞利科技有限公司)。
1.4 分组与造模
40只小鼠适应性饲养1周后,随机取10只作为假手术组,剩余30只小鼠行TAC术造模。术前24 h,用脱毛膏对小鼠胸前区进行脱毛处理,术前12 h禁食,自由饮水。称量小鼠体质量,3%戊巴比妥钠3 mL/kg腹腔注射麻醉,仰卧位固定四肢及躯干,胸前手术区域碘伏消毒,以正中线第一肋骨位置为中心,纵向剪开皮肤,紧贴胸骨柄左侧缘,连带肌肉剪断第一肋骨至第二肋骨上缘,使用自制拉钩撑开纵膈,分离胸腺,暴露主动脉弓,用显微镊夹住7-0丝线,环绕主动脉弓,将27G胰岛素针头置于主动脉弓和丝线之间进行垫扎,造成TAC。结扎丝线,抽出针头,恢复胸腺位置,用4-0针线快速对两侧纵膈进行“8”字缝合,挤压胸膈排出气体,缝合皮肤后用碘伏再次消毒,放于37 ℃恒温垫上进行保温。待小鼠恢复自主呼吸后,将其放回笼内正常饲养。假手术组只开胸,不进行主动脉弓结扎。术后将30只小鼠随机分为模型组、AACO方组和卡维地洛组,每组10只。
1.5 给药
造模后次日开始给药,根据人与小鼠体表面积换算等效剂量,AACO方组予AACO方混悬液6.93 g/kg(相当于免煎颗粒1.586 mg/kg)灌胃,卡维地洛组予卡维地洛混悬液1.73 mg/kg灌胃,假手术组和模型组予等量双蒸水灌胃,每日1次,连续8周。
1.6 超声心动图检测
给药结束后,使用脱毛膏对小鼠胸前区域进行脱毛,异氟烷吸入麻醉,仰卧位固定,将超声探头置于小鼠左胸部,使用小动物超声仪行超声心动图检测,选取左心室长轴切面,检测心率、左室射血分数(LVEF)、左室短轴缩短率(FS)、左室舒张末期内径(LVIDd)。各指标测量5个心动周期并计算平均值。
1.7 组织形态学检测
分离小鼠心脏,置于4%多聚甲醛中固定48 h,取1/3横截面组织,置入包埋盒,乙醇梯度脱水,二甲苯透明,浸蜡,包埋,切片(厚度5 μm),脱蜡至水,分别进行HE染色、Masson染色、苦味酸天狼猩红染色,二甲苯透明,封片。观察心脏形态和心肌纤维化情况,Image J软件计算Masson染色、苦味酸天狼猩红染色切片胶原面积或纤维化面积占心肌总面积的百分比,计算胶原容积分数(CVF)和心肌纤维化面积比。CVF(%)=胶原面积/总面积×100%,心肌纤维化面积比(%)=纤维化面积/总面积×100%。
1.8 免疫荧光染色
心脏组织石蜡切片常规脱蜡至水,0.01 mol/L柠檬酸钠(pH 6.0)高压修复,PBS 洗3 次,每次5 min;3%H2O2室温避光孵育10 min去除内源性酶,PBS洗5 min×3次;10%BSA室温封闭30 min,加入α-SMA一抗(1∶1 000)、ColⅠ一抗(1∶200),4 ℃孵育过夜;PBS洗3次,滴加荧光二抗(1∶100),室温避光孵育1 h,PBS 洗3 次,10%BSA 室温封闭1 h,加入α-SMA一抗(1∶1 000)、ColⅠ一抗(1∶200),室温孵育2 h,PBS洗3次,滴加荧光二抗(1∶100),室温避光孵育1 h,PBS 洗3 次,DAPI 染细胞核10 min,PBS洗3次,封片。观察心脏组织α-SMA和ColⅠ荧光表达情况,Image J软件计算α-SMA和ColⅠ荧光面积比(荧光面积/总面积×100%)。
1.9 RT-qPCR检测
取心尖组织,加入Trizol 试剂提取总RNA,将RNA 反转录为cDNA,参照AceQTMUniversal SYBR qPCR Master Mix试剂盒说明书配制10 μL反应体系,反应条件:95 ℃预变性5 min;95 ℃、5 min,共40个循环;95 ℃、15 s,60 ℃、60 s,95 ℃、15 s。以GAPDH为内参,采用2-ΔΔCt法计算各基因相对表达量。引物序列见表1。

表1 各基因PCR引物序列
1.10 Western blot检测
取心尖组织,加入含蛋白酶抑制剂和磷酸酶抑制剂的RIPA裂解液提取总蛋白,BCA法测定蛋白浓度,加入loading buffer,蛋白变性后,20 μg蛋白上样,凝胶电泳,转膜至PVDF膜,5%脱脂牛奶室温封闭1 h,加入α-SMA、TGF-β1、Smad3、p-Smad3一抗(均为1∶1 000),4 ℃孵育过夜,PBST洗涤3次,加入二抗孵育1 h,PBST 洗涤3 次,增强ECL 发光液显影,Image J软件分析蛋白灰度值。
1.11 统计学方法
2 结果
2.1 AACO方对模型小鼠超声心动图指标的影响
与假手术组比较,模型组小鼠LVEF、FS显著减少(P<0.01),LVIDd显著增加(P<0.01);与模型组比较,AACO方组和卡维地洛组小鼠LVEF、FS显著增加(P<0.01),LVIDd显著减少(P<0.01)。各组小鼠心率差异无统计学意义(P>0.05)。见图1、表2。

图1 各组小鼠超声心动图
表2 各组小鼠超声心动图指标比较()

表2 各组小鼠超声心动图指标比较()
注:与假手术组比较,**P<0.01;与模型组比较,##P<0.01
2.2 AACO方对模型小鼠心脏病理变化的影响
HE染色显示,假手术组小鼠心脏形态正常,心肌呈束状分布,心肌细胞排列有序、间质紧密;模型组小鼠心脏、心肌细胞明显增大,心肌细胞排列紊乱,心肌间质疏松;AACO方组和卡维地洛组小鼠心脏、心肌细胞无明显增大,心肌细胞排列较为规则。见图2。

图2 各组小鼠心脏组织形态(HE染色)
与假手术组比较,模型组小鼠心脏组织CVF和心肌纤维化面积比显著增加(P<0.01);与模型组比较,AACO方组和卡维地洛组小鼠心脏组织CVF和心肌纤维化面积比显著减少(P<0.05,P<0.01)。见图3、图4、表3。

图3 各组小鼠心脏组织形态(Masson染色,标尺=50 μm)

图4 各组小鼠心脏组织形态(苦味酸天狼猩红染色,标尺=50 μm)
表3 各组小鼠心脏组织CVF和心肌纤维化面积比比较(,%)

表3 各组小鼠心脏组织CVF和心肌纤维化面积比比较(,%)
注:与假手术组比较,**P<0.01;与模型组比较,#P<0.05,##P<0.01
2.3 AACO 方对模型小鼠心脏组织α-平滑肌肌动蛋白和Ⅰ型胶原表达的影响
与假手术组比较,模型组小鼠心脏组织α-SMA和Col Ⅰ表达显著升高(P<0.01);与模型组比较,AACO 方组和卡维地洛组小鼠心脏组织α-SMA 和ColⅠ表达显著降低(P<0.01)。见图5、图6、表4。
表4 各组小鼠心脏组织α-SMA和ColⅠ表达比较(,荧光面积比,%)

表4 各组小鼠心脏组织α-SMA和ColⅠ表达比较(,荧光面积比,%)
注:与假手术组比较,**P<0.01;与模型组比较,##P<0.01

图5 各组小鼠心脏组织α-SMA表达(免疫荧光染色,标尺=50 μm)
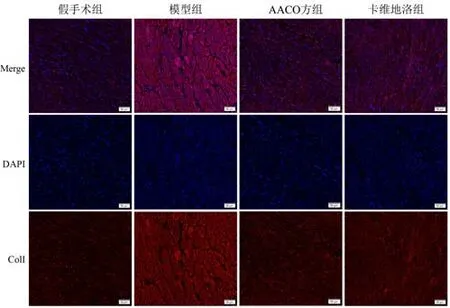
图6 各组小鼠心脏组织ColⅠ表达(免疫荧光染色,标尺=50 μm)
2.4 AACO 方对模型小鼠心尖组织Ⅰ型胶原和Ⅲ型胶原mRNA表达的影响
与假手术组比较,模型组小鼠心尖组织ColⅠ和ColⅢmRNA表达显著升高(P<0.01);与模型组比较,AACO方组和卡维地洛组小鼠心尖组织ColⅠ、ColⅢmRNA表达显著降低(P<0.01)。见表5。
表5 各组小鼠心尖组织ColⅠ、ColⅢmRNA表达比较()

表5 各组小鼠心尖组织ColⅠ、ColⅢmRNA表达比较()
注:与假手术组比较,**P<0.01;与模型组比较,##P<0.01
2.5 AACO方对模型小鼠心尖组织TGF-β1/Smad3信号通路相关蛋白表达的影响
与假手术组比较,模型组小鼠心尖组织α-SMA、p-Smad3、TGF-β1 蛋白表达显著升高(P<0.05,P<0.01);与模型组比较,AACO方组和卡维地洛组小鼠心尖组织α-SMA、p-Smad3、TGF-β1蛋白表达显著降低(P<0.05,P<0.01)。见表6、图7。
表6 各组小鼠心尖组织α-SMA、Smad3、p-Smad3、TGF-β1蛋白表达比较()
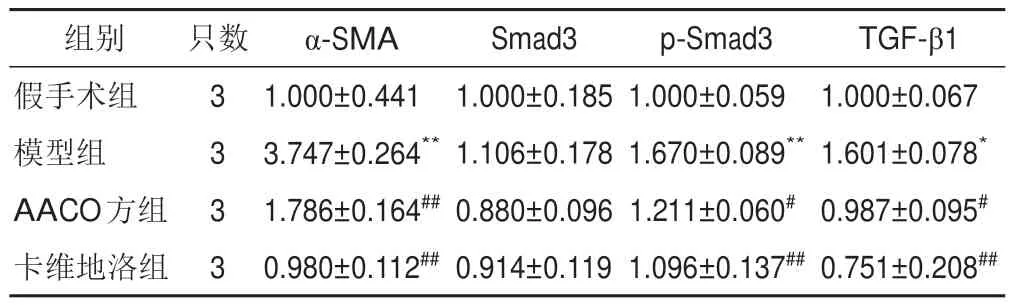
表6 各组小鼠心尖组织α-SMA、Smad3、p-Smad3、TGF-β1蛋白表达比较()
注:与假手术组比较,*P<0.05,**P<0.01;与模型组比较,#P<0.05,##P<0.01

图7 各组小鼠心尖组织α-SMA、Smad3、p-Smad3、TGF-β1蛋白免疫印迹
3 讨论
心肌纤维化是CHF的主要病理变化之一,是不良心肌重构的主要表现,而心肌重构又可降低组织顺应性,损伤心脏功能,促进心律失常发生,加速HF进展[14]。胶原是细胞外基质的主要成分,其中ColⅠ约占85%,ColⅢ约占11%[15]。TGF-β1是多效性细胞因子,参与多种细胞功能,对炎症、细胞外基质沉积、细胞增殖、分化具有重要调节作用。过表达TGF-β1能加速心肌肥厚和心肌纤维化发展[16],TAC所致心脏重构动物模型中,TGF-β1水平显著升高[17],TGF-β1/Smad3信号通路激活,p-Smad3表达增加,诱导肌成纤维细胞标志物α-SMA 表达升高,加速心肌纤维化发展[18],Smad3敲除小鼠心肌梗死后扩张性心肌重构减少,舒张功能障碍减轻[19]。本研究选取β受体阻滞剂卡维地洛作为阳性对照,研究显示,卡维地洛可通过抑制TGF-β1表达改善心肌纤维化,保护心脏功能[20-21],且卡维地洛可通过抑制TGF-β1/Smad3信号通路减少胶原合成,改善大鼠肝硬化[22]。
CHF属中医学“心痹”“心水”范畴,为本虚标实之证,其病机可概括为“瘀”“虚”“水”[23]。AACO方源于坎离颗粒,原方以温振心肾阳气、利水活血为治法而创,对CHF疗效确切[24-25]。课题组前期通过均匀设计筛选出坎离颗粒防治CHF的最佳中药及配比,命名为AACO方。本研究结果显示,AACO方可提高CHF小鼠LVEF和FS,降低LVIDd,改善心肌纤维化。
为进一步研究AACO方防治CHF心肌纤维化的作用机制,本研究检测TGF-β1/Smad3信号通路关键靶点TGF-β1、Smad3、p-Smad3、α-SMA、ColⅠ、ColⅢ表达。结果显示,与假手术组比较,模型组小鼠心尖组织TGF-β1、p-Smad3、α-SMA、ColⅠ、ColⅢ表达均显著升高;与模型组比较,AACO方组和卡维地洛组小鼠心尖组织TGF-β1、p-Smad3、α-SMA、ColⅠ、ColⅢ表达均显著降低,且AACO方与卡维地洛作用相当,提示AACO 方抑制CHF 心肌纤维化可能与抑制TGF-β1表达及下游Smad3磷酸化有关。
综上所述,AACO方可显著抑制CHF小鼠心肌纤维化,其机制可能与抑制TGF-β1/Smad3 信号通路有关。
