延龄草总皂苷对D-gal诱导的衰老大鼠认知功能及线粒体自噬的影响
2023-02-06杨丽君覃晓莉赵方毓向家鹏何一多陈显兵
王 刚,谢 雅,杨丽君,覃晓莉,赵方毓,,向家鹏,何一多,陈显兵,
(1.湖北民族大学医学部,2.湖北民族大学附属民大医院,湖北 恩施 445000)
根据第七次全国人口普查结果显示,截止2020年我国65岁及以上人口约有1.9亿人,占总人口的13.5%,与第六次普查相比上升了4.63%,现已成为世界上老龄化速度最快的国家之一[1]。研究显示,在人体衰老的进程中,大脑是最先衰老的器官之一,脑衰老可诱发阿尔茨海默病、帕金森病、亨廷顿病等多种神经退行性疾病,给老年人的健康带来严重影响。
线粒体自噬是一种选择性的自噬,可特异性的清除功能失调或受损的线粒体,是维持线粒体稳态及功能的重要途径[2]。在衰老的进程中,存在大量错误折叠的蛋白质及功能老化的线粒体,且随着年龄的增加,线粒体自噬的水平逐渐减弱,对受损细胞器和蛋白的降解能力降低,同时自噬水平的减弱也加速衰老的进程[3]。脑衰老会引起多种机体功能障碍,其中以学习记忆功能减退最为突出。研究显示PTEN诱导假定激酶1(Pink1)/E3泛素-连接酶活性帕金森病蛋白2(Parkin)介导的线粒体自噬与学习记忆能力有着密切的关系,且Pink1、Parkin基因的突变可诱发线粒体自噬异常,使受损线粒体聚集增多从而引起神经元和胶质细胞损伤以及神经轴突退化变性,这也是神经系统疾病的主要致病机制之一[4]。此外Pink1/Parkin介导的线粒体自噬在异常线粒体清除,缓解突触消失和认知损害方面也发挥着重要的作用。
延龄草(Trilliumtschonoskiimaxim,TTM)为湖北省恩施州土家族地区珍贵药材,味甘、性平,有小毒,其活性成分皂苷类具有抗炎镇痛、抗氧化、改善心功能及抗衰老等作用[5-6]。前期研究显示,TST具有延缓衰老、促进学习记忆等功效[7-8],但作用机制尚未完全阐明。本研究通过给大鼠注射D-gal诱导衰老模型,探究延龄草总皂苷(total saponins fromTrilliumtschonoskiimaxim,TST)对D-gal诱导的衰老大鼠认知功能及线粒体自噬相关蛋白表达水平的影响,深入探讨其作用机制,为延龄草总皂苷延缓衰老尤其是延缓脑部衰老作用提供现代生物学依据。
1 材料与方法
1.1 动物选取SPF级雄性SD大鼠50只,8周龄,体质量达(220±20) g,购自湖北省动物实验中心,许可证号:SCXK (鄂)2015-0018。分笼饲养,每笼5只,饲养温度保持在22 ℃~26 ℃、相对湿度保持在50%~55%之间,12 h自然交替给予照明,自由进食饮水。本次实验研究经湖北民族大学医学伦理委员会批准同意进行。
1.2 药物与试剂药材采自恩施州,由湖北民族大学中药实验室殷智教授鉴定为延龄草植物的干燥根茎(TTM)。TST由该校中药学实验中心自制,除去药材非药用部位及泥土杂质后,经60 ℃恒温箱干燥后进行粉碎处理,将药材粉末置于圆底烧瓶后加入适量75%乙醇浸泡萃取,将提取后的药液过滤并浓缩干燥,得TST总提取物。加入双蒸水,将总提取物完全溶解,采用饱和正丁醇再次萃取,减压浓缩干燥,得到含量为61.48%TST。通过TST对照品制作标准曲线,测定得总皂苷含量为14.72 mg·g-1生药。
D-gal(批号:G5388)购自美国Sigma-Aldrich试剂公司,Anti-rabbit IgG(批号:7074S)购自CST 公司,Parkin(批号:bs-1865R)购自博奥森生物公司,尼氏(Nissl)染液(批号:C0117)、β-actin(批号:0831171710)、PINK1(批号:AF7755)、LC3(批号:AF5225)、p62(批号:AF5312)及Beclin1(批号:AF5123)购自碧云天生物公司,免疫组化试剂盒购自迈新生物公司。
1.3 仪器酶标仪(1510型)购自Thermo Scientific公司;Morris水迷宫系统(DMS-2型)购自中国医学科学院药物研究所;Western印迹全套设备购自美国Bio-Rad公司;荧光显微镜(Eclipse80i)购自日本Nikon公司;-80 ℃冰箱购自SANYO公司;全自动曝光成像系统(Tanon-5200)购自上海天能科技公司。
1.4 动物分组、造模及干预方法采用随机数字表法将实验大鼠分为5组:正常对照组(Normal control)、模型组(D-gal model)、TST低、中、高(TST50、100、200 mg·kg-1)剂量组,每组10只。模型组及TST各剂量组的大鼠经颈背部皮下注射D-半乳糖(D-gal,100 mg·kg-1,注射容积为10 mL·kg-1·d-1)构建大鼠脑衰老模型,Normal control注射等量生量盐水,连续注射6周。TST各剂量组每日分别给予50、100、200 mg·kg-1的TST进行灌胃干预,Normal control和D-gal model每日给予等体积的双蒸水灌胃,连续灌胃6周。
1.5 检测指标
1.5.1Morris水迷宫 水迷宫实验在封闭隔音、无光环境中进行,于造模d 36~40行定位航行实验:系统自动将圆形水池分为四个象限,在第三象限放置一个略低于水面0.6~1 cm的圆形逃生平台,设定好水中游泳最长时间为60 s,每组7只大鼠进行实验。将大鼠面向池壁分别沿1、2、4象限边缘缓慢放下,此时系统记录大鼠游泳轨迹和上平台时间,在大鼠掉入水后由于求生本能会寻找逃离水的方法,若在60 s内没有找到逃生平台则需人为引导站在台上并停留15 s使其形成记忆,记录并分析大鼠在d5的平台潜伏期;水迷宫实验的d 6休息,d 7行空间探索实验:将求生平台撤去,大鼠沿第一象限边缘放入,记录60 s内大鼠穿越平台次数、第一次上平台及在目标象限停留时间,并进行统计学分析。
1.5.2组织灌注和取材 水迷宫实验结束后,用10%水合氯醛(0.3 mL/100 g)腹腔注射麻醉大鼠。每组随机选取7只大鼠,断头取海马组织并储存至-80 ℃冰箱;剩余3只大鼠麻醉后将其固定,用有齿镊夹持胸骨剑突,剪刀垂直打开胸腔,从心尖稍左侧位置插入穿刺针至升主动脉处,剪开右心耳。先快速灌注温生理盐水直至血液流净,再换4%多聚甲醛溶液灌注固定,脱水后石蜡包埋切片备用。
1.5.3HE、Nissl染色 各组大鼠脑组织切片常规脱蜡后,苏木精染色5~10 min,双蒸水洗涤,0.5%盐酸乙醇分化5~10 s,双蒸水冲洗,0.2%氨水反蓝40 s,双蒸水冲洗,伊红染色5 min后用双蒸水速洗,再行脱水、透明、封固;标本切片脱蜡后,放入尼氏染液中染色15 min,双蒸水洗涤数秒后进行脱水、透明、封固等步骤完成尼氏染色,最后扫描切片。
1.5.4免疫组化检测 取制备的脑组织蜡块样本,4 μm切片,70 ℃烤片过夜,二甲苯梯度脱蜡3次,梯度乙醇水化。高压锅抗原修复5 min,待切片冷却至常温后再用PBS漂洗3次,每次3 min,甩干后滴加3%H2O2以清除内源性过氧化物酶。PBS漂洗3次甩干,滴加5%BSA封闭液,湿盒静置30 min,甩去封闭液,滴加一抗Pink1和Parkin,4 ℃孵育过夜。次日室温环境中复温30 min,PBS漂洗3次甩干,滴加生物标记山羊抗兔IgG静置1 h。PBS漂洗3次甩干,滴加DAB显色液避光静置10 min,此时可以镜下观察着色程度。纯水洗涤数秒后苏木精复染1 min,1%盐酸酒精分化1 min,反蓝30 s,无水乙醇2 min,二甲苯透明2 min,中性树胶封固、切片扫描。
1.5.5海马组织蛋白的提取及Western blot检测 从-80 ℃低温冰箱中取出适量海马组织,按照1 mg组织加入9 μL裂解液、0.09 μL蛋白酶抑制剂的比例进行组织匀浆、超声,匀浆液低温高速离心(4 ℃,12 000 r·min-1,15 min)后取上清液,用BCA试剂盒测组织蛋白浓度并进行配平。
制备SDS-PAGE凝胶(12%分离胶,5%浓缩胶),依次进行电泳、转膜、封闭、洗膜、4 ℃孵育一抗Pink1(1 ∶1 000)、Parkin(1 ∶2 000)、p62(1 ∶1 000)、LC3(1 ∶1 000)、Beclin1(1 ∶1 000)过夜。次日洗膜、二抗孵育1 h、洗膜,最后采用化学发光法在成像系统下显影并记录其灰度值。以目标蛋白/内参蛋白(β-actin)的灰度值比值进行结果分析。
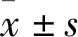
2 结果
2.1 TST对衰老大鼠学习能力的影响与正常对照组比较,D-gal模型组大鼠游泳轨迹杂乱,逃避潜伏期时间延长,第1次抵达求生平台时间明显增加(P<0.05),穿越平台次数减少,停留在目标象限时间缩短(P<0.05)。与D-gal模型组比较,TST各剂量组大鼠表现出一定的目标趋向性,逃避潜伏期明显缩短,第1次抵达求生平台时间明显减少(P<0.05),穿越求生平台次数增加,停留在目标象限的时间明显延长(P<0.05)(Fig 1,2,Tab 1)。

Tab 1 Results in spatial probe test of each
2.2 TST对衰老大鼠脑组织结构的影响如Fig 3所示,正常对照组海马CA1区和皮质着色较深,神经元数目较多、排列整齐,胞浆丰富、胞核清晰饱满;D-gal模型组海马CA1区和皮质着色较浅,神经元稀疏、排列紊乱,细胞核丢失,可见细胞肿胀空泡化,其海马组织内神经细胞的数量明显少于正常组;TST各剂量组海马CA1区和皮质着色较D-gal模型组深,细胞损伤性改变减轻,海马组织内神经元尼氏小体的数量明显多于模型组,且排列相对整齐,胞体之间的间隔较小(Fig 3)。

Fig 1 Results in place navigation test of each groupA:Swimming track in each group;B:The relative change of time of escape latency in each group.1:Normal control;2:D-gal model;3:D-gal+TST 50 mg·kg-1;4:D-gal+TST 100 mg·kg-1;5:D-gal+TST 200 mg·kg-1.#P<0.05 vs normal control,*P<0.05 vs D-gal model.
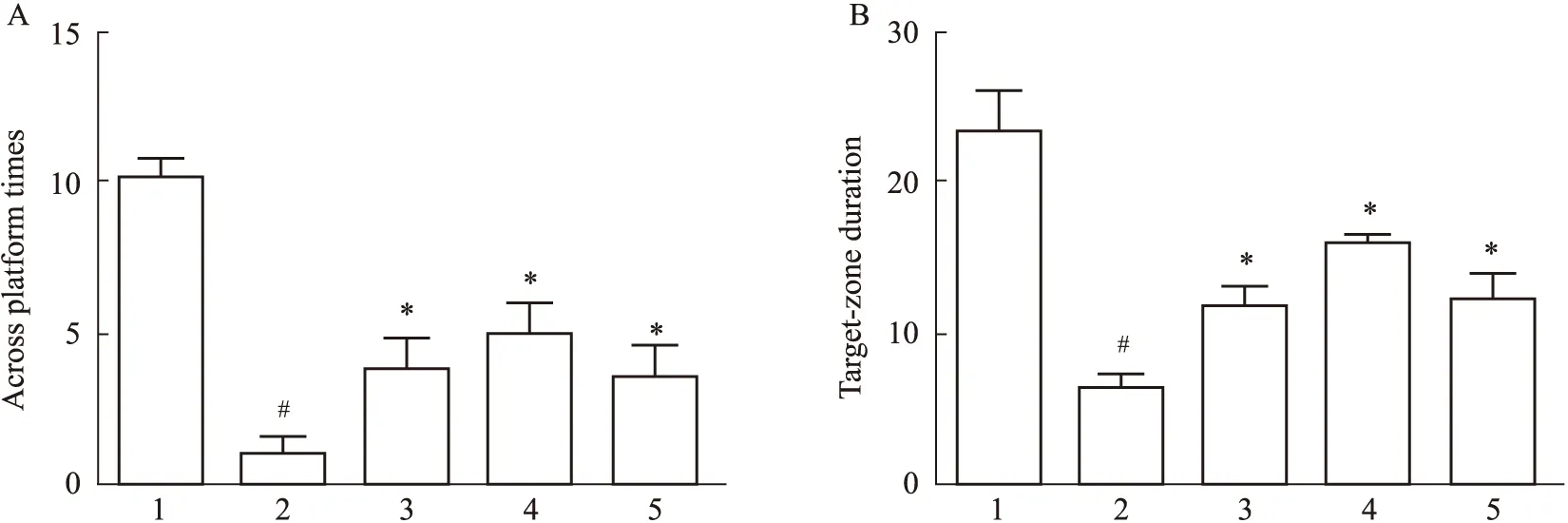
Fig 2 Results in spatial probe test of each groupA:The relative change of target-zone frequency in each group;B:The relative change of target-zone duration.1:Normal control;2:D-gal model;3:D-gal+TST 50 mg·kg-1;4:D-gal+TST 100 mg·kg-1;5:D-gal+TST 200 mg·kg-1.#P<0.05 vs normal control,*P<0.05 vs D-gal model.
2.3 TST对衰老大鼠海马组织Pink1、Parkin表达的影响免疫组化结果显示,与正常对照组相比,D-gal模型组海马CA1、CA3、DG区Pink1、Parkin的阳性细胞明显减少,着色较淡;与D-gal模型组相比,TST中、高剂量组Pink1、Parkin在海马CA1、CA3、DG区的阳性细胞明显增加,着色加深;低剂量组Pink1在CA1、CA3区阳性细胞明显增加,DG区无明显差别,低剂量组Parkin在CA1区阳性细胞增加,CA3区无明显差别、DG区减少(Fig 4A);Western blot结果显示,与正常对照组相比,D-gal模型组海马Pink1、Parkin蛋白表达降低(P<0.05),与D-gal模型组相比,TST各剂量组海马Pink1、Parkin蛋白表达增加(P<0.05)(Fig 4B)。
2.4 TST对衰老大鼠海马组织LC3-Ⅱ、Beclin1、p62表达的影响与正常对照组相比,D-gal模型组海马LC3-Ⅱ、Beclin1蛋白表达明显下降(P<0.05),分别是正常组的0.49倍、0.77倍。p62的表达明显上升,是正常对照组的1.98倍(P<0.05),提示大脑海马组织自噬活性降低,且海马组织损伤严重;与D-gal模型组相比,TST低、中、高剂量组海马LC3-Ⅱ蛋白表达量明显上升(P<0.05),分别是D-gal模型组的1.74倍、2.09倍、2.58倍。Beclin1蛋白的表达量明显上升(P<0.05),分别是D-gal模型组的1.77倍、1.62倍、1.69倍。p62蛋白的表达量明显下降(P<0.05),分别是D-gal模型组的1.17倍、0.59倍、0.63倍,说明TST可以激活自噬,减轻海马组织损伤(Fig 5)。
3 讨论
在脑衰老进程中主要有反应迟缓、感觉迟钝、记忆力下降等症状,其中学习记忆障碍为衡量脑衰老模型的重要指标[9]。研究表明[10]过量注射D-gal可诱导大量氧自由基的产生与累积,降低抗氧化酶活性,加速脂质过氧化物反应,损伤组织细胞,引起动物衰老。本研究通过Morris水迷宫实验发现,大鼠注射D-gal后逃避潜伏期时间增加,穿越平台次数及目标象限停留时间减少,均说明大鼠出现明显的学习记忆障碍,而不同剂量TST干预可改善D-gal所致的模型大鼠学习记忆功能,表明TST具有改善衰老大鼠学习记忆障碍的作用。
研究显示[10],神经元衰老后,细胞内可见大量损伤的蛋白质和细胞器,而线粒体自噬是清除这类物质的主要途径之一。Wu等[11]研究发现,Pink1/Parkin介导的线粒体自噬激活时,脑神经细胞的凋亡受到抑制,延缓脑部的衰老。Du等[12]研究发现,抑制Pink1/Parkin的蛋白表达,导致线粒体自噬水平下降,从而加重了AD大鼠认知功能障碍。本研究发现过量注射D-gal可引起衰老模型大鼠神经元受损和Pink1、Parkin的表达降低,通过TST干预后上调了海马组织内Pink1和Parkin的表达,从而提高了对衰老大鼠海马中受损线粒体的清除水平,因而表明TST改善衰老大鼠学习记忆障碍可能与上调Pink1/Parkin介导的线粒体自噬有关。

Fig 3 Morphology of hippocampus and cortex in each group by hematoxylin-eosin staining and Nissl staining HE staining(Ai 40×,Aii 400×);Nissl staining(Ai 40×,Aii 400×).
Fig 4 Expression of Pink1,Parkin in hippocampus of each A.Immunohistochemistry staining;B.Relative expression of Pink 1 and Parkin.#P<0.05 vs normal control,*P<0.05 vs D-gal model.
LC3、p62、Beclin1对于调控自噬起着至关重要的作用。当自噬发生时,LC3会被酯化成LC3-Ⅱ,此时位于损伤线粒体外膜上的Pink1蛋白维持其激酶活性,同时招募Parkin蛋白并使其磷酸化,从而将受损的线粒体分离出来;活化后的Parkin蛋白继而招募泛素结合因子p62,并与LC3-Ⅱ结合形成自噬小体并包裹受损的线粒体片段,随后与溶酶体结合形成自噬溶酶体从而将线粒体片段降解[13-14]。LC3-Ⅱ可评估自噬体的稳定状态;p62可作为溶酶体降解活性的标志;Beclin1与自噬的活性呈正相关,也是自噬过程中最重要的调节因子。在本实验的研究中,对比正常组,D-gal模型组海马组织中p62蛋白的表达量有所上调,Beclin1、LC3-Ⅱ蛋白的表达量下调;对比D-gal模型组,在各剂量TST干预后,大鼠海马组织中p62的表达量下调,Beclin1、LC3-Ⅱ的表达量有所上调,说明TST能够在一定程度上激活线粒体自噬,以延缓衰老。
综上所述,TST干预能够改善D-gal诱导的衰老大鼠认知功能障碍,并上调海马组织中Pink1和Parkin的表达,激活线粒体自噬,减轻神经元损伤,从而发挥抗衰老作用。
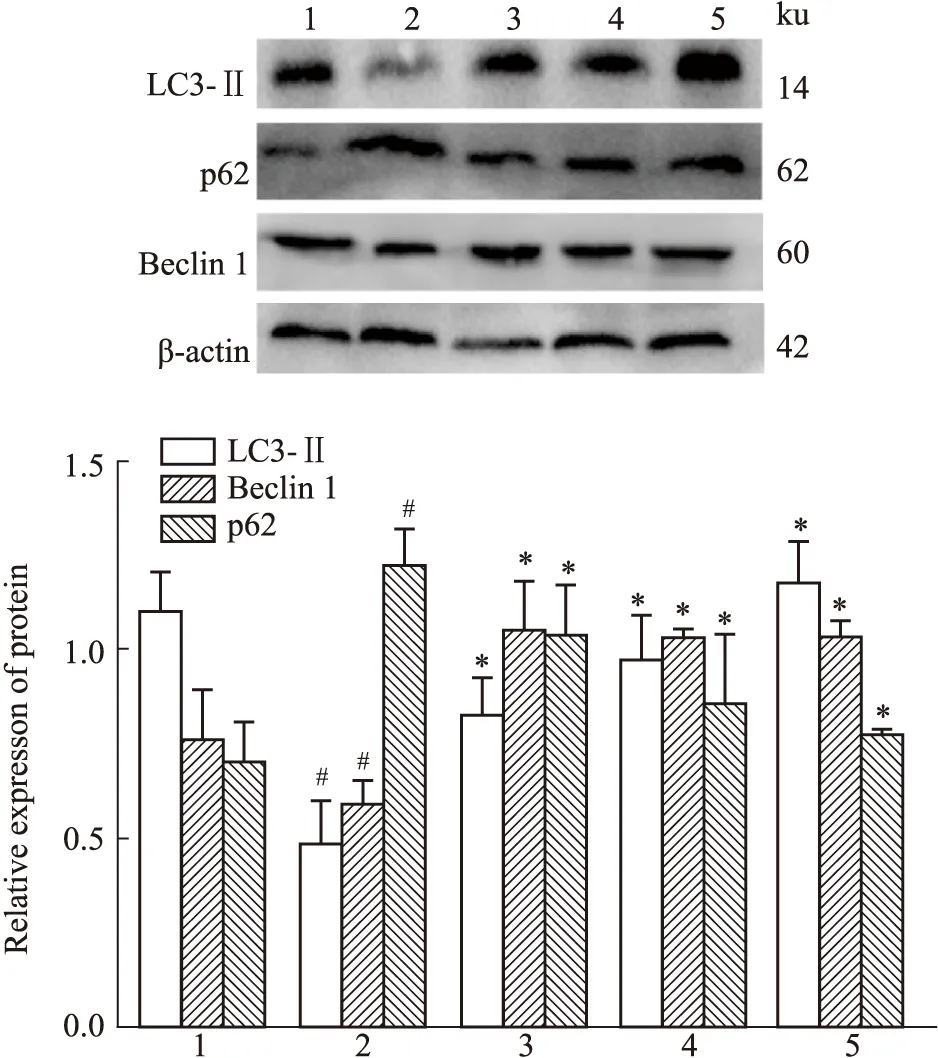
Fig 5 Expressions of LC3-Ⅱ,p62 and Beclin1 in hippocampus of each
