含蜂毒肽的前列腺癌外泌体制备及体外评价
2023-02-06吕立国吴巧玲白遵光陈志强付江波古炽明陈艳芬
吕立国,吴巧玲,黄 娟,白遵光,陈志强,付江波,古炽明,陈艳芬
(广东省中医院 1.泌尿外科、2.肿瘤科,广东 广州 510120;3.广东药科大学中药学院,广东 广州 510006)
前列腺癌是全世界发病率排名第二的男性恶性肿瘤,在美国发病率占男性恶性肿瘤的第一位。既往临床研究显示,以蜂毒为主要作用成分的蜂针疗法在控制前列腺癌进展方面有一定临床疗效[1]。蜂毒肽是蜂毒的主要成分,实验研究[2]显示蜂毒肽对前列腺癌细胞具有增殖抑制和凋亡诱导作用,可抑制膀胱癌细胞的增殖、迁移和侵袭[3]。但由于蜂毒肽对肿瘤细胞的增殖抑制和凋亡诱导没有靶向性,临床应用有溶血性等不良反应,明显限制了其临床应用。外泌体是目前肿瘤微环境研究的热点,具有免疫原性低、递送效率高、可跨过多种生物屏障和靶向性等特点[4],可以作为药物的载体,通过内吞形式摄入靶细胞内,直接作用于肿瘤细胞。研究显示,将药物融合入前列腺癌细胞来源的外泌体[5],并将其靶向作用于前列腺癌细胞,外泌体介导的药物体现出更强的细胞毒性,说明外泌体可以成为前列腺癌靶向治疗药物的运载体。本研究拟在既往研究基础上,探索构建含蜂毒肽的前列腺癌细胞外泌体的方法,并体外评价前列腺癌细胞对其吞噬摄纳作用,为蜂毒肽在肿瘤疾病的应用提供借鉴。
1 材料与方法
1.1 材料与试剂
1.1.1细胞株和培养 细胞株:人前列腺癌PC-3细胞株、DU145细胞株、LNCaP细胞株由广东省中医药科学院惠赠。PC-3细胞、DU145细胞、LNCaP细胞用含5%FBS的DMEM,37 ℃,5% CO2,饱和湿度恒温培养箱培养,0.25%胰酶消化传代。
1.1.2主要仪器 恒温CO2培养箱(赛默飞世尔科技,156081-504);倒置显微镜(Olympbus,CKX41);荧光倒置显微镜(Olympus,CKX53);电子透射显微镜(日本电子株式会社,JEM-1400/JEM-1400 PLUS);高速离心机(德国Sigma公司,3-30K);全自动酶标仪(BioTek Instruments,ELX800);恒温水浴锅(上海新苗医疗器械制造有限公司,S21-6新高);超低温冷冻储存箱(中科美菱低温科技有限公司,DW-hL218);分析天平(ShIMADZU,AUY120);CCD(美国gatan,830);纳米颗粒跟踪分析仪(NTA)(英国/Malvern,Nanosight NS300);Wes全自动蛋白质印迹定量分析系统(美国ProteinSimple,S/N:WS-2494);高效液相色谱仪(ShIMADZU,RESERVOR TRAY);高效液相色谱柱(GL Science Inc,1A7150534);电转仪(美国Bio-Rad,MicroPulser);电击杯(美国Bio-Rad,Gene Pulser®/MicroPulserTM);马尔文激光粒度仪(Malvern Instruments,Zetasize NanoZS90)。
1.1.3主要试剂 蜂毒肽(上海阿拉丁,1902001),分子式为:C131H229N39O31;氨基酸序列为:Gly-Ile-Gly-Ala-Val-Leu-Lys-Val-Leu-Thr-Thr-Gly-Leu-Pro-Ala-Leu-Ile-Ser-Trp-Ile-Lys-Arg-Lys-Arg-Gln-Gln-NH2);DMEM培养基(美国hyclon,8119078);青霉素-链霉素双抗(美国Solarbio,20170413);胎牛血清(Gibco,42Q1782K);0.25%Tripisin-EDTA(1×)胰酶(Invitrogen,2048080);DMSO(广州瑞舒,批号:67-68-5);MTT(广州瑞舒,20171012);BCA 蛋白浓度测定试剂盒(碧云天生物技术,062118180930);RIPA 裂解液(Thermo Scientific,USA,89901);蛋白酶抑制剂混合物(beyotime P1006);色谱甲醇(天津市科密欧,20181010);色谱乙醇(天津市科密欧,20180725);色谱乙腈(上海阿拉丁,K1623001);三氟乙酸(上海阿拉丁,J1626023);PKh67试剂盒(上海贝博,BB-441112);DAPI溶液(北京博奥森,AI10087467);牛血清白蛋白(BSA,大连美仑生物,F0109A)。
1.2 实验方法
1.2.1筛选不同时间饥饿处理的细胞 分别设置0、12、24、36、48 h为观察点对饥饿处理后的PC-3细胞形态以及生长状况进行观察并拍照。
1.2.2超速离心法提取PC-3细胞外泌体 PC-3细胞常规培养,待细胞状态较好且细胞密度达80%左右时,将其用无胎牛血清的基础培养基饥饿培养24 h后收集细胞上清液,将上清液于-80 ℃储存,择期采用超速离心法提取PC-3细胞外泌体。
1.2.3外泌体的鉴定
1.2.3.1 外泌体的形态学鉴定 将外泌体提取液滴在封口膜洁净面,将铜网膜面放在外泌体液滴上,悬浮吸附10 min,用滤纸缓慢吸干。转移铜网至1%醋酸双氧铀染液液滴上染色10 min,滤纸吸干;转移铜网到双蒸水液滴上,3次,每次2 min,滤纸吸干;自然晾干,透射电子显微镜观察并采集图像。
1.2.3.2 Nanosight(NTA)检测外泌体粒径 采用动态光散射方法检测,对外泌体粒径分布进行研究,将收集的外泌体稀释成颗粒浓度为1010L-1的密度,0.22 μm微孔滤膜过滤后,将其注入Nanosight纳米颗粒跟踪分析仪进行分析。
1.2.3.3 Western blot检测外泌体特异标志蛋白 外泌体的BCA蛋白定量用酶标仪测其在562 nm波长处的吸光度值,根据标准曲线计算蛋白浓度。Western blot检测外泌体标志物蛋白Alix、CD63的含量。
1.2.4蜂毒肽外泌体体系的制备 精密称取5.00 mg蜂毒肽,用PBS缓冲液配成浓度为1 g·L-1的溶液。将外泌体溶液与蜂毒肽溶液以1 ∶4的比例混合均匀,分别采用以下3种方法制备:室温孵育法:蜂毒肽外泌体溶液涡旋10 min后,将其放入37 ℃恒温培养箱中孵育12 h。标记为“F”。反复冻融法:蜂毒肽外泌体溶液涡旋5 min后,将其置于37 ℃中孵育30 min,然后在-80 ℃快速冷冻,并在温室下解冻。重复3次。标记为“D”。电穿孔法:将蜂毒肽外泌体加入电击杯中,打开电转仪,将其以“0.55 kV,0.6 ms”的条件电击5次,每次间隔1 min,将其置于冰上。电击结束后将液体转移至EP管中,37 ℃孵育30 min,转置于4 ℃中。标记为“K”。
1.2.5超速离心法测其包封率 分别取一定量的“F、D、K”于超速离心管中,以100 000×g,4 ℃的条件离心70 min。离心后分别取上清液于EP管内,将沉淀收集于另一EP管中待用。分别取一定量的“F、D、K”,与等量的甲醇混合,将其超声30 min进行破乳,0.22 μm的微孔滤膜过滤。分别取等量的“F、D、K”离心过的上清,加等量的甲醇超声破乳30 min后,用0.22 μm微孔滤膜过滤后,用高效液相按照“1.2.7.3”的色谱条件进样分析,利用峰面积计算出包封率,计算公式如下:

注:W总为总体系的峰面积,W游为游离上清的峰面积。
1.2.6蜂毒肽外泌体的粒径检测 电穿孔制备蜂毒肽外泌体。取30 μL外泌体和蜂毒肽外泌体溶液,将其稀释40倍,轻轻涡旋后用0.22 μm的微孔滤膜进行过滤,用马尔文激光粒度仪测其粒径大小。
1.2.7蜂毒肽外泌体含量测定方法的建立
1.2.7.1 对照品溶液的制备 精密称取蜂毒肽对照品5.0 mg,用色谱甲醇超声溶解,定容成浓度为1 g·L-1的标准溶液,过0.22 μm的微孔滤膜,取滤液待测。
1.2.7.2 供试品溶液的制备 超速离心法提取外泌体,PBS缓冲液进行重悬。取空白外泌体0.2 mL,取等量色谱甲醇,超声破乳30 min,0.22 μm微孔滤膜过滤,取滤液即得空白外泌体供试品。电穿孔制备蜂毒肽外泌体,取蜂毒肽外泌体0.2 mL,取等量的色谱甲醇,超声破乳30 min,0.22 μm微孔滤膜过滤,取滤液即得蜂毒肽外泌体供试品。
1.2.7.3 色谱条件色谱柱 C18柱;流动相:乙腈、水(0.1%三氟乙酸);检测波长:220 nm;流速:1 mL· min-1;柱温:25 ℃;进样量:5 μL。程序:A:乙腈 B:水(0.1%三氟乙酸)。0 min:A:39%,B:61%;20 min:A:64% B:36%;25 min:A:100%,B:0%;25.01 min:stop.
1.2.7.4 专属性试验 取上述的空白外泌体,蜂毒肽外泌体供试品溶液,以及蜂毒肽对照品溶液,以“1.2.7.3”的色谱条件进样分析。
1.2.7.5 线性关系的考察 精密量取1 g·L-1的蜂毒肽,用甲醇定容配得蜂毒肽浓度梯度为0.1、0.2、0.3、0.4、0.5、0.6 g·L-1的对照品溶液。以上述色谱条件进行分析,记录峰面积,以峰面积为纵坐标,浓度为横坐标,绘制相关的标准曲线。
1.2.7.6 精密度试验 精密称取蜂毒肽对照品,用甲醇定容成0.3 g·L-1的溶液,以上述色谱条件进样分析,连续进样6次,记录每次进样峰面积,计算峰面积的RSD值。
1.2.7.7 重复性试验 取蜂毒肽外泌体,按照上述步骤平行制备供试品溶液5份,按照以上的色谱条件进样分析,记录峰面积,按照以上的线性曲线得到对应的蜂毒肽浓度,计算蜂毒肽浓度的RSD值。
1.2.7.8 稳定性试验 取蜂毒肽外泌体溶液按照上述步骤制备供试品溶液,分别于0、2、4、8、12、24 h进样分析,记录峰面积。
1.2.7.9 回收率试验 精密取50 μL空白外泌体9份,分成3组,每组3份,分别加1 g·L-1的蜂毒肽40、60、100 μL,用甲醇定容至200 μL,超声30 min,每组蜂毒肽外泌体混悬液所含有的蜂毒肽浓度为0.2、0.3、0.5 g·L-1,过0.22 μm滤膜后取滤液进样分析。
1.2.8前列腺癌细胞对蜂毒肽外泌体的摄取 PC-3细胞、DU145细胞以及LNCaP细胞种96孔板24 h。EXO-MEL用PKh67试剂盒染色后将其避光与培养基均匀混合,避光加入96孔板中,每孔200 μL,置于5% CO2,37 ℃培养箱中避光孵育。于6、12、24 h以及48 h时取出96孔板,将上清吸弃,加入100 μL的4%多聚甲醛溶液固定细胞,37 ℃中孵育10 min。取出,吸弃多聚甲醛溶液。在避光条件下,加入50 μL的10 mg·L-1DAPI染色液,37 ℃中孵育5 min。取出吸弃染色液,PBS洗涤。最后加入100 μL的PBS缓冲液在荧光倒置显微镜下进行观察,拍照并记录不同时间点各细胞摄取EXO-MEL的状况。图像应用ImageJ图像分析软件分析,得出平均光密度值。

2 结果
2.1 筛选不同时间饥饿处理的细胞用于提取外泌体由Fig 1可以得出,PC-3细胞在饥饿处理前,细胞状态较好,细胞壁清晰且贴壁较牢。当细胞饥饿12、24 h时,细胞状态仍然较好,死亡细胞稍许有增加,但基本控制在5%左右。当饥饿处理36、48 h时,可见死亡细胞有明显增多,且在48 h时,细胞状态明显变差,部分细胞的细胞壁模糊。故以饥饿处理24 h为最佳时间点。
2.2 外泌体的鉴定由Fig 2~4的结果可知,外泌体外形呈圆形或椭圆形,具有明显的膜性结构,大小不一,直径在100 nm左右。可单个分布,也可聚集成团。NTA结果是所提的外泌体用PBS缓冲液稀释了40倍上机所检测颗粒的浓度(1010L-1),图片显示单峰且曲线流畅,无多余杂峰,粒径峰值为134 nm。总体来说粒径为0~200 nm的占比>80%,平均粒径为(163.3±51) nm。有些许粒径较大的颗粒可能与颗粒之间的黏附有关。稀释4倍外泌体测得的OD值为0.126,根据蛋白标准品与OD值的线性方程(Y=1.059X-0.127,R2=0.999 6),计算可得外泌体的蛋白浓度为0.222 g·L-1。Western blot检测外泌体的标志蛋白结果显示Alix、CD63为阳性表达。从形态、粒径以及标志蛋白3种实验得出的结果与理论上外泌体的参数基本相符合,说明利用饥饿培养所得到的PC-3细胞上清液,再通过超速离心法提取可得到实验所需的外泌体。

Tab 1 Interval ratios of particle size for NTA detection
2.3 超速离心法测其包封率由Tab 2可知,电穿孔法的包封率>反复冻融法>室温孵育法,且电穿孔法与反复冻融法、室温孵育法相比较,P<0.05,有明显差异。故选择电穿孔法作为制备蜂毒肽外泌体的方式。

Fig 1 Morphological observation of PC-3 cells treated with starvation for different time points (×100)

Fig 2 Analysis of NTA detection in exosomes
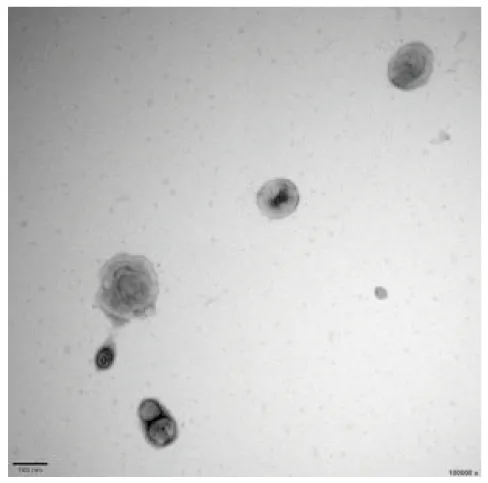
Fig 3 Morphology of exosomes by TEM(×100 000)

Fig 4 Expression of exosome marker proteins determined by WB

Tab 2 Encapsulation efficiency of melittin exosomes prepared by different methods
2.4 蜂毒肽外泌体的粒径检测结果如Fig 5所示,外泌体与蜂毒肽外泌体的峰形均为单峰,无驼峰出现,曲线流畅,说明其粒径较为均匀。外泌体组数据结果显示峰值为161.9 nm,均值为147.7±53.68 nm。蜂毒肽外泌体组显示峰值为246.7 nm,均值为241.9±58.54 nm。可见载入蜂毒肽的外泌体溶液的粒径比未载药的外泌体粒径大。
2.5 蜂毒肽外泌体含量测定方法的建立
2.5.1专属性试验 结果表明,在实验所设定的液相条件下,空白外泌体与蜂毒肽对照品的特征峰无干扰,其分离效果较好,专属性较好,符合测定的相关标准。
2.5.2线性关系的考察 由Tab 3所示,以蜂毒肽的液相峰面积为纵坐标,以浓度为横坐标进行线性回归,得回归方程为:Y=2E+06X-13 066,R2=0.999 9,表明蜂毒肽在0.1~0.6 g·L-1浓度内与其峰面积呈现良好的线性关系。

Tab 3 Data sheet for melittin standard curve

Fig 5 Particle size distribution of exosomes (top) and melittin exosomes (bottom)
2.5.3精密度试验 以上述色谱条件进样分析,连续进样6次,记录每次进样的峰面积,计算峰面积的RSD值,结果显示RSD值为0.74%,表明其精密度较好,见Tab 4。

Tab 4 Results of precision testing
2.5.4重复性试验 根据峰面积,按照以上的线性标准曲线计算得到对应的蜂毒肽浓度,计算蜂毒肽浓度的RSD值。RSD值为1.08%,表明此方法有较好的重复性,符合分析要求,见Tab 5。

Tab 5 Reproducibility test results
2.5.5稳定性试验 取蜂毒肽外泌体溶液制备供试品溶液,分别于0、2、4、8、12、24 h进样分析,记录峰面积。计算得蜂毒肽峰面积的RSD值为0.46%,表明其在24 h内稳定性较好,见Tab 6。

Tab 6 Stability test results
2.5.6回收率试验 进样分析后得相对应的峰面积,依据线性曲线的回归方程计算得到相对应的浓度,计算其回收率。结果见其回收率在95%~105%,且每组的RSD<5%,说明其回收率较好,见Tab 7,Fig 6~8。

Tab 7 Results of recovery test

Fig 6 HPLC chromatogram of blank exosome solution
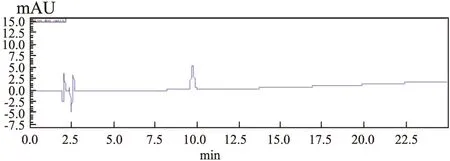
Fig 7 HPLC chromatograms of melittin control solution
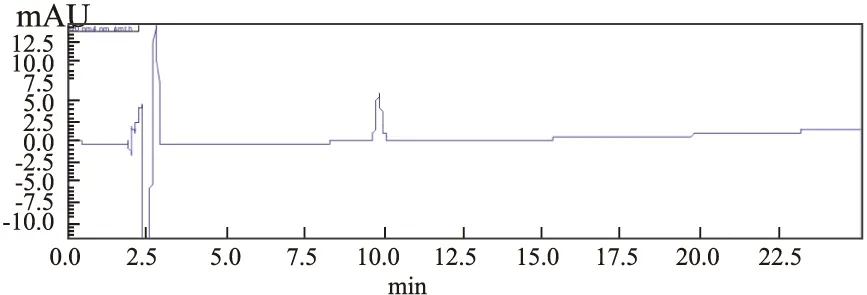
Fig 8 HPLC chromatogram of melittin exosome solution
2.6 前列腺癌细胞对蜂毒肽外泌体的摄取结果如Fig 9,10所示,绿色荧光为PKh67染色后的外泌体,蓝色荧光为DAPI染色的细胞核。对于PC-3细胞,在6 h时EXO-MEL较少且大多在细胞之外,可能是因为时间太短,细胞还未开始摄取EXO-MEL。在12 h时,结合荧光以及明场图片,发现有部分EXO-MEL进入细胞质中。24 h以及48 h时,在PC-3细胞的核膜周围明显分布有绿色荧光,说明细胞摄取增多。综合看来,PC-3细胞可以有效摄取EXO-MEL,且其摄取程度有一定的时间依赖性。同理从Fig 11,12可以看出,随着时间的推移,DU145以及LNCaP两种前列腺癌细胞也能摄取EXO-MEL。ImageJ图像分析软件对摄取图进行定量分析荧光值,随着时间的推移,3种细胞的摄取逐渐增多,平均光密度值逐渐增大。
3 讨论
前列腺癌在国内是泌尿系统发病率最高的恶性肿瘤,且发病率呈现逐年升高的趋势,严重威胁着我国中老年男性的健康[6]。前列腺癌确诊时多数为晚期,内分泌治疗初始有效,但经过中位时间18~24个月,几乎所有患者都进展为去势抵抗性前列腺癌,生活质量下降,生存期短[7]。如何延缓前列腺癌的进展,延长前列腺癌患者的生存期,是临床治疗的难点及医学研究的热点。以蜂毒肽等为主要作用成分的蜂针疗法在控制前列腺癌进展方面有一定的临床疗效[1],提示蜂毒肽可能具有独特的抗肿瘤优势,但由于某些缺点阻碍了其在抗肿瘤方面的广泛应用[8]。外泌体是各种活细胞产生的天然细胞外囊泡,在前列腺癌患者的血液、尿液以及前列腺液中均可以分离得到[9-10],前列腺癌来源的外泌体中的蛋白和核酸等物质为前列腺肿瘤早期诊断及预后判断提供了重要依据[5]。此外,外泌体与前列腺癌的化疗耐药、免疫抑制、增殖、凋亡和血管形成有关,表明前列腺源性外泌体可能是潜在的前列腺癌治疗靶点[11],利用外泌体作为药物或抗原载体进行靶向给药及免疫治疗具有一定的研究意义。因此,本研究从外泌体的结构特性和载药优势出发,探讨合适的方法制备蜂毒肽外泌体体系,为外泌体的载药研究和蜂毒肽的研发利用提供实验依据。

Fig 9 Fluorescence of EXO-MEL uptake by PC-3 cells at various time points
提取细胞外泌体,生长状况是影响其质量的关键因素。
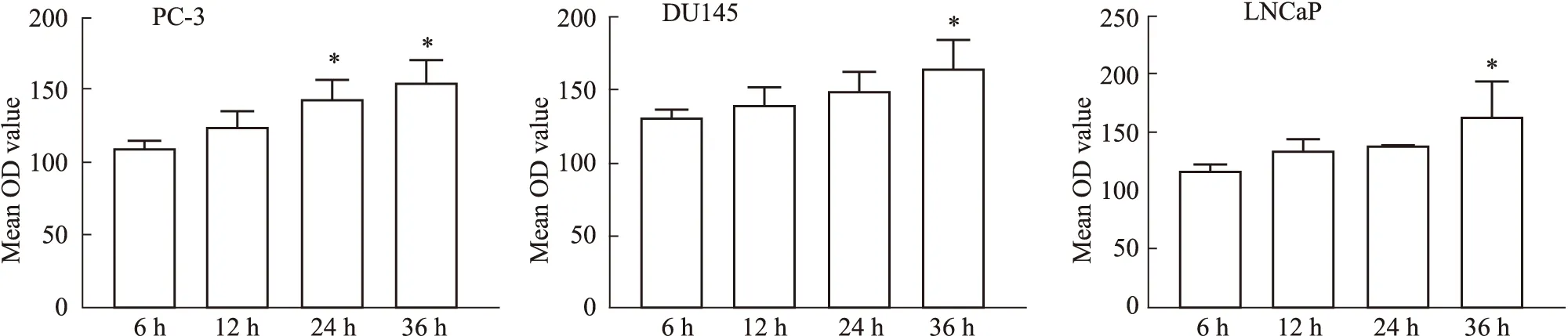
Fig 10 Mean optical density values of EXO-MEL uptake by cells at various time points*P<0.05 vs 6 h group

Fig 11 Fluorescence of EXO-MEL uptake by D-U145 cells at various time points(×100)A,B,C and D represent EXO-MEL incubation time of 6,12,24 and 48 h respectively

Fig 12 Fluorescence of EXO-MEL uptake by LNCaP cells at various time points(×100)A,B,C and D represent EXO-MEL incubation time of 6,12,24 and 48 h respectively
一些细胞如肿瘤细胞具有较强的嗜血性,其生长条件中需要加入血清成分,但大部分的血清中通常会含有一定量的外泌体,这会直接影响到外泌体的纯度。在这种情况下通常有3种方法:使用无外泌体的胎牛血清;利用超速离心法将普通的胎牛血清连续过夜超速离心去除其中的外泌体[12];或使用饥饿处理的方法提取外泌体。无外泌体的胎牛血清价格昂贵且产品质量参差不齐,可能直接影响细胞的贴壁能力以及细胞分泌外泌体的质量;而连续过夜超速离心胎牛血清可能会损失血清中的营养成分从而使得血清质量下降。细胞饥饿处理的前提是细胞生长状况良好且密度合适,饥饿处的时间一般不超过48 h,细胞死亡率控制在10%以内。本研究通过设计不同的时间点观察饥饿处理的细胞状态,筛选合适的收集细胞上清液的时间,实验结果表明饥饿处理24 h的细胞状态最佳。目前大多数文献均采用传统的超速离心法提取外泌体,或在传统方法上进行改良提取[13]。但已知的提取手段均很难获得纯度高的外泌体样品,且没有任何一个单一的实验可以确定外泌体的存在。因此,从形态、粒径和标志物蛋白三个方面对提取的外泌体进行鉴定:透射电镜观察提取的外泌体外形呈圆形或椭圆形,具有明显标志性的膜性结构;Western blot检测外泌体的标志物蛋白Alix、CD63显示阳性;NTA对所提颗粒进行粒径分析显示呈单峰且曲线流畅,颗粒较为集中,无多余杂峰,粒径峰值为134 nm,且总体粒径为0~200 nm的占比大于80%。上述结果说明,利用饥饿培养24 h的PC-3细胞结合超速离心法可成功制备外泌体。
研究报道外泌体的载药方式多种多样,如电穿孔、辅助超声、共孵育以及化学转染等[14]。在嵌段共聚物纳米粒的质量评价方面,包封率的测定方法是一个十分重要的评价因素。常用的包封率测定方法包括离心法、微型柱离心法、透析法和葡聚糖凝胶柱层析法等[15]。本研究结合蜂毒肽的分子量大小和性质,分别利用反复冻融法、室温孵育法以及电穿孔法进行外泌体载药,并选择超速离心法测其不同载药方式的包封率大小,从而筛选出最优载药方式。实验结果表明,使用电穿孔方法测得的包封率为17.51%,显著大于反复冻融法和室温孵育法测得的包封率。故最终选择电穿孔法作为外泌体的载药方式进行后续实验,粒径测量结果表明,蜂毒肽外泌体为单峰,峰形流畅,说明其分散度较好,可作为下一步的研究。本研究还建立了蜂毒肽外泌体中蜂毒肽含量测定的高效液相法,并进行了方法学考察,实验数据显示,该方法在0.1~0.6 g·L-1的浓度范围内具有良好的线性关系;此外还进行了专属性实验、精密度实验、重现性实验、稳定性以及回收率实验。
外泌体是由活细胞分泌小囊泡,具有典型的脂质双分子层结构[16]。对分离的外泌体进行体外标记或活体示踪,有助于对外泌体的功能进行进一步的研究[17]。目前,对于外泌体的标记方法有很多种,包括亲脂性的染料和膜渗透型的化合物等。PKh67是常用的外泌体体标记物,可以稳定地与细胞膜脂质区结合并发出荧光,且对细胞毒性较小,脂溶性高,通过与膜结构的脂质分子结合而标记细胞,有着强而稳定的绿色荧光,特别适用于细胞体外标记、体外细胞增殖研究以及体内外的细胞失踪研究[18],DAPI则是一种常用的DNA特异性染料。本实验通过不同时间点观察了PC-3细胞摄取蜂毒肽外泌体的情况,结果表明PC-3细胞可以有效摄取EXO-MEL,且摄取程度有一定的时间依赖性。这一结果说明PC-3细胞可成为自身来源外泌体的靶细胞,通过摄取将自身外泌体作为载体的载药体系,进而改变自身基因表型并影响生物学功能。此外,本实验还证实蜂毒肽外泌体也能被另外两种人前列腺癌细胞即去势抵抗性DU145细胞和内分泌敏感性LNCaP细胞的摄取,提示蜂毒肽外泌体可能对不同分期的前列腺癌有潜在的治疗作用。
综上所述,本实验成功制备了前列腺癌蜂毒肽外泌体体系,并通过荧光显微镜观察蜂毒肽外泌体可以被前列腺癌细胞摄取,进一步还可对该蜂毒肽外泌体体系对前列腺癌细胞的作用机制进行深入探究,为前列腺癌的临床治疗提供新的研究思路。
