沙利度胺对Aβ1-42致AD模型小鼠的海马蛋白质组学影响
2023-02-06吴宿慧张宇航牛婷媛李寒冰高剑峰李根林
吴宿慧,张 晗,张宇航,牛婷媛,李寒冰,高剑峰,李根林
(河南中医药大学,河南省仲景方药健康衰老产业工程研究中心,河南 郑州 450046)
阿尔茨海默病(Alzheimer’s disease,AD)是一类存在于人类中枢神经系统的不可逆的退行性疾病。主要症状为学习及记忆功能障碍,其典型病理变化是脑组织中β-淀粉样蛋白(β-amyloid,Aβ)大量沉积所产生的老年斑的损伤,细胞体β-淀粉样蛋白在脑内的过量沉积则会引起线粒体功能障碍、突触功能障碍、炎症反应等病理过程,加速氧化应激和神经炎症级联反应,诱导能量代谢衰竭和神经元凋亡。最终导致中枢神经系统功能异常[1]。沙利度胺是一种新型的免疫调节药物和抗炎药,引起中枢抑制的药物可减轻中枢神经系统炎症,促进脑血供,预防脑梗死的发生,促进神经系统功能的恢复。目前,临床资料表明,沙利度胺可抑制单个核细胞和巨噬细胞分泌肿瘤坏死因子-α,从而减少淀粉样蛋白的形成,下调β-淀粉样蛋白转化酶1(BACE1)的表达,具有较强的抗炎作用,这可能通过减少AD的中枢神经系统炎症和淀粉样蛋白的形成发挥作用。此外,沙利度胺对AD患者的中枢神经系统毒性较小,但安全性和耐受性仍未得到广泛认可[2-3]。目前,沙利度胺作为一种潜在的治疗脑损伤及相关疾病的药物,是治疗AD疾病的药物研究热点,但缺乏预防治疗和机制探索,其效果值得进一步研究。蛋白质组学是一种蛋白质鉴定和蛋白质特性研究的先进技术。近年来,蛋白质组学为AD的防治和药物研发提供了重要思路[4]。本研究使用Aβ1-42诱导的AD小鼠模型,应用Morris水迷宫实验评价沙利度胺的认知改善作用,同时观察海马蛋白质组的表达差异,从蛋白分子水平探究沙利度胺干预AD的可能机制。
1 材料
1.1 动物雄性ICR小鼠40只,SPF级,体质量(30~35) g,由斯贝福(北京)生物技术有限公司提供,动物许可证号SCXK(京)2019-0010。根据动物伦理委员会要求,该动物在河南中医药大学SPF级动物饲养室饲养,自由摄食、饮水,环境温度控制在(22±2) ℃,光周期为12 h明/暗,适应性饲养3 d。
1.2 药物和试剂Aβ1-42(美国Abcam公司,批号:APN18050-1-1);沙利度胺(常州制药厂有限公司,批号:19031332);BCA试剂盒(批号:20191022);线粒体呼吸链复合体Ⅰ、Ⅱ、IV、V试剂盒(北京索莱宝科技有限公司,批号:BC0515、BC3235、BC0945、BC1445);十二烷基硫酸钠(SDS,美国Bio-Rad,批号:161-0302);尿素(美国Bio-Rad,批号:161-0731);Tris(美国Sigma,批号:A6141);二硫苏糖醇(DTT,美国Bio-Rad,批号:161-0404);碘乙酰胺(IAA,美国Bio-Rad,批号:163-2109);甲酸(FA,德国Fluke,批号:06450);三氟乙酸(TFA,美国Sigma,批号:T6508);乙腈(ACN,德国Merck,批号:I592230123)。
1.3 主要仪器小鼠脑立体定位仪(实科生物技术有限公司);空气恒温摇床(武汉中科科仪技术发展有限责任公司);快速样品匀浆系统(上海净信实业发展有限公司);高速冷冻离心机和全波长酶标仪(Thermo Fisher Scientific);紫外可见光分光光度计(上海仪电分析仪器有限公司制造);AKTA Purifier100纯化仪和电泳仪(美国GE Healthcare);Easy nick色谱系统、Q Ex active质谱仪、SCX色谱柱、上样柱、分析柱(美国Thermo Scientific)。
2 方法
2.1 动物分组、模型建立及给药将Aβ1-42溶于0.9%生理盐水中,稀释至1 g·L-1,密封后,在37 ℃恒温摇床中孵育7 d,老化至有毒聚集状态,保存在4 ℃冰箱中。采用Morris水迷宫筛选不敏感的小鼠(90 s内未找到平台),随机分为空白组、模型组、沙利度胺高剂量组(35 mg·kg-1)和沙利度胺低剂量组(18 mg·kg-1)。适应性饲养3 d后,各组小鼠分别称质量,根据体质量,用l0%水合氯醛(3 mg·10 g-1)腹腔麻醉小鼠,俯卧位将小鼠头部固定在脑立体定位仪上,暴露前囟门,前、后囟门处于一水平面上,根据《小鼠脑立体定位图谱》,选择注射区域为小鼠双侧海马CA1区,剪开头皮,暴露前囟门,沿头颅中线切开长约2 cm切口,确定方位后,以卤门为零点,后0.5 mm,侧开1.0 mm距离,移动微量进样器,深度为3.00 mm,每侧注入3 μL聚集合的Aβ1-42,3 min内缓慢注入,保持进针5 min,用牙托粉封闭创伤口,缝合头皮,单笼饲养,注意保暖,建立AD小鼠模型[5]。造模后恢复7 d,每天早上9时按照体质量灌胃给药,每天1次,持续21 d,空白组和模型组灌胃等体积的生理盐水。
2.2 Morris水迷宫实验测定小鼠空间与学习记忆能力用Morris水迷宫试验对小鼠的学习记忆和空间识别能力进行了评估。水迷宫直径为1.2 m,水深25 cm,水温控制在(21±1) ℃,以黑白图案作为参照物悬挂于水池周围,整个实验在避光、安静环境下进行。定位航行实验:检测小鼠空间学习记忆的获取能力。实验开始后,将直径为8 cm的平台放置于第Ⅰ象限水下2 cm,小鼠分别从第Ⅱ、Ⅲ、Ⅳ象限同一位置入水,潜伏期:记录小鼠90 s内找到水下平台并站立于其上的时间;动物行为分析软件追踪小鼠的运动轨迹,每只小鼠持续4 d训练,每日4次。空间探索实验:检测小鼠的空间记忆保持能力。d 5进行空间探索实验时移除平台,内壁参照物不变,将小鼠从同一个位置面向池壁放入水中,记录小鼠在原平台象限停留时间和90 s内跨越平台的次数。
2.3 ELISA法检测沙利度胺对小鼠海马线粒体呼吸链复合物Ⅰ、Ⅱ、Ⅳ、Ⅴ的活性表达Morris水迷宫实验结束后,各组小鼠以3 mg·10 g-1剂量的l0%水合氯醛进行腹腔麻醉,冰上剥离海马组织并称质量。ELISA法测定小鼠海马线粒体呼吸链复合体Ⅰ、Ⅱ、Ⅳ、Ⅴ的活性。
2.4 HE染色观察小鼠海马CA1、CA2、CA3、DG区病理学改变行为学实验结束后,各组小鼠断头并处死,脑组织被迅速移除并用4%多聚甲醛固定,取脑组织石蜡切片至水、石蜡包埋、切片3 μm厚、苏木精-伊红染色,400倍显微镜下观察。
2.5 尼氏染色观察小鼠海马CA3区病理学改变常规脱蜡至水,后将切片放入10 g·L-1甲苯胺蓝溶液中染色6 min,用蒸馏水浸泡约5 min后消除浮色,1%的冰醋酸分化,终止反应,控制分化程度,水洗,烤干切片,再用二甲苯透明,中性树胶封片,在400倍镜下比对海马组织形态、神经元损伤程度和尼氏小体丰富程度改变。
2.6 小鼠海马组织蛋白组学分析
2.6.1LC-MS/MS分析 分别收集空白组、模型组和沙利度胺给药组各3只小鼠海马组织,样本数量为9例。每个样品的200 μg蛋白质被整合到30 μL SDT缓冲液(4% SDS,100 mmol·L-1DTT,100 mmol·L-1Tris-HCl pH 7.6),沸水浴5 min,超声2 min,再沸水浴5 min,4 ℃ 20 000×g离心取上清。BCA法蛋白定量后进行蛋白样品酶解,C18Cartridge脱盐,在最大真空度下冷冻并干燥。之后的肽段用40 μL 0.1%甲酸溶液复溶,肽段定量(OD280),将多肽片段含量计算后进行LC-MS分析。将每组适量的样本肽段用纳升流速的HPLC液相系统Easy nLC(Easy nLC色谱系统)进行分离,肽段分离后用Q-Ex active质谱仪进行质谱分析。
2.6.2数据库检索及蛋白鉴定、筛选 采用的质谱数据库检索软件为Maquan(版本号1.5.3.17),使用Uniport date base。并通过FDR<0.01的标准对数据进行伪阳性筛选,最后依据实验目的输出可以得到蛋白质定性或者蛋白定量分析数据表。在label-free quantification中质谱峰面积代表肽的绝对含量,通过对比各个样品相同肽的质谱峰面积,直接获得该肽段所代表蛋白质的相对定量信息。
2.6.3生物信息学分析 通过对不同样本间鉴定到的蛋白质进行比较,采用标准生信分析方式GO注释及富集分析、KEGG通路注释及富集分析、蛋白质相互作用网络分析等,以表达倍数>1.2倍并≤0.83倍值且P值<0.05(T-test或其他)的筛选标准,得到的显著差异表达蛋白质有效的分开。
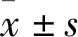
3 结果
3.1 药效学评价
3.1.1沙利度胺对Aβ1-42致AD模型小鼠体质量影响 实验期间,各组小鼠状态良好,各组小鼠体质量均有增加,统计分析结果表明,不同组间小鼠体质量差异均无统计学意义(P>0.05)。沙利度胺对小鼠体质量没有明显影响。

Tab 1 Effect of thalidomide on body weight of each group of mice
3.1.2沙利度胺对Aβ1-42致AD模型小鼠空间学习记忆障碍改善作用 定位航行实验:随着训练时间的延长,各组小鼠逃避潜伏期均缩短。在4 d的实验训练中,与空白组相比,模型组小鼠在d 3、4潜伏期时长明显增加(P<0.01);与模型组相比较,沙利度胺高、低剂量组小鼠在d 3、4潜伏期时长明显减少,差异有统计学意义(P<0.01或P<0.05),d 4沙利度胺高、低剂量组平均逃避潜伏期接近空白组,表明沙利度胺能改善AD小鼠学习记忆能力,见Fig 1。空间探索实验:与空白组相比,模型组穿越平台的次数明显缩短(P<0.05),具有统计学意义,表明造模成功。与模型组相比,沙利度胺高、低剂量组小鼠通过平台次数明显增加,与空白对照组接近(P<0.05),见Fig 2,3。

Fig 1 Influence of thalidomide on escape latency in different periods of AD mice #P<0.05,##P<0.01 vs Control group;**P<0.01 vs Model group
Fig 2 Influence of thalidomide on number of times crossing target platform in AD mice #P<0.05 vs Control group;*P<0.05 vs Model group

Fig 3 The experimental trajectory of thalidomide on water maze space exploration in AD A:Control group;B:Model control;C:High-dose group 35 mg·kg-1;D:Low-dose group 18 mg·kg-1
3.1.3沙利度胺对AD模型小鼠海马线粒体复合物酶活性表达的影响 与空白组相比,模型组海马线粒体呼吸链复合体Ⅰ、Ⅱ、Ⅴ活性明显降低(P<0.05),与模型组相比,沙利度胺高、低剂量组AD模型小鼠海马组织线粒体复合物Ⅰ、Ⅱ、Ⅳ、Ⅴ活性的表达明显增加(P<0.05),见Tab 2。
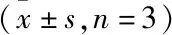
Tab 2 The experimental results of thalidomide on mitochondrial viability in hippocampus of AD model mice
3.1.4各组小鼠海马区HE染色结果 空白对照组小鼠海马CA1-3(CA1/CA2/CA3)区及齿状回(DG)的锥体层结构完整,神经元形态规则,胞浆透明且染色均匀;与空白对照组相比,模型组海马神经元水平降低,细胞轮廓模糊,胞质缺失,胞核有缺损,核固缩程度不同,染色深。与模型组相比,沙利度胺高、低剂量组虽有轻度紊乱,但锥体细胞带的细胞正常,细胞轮廓较清晰,核结构较明显,胞浆透明,见Fig 4。
3.1.5各组小鼠海马区尼氏染色结果 空白对照组海马神经细胞形态结构完整,胞体饱满,颜色较深,可见较多的尼氏小体。模型组小鼠海马CA3区神经细胞数量明显减少,细胞多成空泡状,神经元核仁固缩或消失,尼氏颗粒不明显,海马正常结构毁损。与模型组相比,沙利度胺高剂量组海马区恢复较好,神经元细胞数量增多,胞体饱满,核仁大而圆,可见较多的尼氏体,见Fig 5。

Fig 4 Effect of thalidomide on hippocampal pathological morphology in AD mice A:Control group;B:Model control;C:High-dose group 35 mg·kg-1;D:Low-dose group 18 mg·kg-1;Black arrow:The cell shrank and was vacuolated;red arrow:The cell gap increased.
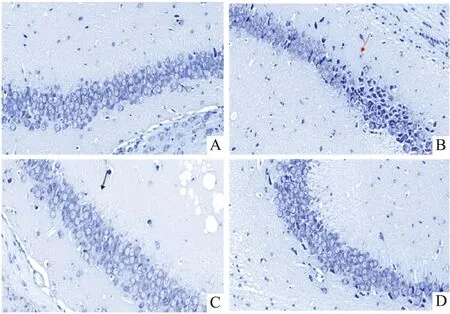
Fig 5 Effect of thalidomide on hippocampal Nissl body in AD mice A:Control group;B:Model control;C:High-dose group 35 mg·kg-1;D:Low-dose group 18 mg·kg-1;Black arrow:Nissl body;red arrow:Increased intercellular space
3.2 AD小鼠海马蛋白质组差异表达及生物信息学分析
3.2.1AD小鼠海马组织差异蛋白表达筛选 基于Label free组学技术,以表达倍数>1.2倍并<0.83倍且Pvalue<0.05(T-test或其他)的筛选标准结果表明,共有580个显著性差异蛋白质,其中有227个上调蛋白和358个下调蛋白,与空白组相比较,在AD模型小鼠海马区共有259个差异表达蛋白,其中上调90个,下调169个,其上调差异性蛋白主要参与细胞调节,DNA和蛋白质的合成,线粒体运输及调控和跨膜转运等生物过程,下调差异表达蛋白参与细胞过程异常调节,氨基酸代谢异常和蛋白质合成或代谢障碍,神经结构和功能的相关蛋白调节障碍等生物过程。
3.2.2AD小鼠海马差异蛋白GO注释及富集分析 根据GO蛋白数量富集分析发现,在生物学过程(biological process,BP)中,AD小鼠表达的差异蛋白质主要涉及蛋白质结构与代谢、骨形成调控作用、细胞内pH调节和内源性凋亡信号等,在细胞组分(cellular component,CC)分类中,差异蛋白质主要富集于内质网信号转导,核糖体合成与代谢、胞质核糖体与小核糖体亚单位等,在分子功能(molecular function,MF)中,这些差异性蛋白质富集于核糖体结构组成、神经细胞轴突髓鞘结构组成和维生素D合成等,见Fig 6。
3.2.3AD小鼠海马差异蛋白的KEGG富集分析与通路注释 比较AD小鼠与空白对照组,KEGG富集分析发现,差异性蛋白涉及的信号通路主要为核糖体、输出蛋白、嘧啶代谢、N-聚糖生物合成、糖胺聚糖降解通路发生明显的蛋白质变化,见Tab 3。其中差异蛋白质最多的是核糖体通路有16个差异蛋白表达,作用于蛋白质翻译、产热通路有14个差异蛋白表达,调节适应环境和能量代谢水平氧化磷酸化通路有11个差异蛋白表达,见Fig 7。
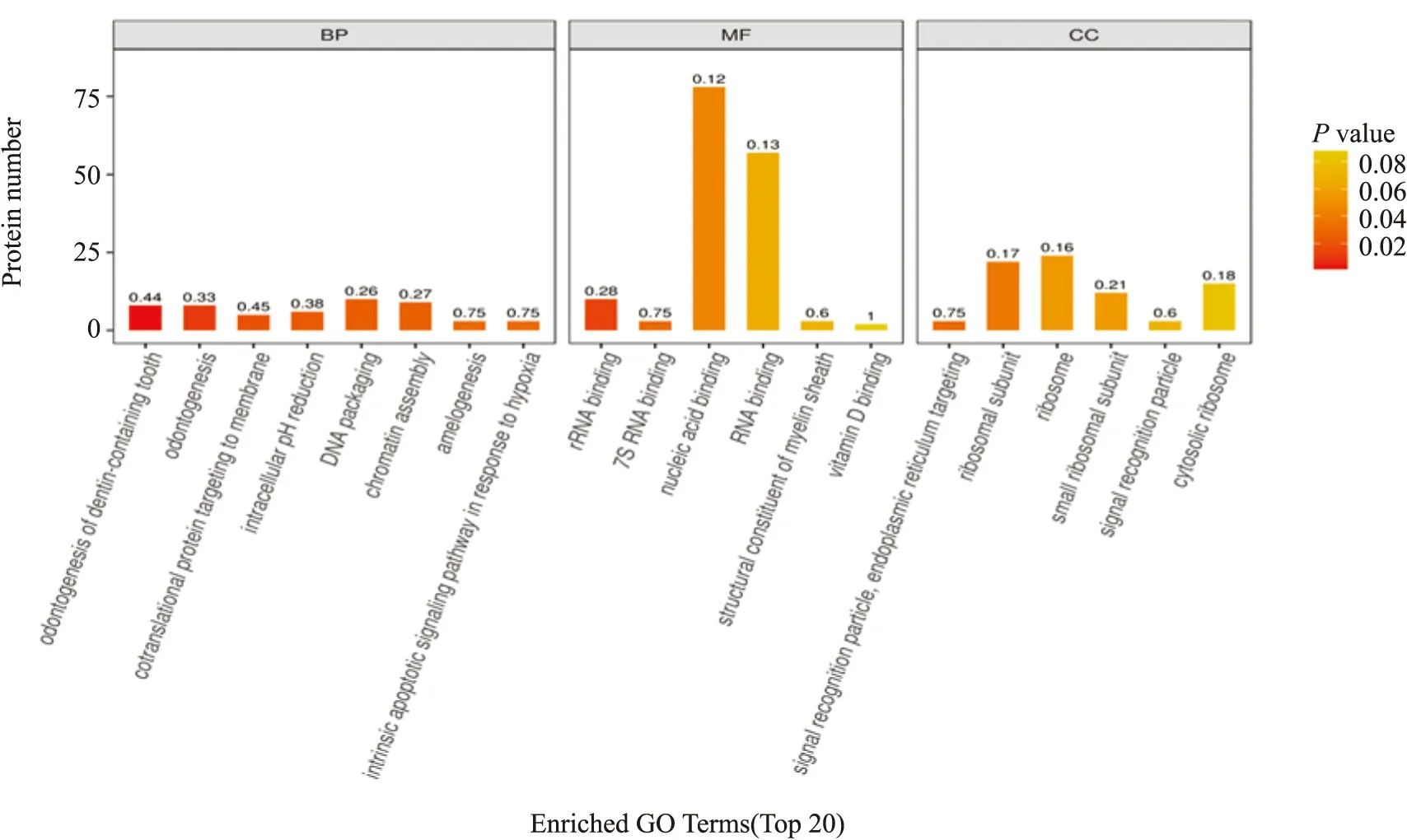
Fig 6 GO enrichment analysis of differential proteins between blank group and model group
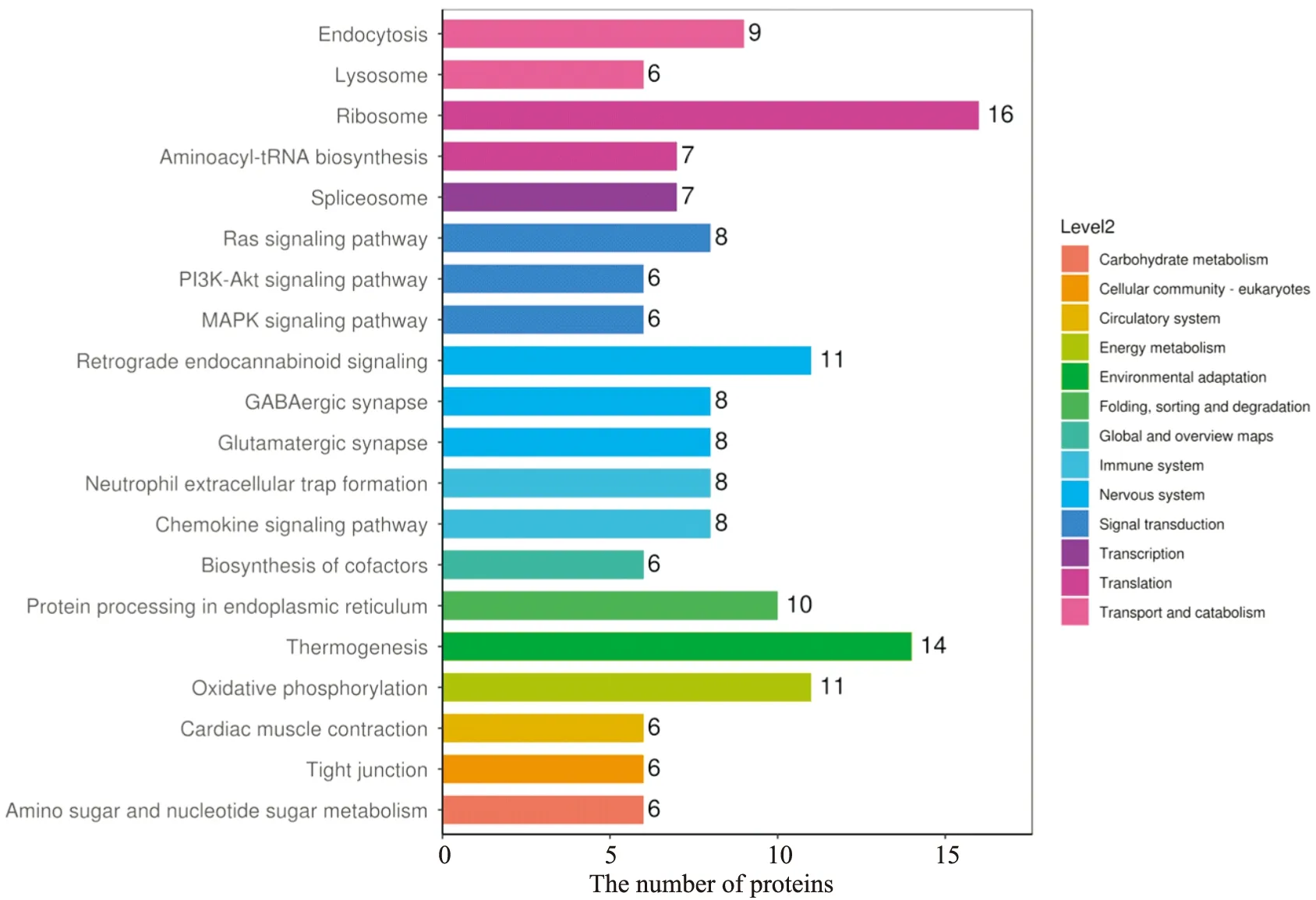
Fig 7 KEGG analysis of differential proteins in AD model mice
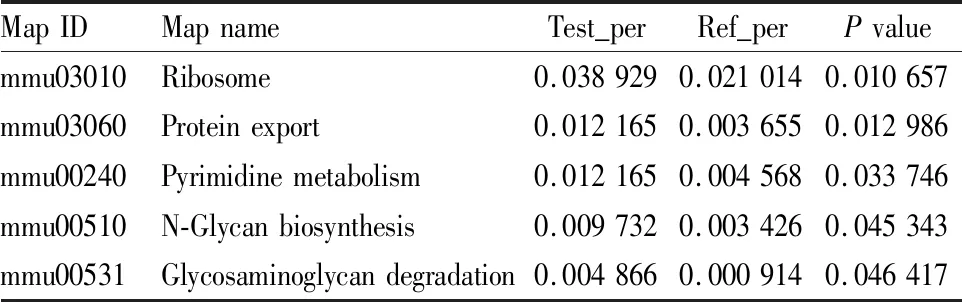
Tab 3 Enrichment analysis of KEGG pathway of differentially expressed proteins in hippocampus of AD model mice
3.3 沙利度胺干预AD小鼠海马差异表达蛋白及生物信息学分析
3.3.1沙利度胺干预AD小鼠海马组织差异蛋白表达筛选 经过给药治疗后,与模型组相比,沙利度胺给药组共有127个蛋白表达差异,其中上调67个,下调60个,其中突触小泡膜蛋白、小窝相关蛋白1过度表达,在调节细胞组成、组织、神经结构和功能的可塑性方面有着重要作用,并支持蛋白质合成、代谢和线粒体运输等生物过程,其细胞定位包括细胞膜、细胞质、线粒体、细胞核等。
3.3.2沙利度胺干预AD小鼠海马差异蛋白GO注释及富集分析 与模型组比较,在BP中,沙利度胺给药组表达差异蛋白质主要涉及到尿嘧啶合成与代谢过程、嘧啶核苷单磷酸合成与代谢过程、终止信号转导调控和鞘磷脂代谢过程等。CC分类中,差异蛋白质主要富集于BRCA1-A复合物、线粒体呼吸链复合物IV、BRISC复合体和分泌性蛋白颗粒膜等。在MF中,差异蛋白质富集于丙氨酸转氨酶活性、RNA聚合酶活性、DNA结合和氧化还原酶活性等,见Fig 8。
3.3.3沙利度胺干预AD小鼠海马差异蛋白的KEGG注释与富集分析 给药组与模型组相比较,通过KEGG富集分析显示真核生物中的核糖体生物发生通路、嘧啶代谢通路、鞘脂代谢通路、丙氨酸、天冬氨酸和谷氨酸代谢通路等发生了明显变化。其中差异蛋白质最多的是产热通路有11个蛋白表达差异,作用于环境调节和内质网中的蛋白质加工通路有6个蛋白表达差异,参与蛋白质折叠、分类和降解,见Fig 9,Tab 4。
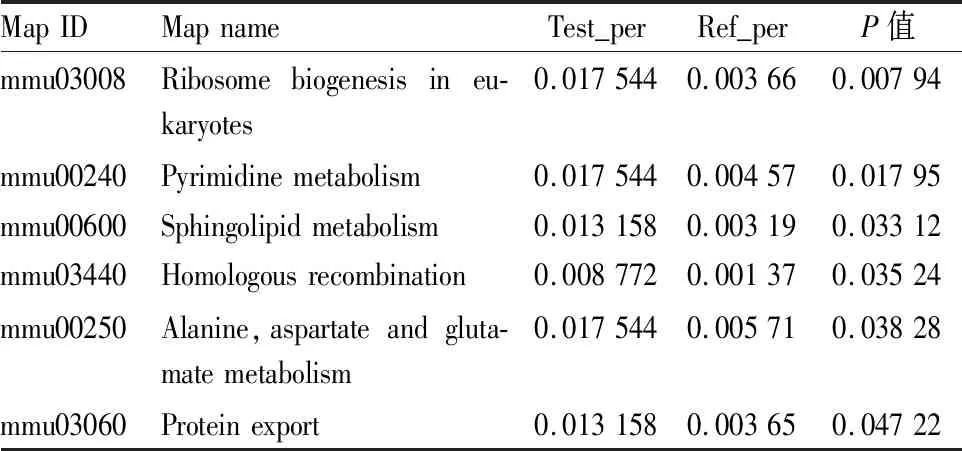
Tab 4 The enrichment analysis of KEGG pathway in intervention of thalidomide on differentially expressed proteins in hippocampus of AD model mice

Fig 8 Analysis of GO enrichment of differential proteins between thalidomide group and model group
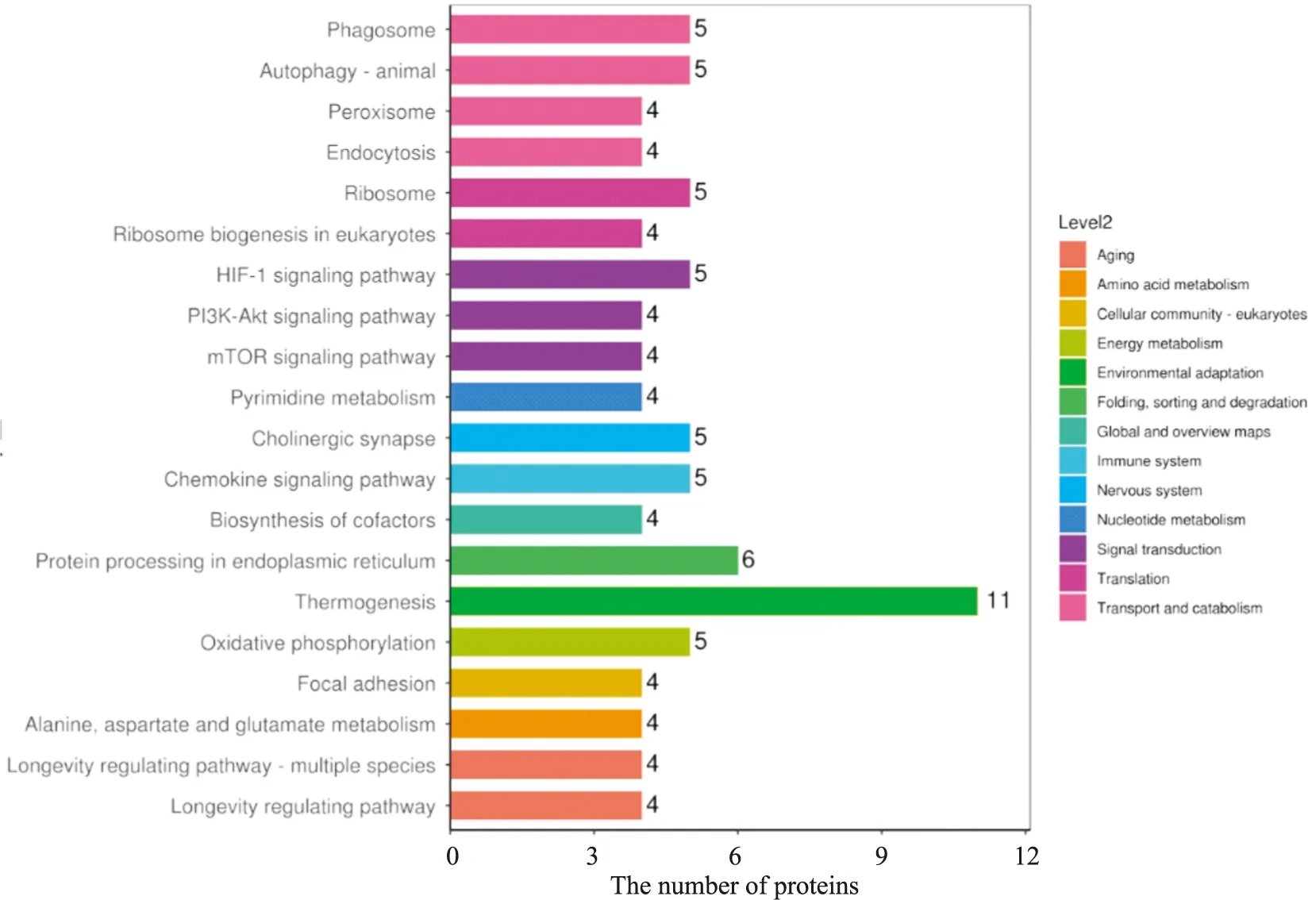
Fig 9 KEGG analysis of thalidomide intervention of differential proteins in AD model mice
3.3.4沙利度胺干预AD小鼠海马差异蛋白相互作用网络(PPI)分析 所有的高剂量给药组和模型组的差异性蛋白构成了一个蛋白调控拓扑网络,127个蛋白质有相互作用关系,拓扑网路中包含5个子网络,橙色网络团与抗细胞凋亡和调节自噬有关,下调CAD蛋白(Cad)为关键蛋白酶;橘色网络团与神经递质的释放和跨膜转运相关,下调突触体相关蛋白23(Snap23)为关键蛋白酶;绿色网络团与细胞信号转导相关,下调磷脂酰肌醇3-激酶调节亚基β(Pik3r2)为关键蛋白酶;黄色网络团与线粒体代谢相关,下调组蛋白结合蛋白(Rbbp7)和上调NAD依赖性蛋白脱酰基酶sirtuin-5(Sirt5)为关键蛋白酶;红色网络与蛋白质的合成和转运相关,上调rRNA 2-O-甲基转移酶原纤维蛋白(FL),下调蛋白质转运蛋白Sec61亚基γ(Sec61g)为关键节点蛋白,其关键蛋白为沙利度胺干预AD小鼠作用的相关预测蛋白质,见Fig 10。

Fig 10 Thalidomide intervention network diagram of differentially expressed proteins in hippocampus of AD mice
3.3.5AD小鼠与沙利度胺干预AD小鼠海马的差异表达蛋白和生物信息学分析
3.3.5.1AD小鼠和沙利度胺干预AD小鼠差异表达蛋白 AD小鼠与沙利度胺干预AD治疗后的海马组织的差异性蛋白进行比较,共同表达的差异性蛋白质有36个。其中线粒体泛醌生物合成单加酶COQ6(Coq6)、线粒体UMP-CMP激酶(Cmpk2)、突触体相关蛋白23(Snap23)、囊泡相关酶蛋白7(Vamp7)和突触融合蛋白结合蛋白(Stxbp5l)等蛋白在AD模型小鼠中过度表达,经过沙利度胺干预治疗后其蛋白均表达下调。另外NADH脱氢酶(Ndufa5)、核糖体蛋白(Rps9)、微管蛋白(Tuba1a)、cAMP依赖性蛋白激酶(Prkar2b)和组蛋白1(H1-1)等蛋白在沙利度胺给药治疗后的表达变化和空白组趋向一致,均表达上调,有回调趋势,见Tab 5。

Tab 5 Thalidomide interfered with differentially expressed proteins in hippocampus of AD mice
3.3.5.2AD和沙利度胺干预AD小鼠差异表达蛋白KEGG通路 比较空白组、模型组和沙利度胺给药组,确定受到显著性影响的代谢和信号转导途径的KEGG通路富集分析,共筛选出13个具有差异性的通路,主要有神经变性的途径-多种疾病(pathways of neurodegeneration-multiple diseases)通路,有34个蛋白表达差异;阿尔茨海默病通路,有29个蛋白表达差异;脘病毒病通路,有25个蛋白表达差异和帕金森综合征通路,有24个蛋白表达差异,见Tab 6。其中参与阿尔茨海默病通路的蛋白主要有N-甲基-D-天冬氨酸受体钙蛋白酶催化亚基2,细胞外信号调节激酶(ERK 1/2)、β-链蛋白,α-突触核蛋白(α-synuclein,SNCA)、钙蛋白酶(calpain)和20s、19s蛋白酶体(20s、19s Proteasome)等蛋白,其可能主要通过调控Wnt信号通路、氧化磷酸化和钙信号通路来实现沙利度胺对AD治疗作用。

Tab 6 Joint analysis of KEGG pathway of differentially expressed proteins in hippocampus of AD model mice
4 讨论
近年来已经有多项研究发现,沙利度胺是一种应用广泛的化合物,其分子机制是多方面的,沙利度胺及其衍生物被称为免疫调节性酰亚胺类药物(IMIDs),是谷氨酸的衍生物,它们具有特异性和广泛性的抗炎、免疫调节和抑制血管生成作用,可能会减少中枢神经系统炎症,是一种新的免疫调节药物和抗炎药物,并且具有血脑屏障通透性和高生物利用度,有可能缓解神经退行性疾病的症状,减缓疾病的进展[6-7]。研究证实,沙利度胺对AD模型小鼠的中枢神经系统毒性作用较少,抑制AD β-分泌酶(BACE1),降低了脑组织BACE1和抑制淀粉样蛋白沉积的水平,减少神经胶质细胞的活化大量激活的小胶质细胞和星形胶质细胞,减轻其炎症反应,似乎是一种很有前途的治疗方法[3],因此我们选择在Aβ动物模型上研究沙利度胺的治疗作用。Morris水迷宫实验结果表明,沙利度胺能提高AD小鼠的学习记忆能力,海马组织病理形态明显改善,同时伴随着海马组织蛋白质表达的变化。
蛋白质组学已被证明成为揭示复杂生命活动各个方面的有效工具[8],基于蛋白组学检测和生物信息分析,沙利度胺干预AD小鼠海马组织差异性蛋白质主要参与氧化磷酸化,调节线粒体的结构和功能。线粒体作为糖类、脂代谢的主要场所,在基质内进行由氧化磷酸化过程而产生的大量ATP,为机体供给热能,调控Ca2+通道,调节氧化应激及细胞凋亡[9-10]。线粒体缺陷在AD突触损伤和氧化损伤过程中产生了关键作用,其形式和功能的失常将会引起胆固醇和磷脂代谢紊乱、Ca2+失调和能量代谢缺乏等细胞功能障碍,其活性下降导致AD病理发生[1,11]。线粒体呼吸链酶复合物是位于线粒体内膜上的一种与氧化磷酸化有关的蛋白质,是由NADH脱氢酶复合物(Cx Ⅰ)、琥珀酸脱氢酶复合物(Cx Ⅱ)、细胞色素还原酶复合物(Cx III)、细胞色素氧化酶复合物(Cx Ⅳ)和ATP合成酶(Cx V)组成。在能量代谢中发挥着重要作用,线粒体复合物I是最大和最复杂的复合体,与复合物III和复合物IV形成呼吸小体,其缺失将会造成呼吸链受损而供能不足,影响ATP合成代谢,增加ROS,诱发氧化应激,释放细胞色素C,并直接导致细胞凋亡[12-13]。因此,提高线粒体复合物Ⅰ及相关蛋白的活性有助于改善线粒体呼吸功能,在AD模型小鼠中线粒体复合物Ⅰ、Ⅱ、Ⅳ、V的活性减低,沙利度胺能够明显提高其活性,另外从蛋白组学的角度分析沙利度胺治疗AD模型小鼠后同样上调CxⅠ、Ⅱ、Ⅳ、V以及Sirt5蛋白的表达,下调蛋白包括泛醌生物合成单加氧酶COQ6、神经溶素等蛋白的表达,进一步证实了沙利度胺对线粒体功能有保护作用,从而改善线粒体功能及能量代谢障碍。另外线粒体缺陷在AD突触损伤和突触传递中起到关键作用,Aβ诱导的AD小鼠中,大脑组织中突触相关蛋白也发生了改变,包括Snap23、Vamp7和Stxbp5l[14]。
此外,药物同时对细胞骨架锚蛋白1(Ankyrin-1)以及微管相关蛋白(如小窝相关蛋白,微管蛋白α-1A链)可明显增强,筛选出来的组蛋白3.3、核心组蛋白H2A以及组蛋白1.1,其乙酰化可以通过细胞应激诱导APP产生,组蛋白乙酰化修饰异常可能与AD发生发展密切相关,沙利度胺干预治疗后均有回调,检测出来的肌苷5-磷酸脱氢酶2(Impdh2)已被证实为抗神经炎症的一个显著的靶点[15],沙利度胺干预治疗后其表达量下降,抑制了Impdh2依赖的神经炎性反应,此外相关蛋白,如小窝相关蛋白、cAMP依赖性蛋白激酶Ⅱ-β型调节亚基(Prkar2b)、磷脂酰肌醇3-激酶调节亚基β(Pik3r2)等也被发现与AD或者Aβ有着直接或者间接关系[16]。
综上,本文基于label-free非标记定量蛋白质组学研究发现沙利度胺干预AD模型小鼠主要通过改变线粒体跨膜转运蛋白和能量代谢相关蛋白的表达发生,有36个蛋白呈回调趋势,并可能通过调控神经变性的途径-多种疾病、阿尔茨海默病和帕金森综合征3条通路实现对AD干预治疗,其可能主要调控Wnt信号通路、氧化磷酸化。
