二氯乙酸盐协同维生素C抑制神经胶质瘤细胞的增殖、迁移和侵袭及其作用机制
2023-02-06张晓宇龙妮娅出良钊
张晓宇,龙妮娅,刘 健,3,出良钊,
(贵州医科大学1.临床医学院、2.附属医院神经外科,3.贵州省人民医院神经外科,贵州 贵阳 550004)
神经胶质瘤是神经外科常见的恶性肿瘤之一,是中枢神经系统最常见以及恶性程度最高的原发性肿瘤[1]。外科手术联合放化疗是其主要的治疗方法,然而神经胶质瘤病人的预后较差[2]。神经胶质瘤细胞会侵入到人体颅脑的中枢神经系统,造成脑部肿瘤的侵袭及对颅脑的压迫等一系列问题,给治疗带来了较多困难[3]。二氯乙酸盐(dichloroacetate,DCA)是一种小分子物质,目前作为丙酮酸脱氢酶的抑制剂,应用于乳酸中毒的治疗[4]。近年来,有文献报道DCA能够影响神经胶质瘤细胞和胰腺癌细胞的代谢,进而抑制细胞的增殖[5]。维生素C(vitamin C,VC),又称维他命C,是一种多羟基化合物,结构类似葡萄糖,其分子中第2及第3位上两个相邻的烯醇式羟基极易解离而释出H+,故具有酸的性质,又称L-抗坏血酸[6]。近年来,研究发现,药物剂量的维生素C具有潜在的抗肿瘤活性,如胰腺癌、卵巢癌和非小细胞肺癌等,且药物耐受性是在可接受范围内[7]。此外,药物剂量的VC可以增强肿瘤对药物的敏感性[8]。如研究者发现VC可以稳定姜黄素在大鼠体内药效的稳定性,协同姜黄素抑制小鼠结直肠癌肿瘤的生成[9]。然而,VC与DCA是否具有协同作用以及其作用机制仍不清楚。
本研究探讨了DCA和VC联合用药后对神经胶质瘤细胞U87、U251增殖、迁移以及侵袭的影响,并分析其可能的作用机制,以期为临床的神经胶质瘤治疗提供潜在的治疗策略。
1 材料与方法
1.1 材料
1.1.1细胞 人正常神经胶质细胞NHA以及神经胶质瘤细胞U87和U251均购自武汉Procell公司。
1.1.2主要试剂 Dulbecco′s modified eagle medium (DMEM)培养基(货号:C11995500BT)购自美国Gibco生物公司;青霉素-链霉素-两性霉素三抗(货号:J180027)购自索莱宝公司;胎牛血清(FBS;货号:1913444)购自Biological industries公司;DCA(货号:HY-Y0445A)购自MedChemExpress公司;VC(货号:A800295)购自美国麦克林公司;放线菌酮(CHX)购自Selleck生物公司;CCK-8试剂(货号:CK-04)购自日本同仁公司;活性氧检测试剂盒(DCFH-DA货号:CA1410)购自北京北奥莱博科技公司;细胞凋亡试剂盒(货号:40302ES60)购自上海翊圣生物公司;细胞周期试剂盒(货号:KGA511)购自南京凯基生物公司;BALB/c雌性裸鼠(5周) 购自长沙天勤生物技术有限公司;多克隆抗体BCL2A1(货号:12789-1-AP)、CDC25A(货号:55031-1-AP)、细胞色素C(Cytochrome,货号:10993-1-AP)、caspase-7(货号:27155-1-AP)、CDK4(货号:11026-1-AP)、CDK6(货号:14052-1-AP)和β-actin(货号:20536-1-AP)均购自武汉三鹰Proteintech公司;多克隆抗体cleaved-caspase-7(货号:8438)购自于美国CST生物公司;山羊抗兔二抗(货号:BS13278)购自博士德有限公司;Immobilon Western HRP曝光液(货号:WBKLS0500)购自EMD Millipore公司。
1.1.3仪器 恒温细胞培养箱(货号:2001HY-6003,美国赛默飞公司);超净操作工作台(货号:SW-CJ2D,苏州净化生物有限公司);Epoch型全波长酶标仪(货号:ELx800,美国Bio-Tek公司);流式细胞仪(货号:6890-5973N,美国安捷伦生物公司);倒置显微镜(DM500,德国徕卡公司);多功能成像系统(货号:JP-K300,美国Bio-Rad公司)。
1.2 方法
1.2.1细胞培养与药液配置 神经胶质瘤细胞NHA、U87和U251培养在完全培养基(高糖DMEM,其中添加10%胎牛血清FBS和1%青霉素-链霉素-两性霉素)中,将其放置于37 ℃、含5%CO2的培养箱中培养。DCA、VC和CHX分别用DMSO配置为100 mmol·L-1的母液,使用前母液均存储于-20 ℃冰箱。
1.2.2CCK-8法检测神经胶质瘤细胞的活性 取细胞状态良好且处于对数生长期的NHA、U87和U251细胞,5×103个/孔均匀接种于无菌的96孔板,每孔100 μL细胞;分别予以0、1、2、3、4、5、6、7和8 mmol·L-1的VC处理NHA、U87和U251细胞;在探究DCA与VC的协同效果时,分别以0、5、10、15、20和25 mmol·L-1的DCA单独或联合5 mmol·L-1VC处理U87和U251细胞,每组设置6个复孔。药物处理48 h后,每孔加入10 μL CCK-8试剂,放置在培养箱中且避光孵育2 h后用酶标仪在450 nm处检测其OD值。细胞增殖率/%=(试验组OD值-空白组OD值)/(对照组OD值-空白组OD值)×100%。此外,用金氏公式计算两个药物的协同作用。公式为:q=E(A+B)/[EA+(1- EA)·EB],其中E(A+B)为两药物联合作用细胞后的抑制率,EA、EB分别为单一药物分别作用细胞后的抑制率,q>1.15为协同作用,实验独立重复3次。
1.2.3平板克隆实验检测神经胶质瘤细胞的增殖能力 取细胞状态良好且处于对数生长期的U87和U251细胞(3×103个/孔)均匀接种于6孔板中,分别以等体积DMSO(对照组)、15 mmol·L-1DCA单药、5 mmol·L-1VC单药以及两者联合处理细胞,每组设置3个复孔。14 d后吸弃6孔板中的培养基,用磷酸盐缓冲液(PBS)清洗3次,每次3 min,用4%的多聚甲醛溶液固定细胞25 min。吸弃4%的多聚甲醛溶液,用PBS清洗3次,每次3 min,再用0.1%结晶紫溶液在室温下染色25 min。吸弃0.1%结晶紫溶液,用PBS清洗3次,每次3 min,烘箱过夜烘干,拍照,计数各组的克隆形成数,实验独立重复3次。
1.2.4流式细胞术检测神经胶质瘤细胞的活性氧含量 取细胞状态良好且处于对数生长期的U87和U251细胞,5×104个/孔均匀接种于6孔板中,待细胞24 h贴壁后,分别以等体积DMSO(对照组)、15 mmol·L-1DCA单药、5 mmol·L-1VC单药以及两者联合处理细胞。各组培养24 h后,用无EDTA的胰酶消化细胞并收集细胞,将提前配置好的1 ∶1 000用无血清培养基稀释DCFH-DA加入各管细胞中,在37 ℃培养箱中培养20 min,用无血清培养基洗涤3次,室温避光30 min内进行流式细胞仪的上机检测。实验独立重复3次。
1.2.5流式细胞术检测神经胶质瘤细胞的凋亡 细胞处理方法同“1.2.4”,加入15 μL的异硫氰酸荧光素(fluorescein isothiocyanate isomer,Annex V-FITC)、5 μL的碘化丙啶(propidium iodide,PI)和400 μL的Loading buffer室温避光30 min后,进行流式细胞仪的上机检测。实验独立重复3次。
1.2.6流式细胞术检测神经胶质瘤细胞的周期 细胞处理方法同1.2.4,加入5 μL RNase酶,在37 ℃恒温摇床孵育15 min后,加入400 μL的碘化丙啶(propidium iodide,PI)室温避光反应30 min后,进行流式细胞仪的上机检测。实验独立重复3次。
1.2.7划痕愈合实验检测神经胶质瘤细胞的迁移的能力 细胞处理方法同1.2.4,待培养至细胞密度为90%~100%融合度时,用200 μL枪头在6孔板各孔底部做轻柔划痕,用PBS清洗细胞3次,每次3 min。分别以等体积DMSO(对照组)、15 mmol·L-1DCA单药、5 mmol·L-1VC单药以及两者联合处理细胞,分别于0 h和24 h拍照,使用软件ImageJ测量划痕宽度,并计算细胞迁移率。细胞的迁移率/%=(0 h划痕的宽度-24 h划痕的宽度)/0 h划痕的宽度×100%。实验独立重复3次。
1.2.8Transwell实验检测神经胶质瘤细胞的侵袭能力 用Matrigel胶均匀铺于24孔板的小室上室内,取细胞状态良好且处于对数生长期的U87和U251细胞(2×104个/孔)在无血清培养基混匀后接种于24孔板中上室。下室每孔加入700 μL的完全培养基。分别以等体积DMSO(对照组)、15 mmol·L-1DCA单药、5 mmol·L-1VC单药以及两者联合处理细胞,待24 h后,吸去上室和下室中的培养基,用4%的多聚甲醛溶液固定细胞25 min,吸弃4%的多聚甲醛溶液,用PBS清洗3次,再用0.1%结晶紫溶液在室温下染色25 min。PBS清洗3次,烘箱过夜烘干。取出置于倒置显微镜下观察,随机选取5个视野(上、下、左、右和中)拍照并计数。实验独立重复3次。
1.2.9皮下移植瘤动物模型的建立 BALB/c雌性裸鼠(饲养于温度为25 ℃,湿度在50%的环境下,光照时间为12 h·d-1,自由进食无菌水和无菌饲料,喂养1周适应新环境后接种细胞。本实验经贵州医科大学伦理委员会批准,并严格按照实验,在每只裸鼠左侧腋窝处给予U251细胞悬液0.1 mL(含2×106个细胞)。d 12后,挑选肿瘤体积在50~60 mm3的裸鼠,随机分为4组,即DMSO、DCA单药、VC单药以及两药联合处理组。DCA组每天瘤周注射15 mmol·L-1DCA液100 μL,VC组每天瘤周注射5 mmol·L-1VC液100 μL,联合组每天瘤周注射含15 mmol·L-1DCA和5 mmol·L-1VC的混合液100 μL,而DMSO组则每天瘤周注射等体积DMSO。每3 d测量1次肿瘤体积,肿瘤体积:V=(长×宽)2/2。d 27对裸鼠进行安乐死处理,解剖肿瘤并拍照。
1.2.10DCA和VC在神经胶质瘤中的重要靶点预测分析 根据DCA、VC的药效团,利用TargetNet(http://targetnet.scbdd.com/)分析预测DCA和VC的蛋白靶点,以Cytoscape软件可视化药物靶点的关系网络。此外,运用在线工具GEPIA软件(http://gepia.cancer-pku.cn/)分析靶点的表达量与神经胶质瘤患者预后的关系。
1.2.11Western blot法检测蛋白的表达 取细胞状态良好且处于对数生长期的U87和U251细胞(1×106个/孔)均匀接种于6孔板中,待细胞密度至70%~80%的融合度后,以等体积DMSO(对照组)、15 mmol·L-1DCA单药、5 mmol·L-1VC单药以及两者联合处理细胞。处理48 h后,弃掉培养基,PBS洗涤后分别加入RIPA 细胞裂解液混合液100 μL,放置于冰上且在摇床上裂解20 min,收集含蛋白的裂解液于1.5 mL离心管中,于4 ℃、12 000 r·min-1离心后取上清液,运用BCA法定量相关蛋白浓度,将蛋白样品与上样缓冲液5×loading buffer混合,100 ℃,15 min。各加入25 μg蛋白样品以110 V恒压电泳,并以300 mA恒定电流将蛋白电转移至PVDF膜。用5%的脱脂奶粉封闭,分别加入BCL2A1、CDC25A、cytochrome C、caspase-7、cleaved-caspase-7、CDK4、CDK6和β-actin抗体,4 ℃孵育过夜。回收一抗后,用TBST清洗,加入山羊抗兔/山羊抗鼠二抗,室温孵育,清洗条带,曝光,于多功能成像系统曝光显影。BCL2A1、CDC25A、cytochrome C、CDK4和CDK6以β-actin作为内参蛋白,cleaved-caspase-7以caspase-7为内参蛋白,根据其灰度值计算其相对表达量。实验独立重复3次。
1.2.12蛋白降解率检测 用1 μmol·L-1放线菌酮(CHX)抑制U87和U251细胞的蛋白翻译,同时分别给予DMSO、15 mmol·L-1DCA和5 mmol·L-1VC单药以及两者联合处理0、0.5、1.0和2.0 h。RIPA裂解细胞,提取蛋白样本,步骤同“1.2.11”,检测各组细胞中BCL2A1和CDC25A的降解水平。
2 结果
2.1 DCA、VC和两者联合作用对神经胶质瘤细胞增殖的影响CCK-8细胞结果(Fig 1A)显示,VC对U87和U251的IC50为7.6 mmol·L-1和7.1 mmol·L-1。然而,此浓度对NHA有较大的非特异性毒性;5 mmol·L-1VC对NHA毒性较低,被选做用于后续联合的浓度。以不同浓度(0、5、10、15、20、25 mmol·L-1)的DCA单独处理或联合5 mmol·L-1VC处理U87细胞,联合协同指数(q值)分别为0.91、1.33、1.75、1.47、1.40,其中,DCA单药对U87的IC50为24.1 mmol·L-1,而存在5 mmol·L-1VC的情况下IC50为16.8 mmol·L-1。以不同浓度(0、5、10、15、20、25 mmol·L-1)的DCA单独处理或联合5 mmol·L-1VC处理U251细胞,各组联合协同指数(q值)分别为0.87、1.30、1.67、1.40、1.38,其中,DCA单药对U251的IC50为22.8 mmol·L-1,而存在5 mmol·L-1VC的情况下IC50为17.2 mmol·L-1。结果提示,10、15、20和25 mmol·L-1DCA与5 mmol·L-1VC能够协同抑制神经胶质瘤细胞U87和U251细胞的增殖,其中,15 mmol·L-1DCA与5 mmol·L-1VC的联合指数最佳,因此,选择该联合剂量用于后续研究。

Fig 1 Effects of different concentrations of DCA,VC and their combination on proliferation of neuroglioma U87 and U251 cells in vitro A:Effect of different concentrations of VC on proliferation of neuroglioma U87 and U251 cells;B:Effect of different concentrations of DCA combined with 5 mmol·L-1 VC on proliferation of neuroglioma U87 and U251 cells.**P<0.01 vs control.
2.2 DCA联合VC对神经胶质瘤细胞克隆形成的影响克隆形成实验结果(Fig 2)显示,DMSO对照组、DCA单药组、VC单药组、联合用药组中U87细胞的克隆形成数分别为(333±25.24)个、(241±10.50)个、(212±11.15)个、(113±10.21)个;DMSO对照组、DCA单药组、VC单药组、联合用药组U251克隆形成数分别为(83±5.13)个、(64±3.22)个、(73±4.36)个、(31±7.51)个;与DMSO对照相比,单药和联合处理后U87和U251细胞的增殖率均明显减少(P<0.05);与单药处理相比,联合处理后U87和U251细胞的增殖率均明显减少(P<0.05)。提示,VC能够协同DCA抑制神经胶质瘤细胞克隆形成。

Fig 2 Effect of DMSO,DCA,VC and their combination on cell colonies of neuroglioma U87 and U251 *P<0.05 vs control,#P<0.05 vs DCA,δP<0.05 vs VC.
2.3 DCA联合VC对神经胶质瘤细胞产生活性氧含量的影响流式细胞术结果(Fig 3)显示,与DMSO对照相比,单药处理后U87和U251细胞的活性氧含量增加不明显;然而,与对照组和单药处理组相比,联合处理后U87和U251细胞的活性氧含量明显增加。提示,VC能够协同DCA促进神经胶质瘤细胞的活性氧生成。
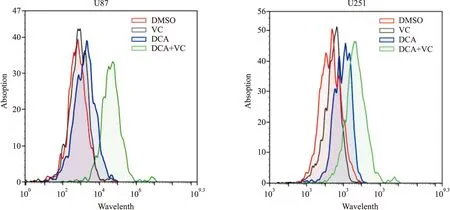
Fig 3 Effect of DMSO,DCA,VC and their combination on reactive oxygen content of neuroglioma U87 and U251

Fig 4 Effect of DMSO,DCA,VC and their combination on apoptosis of neuroglioma U87 and U251 *P<0.05 vs control,#P<0.05 vs DCA,δP<0.05 vs VC.
2.4 DCA联合VC对神经胶质瘤细胞凋亡的影响流式细胞术结果(Fig 4)显示,DMSO对照组、DCA单药组、VC单药组和联合用药组中U87细胞的凋亡率分别为(2.39±0.67)%、(5.49±0.27)%、(7.12±1.05)%、(17.56±0.68)%。DMSO对照组、DCA单药组、VC单药组和联合用药组中U251细胞的凋亡率分别为(2.76±0.56 )%、(6.22±0.92)%、(5.98±1.43)%、(16.22±1.02)%;与DMSO对照相比,单药和联合处理后U87和U251细胞的凋亡率均明显增加(P<0.05);与单药处理相比,联合处理后U87和U251细胞的凋亡率均明显增加(P<0.05)。提示,VC能够协同DCA促进神经胶质瘤细胞的凋亡。
2.5 DCA联合VC对神经胶质瘤细胞周期的影响流式细胞术结果(Fig 5)显示,DMSO对照组、DCA单药组、VC单药组、联合用药组中U87细胞在G1期的百分比分别为(51.39±1.19)%、(57.48±2.05)%、(56.53±1.01)%、(74.72±1.50)%;在S期的百分比分别为(33.23±0.86)%、(28.57±0.79)%、(29.84±2.86)%、(21.60±1.03)%;在G2/M期的百分比分别为(16.41±1.06)%、(13.49±1.09)%、(11.42±0.62)%、(5.46±0.84)%。DMSO对照组、DCA单药组、VC单药组、联合用药组中U251细胞在G1期的百分比(24.31±2.32)%、(44.48±2.20)%、(46.92±1.58)%、(62.83±2.21)%;在S期的百分比分别为( 31.72± 1.52)%、(28.91±1.78)%、(28.11±1.55)%、(25.09 ±1.80)%;在G2/M期的百分比分别为(43.84±1.67)%、(22.53±1.47)%、(22.81 ±1.86)%、(8.23 ±1.88)%。与DMSO对照相比,单药和联合处理后U87和U251细胞的阻滞在G1期的细胞百分比均明显增加(P均<0.05);与单药处理相比,联合处理后U87和U251细胞的阻滞在G1期的细胞百分比均明显增加(P<0.05)。提示,VC能够协同DCA诱导神经胶质瘤细胞阻滞在G1期。
2.6 DCA联合VC对神经胶质瘤细胞迁移的影响划痕实验结果(Fig 6)显示,DMSO对照组、DCA单药组、VC单药组和联合用药组U87细胞迁移率分别为(100.00±7.00)%、(44.33±4.90)%、(56.00±5.60)%、(26.33±4.50)%;DMSO对照组、DCA单药组、VC单药组和联合用药组U251细胞迁移率分别为(100.00±8.50)%、(66.00±10.40)%、(73.33±1.70)%、(37.33±3.50)%。与DMSO对照相比,单药和联合处理后U87和U251细胞的迁移率均明显减少(P<0.05);与单药处理相比,联合处理后U87和U251细胞的迁移率也均明显减少(P<0.05)。提示,VC能够协同DCA抑制神经胶质瘤细胞的迁移能力。

Fig 5 Effect DMSO,DCA,VC and their combination on cell cycle of neuroglioma U87 and U251 *P<0.05 vs control,#P<0.05 vs DCA,δP<0.05 vs VC.
2.7 DCA联合VC对神经胶质瘤细胞侵袭的影响Transwell小室实验结果(Fig 7)显示,DMSO对照组、DCA单药组、VC单药组和联合用药组中U87细胞侵袭细胞数分别为(850±36)个、(440±40)个、(449±30)个和(80±17)个;DMSO对照组、DCA单药组、VC单药组和联合用药组中U251细胞侵袭细胞数分别为(868±66)个、(729±34)个、(423±20)个和(76±15)个。与DMSO对照相比,单药和联合处理后U87和U251细胞的侵袭细胞数均明显减少(P均<0.05);与单药处理相比,联合处理后U87和U251细胞的侵袭细胞数也均明显减少(P<0.05)。提示,VC能够协同DCA抑制神经胶质瘤细胞的侵袭能力。
2.8 DCA联合VC对神经胶质瘤细胞U251体内增殖的影响如Fig 8,与DMSO对照组相比,DCA和VC单药处理后U251形成的肿瘤组织体积减少;与DCA和VC单药相比,两者联合处理后,肿瘤组织体积明显减少(P均<0.05)。
2.9 分析DCA与VC在神经胶质瘤中的重要靶点根据DCA和VC的药效团,利用在线软件TargetNet预测发现,DCA有36个可能的作用靶点,VC有9个可能的作用靶点。其中,有7个蛋白靶点为两者共同的作用靶点,如CDC25A、S1PR2、PPO2F、DPS、BCL2A1、ALOX15和CES1(Fig 9A-B)。其中,对作用靶点与神经胶质瘤患者的预后关系进行分析发现,高表达蛋白靶点BCL2A1和CDC25A患者较低表达患者总体生存率明显减少(Fig 9C-D)。提示,抑制BCL2A1和CDC25A是治疗神经胶质瘤的一种治疗策略,BCL2A1和CDC25A可能是DCA和VC在神经胶质瘤中发挥作用的重要靶点。

Fig 6 Effect of DMSO,DCA,VC and their combination on migration of neuroglioma U87 and U251 using wound *P<0.05 vs control,#P<0.05 vs DCA,δP<0.05 vs VC.

Fig 7 Effect of DMSO,DCA,VC and their combination on invasion of neuroglioma U87 and U251 cell using *P<0.05 vs control,#P<0.05 vs DCA,δP<0.05 vs VC.
2.10 DCA联合VC对神经胶质瘤细胞BCL2A1、CDC25A、CDK4、CDK6、cytochrome C和cleaved- caspase-7的影响Western blot结果(Fig 10)表明,与DMSO对照组相比,DCA和VC以及两者联合处理后U87和U251细胞中BCL2A1、CDC25A、CDK4和CDK6的表达量明显减少(P<0.05),cytochrome C和cleaved-caspase-7的表达量明显增加(P<0.05);与DCA和VC单独用药组相比,两者联合处理后U87和U251细胞中BCL2A1、CDC25A、CDK4和CDK6的表达量也明显减少(P<0.05),cytochrome C和cleaved-caspase-7的表达量也明显增加(P<0.05)。
2.11 VC联合DCA对BCL2A1和CDC25A蛋白降解率的影响基于BCL2A1和CDC25A可能是DCA联合VC的重要靶点,我们以CHX抑制细胞的蛋白合成后,探究各组细胞中BCL2A1和CDC25A蛋白的降解率。结果提示(Fig 11),与DMSO对照组相比,各处理组BCL2A1和CDC25A蛋白的降解率均明显增加。与DCA和VC单药相比,联合组中BCL2A1和CDC25A蛋白的降解率明显增加。提示,VC和DCA两者联合具有促进BCL2A1和CDC25A降解的作用。

Fig 9 Prediction of target proteins of BCL2A1 and CDC25 action (A,B) between DCA and VC,the prognosis of patients between BCL2A1 and CDC25A (C,D)
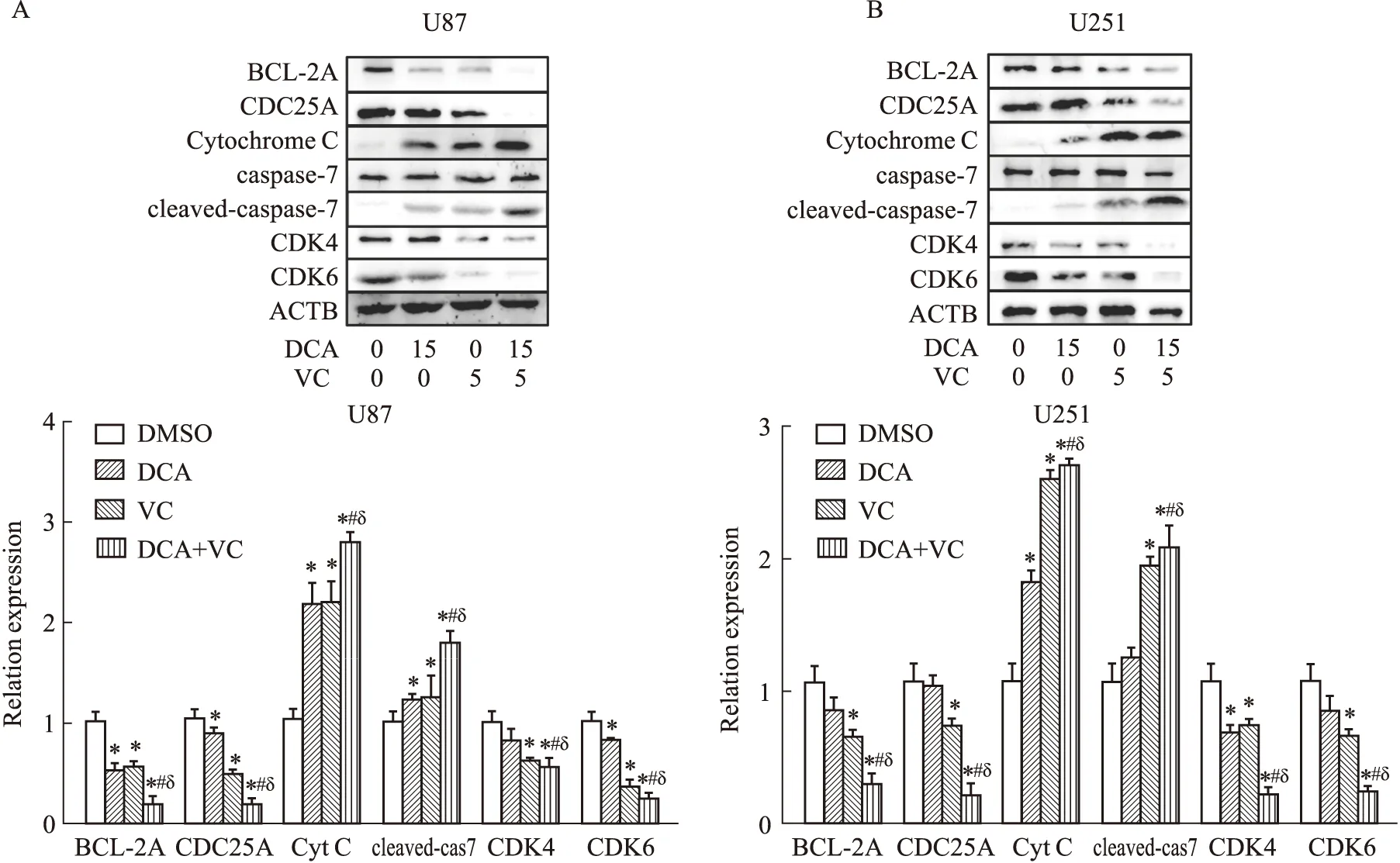
Fig 10 Effect of DMSO,DCA,VC and their combination on expression of BCL2A1,CDC25A,CDK4,CDK6,cytochrome C, caspase-7,cleaved-caspase-7 proteins in neuroglioma U87 and U251 cells detected by Western blot A:Protein expression in U87;B:Protein expression in U251.*P<0.05 vs control,#P<0.05 vs DCA,δP<0.05 vs VC.

Fig 11 Effect of DMSO,DCA,VC and their combination on expression of BCL2A1, CDC25A U87 and U251cells detected by Western blot A:Protein expression in U87;B:Protein expression in U251.
3 讨论
神经胶质瘤是最常见的中枢神经系统恶性肿瘤,由于神经胶质瘤的发病位置比较特殊,正常的脑组织与肿瘤组织之间的边界较模糊,通过外科手术彻底清除病灶的难度较大,治疗效果较差且容易复发,病死率高[10]。因此,开发新的治疗药物对神经胶质瘤的治疗有重要意义。
DCA是一种临床上用于治疗糖尿病的代谢调节剂。近年来,研究发现DCA能够抑制丙酮酸脱氢酶激酶的活性,继而减少乳酸的形成,因此可以逆转瓦尔堡效应,促进肿瘤细胞的凋亡[11]。DCA能够通过促进YAP通路抑制肝癌细胞的增殖[12]。此外,Korsakova等[13]研究发现,DCA和二甲双胍联合用药可以靶向抑制体内外神经胶质瘤细胞的生长。因此,DCA与其他药物联合应用可能成为提高疗效的一种可行方法。有研究发现高剂量VC对多种恶性肿瘤,例如淋巴瘤等,均有明显的治疗效果,并有临床试验证实了静脉滴注大剂量VC对恶性肿瘤的治疗效果甚佳[14]。此外,研究发现,VC是一种良好的增敏剂,与多种传统的化疗药物有协同作用[8]。
本研究通过CCK-8实验发现,VC与多个浓度(10、15、20和25 mmol·L-1)的DCA具有协同作用。其中,5 mmol·L-1的VC与15 mmol·L-1的DCA的协同效果最佳。进一步,以该协同浓度处理神经胶质瘤细胞U87和U251细胞。克隆平板、流式细胞术、划痕实验以及transwell小室实验分析发现,5 mmol·L-1的VC与15 mmol·L-1的DCA能够协同减少神经胶质瘤细胞U251和U87的克隆形成、迁移和侵袭能力,并明显诱导细胞活性氧含量的增加,细胞凋亡和G1期阻滞。此外,皮下成瘤实验表明,5 mmol·L-1的VC与15 mmol·L-1的DCA能够明显抑制神经胶质瘤细胞U251体内的增殖。这些证据均表明,DCA和VC联合可能是抑制神经胶质瘤细胞恶性行为的一种有效治疗策略。
网络药理学是通过生物信息学手段,预测及模拟药物分子与靶蛋白之间的相互作用,为分子的作用提供间接或直接证据。为探究DCA和VC是如何发挥协同机制的,本研究基于DCA和VC的药效团进行网络药理学分析,发现DCA有36个潜在作用靶点,VC可能有9个潜在作用靶点。两者取交集得到7个共同靶点,其中包括BCL2A1、CDC25A和S1PR2等。进一步生物信息学发现,高表达BCL2A1和CDC25A的神经胶质瘤患者总体生存率较低。BCL2A1是BCL-2家族的一个抗凋亡成员,半衰期较短,这限制了其固有的促生存活性,这一特征与它的两个近亲MCL-1和BCL-B相同。有文献报道,降解BCL2A1可促进细胞内Cytochrome C的增加和释放,进而诱导肿瘤细胞的凋亡。CDC25A是CDC25磷酸酶家族的一员,可以调控周期蛋白CDK4/CDK6复合物,从而调节细胞周期进程[15]。CDC25A的表达在多种肿瘤中表达升高,如神经胶质瘤等[16]。此外,研究发现,CDC25A能够通过活化多个信号通路如FAK和AKT等促进肿瘤细胞的迁移和侵袭[17]。
为探究DCA与VC的协同机制是否与抑制BCL2A1和CDC25A相关,本研究进行了Western blot实验,结果发现,DCA能够协同VC抑制BCL2A1和CDC25A的表达,并减少CDC25A下游CDK4和CDK6的表达。CDK4/CDK6是细胞通过G1期检查点必要的蛋白,该实验结果与流式细胞术G1期阻滞结果一致。此外,BCL2A1下游的Cytochrome C和cleave-caspase-7在联合处理后也明显增加。已有研究表明,药物与靶点蛋白直接结合后,可仅影响蛋白的修饰水平(不影响表达),也可能会影响蛋白的构象改变,进而影响蛋白降解[18]。进一步,为证实VC和DCA是否具有直接影响BCL2A1和CDC25A的作用,我们以CHX抑制U87和U251细胞中的蛋白合成,发现,VC和DCA均能促进BCL2A1和CDC25A的降解率,两者联合诱导蛋白降解的效果更加明显。结果提示,DCA和VC可能是协同促进BCL2A1和CDC25A的降解,发挥其作用的。
综上所述,VC能够协同DCA促进BCL2A1和CDC25A的降解,抑制神经胶质瘤细胞的恶性行为。VC联合DCA可能是神经胶质瘤治疗的一种可行策略。
