芍药内酯苷对人卵巢癌多药耐药的逆转作用
2023-02-06郭晓娟杜瑞娟费庆林郭克磊
韩 立,郭晓娟,杜瑞娟,陈 怡,费庆林,郭克磊,卞 华
(1.南阳理工学院张仲景国医国药学院,2.南阳理工学院,河南省张仲景方药与免疫调节重点实验室,河南 南阳 473004)
卵巢癌是妇科死亡率最高的恶性肿瘤,以上皮性卵巢癌居多[1]。外科手术结合基于铂类的化疗或者不宜手术的患者直接进行化疗是目前卵巢癌的治疗方式。然而,化疗导致的肿瘤多药耐药性(multidrug resistance,MDR)始终是临床肿瘤治疗难以逾越的障碍。
MYC(也称为c-myc)是编码转录因子的调节基因或原癌基因家族第一个发现的基因,该基因家族还包括l-myc(MYCL)和n-myc(MYCN)。MYC高表达可促进卵巢癌的发展、浸润和转移,并与CDK4/6抑制剂单药治疗复发性卵巢癌的临床疗效差密切相关[2]。此外,MYC可通过直接与程序性死亡蛋白-1(programmed death 1,PD-1)启动子结合而调控其表达,MYC激活可促进PD-1表达,抑制MYC则抑制PD-1表达,增强肿瘤对抗PD1免疫治疗的敏感性,表明MYC本身可作为抗肿瘤治疗的一个重要靶点[3]。WW结构域E3泛素连接酶1(WW domain-containing ubiquitin E3 ligase 1,WWP1)高表达与卵巢癌预后差密切相关[4]。有研究表明,MYC通过直接靶向WWP1,促进肿瘤MDR[5]。因此,靶向MYC和WWP1开发逆转MDR药物对于临床肿瘤的治疗具有重要意义。
芍药内酯苷(albiflorin,AL)是芍药、牡丹皮等中药的活性成分之一,具有治疗认知功能障碍和镇痛等作用[6-7]。有研究发现,AL对肝癌HepG2细胞增殖和侵袭有抑制作用[8]。此外,AL可抑制药物跨膜转运模型细胞MDCK-MDR1中ATP结合盒亚家族B成员1(ATP-binding cassette subfamily B member 1,ABCB1)编码的泵药蛋白P-糖蛋白( P-glycoprotein,P-gp)表达[9],具有潜在的肿瘤耐药逆转作用。因此,本研究旨在探讨AL对卵巢癌的耐药逆转作用及其对MYC、WWP1的影响,为AL开发作为肿瘤耐药逆转剂提供依据。
1 材料与方法
1.1 药物注射用顺铂(20mg,8L012A88),齐鲁制药有限公司;MYC抑制剂MYCi975(纯度98.95%,S8906),美国Selleck Chemicals公司;芍药内酯苷(纯度≥98.0%,HY-N0037),美国MCE公司。
1.2 主要试剂与仪器SPARKeasy 总RNA快速提取试剂盒(AC0205,山东思科捷生物技术有限公司),RevertAid First Strand cDNA Synthesis 试剂盒(K1662,美国Thermo Fisher),QuantiNova SYBR Green PCR 试剂盒(208054,美国QIAGEN),MinuteTM总蛋白提取试剂盒(SN001,美国Invent Biotechnologies公司),HRP直标GAPDH鼠单抗(HRP-60004,PROTEINTECH),Pierce Rapid Gold BCA蛋白浓度检测试剂盒(A53225,美国Thermo Fisher),Kemix速溶快速封闭颗粒(KSF0101)、ECL超敏化学发光试剂盒(KE0102-100,密码子(中国)生物科技公司),优级胎牛血清(CTCC-002-001)、RPMI1640培养基(CTCC-002-006,浙江美森细胞科技有限公司),罗丹明123(R8004,Sigma公司),CCK-8试剂盒(BS350B,兰杰柯科技有限公司),MYC兔单抗(ab32072)、WWP1兔多抗(ab43791)、P-gp兔单抗(EPR10364-57,Abcam公司),HRP标记羊抗兔二抗(5220-0336,美国KPL)。实时荧光定量PCR仪(ABI ViiA7,赛默飞世尔公司),流式细胞仪(FACSCelesta,BD公司),凝胶化学发光成像系统(Tanon-5200,上海天能公司),全功能酶标仪(Synergy H1,美国BioTek公司)。
1.3 细胞培养和MYC敲低细胞株构建293T细胞、人卵巢癌顺铂敏感SKOV3细胞及其耐顺铂SKOV3/DDP细胞购自浙江美森细胞科技有限公司,于37 ℃、5% CO2条件下培养在含10%胎牛血清、链霉素和青霉素各100 kU·L-1的RPMI 1640培养基中。SKOV3/DDP细胞在培养过程中加入2 μmol·L-1的顺铂维持耐药性。细胞每3 ~4 d胰蛋白酶消化传代1次。
设计合成靶向MYC的ShRNA序列(如Tab 1所示)克隆入pLKO.1载体,挑选阳性克隆测序验证后,感染293T细胞,用puromycin筛选基因组稳定整合靶向MYC-shRNA序列的细胞。继续培养293T细胞48 h,收集含有慢病毒颗粒的上清液。采用收集的上清液转染至SKOV3/DDP细胞,继续用puromycin筛选,构建MYC稳定敲低的shMYC-SKOV3/DDP细胞株。收取部分细胞提取总RNA和蛋白,验证MYC敲低效果。
1.4 细胞毒性检测取对数生长期的SKOV3/DDP和SKOV3细胞,以及shMYC-SKOV3/DDP细胞,分别接种96孔板,每孔100 μL,含5 000个细胞。对于AL单用的细胞毒性检测,细胞贴壁后加入不同浓度AL,溶剂加入含细胞孔作为阴性对照,无细胞培养基作为背景对照。AL的耐药逆转作用检测分组为:各孔加入不同浓度的顺铂,或者AL联用顺铂。同时增加MYC抑制剂MYCi975单用或联用顺铂组。各组细胞48 h后加入10 μL CCK-8,继续孵育2 h。酶标仪检测450nm处每孔吸光度值(A),各孔吸光度值减去背景值,计算细胞存活率,细胞存活率/%=(A实验-A背景)/(A对照-A背景)×100%。根据细胞存活率计算顺铂或者AL联用顺铂的半数抑制浓度(median inhibitory concentration,IC50)。
1.5 P-gp功能检测取对数生长期的SKOV3/DDP细胞,分为AL 25、50、100 μmol·L-1组,并设空白对照和阳性对照MYCi975组。另取shMYC-SKOV3/DDP细胞,比较其与SKOV3/DDP细胞P-gp功能的差异。细胞处理48 h后,胰酶消化并加入终浓度为0.5 mg·L-1的罗丹明123(rhodamine 123,Rho123)。在细胞培养环境下继续孵育60 min,冰PBS洗涤3次后,重悬于0.5 mL冰 PBS中,立即采用流式细胞仪检测。FACS Diva软件分析罗丹明123的平均荧光强度(mean fluorescence intensity,MFI)。
1.6 芍药内酯苷对SKOV3/DDP耐药相关基因表达的影响取对数生长期的SKOV3/DDP细胞,接种于12孔板,药物分组和培养条件同1.5。加药孵育48 h后,按照总RNA快速提取试剂盒说明书提取总RNA,逆转录合成cDNA,采用荧光定量PCR扩增各目的基因,引物序列如Tab 1所示。以GAPDH为内参基因,采用2-△△Ct法计算各药物处理组MYC、WWP1和MDR1 mRNA相对于对照组表达量的变化,其中ΔΔCt=(Ct目标基因- Ct内参基因)处理组-(Ct目标基因- Ct内参基因)对照组。

Tab 1 shRNA sequence for MYC and primers for MYC,WWP1,MDR1 and GAPDH
1.7 芍药内酯苷对SKOV3/DDP耐药相关蛋白表达的影响SKOV3/DDP细胞处理和分组同“1.5”,孵育48 h后,弃去培养基,蛋白裂解液裂解细胞,BCA法测定蛋白浓度。SDS-PAGE电泳后转至PVDF膜。Kemix快速封闭液封闭,加入MYC、WWP1、P-gp蛋白一抗,室温孵育2 h,洗膜后加入对应HRP标记兔二抗室温孵育2 h,在凝胶成像分析系统中进行化学发光显影。HRP直标GAPDH鼠单抗直接孵育2 h,化学发光检测GAPDH条带。ImageJ软件分析成像蛋白条带,以目的蛋白条带灰度值/GAPDH蛋白条带灰度值计算各条带相对比值,以各药物处理组相对比值除以空白对照组相对比值计算蛋白相对表达量。
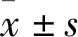
2 结果
2.1 芍药内酯苷对SKOV3和SKOV3/DDP 细胞存活率的影响Fig 1结果显示,25、50和100 μmol·L-1AL作用于SKOV3和SKOV3/DDP细胞48 h,对两种细胞的毒性均较低。25 μmol·L-1AL处理后,两种细胞的存活率均在90%以上。因此,该浓度作为后续耐药逆转试验的联合用药浓度。

Fig 1 Effect of albiflorin on survival rate of SKOV3 and
2.2 芍药内酯苷对 SKOV3/DDP 细胞的耐药逆转作用Tab 2结果显示,shMYC-SKOV3/DDP细胞对顺铂的IC50为(5.74±0.26) mg·L-1,与SKOV3/DDP细胞相比明显下降,提示敲低MYC可以逆转SKOV3/DDP细胞的耐药性。8 μmol·L-1MYCi975联用顺铂后,顺铂对SKOV3和SKOV3/DDP细胞的IC50均明显下降,提示其可能兼具抗肿瘤和逆转肿瘤耐药作用。SKOV3/DDP细胞经25 μmol·L-1AL联用顺铂处理后,对顺铂的IC50从(14.46±0.44) mg·L-1降为(4.92±0.19) mg·L-1,表明其具有耐药逆转作用。

Tab 2 Effects of albiflorin on SKOV3/DDP cell
2.3 芍药内酯苷对P-gp功能的抑制作用Fig 2 A和C结果显示,与正常SKOV3/DDP细胞相比,shMYC-SKOV3/DDP细胞峰右移,MFI增加,表明敲低MYC可抑制P-gp功能。Fig 2 B和D结果显示,SKOV3/DDP细胞经AL处理后,随着AL浓度增加,峰逐渐右移,MFI逐渐增加,提示AL对P-gp功能的抑制具有浓度依赖性(P<0.01)。MYCi975抑制P-gp功能作用强于AL 50 μmol·L-1组,弱于AL 100 μmol·L-1组。

Fig 2 P-gp function changes after SKOV3/DDP cells knocked-down MYC or treated with different A:Histogram Overlay of SKOV3/DDP and shMYC-SKOV3/DDP cells treated with Rho123;B:Histogram Overlay of SKOV3/DDP cells treated with albiflorin and Rho123;C:Comparison of Rho123 MFI in SKOV3/DDP and shMYC-SKOV3/DDP cells;D:Comparison of Rho123 MFI in SKOV3/DDP cells treated with albiflorin.##P<0.01 vs SKOV3/DDP group,**P<0.01 vs control group,ΔΔP<0.01 vs AL 100 μmol·L-1 group.
2.4 芍药内酯苷对ABCB1、MYC和WWP1基因表达的影响Fig 3结果显示,与正常SKOV3/DDP细胞相比,MYC敲低后,shMYC-SKOV3/DDP细胞中MYC、WWP1和ABCB1 mRNA均明显下调(P<0.01),提示敲低shMYC-SKOV3/DDP细胞对顺铂的敏感性增加可能与抑制MYC、WWP1和ABCB1 mRNA表达有关。SKOV3/DDP细胞中MYC、WWP1和ABCB1 mRNA表达随AL浓度增加而下降(P<0.05,P<0.01),100 μmol·L-1AL组对ABCB1和WWP1 mRNA的抑制作用与MYCi975相当(P>0.05)。
2.5 芍药内酯苷对P-gp、MYC和WWP1蛋白表达的影响Fig 4 结果显示,与正常SKOV3/DDP细胞相比,MYC敲低后,shMYC-SKOV3/DDP细胞中MYC、WWP1和P-gp蛋白表达几乎完全被抑制,提示敲低MYC后,shMYC-SKOV3/DDP细胞对顺铂的敏感性增加可能与抑制MYC、WWP1、和P-gp蛋白表达有关。SKOV3/DDP细胞中,随着AL浓度增高,对MYC、WWP1和P-gp蛋白表达的抑制作用逐渐增强。100 μmol·L-1AL组对ABCB1、WWP1 和MYC蛋白的抑制作用与MYCi975相当。
3 讨论
铂类药物用于卵巢癌化疗已有40多年历史,至今仍是卵巢癌的一线治疗药物之一,显示了铂类药物抗肿瘤的临床有效性,但MDR的产生限制了其疗效。肿瘤对铂类耐药的机制较多,例如泵药蛋白增加导致瘤细胞内药物浓度下降、瘤细胞对DNA损伤的修复能力增强等,不同的耐药机制又彼此影响,增加了MDR的复杂性。其中,P-gp是重要的泵药蛋白之一,其高表达亦是卵巢癌对铂类药物耐药的重要原因[10]。自从上个世纪七十年代发现P-gp以来,研究人员一直没有停止以P-gp为靶点开发逆转肿瘤MDR的药物,但至今仍无一种P-gp抑制剂批准用于临床,这些药物大多因人体毒性或临床疗效不理想而止步于临床试验阶段[11]。因此,探寻P-gp表达增高,导致MDR的深层机制和/或开发高效、低毒的抑制剂一直是科研人员努力的方向。
从包括中药在内的天然产物中筛选低毒性、多靶点和具有良好耐受性的MDR逆转剂逐渐成为研究重点和热点。作为一种来源于中药的天然成分,AL以超过临床3 000倍的剂量给予比格犬,未引起任何明显的毒性反应,证明其具有极高的安全性[12]。AL治疗认知功能障碍、镇痛、抗癌等作用与其调控p38 MAPK、AKT、NF-kB 等信号通路有关,表明其药理作用具有多通路、多靶点调控特点[6-8]。我们前期研究发现,方中包括芍药的桂枝茯苓丸可通过抑制PI3K/AKT通路、异黏蛋白(metadherin,MTDH)和诱导PTEN表达逆转卵巢癌MDR[13-14],本课题研究AL逆转卵巢癌MDR的作用机制,旨在为桂枝茯苓丸逆转MDR进一步提供实验基础。

Fig 3 Effect of albiflorin on ABCB1,MYC and WWP1 mRNA expression The relative mRNA level for ABCB1,MYC and WWP1 in SKOV3/DDP and shMYC-SKOV3/DDP cells;B,C and D.The relative mRNA levels of ABCB1,MYC and WWP1 in SKOV3/DDP cells treated with albiflorin.##P<0.01 vs SKOV3/DDP group;*P<0.05,**P<0.01 vs control group,ΔΔP<0.01 vs AL 100 μmol·L-1 group.

Fig 4 Effect of albiflorin on P-gp,MYC and WWP1 protein expression A:Western blot results for P-gp,MYC and WWP1 in SKOV3/DDP and shMYC-SKOV3/DDP cells;B:Western blot results for P-gp,MYC and WWP1 in SKOV3/DDP cells treated with albiflorin;C,D and E:The relative protein expressions levels of P-gp,MYC and WWP1 in SKOV3/DDP cells treated with albiflorin.*P<0.05,**P<0.01 vs control group.
MYC是调控P-gp表达的一个上游靶点,可能通过多种途径调控P-gp表达。E3 泛素连接酶在泛素化级联的最后一步发挥关键作用,通过特异性结合底物蛋白来确定哪种蛋白质被泛素化。WWP1是一种是HECT(homologous to E6AP C-terminus)类E3泛素连接酶,是一个重要的抗肿瘤药物作用靶点[15]。MYC高表达直接上调其靶基因WWP1表达,促进磷酸酶和张力蛋白类似物(phosphatase and tensin homolog,PTEN)多聚泛素化,从而抑制PTEN的二聚化、膜募集和肿瘤抑制功能,进一步激活PI3K/AKT通路,调控P-gp,促进肿瘤MDR[5]。另有研究表明,核内小RNA宿主基因12(small nucleolar RNA host gene 12,SNHG12)亦是MYC的靶基因,MYC抑制SNHG12表达,进而抑制P-gp表达,增强鼻型NK/T细胞淋巴瘤细胞对顺铂的敏感性[16]。
MYCi975是特异性MYC抑制剂,8 μmol·L-1即可明显抑制MYC的表达[17],因此本研究中选择此浓度作为MYC抑制的阳性对照浓度。Rho123是经典P-gp底物,用于P-gp功能评估,在本研究中作为P-gp功能指示剂[18]。本研究发现,AL联用顺铂可明显降低SKOV3/DDP细胞的耐药性,减弱P-gp的泵药作用。同时,采用shRNA敲低MYC表达后,SKOV3/DDP细胞的耐药性下降,P-gp泵药作用同时减弱。经比较,AL的耐药逆转和对P-gp功能的抑制作用与MYCi975抑制和MYC敲低效果均类似。为进一步探讨AL逆转耐药的机制,考察了AL对ABCB1/P-gp、MYC和WWP1基因和蛋白表达的影响。结果发现,AL可明显抑制ABCB1/P-gp、MYC和WWP1基因和蛋白表达。AL对这些基因的抑制作用同样与MYCi975抑制和MYC敲低效果类似。这些结果表明,AL对SKOV3/DDP细胞的耐药逆转作用与减弱P-gp功能,抑制ABCB1/P-gp、MYC和WWP1基因和蛋白表达有关。值得注意的是,中晚期肿瘤患者多受癌痛折磨,AL本身具有镇痛作用[6],其作为化疗辅助用药在逆转肿瘤耐药性,降低化疗药物剂量的同时,预期可以减轻患者的痛苦。
本研究为AL作为耐药逆转剂用于卵巢癌的治疗提供了实验基础,同时对于肿瘤耐药逆转剂的开发提供了一种潜在的新策略,对临床肿瘤的治疗具有重要意义。然而,25 μmol·L-1AL联用顺铂的逆转耐药作用虽然与8 μmol·L-1MYCi975联用顺铂的作用相近,但前者对ABCB1/P-gp、MYC和WWP1以及P-gp功能的抑制作用明显弱于后者,提示AL可能还有其他潜在的逆转耐药调控机制,有待进一步研究验证。
