LncRNA UNC5B-AS1通过调控Toll样受体信号通路对宫颈癌细胞增殖及上皮间质转化的影响
2023-02-06唐永曜李照东李海玉宋方洲
蔡 璟,何 敏,宋 晶,唐永曜,李照东,李海玉,宋方洲
(重庆医科大学1.基础医学院、2.附属第一医院,重庆 400016)
宫颈癌是一种高发的恶性肿瘤,其发病率和死亡率位列全球女性肿瘤第四位[1]。目前,Ⅲ期、Ⅳ期宫颈癌患者预后差,开发潜在的治疗靶点和预后判断生物标志物至关重要[2]。长链非编码RNA(long non-coding RNA,lncRNA)是一种组织细胞特异性高、无编码功能的RNA片段[2]。LncRNA常在肿瘤中表达失调,在不同种类癌症中,lncRNA失调与肿瘤预后、转移和复发密切相关[3]。研究表明,lncRNA可以作为肿瘤抑制基因或促肿瘤基因参与宫颈癌细胞的生长、分化、迁移、侵袭和凋亡,同时影响宫颈癌的发生发展和治疗[4]。因此,深入研究lncRNA与宫颈癌之间的关系,对于促进宫颈癌的临床诊断和有效治疗具有重要意义。LncRNA UNC5B-AS1位于基因组区域10q22.1,包含2个外显子。2019年,研究发现lncRNA UNC5B-AS1在甲状腺乳头状癌中表达水平相对较高,具有致癌活性[5]。2020年,另一项研究发现UNC5B-AS1在前列腺癌和卵巢癌中的高表达水平[6]。本研究通过生物信息学分析及qRT-PCR实验结果证实,相比正常宫颈组织,lncRNA UNC5B-AS1在宫颈癌组织中表达明显升高,拟探索lncRNA UNC5B-AS1在宫颈癌发生中的生物学功能。
1 材料与方法
1.1 临床样本2018~2019年,我们收集重庆医科大学第一附属医院19例宫颈癌组织和23例正常宫颈组织,患者术前均未接受过放疗或化疗等。所有参与者已签署书面知情同意书。本研究方案经重庆医科大学伦理委员会批准(许可证号:2020008),遵循赫尔辛基宣言的原则。
1.2 主要试剂人源宫颈癌细胞株HeLa、CaSki、SiHa(ATCC细胞库);LncRNA UNC5B-AS1干扰载体si-UNC5B-AS1及其阴性对照组si-NC和过表达载体pcDNA3.1-UNC5B-AS1及其空载对照组质粒pcDNA3.1[生工生物工程(上海)有限公司];PCR引物(北京擎科生物科技有限公司)。DMEM培养基、1640培养基及胎牛血清(美国Gibco公司);转染试剂siRNA-Mate(上海吉玛公司);TRIzol试剂及Lipofectamine 2000转染试剂(美国Invitrogen公司);Eastep Super总RNA提取试剂盒(美国Promega公司);Prime Script RT Reagent Kit with gDNA Eraser及SYBR Premix Ex Taq II(日本TaKaRa公司);CCK-8试剂、EdU细胞增殖检测试剂盒BeyoClick EdU-488(上海碧云天公司);BCA蛋白测定试剂盒(美国Thermo Fisher公司);PVDF膜及ECL试剂盒(美国Merck Millipore公司);抗体E-Cadherin、TICAM2、IL-6、酶标亲和纯山羊抗兔IgG和酶标亲和纯山羊抗小鼠IgG(美国Proteintch公司);抗体N-Cadherin、Vimentin及β-actin(美国Bimake公司)。
1.3 主要仪器多功能酶标仪(瑞士Tecan公司);荧光定量PCR仪(瑞士Roche公司);凝胶成像仪、化学发光成像系统(广州光仪公司);倒置显微镜(日本尼康公司)。
1.4 从GEO和TCGA数据库中筛选差异表达lncRNA自GEO数据库中下载数据集GSE63514(GPL570)(检测平台Affymetrix Human Genome U133 Plus 2.0 Arry)。应用GEO2R在线工具根据|LogFC|>2和P<0.05的阈值筛选差异表达基因。从TCGA数据库中下载对应患者宫颈癌RNA表达谱数据,收集患者特征,包括性别、肿瘤分级、TNM分期等,在TCGA数据库中,使用limma包根据|LogFC|>1和FDR<0.05的阈值筛选差异表达基因。将GEO和TCGA筛选的差异lncRNA作交集,寻找存在于两个数据库的差异表达基因。
1.6 细胞培养及细胞转染使用DMEM培养基培养HeLa细胞及SiHa细胞,使用1640培养基培养CaSki细胞。所有细胞在CO2浓度为5%,温度 37 ℃ 的孵育箱中生长。取对数期生长的HeLa、CaSki及SiHa细胞株接种至6孔板,培养过夜。使用siRNA-Mate转染试剂将si-UNC5B-AS1和阴性对照si-NC转染至HeLa及CaSki细胞中;使用Lipofectamine 2000转染试剂将过表达质粒pcDN3.1+UNC5B-AS1及空载对照组质粒pcDNA3.1转染至HeLa及SiHa细胞。48 h后,通过qRT-PCR检测细胞中lncRNA UNC5B-AS1表达水平以验证转染效果。LncRNA UNC5B-AS1的siRNA序列见Tab 1。

Tab 1 Sequence of si-RNA
1.7 提取RNA,进行qRT-PCR使用TRIzol 试剂提取组织总RNA,使用Eastep Super总RNA提取试剂盒提取细胞总RNA,使用Prime Script RT Reagent Kit with gDNA Eraser逆转录合成cDNA,使用SYBR Premix Ex Taq II进行qRT-PCR。所有操作严格按照试剂盒说明书执行。PCR引物序列见Tab 2。
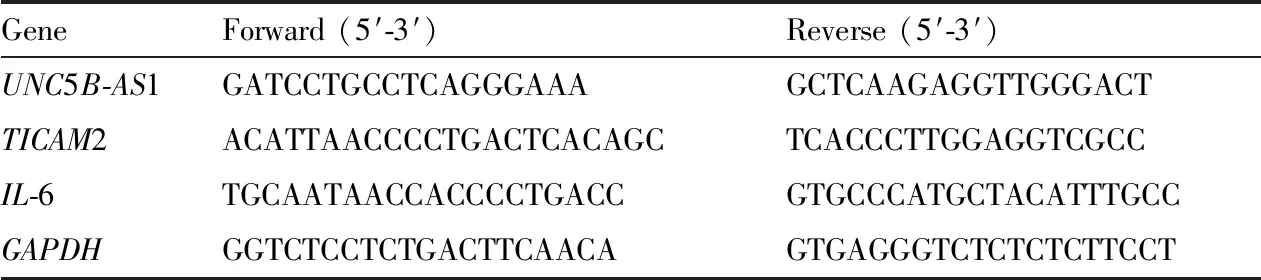
Tab 2 Primer sequences for qRT-PCR
1.8 平板克隆实验检测细胞增殖细胞转染24 h后,消化、收集细胞并将细胞铺至6孔板,每孔加入约800个细胞,4 mL完全培养基,显微镜下观察呈单细胞悬液状态。放置于37 ℃、5% CO2培养箱中培养两周。每隔24 h观察细胞状态,出现克隆即弃去培养基。使用PBS洗涤细胞3次,使用4%多聚甲醛固定20 min,0.25%结晶紫染色20 min后即可观察到克隆。
1.9 CCK-8检测细胞增殖活性转染细胞24 h后,消化及收集细胞,置于96孔板中,每孔加入大约1 000个细胞及100 μL培养液。然后加入10 μL CCK-8试剂,并在指定时间点:0、24、48、72、96 h各孵育1 h。最后,通过MultiskanTMFC酶标仪测量宫颈癌细胞在450 nm波长的吸光度值(OD),汇总每个时间段测量的吸光度值并制作线性图。
1.10 EdU实验检测细胞增殖转染细胞24 h后,消化并收集细胞,置于96孔板中,每孔加入大约8 000个细胞及200 μL培养基。于37 ℃、5% CO2孵育24 h后,配制EdU工作液并加入96孔板中,于室温孵育细胞2 h。最后加入EdU细胞增殖检测试剂盒BeyoClick EdU-488反应液,在倒置荧光显微镜下拍照计数。
1.11 Transwell实验检测细胞迁移和侵袭待细胞转染24 h后,胰酶消化细胞后使用无血清培养基收集细胞。迁移细胞密度为2×105/孔,侵袭细胞密度为2.5×105/孔。将小室置于培养板中,上室加入200 μL细胞悬液,下室加入600 μL含20%血清的完全培养基,确保下室培养液和小室间无气泡。于37 ℃、5% CO2培养箱中培养48 h后,使用PBS洗涤并加入4%多聚甲醛固定20 min,再次使用PBS洗涤细胞,在倒置荧光显微镜下拍照计数。
1.12 转录组RNA测序使用RNA TRIzol试剂分别提取si-NC-HeLa和si-UNC5B-AS1-HeLa的RNA,然后由生工生物工程(上海)有限公司进行转录组测序并分析。所有样品均符合质量控制标准。
1.13 Western blotWestern blot采用标准SDS-PAGE。使用含有1%苯基甲烷磺酰氟的RIPA裂解缓冲液将细胞充分裂解,使用刮棒刮取细胞,于4 ℃下12 000 r·min-1离心5 min得到细胞总蛋白。采用BCA蛋白测定试剂盒检测蛋白浓度,蛋白样品在100 ℃煮沸10 min,在SDS-PAGE凝胶上分离后转移至PVDF膜上。使用脱脂牛奶常温封膜2 h,使用TBST将一抗稀释至适当浓度并于4 ℃孵育PVDF膜过夜。24 h后,使用TBST稀释二抗室温下与PVDF膜共孵育1 h,将膜蛋白面朝下与ECL试剂盒中A、B混合液充分接触后放入化学发光仪内进行发光显影。使用的一抗为E-Cadherin(1 ∶1 000)、N-Cadherin(1 ∶1 000)、Vimentin(1 ∶1 000)、TICAM2(1 ∶1 000)、IL-6(1 ∶5 000)、β-actin(1 ∶2 000)。山羊抗兔IgG(1 ∶5 000)和山羊抗小鼠IgG(1 ∶5 000)作为二抗。
在2022年冬奥会申办之前,我国奥委会就积极响应国家相关政策,大力推广冰雪项目,例如,冰雪阳光体育、北冰南展西扩以及百万青少年上冰雪等。在2022年冬奥会申办成功之后,我国奥委会就加快了北冰南展的进程,让国内更多的人们体验到冰雪运动带来的快乐,这些举措都有利于大众冰雪运动在我国的普及。随着我国社会经济的迅猛发展,人们的思想观念也在发生着变化,他们不仅追求物质发展,更注重精神的感受,所以,向人们普及大众冰雪运动很有必要,同时要不断引导人们参与到体育活动中来。
1.14 数据分析采用SPSS 20.0软件进行t检验和单因素方差分析,P<0.05为差异有统计学意义。
2 结果
2.1 从GEO和TCGA数据库筛选差异表达lncRNA UNC5B-AS1GEO数据库中数据集GSE63514(GPL570)筛选得到599个差异基因,包括177个上调基因和422个下调基因(Fig 1A)。
TCGA数据库中宫颈癌RNA表达谱数据提示宫颈癌患者中位年龄为46岁。Ⅰ期患者167例(52.68%),Ⅱ期患者72例(22.71%),Ⅲ期患者49例(15.46%),约2/3患者(n=272)有淋巴结转移等特征。将GEO和TCGA筛选的差异lncRNA取交集得到15个共差异表达lncRNA(Fig 1B),其中lncRNA UNC5B-AS1在宫颈癌组织中相对正常宫颈组织表达上调。
2.2 LncRNA UNC5B-AS1在不同组织和细胞系的表达水平LncRNA UNC5B-AS1在宫颈癌组织中表达水平明显高于正常组织(Fig 2A)。与HeLa及SiHa细胞相比,lncRNA UNC5B-AS1在CaSki细胞中的表达量相对较高(Fig 2B)。同时,GEPIA网站查询结果与组织验证结果一致(Fig 2C)。Kaplan-Meier曲线和对数秩检验分析提示,lncRNA UNC5B-AS1基因水平升高明显影响宫颈癌患者总生存时间(overall survival,OS),P<0.05(Fig 2D)。
2.3 检测敲低及过表达lncRNA UNC5B-AS1在不同宫颈癌细胞系的效果在HeLa和CaSki细胞株中转染si-UNC5B-AS1后,si-UNC5B-AS1组中lncRNA UNC5B-AS1表达量明显降低(Fig 3A),表明si-UNC5B-AS1转染成功。在lncRNA UNC5B-AS1的过表达模型中,lncRNA UNC5B-AS1表达量在SiHa和HeLa中明显升高(Fig 3B),表明pcDNA3.1+UNC5B-AS1转染成功。
2.4 LncRNA UNC5B-AS1对宫颈癌细胞活力的影响CCK-8检测结果提示,lncRNA UNC5B-AS1敲低显著抑制HeLa细胞(Fig 4A)和CaSki细胞(Fig 4B)的活力,同时lncRNA UNC5B-AS1过表达明显增强SiHa细胞(Fig 4C)和HeLa细胞(Fig 4D)细胞活力。
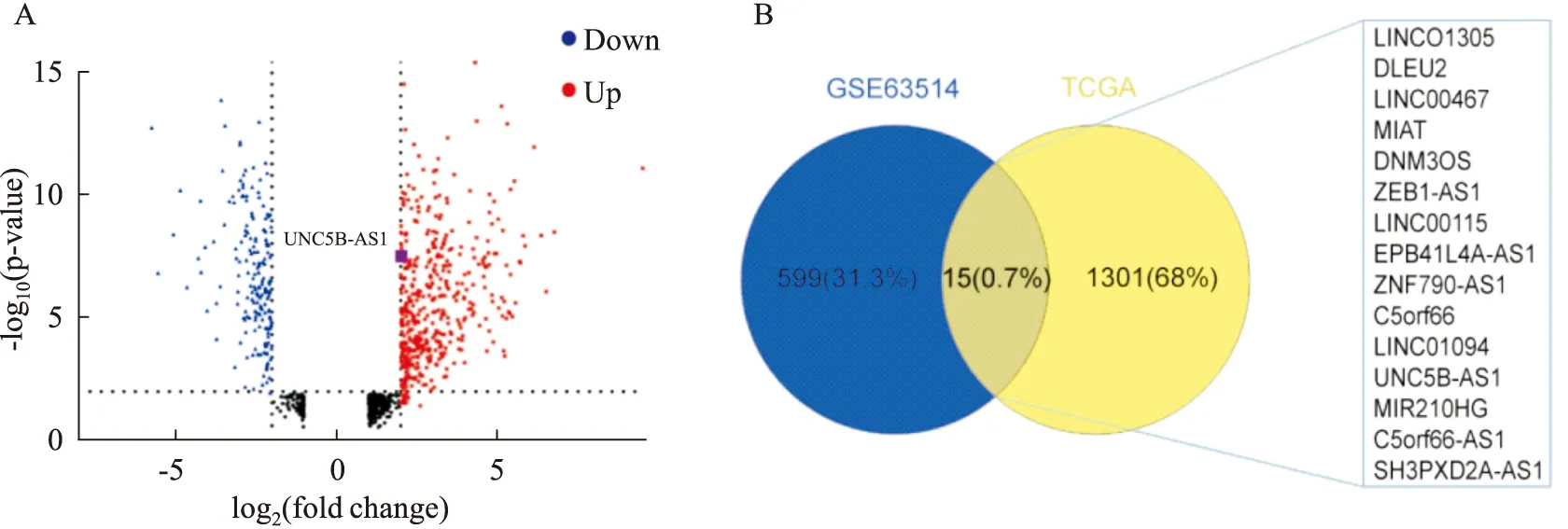
Fig 1 Differentially expressed genes screened from databaseA:Volcano plot indicated the number of different expression genes recognized from GSE63514;B:The intersection of lncRNAs in GSE63514 and TCGA databases.

Fig 2 Relatively higher expression of lncRNA UNC5B-AS1 in cervical cancer tissues and cellsA:The expression level of lncRNA UNC5B-AS1 was relatively higher in cervical cancer tissues;B:LncRNA UNC5B-AS1 was expressed in three cervical cancer cells lines;C:GEPIA was used to demonstrated the higher expression level of lncRNA UNC5B-AS1 in cervical cancer tissues rather than in normal tissues;D:GEPIA demonstrated lncRNA UNC5B-AS1 affected the overall survival(OS)of cervical cancer patients.*P<0.05 vs normal.

Fig 3 The transfection effect of lncRNA UNC5B-AS1 in cervical cancer cellsA:The expression of lncRNA UNC5B-AS1 was obviously down-regulated in HeLa and CaSki cells transfected with si-UNC5B-AS1;B:The expression of lncRNA UNC5B-AS1 was obviously up-regulated in SiHa and HeLa cells transfected with pcDNA3.1+UNC5B-AS1.**P<0.01 vs Control group.

Fig 4 The cell growth ability detected by CCK-8 assayA:Silencing lncRNA UNC5B-AS1 caused the inhibition of HeLa growth;B:Silencing lncRNA UNC5B-AS1 caused the inhibition of CaSki growth;C:Overexpression of lncRNA UNC5B-AS1 caused the increase of SiHa growth;D:Overexpression of lncRNA UNC5B-AS1 caused the increase of HeLa growth.*P<0.05,**P<0.01 vs Control group.
2.5 LncRNA UNC5B-AS1对宫颈癌细胞克隆形成能力的影响通过克隆形成实验及EdU实验检测lncRNA UNC5B-AS1对宫颈癌细胞增殖能力的影响。在克隆形成实验中,lncRNA UNC5B-AS1敲低后,HeLa、CaSki细胞集落数量明显少于阴性对照组细胞数量(Fig 5A),而lncRNA UNC5B-AS1过表达的SiHa和HeLa细胞集落数量明显大于阴性对照组(Fig 5B)。EdU实验证实,敲低lncRNA UNC5B-AS1后细胞增殖明显少于阴性对照组(Fig 5C),而过表达lncRNA UNC5B-AS1细胞增殖明显高于阴性对照组(Fig 5D)。综上所述,lncRNA UNC5B-AS1能调控宫颈癌细胞增殖能力。
2.6 LncRNA UNC5B-AS1对宫颈癌迁移、侵袭能力的影响迁移及侵袭实验表明,与HeLa细胞和CaSki细胞阴性对照组相比,下调lncRNA UNC5B-AS1可显著抑制HeLa细胞(Fig 6A)及CaSki细胞(Fig 6B)迁移、侵袭能力。同时,过表达lncRNA UNC5B-AS1能明显促进SiHa细胞(Fig 6C)和HeLa细胞(Fig 6D)的迁移、侵袭能力。
2.7 LncRNA UNC5B-AS1对宫颈癌细胞上皮间质转化的影响上皮间质转化(epithelial-mesenchymal transition,EMT)与肿瘤细胞迁移及侵袭能力相关。Western blot分析提示,在HeLa和CaSki细胞中敲除lncRNA UNC5B-AS1后,上皮细胞标志物E-Cadherin的表达明显升高,同时导致两种间质标记物N-Cadherin和Vimentin的表达下降(Fig 7A),统计学分析结果如Fig 7C所示。过表达lncRNA UNC5B-AS1使SiHa和HeLa细胞中E-Cadherin的表达明显下降,而N-Cadherin和Vimentin的表达升高(Fig 7B),统计学分析结果如Fig 7D所示。实验结果证实,lncRNA UNC5B-AS1能调控宫颈癌细胞EMT能力。
2.8 转录组测序结果RNA测序共获得31个差异表达基因,包括17个上调基因和14个下调基因(Fig 8A)。KEGG分析提示,差异基因主要富集于Toll样受体(Toll-like receptor,TLR)信号通路、Jak-STAT信号通路、TNF信号通路等(Fig 8B)。其中IL-6、TICAM2明显富集到TLR信号通路(Fig 8C)。
2.9 LncRNA UNC5B-AS1对宫颈癌细胞TLR信号通路的影响LncRNA UNC5B-AS1敲低组中IL-6表达上调而TICAM2表达下调。qRT-PCR实验结果提示IL-6、TICAM2的mRNA表达水平与转录组测序结果一致。在HeLa及CaSki细胞中,敲低lncRNA UNC5B-AS1组IL-6的mRNA表达水平上调,而TICAM2的mRNA表达水平下调(Fig 9A)。同时,lncRNA UNC5B-AS1过表达组中IL-6的mRNA表达水平下调,TICAM2表达水平升高(Fig 9B)。Western blot实验证实,在 HeLa和CaSki细胞中,lncRNA UNC5B-AS1敲低导致IL-6蛋白表达水平上调,TICAM2蛋白表达水平下调(Fig 9C),统计学分析结果如Fig 9E所示。在HeLa细胞和SiHa细胞中,lncRNA UNC5B-AS1过表达导致IL-6蛋白表达水平下调,TICAM2蛋白表达水平上调(Fig 9D),统计学分析结果如Fig 9F所示。实验结果符合转录组测序分析结果。研究结果表明,lncRNA UNC5B-AS1能增强TLR信号通路活性。

Fig 5 Cell colony assay and Edu were used to detect the cell proliferation abilityA:Silenced of lncRNA UNC5B-AS1 inhibited ability of colony formation in HeLa and CaSki cells;B:Overexpression of lncRNA UNC5B-AS1 increased the ability of colony formation in HeLa and SiHa cells;C:Silencing of lncRNA UNC5B-AS1 caused the inhibition of proliferation ability in HeLa and CaSki cells;D:Overexpression of lncRNA UNC5B-AS1 caused the increase of the proliferation ability in HeLa and SiHa cells.1:si-NC;2:si-UNC5B-AS1;3:pcDNA3.1;4:3.1-UNC5B-AS1.*P<0.05,**P<0.01 vs Control group.
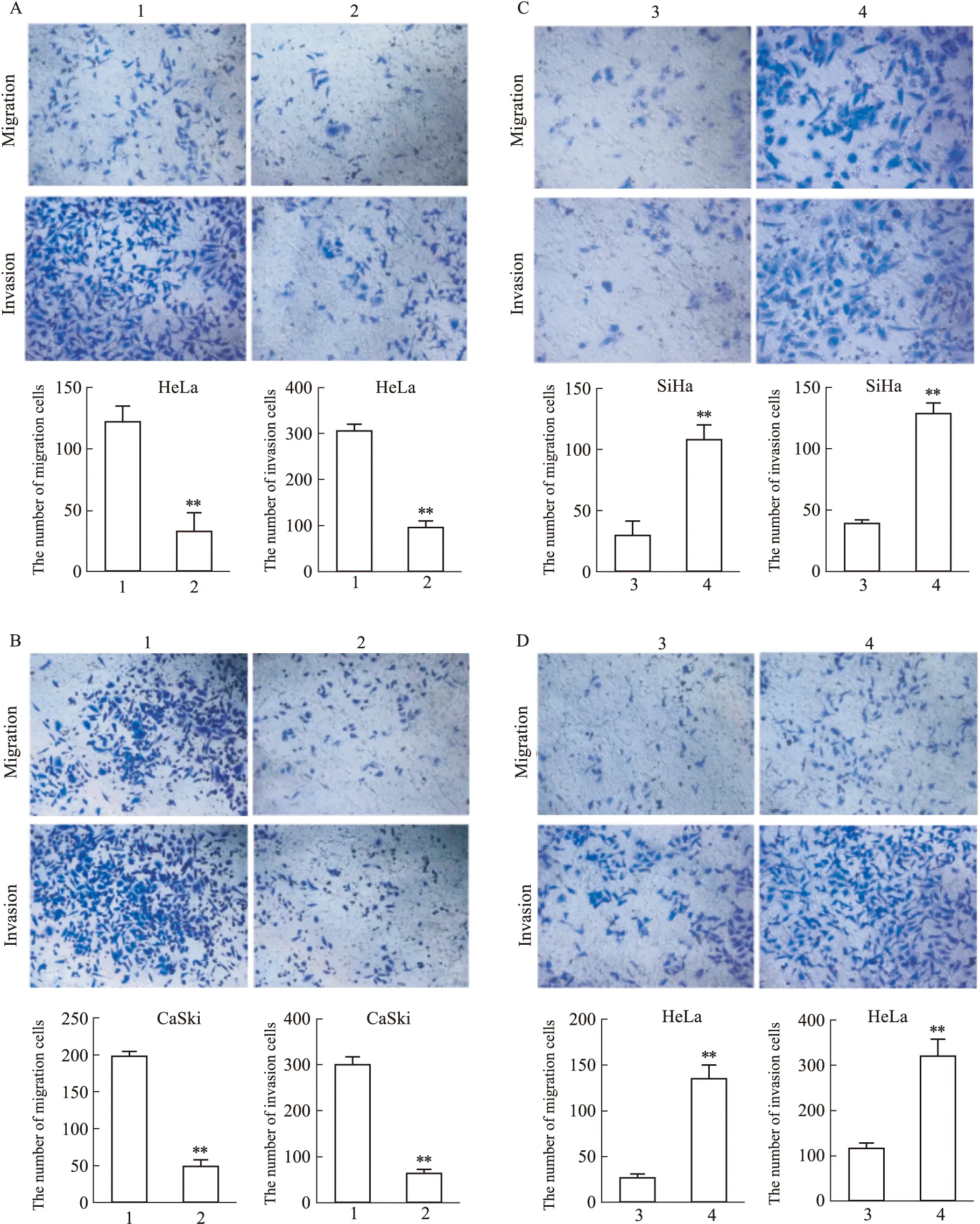
Fig 6 Ability of cell migration and invasion detected by Transwell assayA:Knock-down lncRNA UNC5B-AS1 led to the inhibition of migration and invasion in HeLa;B:Silencing of lncRNA UNC5B-AS1 led to the inhibition of migration and invasion in CaSki cells;C:Overexpression of lncRNA UNC5B-AS1 promoted SiHa to migrate and invade;D:Overexpression of lncRNA UNC5B-AS1 promoted HeLa to migrate and invade.1:si-NC;2:si-UNC5B-AS1;3:pcDNA3.1;4:3.1-UNC5B-AS1.*P<0.05,**P<0.01 vs Control group.

Fig 7 EMT-related proteins for lncRNA UNC5B-AS1 detected by Western blotA:The expression level of EMT-related proteins for knockdown lncRNA UNC5B-AS1 in cervical cancer cells;B:The expression level of EMT-related proteins for overexpressing lncRNA UNC5B-AS1 in cervical cancer cells;C-D:The normalized protein level.1:si-NC;2:si-UNC5B-AS1;3:pc-DNA3.1;4:3.1-UNC5B-AS1.*P<0.05,**P<0.01 vs Control group.
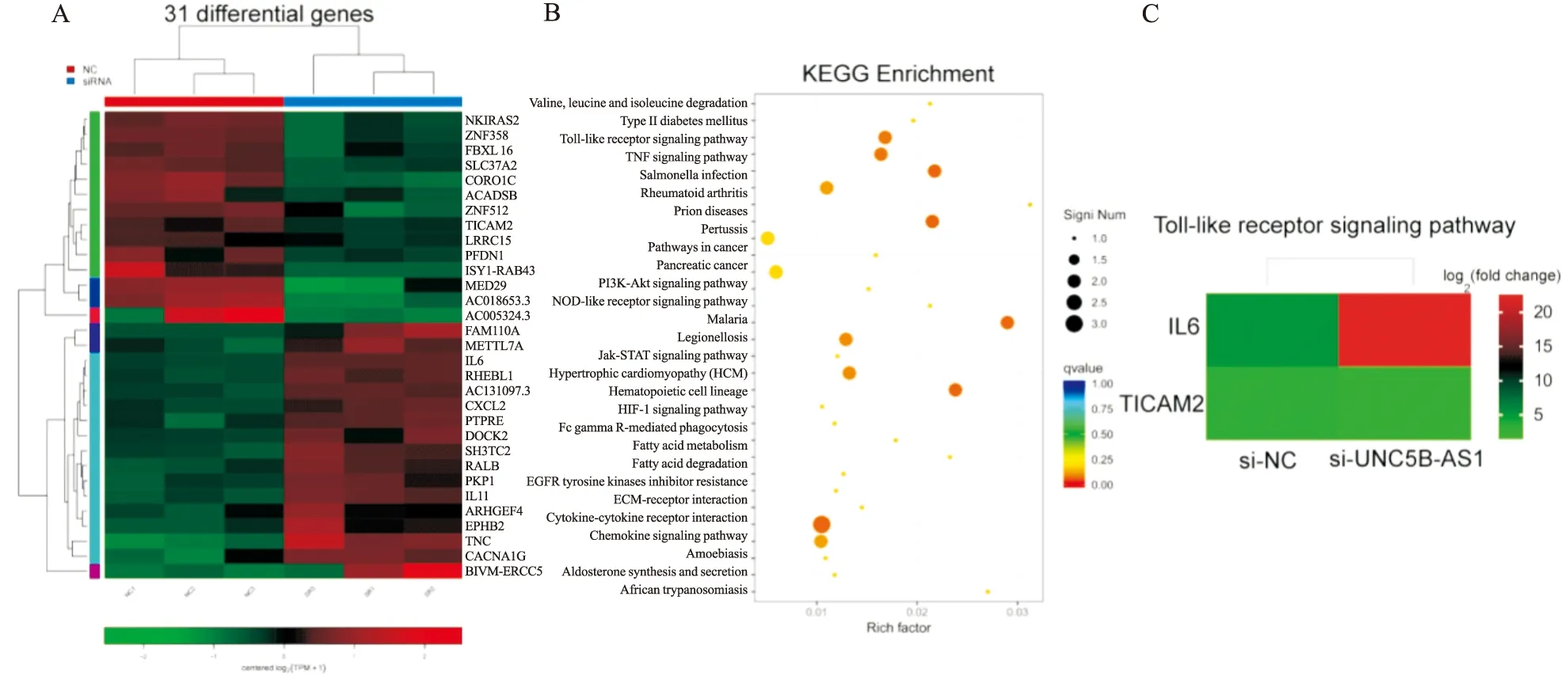
Fig 8 Results of RNA transcriptome sequenceA:Heatmap of differently expressed genes between silenced lncRNA UNC5B-AS1 group of HeLa cell and negative control group of HeLa cells revealed 31 differential genes;B:31 differential expression genes enriched KEGG pathway;C:Heatmap of differentially expressed genes enriched in Toll-like receptor signaling pathway.
3 讨论
宫颈癌是全球女性发病率和死亡率排名居前的恶性肿瘤,对女性健康带来极大威胁。寻找早期诊断标志物是诊断宫颈癌的关键。长链非编码RNA已被证实能调控宫颈癌细胞的增殖、迁移和侵袭能力,并可能是潜在治疗靶点。在这项研究中,我们通过GEO和TCGA数据库筛选得到差异基因lncRNA UNC5B-AS1,并确定lncRNA UNC5B-AS1参与宫颈癌的发生发展。经实验证实,lncRNA UNC5B-AS1在宫颈癌组织和细胞中表达上调,同时沉默lncRNA UNC5B-AS1明显抑制宫颈癌细胞的增殖、迁移和侵袭能力,过表达lncRNA UNC5B-AS1则能促进宫颈癌细胞的增殖、迁移和侵袭。
EMT是上皮细胞在形态学上发生向间质细胞表型的转变并获得迁移能力的生物学过程,在人类疾病的发展中至关重要。研究表明,EMT与肿瘤密切相关,在肿瘤恶性演进的过程中,EMT使肿瘤细胞得以浸润和转移至远端部位,EMT现象见于肿瘤各病理分期[7]。同时,胶质瘤[8]、食管鳞状细胞癌[9]和乳腺癌[10]等的转移均与EMT相关。本研究通过实验证实lncRNA UNC5B-AS1能调控EMT相关蛋白E-Cadherin、N-Cadherin、Vimentin的表达水平,敲低lncRNA UNC5B-AS1能使E-Cadherin上调,N-Cadherin及Vimentin下调,而过表达能使E-Cadherin表达水平下调,N-Cadherin、Vimentin表达水平上调,结果证实lncRNA UNC5B-AS1能促进宫颈癌细胞相关的EMT迁移和侵袭能力。

Fig 9 Toll-like receptor pathway-related gene expression level measured by qRT-PCR and Western blotA-B:The expression level of Toll-like receptor pathway-related altered genes was detected by qRT-PCR when(A):LncRNA UNC5B-AS1 was knockdown and(B):Overexpressed in cervical cancer cells;C-D:Western blot was applied for the measurement of Toll-like receptor pathway-related proteins expression level when(C):LncRNA UNC5B-AS1 was silenced and(D):Overexpressed in cervical cancer cells;E-F:The normalized protein level.1:si-NC;2:si-UNC5B-AS1;3:pc-DNA3.1;4:3.1-UNC5B-AS.*P<0.05,**P<0.01 vs Control group.
TLR在细胞外结构域中有一个富含亮氨酸的重复序列,在细胞内有一个Toll/IL-1受体同源结构域,均对配体识别和信号转导至关重要[11],在先天免疫反应中发挥重要作用,是抵御微生物病原体入侵、组织损伤或癌症的第一道防线[12]。TLR在抗肿瘤方面发挥关键作用[13],能够直接刺激或通过抗原递呈细胞间接刺激适应性免疫系统,并增强其对抗肿瘤中异常表达抗原的能力[14]。几项研究表明,TLR在人和小鼠肿瘤中表达升高,同时,TLR的激活可以促进肿瘤进展并恶化疾病预后,特别是TLR2激活已被证明在恶性肿瘤中具有直接的肿瘤刺激作用,促进肿瘤细胞的存活、增殖和转移能力[15]。同时TLR2还可以通过激活NF-κB来增强对化疗药物的抵抗力[16]。本研究通过转录组测序获得31个差异表达基因,KEGG结果提示差异表达基因主要富集到TLR信号通路、JAK-STAT信号通路、TNF信号通路等。其中富集到TLR信号通路的差异表达基因是IL-6及TICAM2。转录组测序结果表明敲低lncRNA UNC5B-AS1使IL-6表达水平上调,TICAM2表达水平下调,qRT-PCR及Western blot结果与转录组测序结果一致。表明lncRNA UNC5B-AS1能增强TLR信号通路活性,进一步促进宫颈癌细胞的增殖及EMT能力,具体机制有待进一步深入研究。
综上所述,lncRNA UNC5B-AS1在宫颈癌中高表达,并能通过增强TLR信号通路活性调控宫颈癌细胞的增殖及EMT能力。LncRNA UNC5B-AS1有望成为一种新的宫颈癌治疗靶点。
