伴有食管外症状的胃食管反流病患者食管动力学及反流特点分析
2023-02-06郭利华王静静温晋锋叶国良
郭利华,王静静,温晋锋,叶国良
伴有食管外症状的胃食管反流病患者食管动力学及反流特点分析
郭利华,王静静,温晋锋,叶国良
宁波大学医学院附属医院消化内科,浙江宁波 315020
分析伴有或不伴有食管外症状的胃食管反流病(gastroesophageal reflux disease,GERD)患者的食管动力学及反流特点。选取2017年5月至2021年12月于宁波大学医学院附属医院就诊的72例GERD患者,根据是否伴有食管外症状将纳入患者分为伴有食管外症状组(=30)和不伴有食管外症状组(=42),比较两组患者的食管动力及反流的差异。伴有食管外症状组患者4s完整松弛压(integrated relaxation pressure,IRP)、远端收缩积分(distal contractile integral,DCI)均显著低于不伴有食管外症状组(<0.05),蠕动中断显著长于不伴有食管外症状组(<0.05),食管裂孔疝比率显著高于不伴有食管外症状组(<0.05)。两组患者的食管下括约肌(lower esophageal sphincter,LES)静息压、LES长度、食管上括约肌(upper esophageal sphincter,UES)静息压及远端潜伏期比较差异均无统计学意义(>0.05)。伴有食管外症状组患者的总反流、弱酸反流及液体反流次数均显著多于不伴有食管外症状组(<0.05)。受试者操作特征曲线显示蠕动中断及弱酸反流对伴有食管外症状的GERD患者有一定诊断价值,蠕动中断的曲线下面积(area under the curve,AUC)为0.643,敏感度60.00%,特异性61.91%;弱酸反流AUC为0.701,敏感度66.67%,特异性69.05%。食管体部失蠕动及食管裂孔疝的GERD患者更易诱发或加重食管外症状,弱酸反流和液体反流在伴有食管外症状GERD的反流机制中起重要作用。蠕动中断及弱酸反流有助于分析和诊断伴有食管外症状的GERD。
食管外症状;胃食管反流病;高分辨率食管测压;24h pH-阻抗监测
胃食管反流病(gastroesophageal reflux disease,GERD)除了烧心、反流等症状外[1],还可表现为频繁清嗓、咽部异物感、慢性咳嗽、声音嘶哑、气喘等食管外症状,GERD患者可同时伴有或单纯表现为食管外症状,同时伴有食管外症状的GERD患者在临床上并不少见,单纯表现为食管外症状的患者则容易被误诊[2]。本研究旨在回顾性分析伴有食管外症状患者的食管动力学及pH-阻抗与反流特性,为临床诊断此类疾病提供参考。
1 资料与方法
1.1 一般资料
回顾性分析2017年5月至2021年12月于宁波大学医学院附属医院确诊的72例GERD患者。GERD的诊断标准参考《2020年中国胃食管反流病专家共识》[1]。根据是否伴有食管外症状将纳入患者分为伴有食管外症状组(=30)和不伴有食管外症状组(=42)。纳入标准:①年龄18~70岁;②经胃镜检查和(或)24h pH-阻抗监测结果诊断GERD;③患者的咽喉部症状及呼吸道症状经电子喉镜检查及胸部CT、肺功能检测排除咽喉部及呼吸道疾病。排除标准:①胃镜检查发现存在食管癌、食管溃疡等器质性疾病;②伴有严重心肺疾病无法耐受检查者;③有明确病因的咽喉部及呼吸道症状者;④鼻咽反应强烈,无法配合及耐受检查者。本研究经宁波大学医学院附属医院伦理委员会审核批准(伦理审批号:KS20223011)。
1.2 高分辨率食管测压
采用荷兰MMS公司的液态高分辨率食管测压仪,检查前1周患者需停用质子泵抑制剂(proton pump inhibitor,PPI)、钾离子竞争性酸阻滞剂、抗酸药、胃肠动力药及镇静药。校正电极压力后,经鼻腔插管固定。患者平静呼吸适应导管后开始检测,采集10s以上食管静息压力,完成10次5ml温水单口吞咽、多次快速吞咽(multiple rapid swallow,MRS)。完成后拔出测压管。主要指标:食管上括约肌(upper esophageal sphincter,UES)静息压、食管下括约肌(lower esophageal sphincter,LES)静息压、LES腹内长度、4s完整松弛压(integrated relaxation pressure,IRP)、远端收缩积分(distal contractile integral,DCI)、蠕动中断、远端潜伏期。LES静息压<10mmHg(1mmHg=0.133kPa)定义为LES静息压低压,UES静息压<30mmHg定义为UES静息压低压。
1.3 24h pH-阻抗监测
采用MMS公司pH-阻抗监测便携包,完成食管测压后,先将pH-阻抗导管在缓冲液中进行pH校正,经鼻腔将校正过的导管插入食管,插管深度位于LES上缘5cm处,24h后完成监测,嘱被检者详细记录进餐时间、体位改变及症状。记录不同类型反流次数、pH结果,计算DeMeester评分,DeMeester评分≥14.72分表示病理性酸反流。
1.4 统计学方法
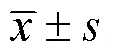
2 结果
2.1 两组患者的一般资料比较
两组患者的性别、年龄、身高、体质量、体质量指数等一般资料比较差异均无统计学意义(>0.05),见表1。

表1 两组患者的一般资料比较
2.2 两组患者的食管测压结果比较
伴有食管外症状组患者的4s IRP、DCI均显著低于不伴有食管外症状组(<0.05),蠕动中断显著长于不伴有食管外症状组(<0.05)。两组患者的LES静息压、LES腹内长度、UES静息压及远端潜伏期比较差异均无统计学意义(>0.05),见表2。
2.3 两组患者的食管运动功能、LES静息压低压和食管裂孔疝比较
两组患者的食管体部运动功能和LES静息压低压比较,差异均无统计学意义(>0.05);伴有食管外症状组患者的食管裂孔疝比率显著高于不伴有食管外症状组(<0.05),见表3。
2.4 两组患者的24h pH-阻抗监测比较
伴有食管外症状组患者的总反流、弱酸反流及液体反流次数均显著多于不伴有食管外症状组(<0.05);两组患者的DeMeester评分、酸反流、无酸反流、混合反流、气体反流次数比较差异均无统计学意义(>0.05),见表4。
2.5 蠕动中断与弱酸反流对伴有食管外症状GERD诊断的价值
蠕动中断区分是否伴有食管外症状的最佳临界值为13.7cm,敏感度60.00%,特异性61.91%,阳性预测值60.61%,阴性预测值66.67%,曲线下面积(area under the curve,AUC)为0.643(95%0.515~0.771),见图1。弱酸反流次数区分是否伴有食管外症状的最佳临界值为22次,敏感度66.67%,特异性69.05%,阳性预测值72.73%,阴性预测值53.85%,AUC为0.701(95%0.574~0.828),见图2。
3 讨论
胃、十二指肠内容物反流至咽部、口腔或气管将引起食管外症状[2],可表现为咳嗽、喘息、气促、咽喉痛、咽部异物感、声嘶等,严重者可伴有反流物误吸、吸入性肺炎等并发症[3]。GERD患者常伴有食管外症状,甚至仅表现为慢性咳嗽、频繁清嗓等表现,喉镜及肺功能检测等相关检查未见明显异常,对症用药效果不佳,临床上往往易被误诊。研究发现GERD占我国慢性咳嗽病因的4.6%[4],临床上伴有食管外症状的GERD并不少见,因此,认识伴有食管外症状患者的食管静息压力、蠕动功能及酸反流、弱酸反流等参数特点,可为该类患者的临床诊疗方案制定提供参考。
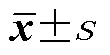
表2 两组患者的食管测压结果比较()
注:1mmHg=0.133kPa
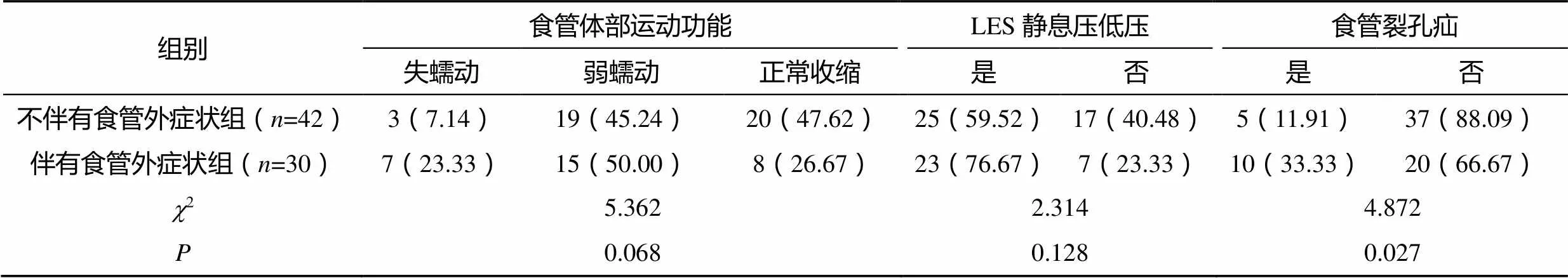
表3 两组患者的食管运动功能、LES静息压低压和食管裂孔疝比较[n(%)]
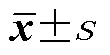
表4 两组患者的24h pH-阻抗监测比较()

图1 蠕动中断区分是否伴有食管外症状的受试者操作特征曲线
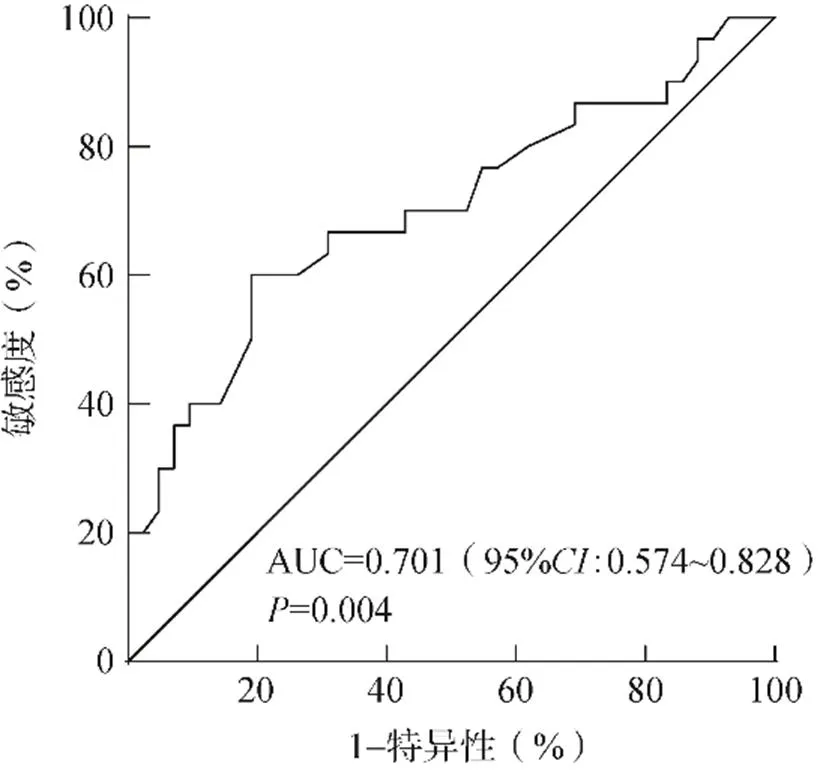
图2 弱酸反流区分是否伴有食管外症状的受试者操作特征曲线
高分辨率食管测压技术可精确了解静息状态和吞咽时食管各部分压力的变化,是诊断食管动力障碍性疾病的金标准[5]。食管动力学异常是GERD发病的基础,GERD患者最常见的食管动力异常有:食管体部运动功能减退及LES静息压低压,前者为食管的蠕动功能及廓清能力,后者为食管的屏障功能,二者功能缺失在GERD患者中可单独存在亦可同时存在,对GERD的发病起重要作用[6]。本研究显示GERD患者均存在不同程度的LES、UES静息压异常;伴有食管外症状组患者的4s IRP、DCI均显著低于不伴有食管外症状组,且食管体部吞咽时存在明显蠕动中断,食管裂孔疝患者比率更高,食管裂孔疝越大的患者越易出现咳嗽气喘和咽喉异物感等食管外症状[7]。研究表明食管下段屏障功能减弱易导致食物滞留在咽部或食管,而食管远端收缩力减弱导致食管对反流物的廓清能力降低[8]。由此推测食管蠕动功能减弱和食管体部廓清能力下降,可增加咽喉反流的暴露。张艳丽等[9]研究显示伴有食管外症状的GERD患者LES长度、LES静息压及IRP均低于对照组,推测前者LES抗反流屏障功能受损更严重,更易发生一过性LES松弛,使胃食管内容物反流至UES以上的咽喉、呼吸道黏膜诱发食管外症状。UES由环咽肌组成,作为食管入口的高压区,它是防止食管内容物反流至口腔及咽喉部的重要屏障[10]。UES防止反流物从食管进入口咽部的功能随着UES静息压的降低而减弱,从而诱发食管外症状[11]。但本研究结果并非如此,本研究中两组患者的UES静息压无明显差异。目前国内外学者对UES静息压在伴有食管外症状GERD中所产生的作用观点不一。有研究认为UES静息压降低易诱发食管外症状[12-13];也有学者持不同观点,袁莉莉等[14]研究发现伴有或不伴有食管外症状GERD患者的LES静息压、UES静息压无明显差异。由此可见,仍需进一步通过多中心研究以确认UES在伴有食管外症状的GERD中的动力学特征和作用。
本研究显示,伴有食管外症状组患者的总反流、弱酸反流及液体反流次数均显著升高,以弱酸反流及蠕动中断作为预测参数,绘制伴有食管外症状GERD的受试者操作特征曲线,其中弱酸反流的AUC最高,为0.701,临界值为22次,诊断敏感度和特异性分别为66.67%和69.05%,蠕动中断的AUC为0.643,也具有一定的诊断效能。研究发现伴有食管外症状患者在应用标准剂量PPI治疗后,通过pH-阻抗监测发现10%~40%的患者仍存在非酸反流[15]。Burton等[16]研究发现难治性咽喉反流患者大剂量PPI治疗后症状仍持续,pH-阻抗监测发现存在不同程度的非酸、弱酸反流,可见食管外症状与存在非酸反流、弱酸反流明显相关,伴有食管外症状的难治性GERD患者弱酸反流更常见[14]。国内一项研究发现伴或不伴有食管外症状患者酸反流、弱酸反流和非酸反流次数均无明显差异,但有食管外症状患者食管近端弱酸和非酸反流百分比较高[9]。且有研究证实食管近端酸反流增多与慢性咳嗽相关[17]。本研究中伴有食管外症状GERD患者弱酸反流与液体反流次数明显增加,说明咽部、气管等对食管近端弱酸反流、液体反流更敏感,因此,食管外症状GERD患者或疑似GERD进行pH-阻抗监测有助于疾病诊断及鉴别诊断。
伴有食管外症状的GERD患者食管蠕动功能显著降低,弱酸反流和液体反流在食管外症状形成中发挥重要作用,弱酸反流次数及蠕动中断有助于预测有无食管外症状。对临床诊断困难、治疗效果不理想的GERD患者选择食管动力学及24h pH-阻抗监测有助于协助诊治。
[1] 中华医学会消化病学分会. 2020年中国胃食管反流病专家共识[J]. 中华消化杂志, 2020, 40(10): 649-663.
[2] 中国医疗保健国际交流促进会胃食管反流多学科分会. 中国胃食管反流病多学科诊疗共识[J]. 中国医学前沿杂志(电子版), 2019, 11(9): 30-56.
[3] GYAWALI C P, KAHRILAS P J, SAVARINO E, et al. Modern diagnosis of GERD: The Lyon consensus[J]. Gut, 2018, 67(7): 1351-1362.
[4] LAI K, CHEN R, LIN J, et al. A prospective, multicenter survey on causes of chronic cough in China[J]. Chest, 2013, 143(3): 613-620.
[5] YADLAPATI R, KAHRILAS P J, FOX M R, et al. Esophageal motility disorders on high-resolution manometry:Chicago classification version 4.0©[J]. Neurogastroenterol Motil, 2021, 33(1): e14058.
[6] LIU L, LI S, ZHU K, et al. Relationship between esophageal motility and severity of gastroesophageal reflux disease according to the Los Angeles classification[J]. Medicine (Baltimore), 2019, 98(19): e15543.
[7] SCHLOTTMANN F, ANDOLFI C, HERBELLA F A, et al. GERD: Presence and size of hiatal hernia influence clinical presentation, esophageal function, reflux profile, and degree of mucosal injury[J]. Am Surg, 2018, 84(6): 978-982.
[8] KUMAR N, PORTER R F, CHANIN J M, et al. Analysis of intersegmental trough and proximal latency of smooth muscle contraction using high-resolution esophageal manometry[J]. J Clin Gastroenterol, 2012, 46(5): 375-381.
[9] 张艳丽, 郑岳, 朱慧婷, 等. 合并或不合并食管外症状的胃食管反流病患者食管动力与反流特征及机制探讨[J]. 中华医学杂志, 2018, 98(44): 3579-3583.
[10] SHAKER R, BABAEI A, NAINI S R. Prevention of esophagopharyngeal reflux by augmenting the upper esophageal sphincter pressure barrier[J]. Laryngoscope, 2014, 124(10): 2268-2274.
[11] HERREGODS T V K, PAUWELS A, JAFARI J, et al. Determinants of reflux-induced chronic cough[J]. Gut, 2017, 66(12): 2057-2062.
[12] NADALETO B F, HERBELLA F A, PINNA B R, et al. Upper esophageal sphincter motility in gastroesophageal reflux disease in the light of the high-resolution manometry[J]. Dis Esophagus, 2017, 30(4): 1-5.
[13] 余琴, 刘曌宇, 廖家智, 等. 胃食管反流性咳嗽患者食管高分辨率测压及阻抗-pH监测特点探讨[J]. 胃肠病学和肝病学杂志, 2015, 24(10): 1196-1199.
[14] 袁莉莉, 季锋, 李治仝, 等. 合并食管外症状的难治性胃食管反流病的临床研究[J]. 中华消化杂志, 2020, 40(1): 45-47.
[15] ABOU-ISMAIL A, VAEZI M F. Evaluation of patients with suspected laryngopharyngeal reflux: A practical approach[J]. Curr Gastroenterol Rep, 2011, 13(3): 213-218.
[16] BURTON L, FALK G L, BAUMGART K, et al. Esophageal clearance in laryngopharyngeal reflux disease: Correlation of reflux scintigraphy and 24-hour impedance/pH in a cohort of refractory symptomatic patients[J]. Mol Imaging Radionucl Ther, 2020, 29(1): 7-16.
[17] LI X, LIN S, WANG Z, et al. Gastroesophageal reflux disease and chronic cough: A possible mechanism elucidated by ambulatory pH-impedance-pressure monitoring[J]. Neurogastroenterol Motil, 2019, 31(12): e13707.
Analysis of esophageal motility and reflux characteristics in gastroesophageal reflux disease with extra-esophageal symptoms
Department of Gastroenterology, the Affiliated Hospital of Medical School, Ningbo University, Ningbo 315020, Zhejiang, China
To analyze the characteristics of esophageal motility and reflux in gastroesophageal reflux disease (GERD) patients with or without extra-esophageal symptoms.A total of 72 patients with GERD admitted in the Affiliated Hospital of Medical School, Ningbo University were selected and divided into extra-esophageal symptom group (=30) and without extra-esophageal symptom group (=42) according to whether they were accompanied by extra-esophageal symptoms. The differences of esophageal motility and reflux between the two groups were compared.The integrated relaxation pressure (IRP) and distal contractile integral (DCI) in extra-esophageal symptom group were significantly lower than those in without extra-esophageal symptom group (<0.05), the distance of peristalsis interruption was longer than that in without extra-esophageal symptom group (<0.05), the rate of esophageal hiatal hernia was significantly higher than that in without extra-esophageal symptom group (<0.05). There were no significant differences in lower esophageal sphincter (LES) resting pressure, LES length, upper esophageal sphincter (UES) resting pressure and distal latency between the two groups (>0.05). The number of total reflux, weak acid reflux and liquid reflux in extra-esophageal symptom group were significantly higher than those in without extra-esophageal symptom group (<0.05). The results of receiver operator characteristic curve showed that peristalsis interruption and weak acid reflux had certain diagnostic value in patients with GERD with extra-esophageal symptoms. The area under the curve (AUC) of peristalsis interruption was 0.643, the sensitivity and the specificity were 60.00% and 61.91%, respectively. The AUC of weak acid reflux was 0.701, the sensitivity and the specificity were 66.67% and 69.05%, respectively.GERD patients with esophageal body dysperistalsis and esophageal hiatal hernia are more likely to induce or aggravate extra-esophageal symptoms. Weak acid reflux and liquid reflux play an important role in the reflux mechanism of GERD with extra-esophageal symptoms. Peristalsis interruption and weak acid reflux are helpful to analysis and diagnose GERD with extra-esophageal symptoms.
Extra-esophageal symptoms; Gastroesophageal reflux disease; High resolution esophageal manometry; 24-Hour pH impedance monitoring
R571
A
10.3969/j.issn.1673-9701.2023.01.016
叶国良,电子信箱:ndfyygl@163.com
(2022–08–29)
(2022–11–27)
