一株褐家鼠戊型肝炎病毒的发现鉴定及系统发生分析
2023-02-04宗利东殷红敏赵维玉徐粉慧韩培钰崔凤灵何明仙张云智
宗利东,殷红敏,杨 银,赵维玉,徐粉慧,韩培钰,崔凤灵,何明仙,张云智*
(1.大理大学公共卫生学院,大理大学预防医学研究所,云南省滇西抗病原植物资源筛选研究重点实验室,云南省高校人兽共患病跨境防控与检疫重点实验室,大理 671000;2.大理州第二人民医院,大理 671000)
戊型肝炎病毒(hepatitis E virus,HEV)属于肝炎病毒科(Hepeviridae),引起的病毒性肝炎称为戊型肝炎。该病是一种主要经粪-口传播、也可通过血液和母婴传播、以家畜或野生动物为宿主的人兽共患病[1]。戊型肝炎病毒感染在临床上常常引起患者发热,普通人群致死率约为1%,孕妇及婴幼儿致死率高达15%~25%[2-4]。HEV 每年造成约2 000 万人感染,2015 年造成全球约4.4 万人死亡[5]。2022 年,国际病毒分类学委员会(The International Committee on Taxonomy of Viruses,ICTV)将戊型肝炎病毒科分为正戊型肝炎病毒(Orthohepevirinae,OHEV)和副戊型肝炎病毒(Parahepevirinae,PHEV)2 个亚科,其中,OHEV 含4 属9 种,PHEV 含1 属1 种[6]。OHEV 感染哺乳动物和鸟类,PHEV 感染鱼类[7]。OHEV 的4 个属分别为:1)灵长偶蹄树鼩兔形目戊型肝炎病毒属(Paslahepevirus,PASLHEV)(2 种),感染灵长目(Primates)、偶蹄目(Artiodactyla)、树鼩目(Scandentia)和兔形目(Lagomorpha)动物,其中,巴拉扬尼种(Paslahepevirus balayani)可分8个基因型(HEV-1~HEV-8),主要感染人(Homo sapiens)、猪(Sus scrofa)、单峰骆(Camelus dromedarius)和双峰驼(Camelus bactrianus);2)啮齿食肉目戊型肝炎病毒属(Rocahepevirus,RCHEV)(2 种),感染啮齿目(Rodentia)和食肉目(Carnivora)动物,其中,家鼠种(Rocahepevirus ratti)分为HEV-C1[感染家鼠属(Rattus)和臭鼩鼱(Suncus murinus)]、HEV-C2[感染雪貂(Mustela putorius)]和HEV-C3[感染田鼠(Apodemus)]3 个基因型;3)翼手目戊型肝炎病毒属(Chirohepevirus,CHHEV)(3 种),感染翼手目(Chiroptera)动物;4)禽类戊型肝炎病毒属(Avihepevirus)(2种),感染禽类(Avian)。
HEV基因组为单股正链RNA,全长约为7.2 kb,通常包含3 个开放阅读框(open reading frame,ORF)。ORF1 的长度约占整个基因组的2/3,编码与复制相关的多聚蛋白。蛋白由1 693 个氨基酸组成,含7 个功能域,包括甲基转移酶(methyltransferase,Met)、Y 结构域、木瓜蛋白酶样半胱氨酸蛋白酶(papain-like cysteine protease,PLP)、高变区(hypervarible,HVR)、X 结构域、RNA 解旋酶(RNA helicase,Hel)和RNA 依赖的RNA 聚合酶(RNA-dependent RNA ploymerase,RdRp)[8-10]。ORF2 编码长度为660 个氨基酸的核衣壳蛋白,含有重要的抗原决定簇[11-12]。ORF3 与ORF2 约有300 个碱基的重叠,编码一个长度约123 个氨基酸的小磷蛋白,参与HEV颗粒从感染细胞中的释放,可能与病毒粒子的形态形成有关[13]。在HEV-1 和啮齿动物携带的HEV 的C1~C3 中还发现了存在于ORF1 中的ORF4。ORF4的编码蛋白被认为可以增强 RdRp 的活性。2021 年的一项研究表明,ORF4 可以促进HEV-3 在细胞中的复制[14-15]。
啮齿目动物种类繁多,且与人类生活关系密切,是HEV-C1 的主要宿主。本研究对云南省大理市褐家鼠(Rattus norvegicus)携带的HEV 开展了筛查,在采集的样本中检测到HEV-C1型毒株,并完成1 株DL147 病毒全基因组序列的鉴定。基因组比较和系统发生分析发现,DL147 与香港1 例肝炎患者血清中检测得到的HEV 高度相似,提示要加强此类病毒在褐家鼠中流行的监测[16]。
1 材料与方法
1.1 样本采集
2021 年11 月—2022 年1 月,在大理市凤仪镇、银桥镇、海东镇、挖色镇、大理镇、上关镇、喜洲镇7个镇采用鼠笼法和鼠夹法(夹夜法)捕获啮齿动物,捕获后的样本带回实验室后立即解剖,分别取心、脾、肾、肺、肝、肠各2 份,放于-80℃冰箱中待检。物种采用形态学和分子鉴定2种方法进行鉴定[17]。
1.2 核酸的提取
将解剖后的啮齿动物肝组织用无菌剪取约1 g放入Gene Ready 动物PIII 粉碎管(遂真,中国杭州)中,加入灭菌的700 μL 磷酸缓冲液,再置于Gene Ready U1-timate 生物样本低温快速制备离心系统(遂真,中国杭州)中进行研磨,然后取300 μL 的研磨液加入到MagaBio plus 病毒DNA/RNA 纯化试剂盒III,放入全自动核酸提取仪(博日,中国杭州)中提取,按照制造商的说明书操作。
1.3 HEV核酸检测
采用巢式RT-PCR 进行病毒核酸检测,两轮PCR 反应体系均为25 μL。第1轮使用Fastking 一步法RT-PCR 试剂盒(TIANGEN,中国北京),RNA模板3 μL,反应程序:逆转录42.0℃ 30 min,预变性94.0℃ 3 min,变性94.0℃ 30 s,退火52.8℃ 30 s,延伸72.0℃ 30 s,循环35 次,再延伸72.0℃ 5 min,4.0℃保存。第2轮使用Green Taq Mix(Vazyme,中国南京),第1 轮产物模板1 μL,反应程序:预变性94.0℃ 3 min,变性94.0℃ 30 s,退火50.0℃ 15 s,延伸72.0℃ 15 s,循环30 次,再延伸72.0℃ 5 min,10.0℃保存。PCR 引物由上海生工生物工程有限公司合成(表1)。将通过琼脂糖凝胶电泳鉴定出的阳性扩增产物送上海生工生物工程股份有限公司进行双向序列测定。若测序结果为重叠峰,则将PCR产物纯化回收(OMEGA Bio-tek,美国诺克罗斯)、T-1克隆(全式金,中国北京),再送阳性克隆菌液测序。
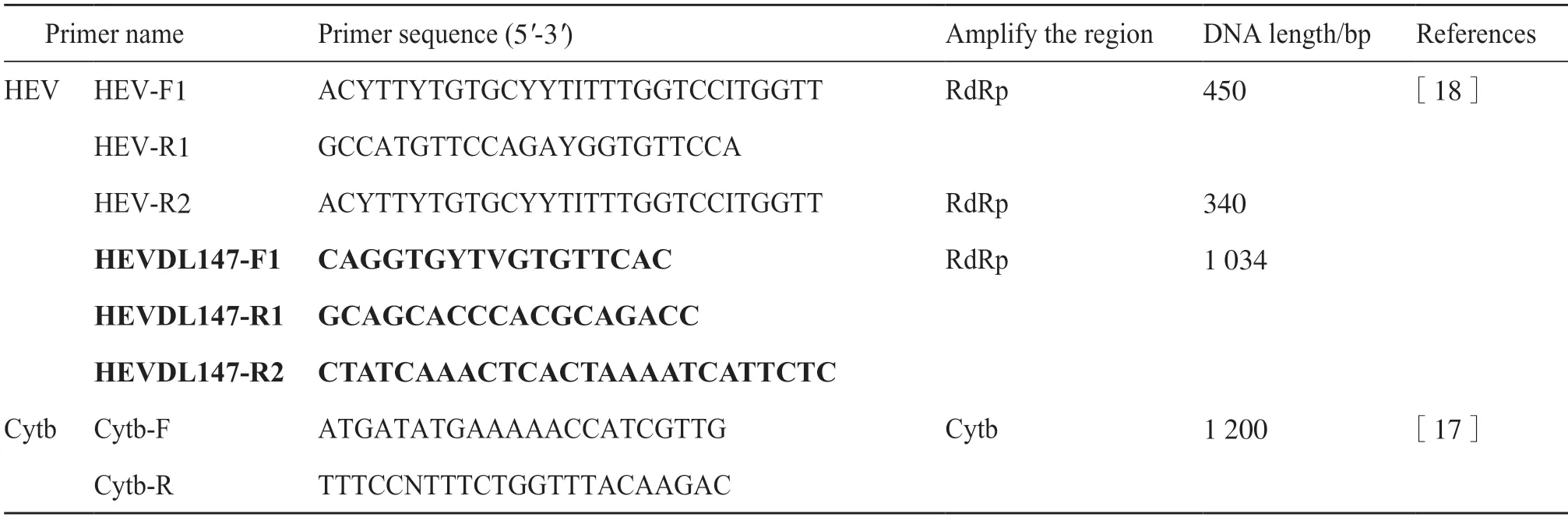
表1 本研究所使用的引物Tab.1 Primer information
1.4 高通量测序与HEV全基因组的扩增
用检测引物扩增获得DL147 号样品基因大小为340 bp。为了进一步获得更长的片段,用引物HEVDL147-F1、HEVDL147-R1、HEVDL147-R2(表1)共扩增得到DL147HEV 的基因片段为1 034 bp,blastn 比对后发现有必要进行高通量测序,再将DL147 核酸样本送至华大基因,采用MGI RS2000 测序仪进行高通量的测序,用fastqc 和Trimmomatic 软件对下机数据进行质量控制,去除原始数据(raw data)中测序质量较差和读长较短的读数(reads),切除reads 中的接头序列,获得清除数据(clean data)用于后续分析。使用DIAMOND 软件将reads 比对至预先建好的HEV 序列数据库,筛选得到clean data 中所含有的HEV reads,使用megahit、soapdenovo 软件对筛选后reads 进行拼接,得到重叠群(contigs),并对所获取contigs 进行blastn 比对,获取最近参考序列。使用Geneious 软件进行有参contigs 拼接,再以拼接后得到的序列为参考序列,对clean data 进行有参拼接,组装得到contigs,所得结果即为高通量测序分析结果。利用在线工具IBS 2.0(https://ibs.renlab.org/#/server)对基因结构示意图进行绘制。
1.5 HEV阳性样本基因分型和系统进化树的构建
从NCBI 的GenBank 中下载HEV 代表株和相似性较高毒株的基因组序列,用MEGA-X 软件进行比对,选择最大似然法(maximum likelihood,ML)进行超1 000次的bootstrap重复,构建系统进化树。
1.6 HEV分歧时间计算
利用IQtree 寻找最适模型,以贝叶斯进化分析软件(BEASTv1.10.4)的BEAUti 程序设置序列的采样时间、氨基酸置换模型分子钟模型、马尔科夫链长和先验参数,利用BEAST 程序运算,通过马尔可夫-蒙特卡洛算法(Markov Chain Monte Carlo,MCMC)进行树的重复抽样,得到具有最大后验概率的进化树。通过TreeAnnotator 程序设置Burnin值,以FigTree v1.4.4 软件对进化树进行修饰和分歧时间的标定,分析病毒序列的演化过程。
1.7 统计分析
使用Excel 建立数据库,用SPSS17.0 软件对数据进行统计分析,P <0.05认为具有统计学意义。
2 结果与分析
2.1 啮齿动物的种类与感染率
共捕获小型哺乳动物114 只,涵盖6 个属的7 种动物,其中居民区黄胸鼠(Rattus tanezumi)占64.79%(46/71),褐家鼠(Rattus norvegicus)占35.21%(25/71);野外耕作地高山姬鼠(Apodemus chevrieri)占83.72%(25/43),大绒鼠(Eothenomys miletus)占6.98%(3/43);树鼩占4.65%(2/43),臭鼩鼱(Suncus murinus)占2.33%(1/43),针毛鼠(Niviventer fulvescens)占2.33%(1/43)。居民区以黄胸鼠和褐家鼠为优势种,野外耕作地以高山姬鼠为优势鼠。检测到2 份HEV 阳性样本(DL143 和DL147),宿主动物均为褐家鼠,感染率为8.00%(2/25)(表2)。
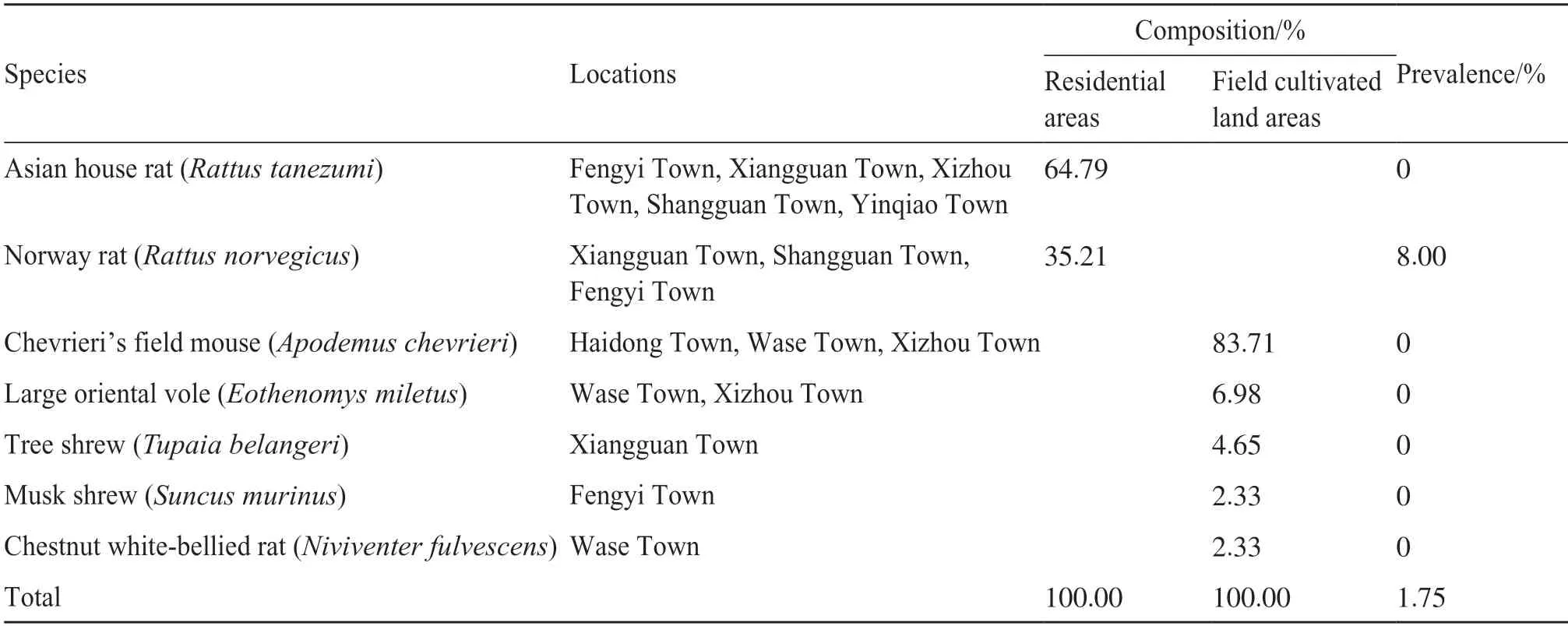
表2 云南省大理市小型哺乳动物物中HEV检测结果Tab.2 Detection of HEV in small mammals from Dali City,Yunnan Province,China
2.2 基因组结构与同源性比对分析
对D L 1 4 7 号样本进行了全基因组测序(OR786722),全长6 970 bp,其中ORF1长4 823 bp,编码1 607 个氨基酸(amino acid,aa)非结构蛋白,其包含的Met 位于159~704 nt(54~234 aa)、Y 域位于639~1 310 nt(214~436 aa),PLP位于1 311~1 731 nt(438~577 aa),HVR 位于2 0 4 2~2 2 2 7 n t(6 8 2~7 4 2 a a),X 域 位于2 249~2 684 nt(751~894 aa),Hel 位于2 746~3 470 nt(916~1 156 aa),RdRp 位于3 485~4 921 nt(1 163~1 640 aa);ORF2 长1 934 bp,编码长为644 aa 的结构蛋白;ORF3 长395 bp,与ORF2 重叠297 bp,编码长为118 aa 的结构蛋白;ORF4 全长551 bp,编码长为183 aa 的非结构蛋白。DL147号全基因组结构模式图见图1。
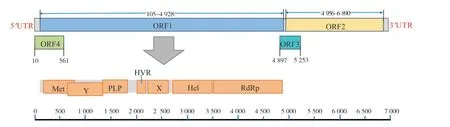
图1 DL147 全基因组结构模式图Fig.1 DL147 genome wide structural pattern map
将DL147 号样本的全基因序列与NCBI 数据库中已知的序列进行blast 比对,选出相似度最高的7条序列再进行比对,发现其与香港1 例HEV 患者血清分离株核苷酸同源率为95.21%(MN450853),与其他6 株从鼠类中分离核苷酸的相互之间的同源性为84.10%~93.89%(表3)。
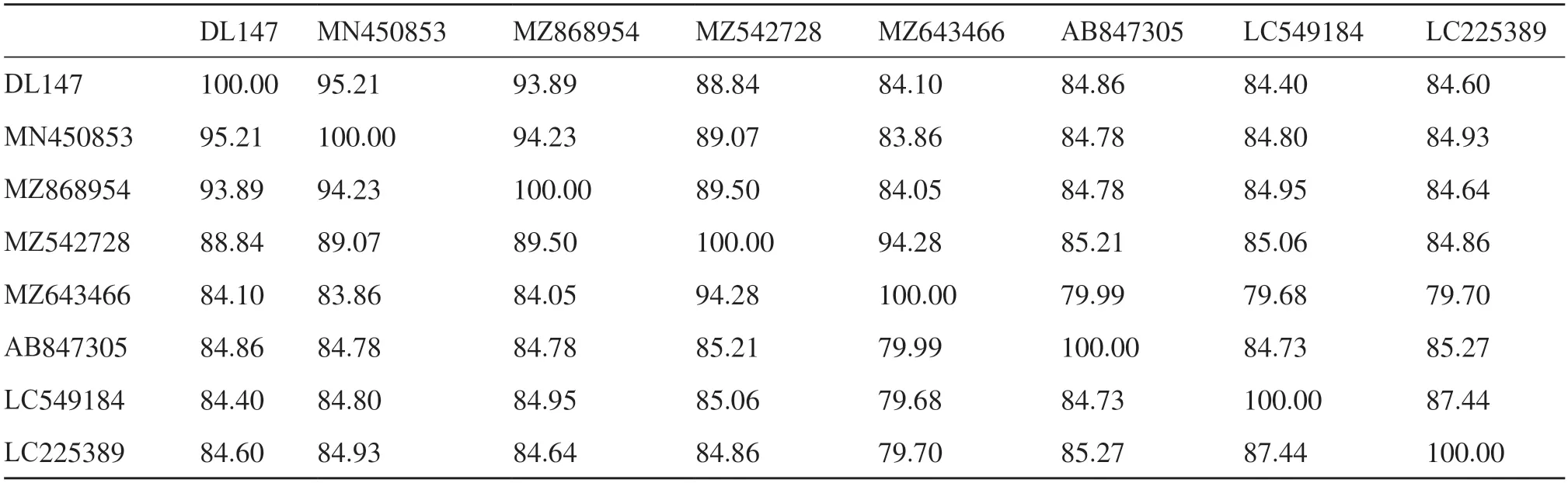
表3 DL147全序列核苷酸同源性比对Tab.3 DL147 whole-sequence nucleotide homology alignment unit: %
2.3 系统进化分析
DL147 号全基因组系统发育树显示,DL147 与香港HEV患者血清中分离得到的病毒(MN450853)亲源性最高,形成一个分支,Bootstrap 值为100%;同时,其与中国香港其他患者、加拿大患者以及鼠类分离出来的其他HEV 型亲缘关系较为集中,均为HEV-C1 型,同属于正戊型肝炎病毒亚科,与OHEV分的其他3个属相差较远(图2)。

图2 基于DL147 全基因组构建的系统发育树Fig.2 Phylogenetic tree constructed based on the whole genome of DL147
2.4 分歧时间计算
HEV ORF2 序列的贝叶斯进化树结果显示,DL147 与香港株的分歧时间约为2003 年,属于较晚分化的HEV 株型。其他分支中较晚分化的株型主要是日本和马来西亚发现的人的HEV 毒株,包括AB220977、AB369690、KX426575 在内的株型约分化于2004 年。除以上三株外,本研究发现的DL147株型分化时间早于世界的其他HEV 毒株,说明大理市褐家鼠中感染的HEV 可能是由其他地区的毒株传播演化而来的(图3)。
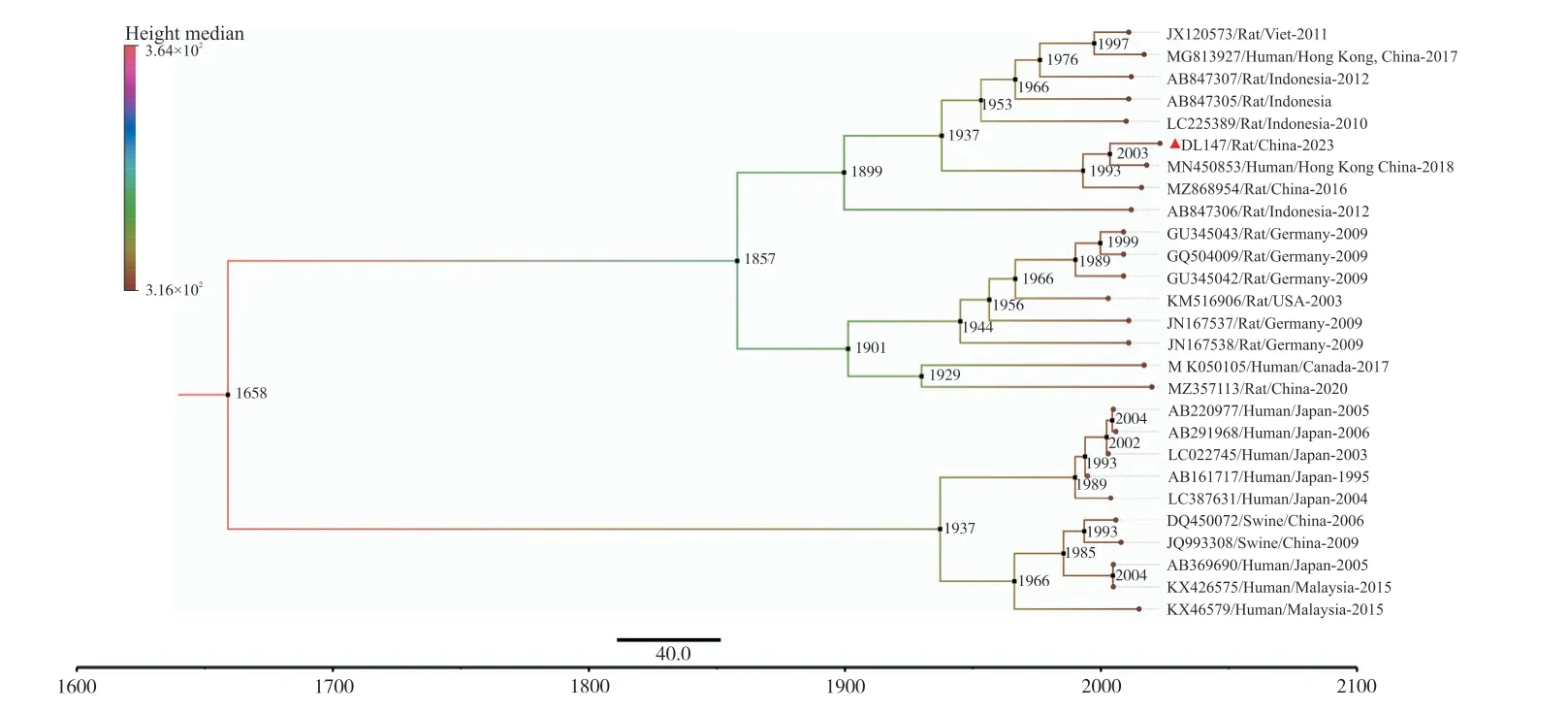
图3 HEV 序列的贝叶斯进化树Fig.3 Bayesian evolutionary tree of HEV sequences
3 讨论
云南省大理市地处云贵高原西部,紧邻青藏高原,独特的地形与气候形成了当地的独特的生物多样性。我们先前的调查在云南省的高山姬鼠(Apodemus chevrieri)和黑腹绒鼠(Eothenomys melanogaster)中发现存在新型HEV,并命名为HEV-C3和HEV-C4[19]。本次调查在褐家鼠(Rattus norvegicus)中检测出HEV,鉴定的DL147号HEV阳性样本与香港患者血清中检测得到的HEV 高度相似,基因组序列一致性达到95.21%。从本次调查获得的DL147的全基因组来看,其属于家鼠种(Rocahepevirus ratti)中的HEV-C1基因型。到目前为止,HEV-C1感染人的病例约有20例被报道[16,20-22]。特别值得注意的是,褐家鼠在居民区活动,为居民区的优势种,与人的关系十分密切[21]。褐家鼠携带的HEV 在云南省大理市是否感染人有待于进一步的研究。
已有研究显示,HEV 中能感染人的巴拉扬尼种(Paslahepevirus balayani)的8个基因型中有4个(HEV-1~HEV-4)主要感染人,其中HEV-1和HEV-2只感染人,而HEV-3 和HEV-4 为人兽共患,猪为其主要的宿主动物。随着养殖业的发展,猪的饲养时间逐渐缩短,一般在半年以内屠宰,所以猪做为HEV-3、HEV-4 保存宿主而导致的感染传播的概率可能会逐渐减少[24]。而鼠类,特别是褐家鼠等家鼠,具有分布广泛、种类数量繁多、繁殖能力强、适应性强等特点,与人类和其他动物的联系又十分密切,其携带的HEV 值得继续关注[23]。病毒分歧时间结果显示,大理市褐家鼠中发现的HEV-C1 出现的时间较晚,有从其他宿主动物感染演化而来的可能。同时,世界各地褐家鼠携带HEV-C1 或相关的HEV 病毒均有报道[25],所以鼠类作为HEV 的宿主动物的情况值得重视。
