包裹R848 的PS仿生脂质体增强H7N9 流感病毒灭活疫苗的黏膜免疫效应
2023-02-04向雨晴周慧旭王成龙张风华常海艳
刘 斌,向雨晴,周慧旭,王成龙,张风华,常海艳
(湖南师范大学生命科学学院,长沙 410081)
流行性感冒病毒(influenza virus)简称流感病毒,归属于正黏病毒科(Orthomyxoviridea),是一种ssRNA 病毒。其引起的流行性感冒以及相关并发症,在全球范围内平均每年造成将近50 万人死亡。根据病毒基质蛋白与核蛋白抗原性的不同,流感病毒家族被分为甲(A)、乙(B)、丙(C)、丁(D)四个型别。而A 型流感病毒在自然界最为常见,宿主具有多样性,且可跨物种传播,是导致流感流行及大流行的主要型别。其原因为,A 型流感病毒的血凝素(hemagglutinin,HA)和神经氨酸酶(neuraminidase,NA)裸露在病毒包膜上,基因片段在流感病毒基因组中最容易发生变异。A 型流感病又根据HA 以及NA 抗原性不同分为HA 亚型(H1~H18)与NA亚型(N1~N11)。感染人的亚型主要包括H5N1、H7N2、H7N3、H7N7、H7N4、H7N9、H5N6 和H5N8,而H7N9 引发的感染由于其前期症状与普通流感相似,后期发病迅速,死亡率可达到40%,已经在中国引发了五波感染,且暂无对应疫苗上市。
目前上市的流感疫苗有减毒活疫苗、灭活疫苗以及重组HA 蛋白疫苗,此外,流感mRNA 疫苗已进入临床后期[1]。目前,灭活疫苗依然是在世界各国广泛使用的流感疫苗,但其通过肌肉注射的途径接种,很难诱导产生黏膜免疫。事实上呼吸道黏膜上皮细胞才是流感病毒感染的第一靶位,相对传统的非胃肠道疫苗只能刺激机体产生相应的血清型免疫球蛋白G(immunoglobulin G,IgG)中和抗体,不能刺激呼吸道黏膜产生分泌型IgA(secretory IgA,sIgA),因此不能更加有效地阻止病毒在呼吸道内的繁殖。黏膜免疫较非胃肠道免疫效果更为理想。除了能诱导产生sIgA 抗体外,黏膜免疫的效应部位并不是只局限在最初致敏的黏膜部位,sIgA 特异性抗体形成细胞前体可从最初的黏膜部位经过位点特异性归家途径(site-specific homing pathways)迁移到全身其他部位。基于这些研究和共识,世界卫生组织(World Health Organization,WHO)大力提倡发展流感疫苗的黏膜免疫。合适的黏膜疫苗或佐剂不仅能诱导局部免疫应答,也可以使机体获得系统性免疫应答,特别是针对流感等呼吸道病毒有着至关重要的意义[2]。
肺表面活性物质(pulmonary surfactant,PS)作为肺黏膜系统的组成部分,既能构成阻止病原微生物进入肺泡区,进而侵袭到肺部的屏障,又能阻止纳米粒子以及亲水性药物分子的通过[3]。有研究发现,利用磷脂及固醇合成的肺表面活性物质的脂质体,能与STING(stimulator of interferon genes)激动剂环鸟苷一磷酸腺苷一磷酸(cyclic guanosine monophosphate-adenosine monophosphate,cGAMP)佐剂制备成PS-GAMP,与流感病毒疫苗包裹后经黏膜免疫小鼠诱导了IgG 和IgA 抗体,并能提供不同亚型流感病毒攻毒的交叉保护[4]。
瑞喹莫德(R848)是一种鸟苷衍生物,是Toll样受体(Toll-like receptors,TLR)7/8 的激动剂[5],最初是作为I 型干扰素(interferon,IFN)的诱导物开发出来的,因其具有抗肿瘤和抗病毒活性在临床得到运用。R848 可以促进Th1 型细胞因子如IFN-γ、IFN-α 和白细胞介素-12(interleukin-12,IL-12)等的分泌,能增强针对抗原的细胞免疫和抗体产生,是一种潜在的 Th1 型候选佐剂[6]。很有趣的一点是,R848 既可以作为一些病毒的抗病毒性药物,又可以作为疫苗佐剂。而作为佐剂,与TLR4 激动剂(脂多糖)和TLR9 激动剂(CpG-C)相比,R848 在体内诱导CD8+T 细胞和IFN-γ+CD8+T 细胞在淋巴结中聚集的程度更大,佐剂效果更强[7-8]。R848 经皮内或鼻内免疫都具有普遍的免疫刺激作用,可以促使鼻内T 细胞激活,诱导体内IL-10 和IL-17 的产生。相反,经皮内免疫疫苗诱导的T 细胞分泌IL-10 的量减少。总之,黏膜免疫的效果与皮内免疫相比诱导的免疫应答较弱,这可能是由于皮内免疫后抗原提呈细胞(antigen-presenting cells,APC)对抗原的局部摄取更强所导致[9]。肺表面活性剂层是II型肺泡上皮细胞(alveolar epithelial cell,AEC)分泌的脂质和蛋白质的混合物,能够阻止R848 进入AEC,如果要使R848 发挥黏膜佐剂效应,必须将其运送到APC或AEC的细胞中,而不破坏AEC层的完整性。
鉴于此,本文利用磷脂及固醇合成肺表面活性物质形成的仿生脂质体PS,与R848 制备成PS-R848佐剂,检测其表征后与H7N9 流感病毒灭活疫苗混合,经鼻腔免疫BALB/c 小鼠,检测诱导的免疫效果与流感病毒攻毒后对免疫小鼠产生的保护效果,比较其与单独疫苗黏膜免疫的增强效果。
1 材料与方法
1.1 病毒、疫苗以及试验动物和细胞
试验动物:6~8 周龄的雌性无特定病原级BALB/c 小鼠(Mus musculus,ired strain),购自斯莱克景达生物有限公司,饲养于本校无特殊病原菌(specific-pathogen-free,SPF)级动物房。
H7N9 病毒株(NIBRG-26):由上海生物制品研究所赠予。
H7N9 全病毒灭活疫苗及佐剂:由上海生物制品研究所提供。
MDCK细胞:本实验室保存。
1.2 佐剂PS-R848的合成
脂质体中含有二棕榈磷脂酰胆碱(dipalmitoyl phosphatidylcholine,DPPC)、二棕榈磷脂酰甘油(dipalmitoyl phosphatidylglycerol,DPPG)、二棕榈磷脂酰乙醇胺-聚乙二醇(dipalmitoyl ethanolamine polyethylene glycol,DPPE-PEG)和胆固醇(cholesterol,Chol),其比例为m(DPPC)∶m(DPPG)∶m(DPPE-PEG)∶m(Chol)=10∶1∶1∶1,均购自MeloPEG 公司。准确称取20 mg DPPC,等比例称取DPPG、DPPE-PEG 和Chol 试剂,将以上试剂溶于3 mL 的三氯甲烷中。并用PBS 配置1 mg/mL 的R848 溶液(R848 购自 Invivogen 公司)。利用薄膜分散法制备脂质体,将以上溶有磷脂的三氯甲烷置于旋转蒸发仪上的50 mL蒸馏瓶中,50℃条件下以220 r/min 旋转,温和地去除有机溶剂。待蒸馏瓶壁上呈现凝胶状薄膜时,加入1 mL 溶有1 mg R848 佐剂的缓冲液或1 mL 不含R848 佐剂的缓冲液,50℃条件下以220 r/min 旋转,进行水化,获得水性混悬液,再经0.45 μm 聚碳酸酯膜挤压塑形,获得装载R848 的PS 脂质体(PS-R848)与空白PS 脂质体,脂质体悬液再在4℃条件下以10 000g离心90 min,将未包裹的佐剂与脂质体分离,上清存于-4℃,脂质体加定量缓冲液后,再加入5%的海藻糖冻干存于-80℃。用马尔文Nano ZS90 动态光散射粒径电位仪检测粒径及Zeta电位,用透射电子显微镜(transmission electron microscope,TEM)检测脂质体。
1.3 小鼠免疫、病毒感染及取样
采用滴鼻免疫途径对小鼠做单次黏膜免疫。试验选取6~8 周龄的 BALB/c 小鼠为动物模型,随机将60 只小鼠分为 5 组,每组12 只,分别设置为阴性对照组(仅滴鼻免疫20 μL PBS)、单独疫苗组(0.5 μg疫苗)、疫苗+佐剂poly(I∶C)组、疫苗+R848组(0.5 μg 疫苗+10 μg R848)以及疫苗+PS-R848 组(0.5 μg 疫苗+10 μg PS-R848)。其中,每只小鼠的疫苗用量为0.5 μg(以流感疫苗所含 HA 的计量为准),R848 为10 μg(PS-R848 中以R848 的含量为准)。疫苗+佐剂的配制过程:将灭活疫苗稀释到0.05 mg/mL,佐剂稀释到1 mg/mL,将疫苗与各佐剂或PBS 按体积1∶1 的比例混合后,在冰箱中使用圆盘旋转混匀仪混匀2 h,之后,按每只小鼠20 μL进行滴鼻免疫。单次免疫后3 周,从小鼠下颔静脉取血,用于抗体检测;而后将小鼠麻醉,通过滴鼻的方式用致死剂量(20 LD50)鼠适应型NIBRG-267(H7N9)病毒感染小鼠,观察感染后小鼠的体征、体重变化和存活率。病毒感染3 d 后,每组取3 只小鼠用氯仿麻醉,取小鼠肺脏于 1.5 mL 病毒稀释液中匀浆,8 000 r/min 离心 20 min,取上清,分装后于-80℃保存,用于肺部病毒的滴度测定。
1.4 抗体检测
用酶联免疫吸附法(enzyme-linked immunosorbent assay,ELISA)测定疫苗特异性BALF-sIgA 和IgG 抗体及其亚类 IgG1 和 IgG2a 的抗体效价。首先,用含10 µg/mL NIBRG-267(H7N9)的灭活疫苗包被96 孔酶标板,37℃温育 2 h 后加入封闭液[含1%牛血清白蛋白(bovine serum albumin,BSA)的PBS]37℃温育 2 h;然后,将待测样本作 2 倍系列稀释后加入酶标板中,37℃温育 2 h;加入生物素标记的羊抗鼠IgA、IgG、IgG1 或IgG2a 二抗(Southern Biotechnology Associates,Inc.,USA),37℃温育 1 h;加入碱性磷酸酶标记的链菌蛋白(Southern Biotechnology Associates,Inc.,USA),37℃温育 1 h;最后,加入含有底物 pNPP(Southern Biotechnology Associates,Inc.,USA)的显色液,37℃培养箱温育30 min。用酶标仪(GENios,TECAN)测定波长为405/450 nm的光密度(optical density,OD)值,与对照组的平均值+2×标准差(+2s)进行比较,确定抗体IgA、IgG、IgG1 和IgG2a的最高稀释度。
1.5 细胞因子检测
用ELISA 方法测定免疫后小鼠产生的细胞因子 IFN-γ、IL-2、IL-4 和 IL-5 的分泌量。单次免疫后3 周,每组随机选3 只小鼠取脾脏,无菌条件下分离淋巴细胞,显微镜下计数后加入24 孔板中37℃培养4 h,再加入5 μg/mL 流感病毒 H7N9 灭活疫苗刺激细胞,37℃继续培养48 h。而后,将培养液以1 500 r/min离心5 min,取上清。
按照细胞因子 ELISA 试剂盒(达科为生物技术股份有限公司)说明书的方法操作,读取450 nm 处OD值后,在标准曲线上确定细胞因子的含量。每组小鼠的细胞因子的含量用样本的平均值 ± 标准差(±s)表示。
1.6 肺部病毒滴度检测
采用噬斑分析法测定小鼠肺部的残余病毒滴度。将小鼠肺匀浆液用病毒释稀液按 10 倍梯度稀释后,分别接种于长有MDCK 细胞(细胞占孔面积的80%左右)的 96 孔板中,37℃培养48 h;观察MDCK细胞的病变效应。每个样本的病毒滴度用Reed-Muench方法计算半数组织培养感染量(median tissue culture infective dose,TCID50)。每组小鼠的病毒滴度值用每毫升样本的平均值±标准差(±s)表示。
1.7 统计与分析
使用GraphPad Prism 中one-way ANOVA 方法对抗体滴度、细胞因子含量、小鼠肺部病毒残余量以及小鼠体重丢失率等进行分析;用long-rank test 分析小鼠的存活率,当P值小于0.05 时,则认为在统计学上具有显著性差异。
2 结果与分析
2.1 脂质体的表征
为了评价制备的脂质体的质量,用马尔文Nano ZS90 动态光散射粒径电位仪检测粒径及Zeta 电位检测本试验中所制备的脂质体,结果如图1 所示。PS 脂质体的粒径为(353.9±88.4)nm,聚集度指数(polydispersity index,PDI)为0.024,Intercept 为0.927,Zeta 电位为-18.3 mV。PS-R848 脂质体的粒径为(392.7±127.3)nm,PDI 为0.137,Intercept 为0.920,Zeta电位为-12.0 mV。

图1 空白仿生PS脂质体与PS-R848 脂质体粒径与电位分布Fig.1 Particle size and potential distribution of uncoated bionic PS liposomes and PS-R848 liposomes
TEM 电镜观察得到的PS-R848 脂质体为球形,分散系数良好,无聚集;利用高效液相色谱(high performance liquid chromatography,HPLC)280 nm 波长检测PS-R848 脂质体,代入EN/%=(1-Cf/Ct)×100% 公式中,计算得出PS-R848 的包封率(EN)为76.3%(图2)。Cf为脂质体悬液离心后上清中R848含量,Ct为悬液中R848的总量。
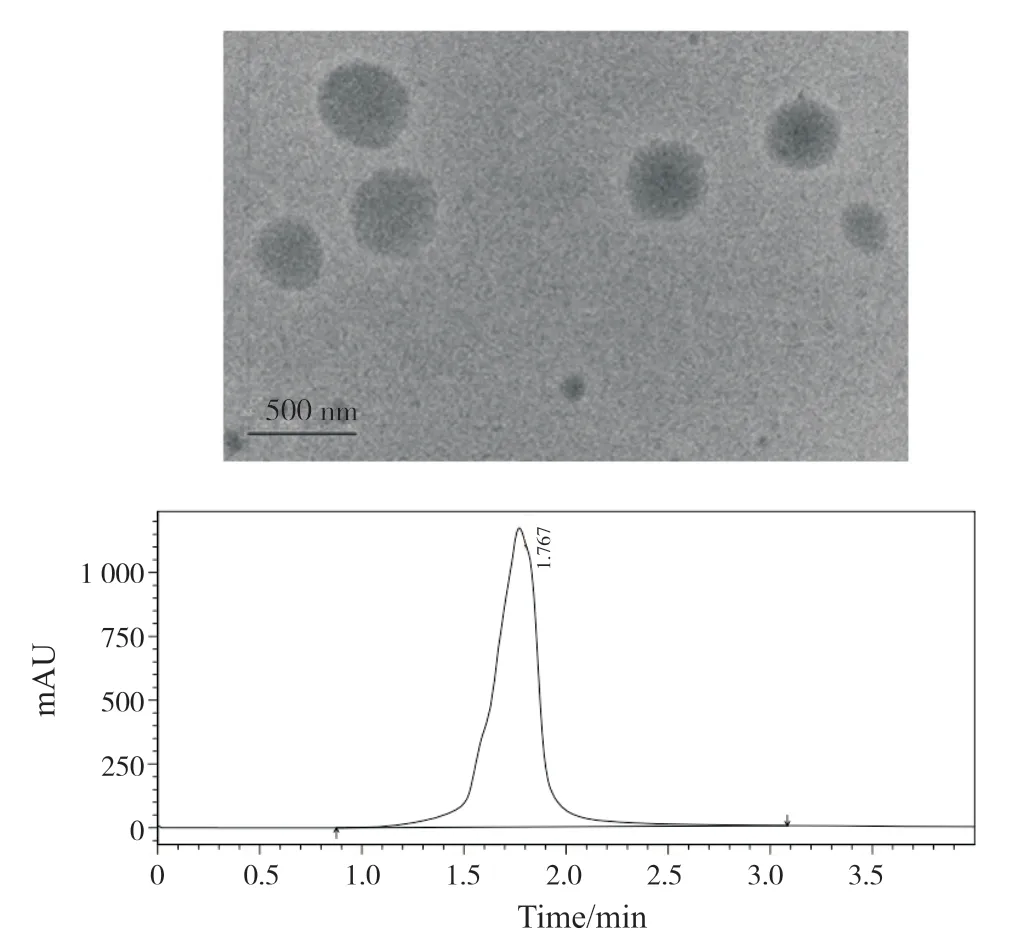
图2 PS-R848脂质体的TEM电镜图与HPLC测定未包封R848峰面积Fig.2 TEM electron microscopy of PS-R848 liposomes and HPLC determination of unencapsulate R848 peak area
2.2 抗原特异性sIgA抗体滴度
为了评价PS-R848 做黏膜佐剂诱导产生sIgA的免疫应答,将H7N9 流感全病毒灭活疫苗与佐剂混合后经滴鼻共免疫小鼠1 次,3 周后取小鼠肺洗液,用ELISA 方法检测抗流感病毒的特异性sIgA抗体滴度。从图3 可知,疫苗+poly(I∶C)试验组以及疫苗+R848 试验组较单独疫苗组诱导的sIgA含量都显著提高,分别提高了4 倍与3 倍。疫苗+PS-R848 佐剂组的小鼠产生的sIgA 含量较疫苗+R848 组提高了4 倍,且其与单独疫苗组以及疫苗+poly(I∶C)组比较分别提高了12倍与3 倍以上,均具有显著性差异。
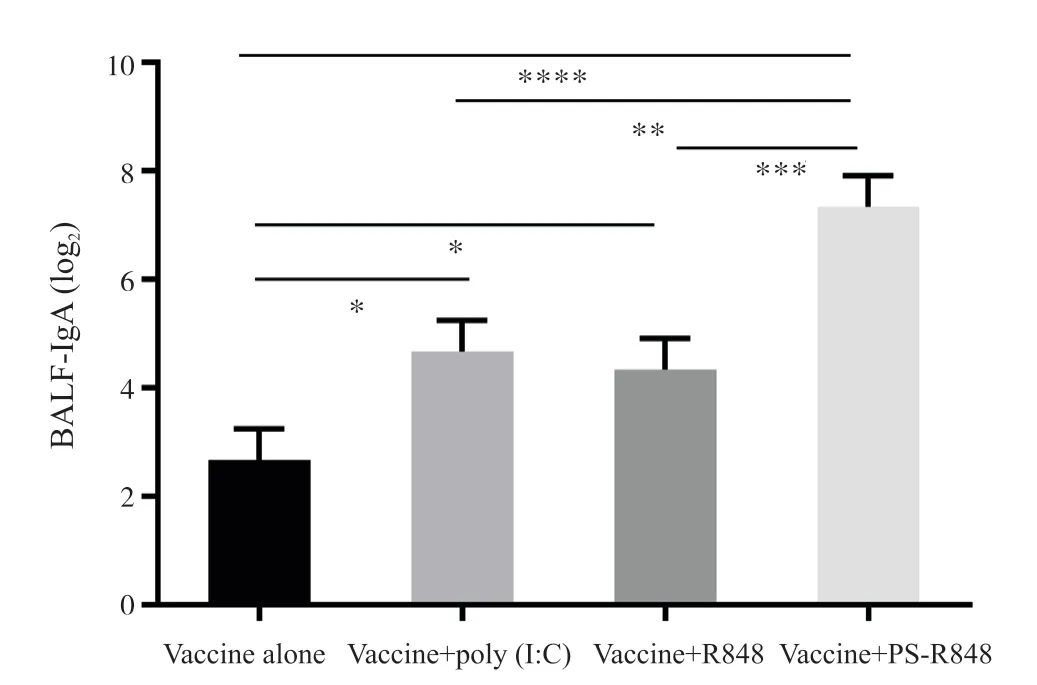
图3 免疫3周后诱导的小鼠支气管肺泡灌洗液 IgA含量Fig.3 BALF IgA titers of mice 3 weeks after immunization
2.3 免疫后小鼠血清中抗原特异性IgG 及其亚型IgG1、IgG2a效价
为评价PS-R848 做黏膜佐剂经滴鼻免疫小鼠诱导的血清抗体滴度,在小鼠免疫1 次后3 周,从每组随机取3 只小鼠取血,用ELISA 方法分别检测血清中的疫苗特异性IgG 抗体和IgG1、IgG2a 的亚类抗体,抗体结果如图4所示。ELISA 结果显示,与未免疫的对照组相比,所有免疫组小鼠体内均诱导产生了疫苗特异性的IgG 抗体(图4a),与无佐剂疫苗组相比,疫苗中添加了佐剂的免疫组小鼠 IgG 抗体滴度均有显著提升(P <0.05)。其中,疫苗+poly(I∶C)组以及疫苗+R848 组较单独疫苗组诱导的IgG 含量分别提高了40 倍与20 倍,疫苗+PS-R848 组分别与单独疫苗组、疫苗+poly(I∶C)与疫苗+R848 比较,依次提高了512 倍、12 倍、25 倍,均具有显著性增加。疫苗+poly(I∶C)组与单独疫苗组IgG1与IgG2a含量均提高了20 倍与25 倍,疫苗+R848 组较单独疫苗组诱导的IgG2a 含量具有显著性差异,提高了12 倍以上。疫苗+PS-R848 组诱导的IgG1 与IgG2a较单独疫苗组与疫苗+R848 组均具有显著性差异(图4b~4c),分别提高了40 倍与203 倍。此外,Ig-G2a/IgG1 偏向表明,单独疫苗组偏向体液免疫,疫苗+PS-R848 组的IgG1 和IgG2a 均有增加,但IgG2a/IgG1的结果表明,免疫反应偏向于Th1 型。
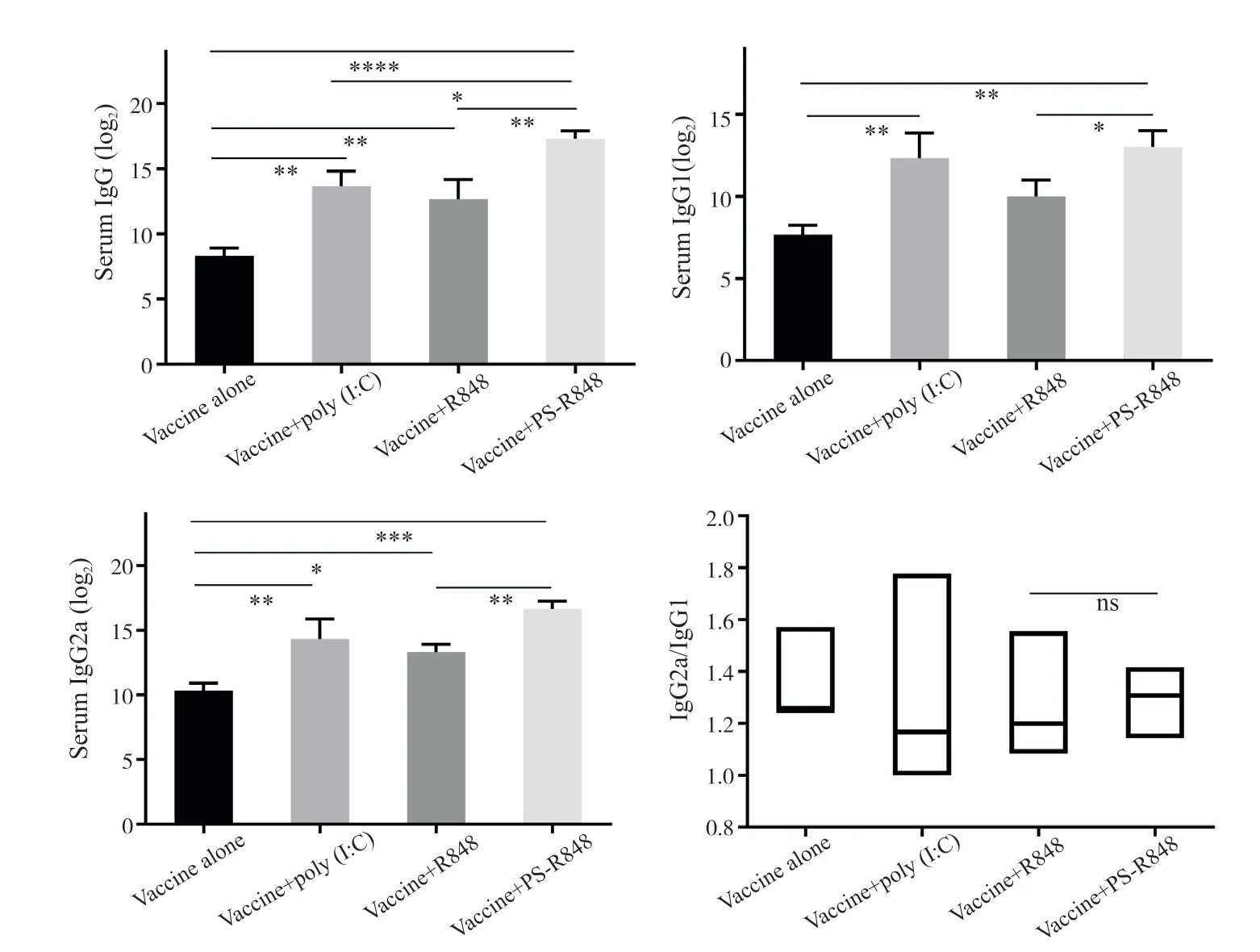
图4 免疫3周后诱导的小鼠血清IgG抗体及其分型抗体效价Fig.4 IgG、IgG1 and IgG2a antibody titers in sera of mice 3 weeks after immunization
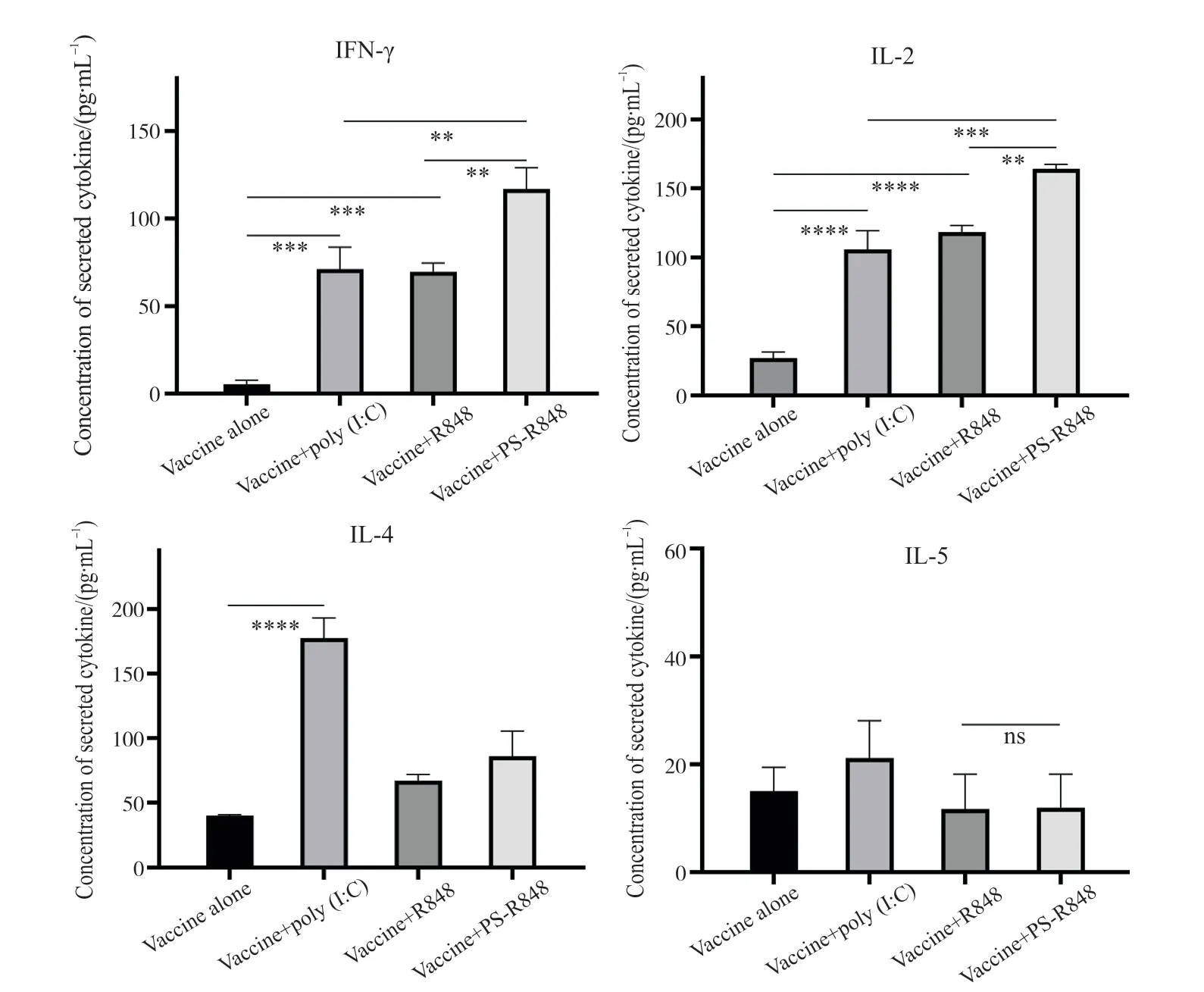
图5 免疫后小鼠脾淋巴细胞受刺激后上清中细胞因子分泌量Fig.5 Secretion of cytokines in splenic lymphocytes of mice 3 weeks after immunization
2.4 免疫小鼠后检测脾淋巴细胞刺激后细胞因子分泌量
为了检测PS-R848 脂质体做黏膜佐剂诱导的细胞免疫效应,小鼠经滴鼻免疫1 次后3 周,每组取3 只小鼠,分离小鼠脾脏淋巴细胞。淋巴细胞经培养后用H7N9 灭活疫苗刺激,收集培养液,用 ELISA试剂盒分别检测其中含有的 IFN-γ、IL-2、IL-4 和IL-5 4 种细胞因子的分泌量。结果如图 5 所示,单独疫苗组小鼠的4 种细胞因子分泌量都很低,疫苗+poly(I∶C)较单独疫苗组诱导的INF-γ、IL-2、IL-4含量均显著性增加,这表明其诱导了细胞与体液混合免疫应答。而疫苗+R848 较单独疫苗组INF-γ、IL-2 含量显著增加,但IL-4、IL-5 含量较单独疫苗组无显著性差异,这表明其诱导偏向细胞免疫应答。疫苗+PS-R848 组较疫苗+R848 组与疫苗+poly(I∶C)组,均具有显著性差异。
2.5 经鼻腔免疫的小鼠攻毒后的保护效应
为评价 PS-R848 佐剂黏膜免疫小鼠后对流感病毒感染提供的保护效果的影响,我们将各组6 只小鼠,经滴鼻免疫1 次,在免疫3 周后用致死剂量(20 LD50)的H7N9 同源病毒进行攻击。在攻毒后21 d 内观察并记录小鼠的状态、体重变化及存活情况和病毒感染后小鼠肺部病毒滴度。结果表明:疫苗+PS-R848组小鼠全部存活(图6a),存活率与各组疫苗免疫后的小组相比,均有显著性差异;病毒攻击后小鼠的体重丢失曲线波动更小(图6b),且最大体重丢失率较单独疫苗组与疫苗+R848 组显著降低。图7 所示的小鼠肺部病毒滴度结果表明,疫苗+R848 组与疫苗+poly(I∶C)组较对照组均显著降低,疫苗+PS-R848组较其他组显著降低。
图6 小鼠免疫后致死量流感病毒攻击后存活率与体重丢失率Fig.6 Survival rate and body weight change of mice within 21 days after lethal-dose challenge
图7 免疫后攻毒小鼠肺部病毒滴度Fig.7 Lung virus titer of mice against lethal virus challenge
3 讨论
每年规律性的接种疫苗,是应对当前流感病毒流行最有效的策略。但由于流感病毒高度易变,以及可能出现的原始抗原过失(original antigenic sin,OAS)现象,现有疫苗的免疫效力并不一定能有效地抵御流行株的感染,故需要寻找合适的佐剂去增强疫苗的免疫应答、改善免疫偏向或诱导交叉保护作用。由于流感病毒是呼吸道病毒,经黏膜免疫诱导的sIgA 产生的免疫应答,对于阻止流感病毒的感染有非常重要的意义。由于黏膜对外来物质的清除效应以及疫苗递送到黏膜表面后引起的免疫反应较弱的原因,需要有效的黏膜免疫佐剂或递送系统,促使抗原释放延长来改善免疫效应。R848作为流感疫苗佐剂,可显著增加疫苗的免疫应答反应,在24 h 内,R848 可显著增加淋巴结中细胞数量,以及早期B 细胞的激活,减少病毒感染后肺部损伤[10-11]。此外,Holbrook 等[12]的研究发现,R848经鼻内或皮内免疫均可以诱导树突状细胞(dendritic cell,DC)亚群的局部转移,引流淋巴结CD11b+DC增加,CD103+DC减少,偏向于Th1 型极化。Clemens等[13]将甲型流感疫苗与R848 混合后对幼年非洲绿猴免疫,引发了针对高度保守的HA 茎部抗体应答,并在病毒攻击后促进病毒中和特异性抗体的快速诱导,证明其能在幼儿这一高危人群中增强对异源流感病毒的抗体应答能力。此后一年,Crofts 等[14]的新研究采用老年非洲绿猴(African green monkeys,AGM)模型对R848 作为IPR8 佐剂的效果进行评估,观察到接种IPR8-R848 而非单独接种IPR8 的AGM,初次接种后10 d 病毒特异性IgM 抗体水平升高。此外,在IPR8-R848 疫苗接种动物中病毒特异性IgG 显著增加。因此,R848 作为佐剂能有效扩宽流感疫苗的适龄人群。
R848 作为TLR7/8 激动剂,具有诱导过度免疫的危险,替代措施一般为采用脂质体或其他纳米颗粒对其进行包埋或吸附[15],将其保持在给药或靶向部位,改善其药代动力学[16]。而Dowling 等[17]在其多项研究中进一步证明其可行性。
肺表面活性物质覆盖在整个呼吸道与肺表面,作为抵御细菌、病毒等有害物的屏障。有研究表明,在食蟹猕猴上利用肺表面活性剂制备的脂质体,通过鼻腔递送裂解流感疫苗,相对单独疫苗,更有效诱导了试验动物的sIgA 和IgG 的分泌量,更明显地表现出对异源病毒的交叉保护作用[18]。
在本研究中,我们利用小鼠模型探讨了仿生PS包裹R848 做黏膜佐剂,经滴鼻免疫流感H7N9 全病毒灭活疫苗的免疫增强效果。滴鼻免疫一次后,用致死剂量(20 LD50)的同源病毒进行攻击。攻毒后通过检测小鼠的存活率、体重变化和肺部病毒滴度来评判黏膜免疫效果。试验结果表明,PS-R848作为疫苗佐剂能够100%保护小鼠抵抗病毒的攻击,小鼠的体重丢失率与R848与H7N9流感病毒灭活疫苗混合后免疫的相比,由16.71%降低到了9.95%,且肺部病毒滴度最低。由此可见,R848仿生PS脂质体增强了H7N9流感病毒灭活疫苗的黏膜免疫效应。
ELISA检测的系统性血清抗体IgG、IgG1、IgG2a效价与细胞因子IFN-γ、IL-2 与未包裹的R848 佐剂组相比均显著增加,支气管肺泡灌洗液中的分泌型IgA 含量也显著提高,这表明,PS 脂质体对R848 的递送既增强了系统免疫应答,也增强了肺局部的免疫应答。IgG2a/IgG1 的比值能在一定程度上判断细胞免疫与体液免疫的平衡,其比值越高,越偏向Th1 型免疫[19]。本试验中疫苗+PS-R848 组与疫苗+R848组比较,细胞因子IFN-γ与IL-2含量有显著提高,且两组IgG2a/IgG1 比值无显著性差异,这表明,PS 脂质体的递送并没有明显的改变R848 的免疫偏向,且能提高其引起的细胞免疫应答效果。这均表明,PS-R848脂质体作为H7N9流感病毒灭活疫苗黏膜佐剂,是值得进一步的研究与优化的。
