抗生素与杀菌剂顺序暴露对绿藻的联合毒性
2023-02-04李超杰农琼媛覃礼堂莫凌云梁延鹏曾鸿鹄邓振贵
李超杰,农琼媛,覃礼堂,2,3*,莫凌云,梁延鹏,2,3,曾鸿鹄,2,3,邓振贵,刘 良
抗生素与杀菌剂顺序暴露对绿藻的联合毒性
李超杰1,农琼媛1,覃礼堂1,2,3*,莫凌云2,3,4,梁延鹏1,2,3,曾鸿鹄1,2,3,邓振贵5,刘 良5
(1.桂林理工大学环境科学与工程学院,广西 桂林 541004;2.桂林理工大学广西环境污染控制理论与技术重点实验室,广西 桂林 541004;3.桂林理工大学岩溶地区水污染控制与用水安全保障协同创新中心,广西 桂林 541004;4.自然资源部南方石山地区矿山地质环境修复工程技术创新中心,广西 南宁 530022;5.恒晟水环境治理有限公司,广西 桂林 541199)
本文选取常见的3种抗生素盐酸强力霉素(DOX)、红霉素(ERY)、土霉素(OXY)和3种三唑类杀菌剂腈菌唑(MYC)、丙环唑(PRO)、戊唑醇(TCZ)混合体系为研究对象,以生态系统中初级生产者绿藻(蛋白核小球藻)为受试生物,研究目标污染物顺序暴露的联合毒性.结果表明,6种单一目标污染物对蛋白核小球藻抑制毒性大小为:PRO>DOX>TCZ>ERY>MYC>OXY.抗生素-三唑类杀菌剂混合体系在50%效应浓度(EC50)下同时暴露和顺序暴露的抑制率差异为0.38%~36.76%.DOX与PRO、TCZ、MYC任何一种三唑类杀菌剂顺序暴露于蛋白核小球藻,顺序相反后,对蛋白核小球藻的毒性作用均增强,最大可增强36.82%.在不同浓度与时间的影响下,PRO-DOX和TCZ-DOX顺序暴露毒性高于调整暴露顺序后的DOX-PRO和DOX-TCZ顺序暴露毒性,且浓度越高,抑制率差异越大.在96h~144h暴露时间下,暴露浓度EC50/20的顺序暴露抑制率差异为0.65%~11.57%;暴露浓度EC50的顺序暴露抑制率差异为0.15%~36.93%,顺序暴露的抑制率差异范围随浓度增加变大.在EC50/20~EC50暴露浓度下,暴露时间96h的顺序暴露抑制率差异为0.29%~36.93%,暴露时间144h的顺序暴露抑制率差异为0.215%~30.09%,顺序暴露的抑制率差异范围随时间增加变小.因此,顺序暴露会改变抗生素与三唑类杀菌剂对蛋白核小球藻联合毒性大小,且顺序暴露、暴露时间和暴露浓度是影响毒性作用大小的关键因素.
抗生素;三唑类杀菌剂;蛋白核小球藻;联合毒性;顺序暴露
抗生素自临床以来,被广泛地应用于人类及动物的疾病防治等领域[1].人体和动物的代谢不足使抗生素大部分以原药形式排出,同时传统技术处理效果不理想,去除率低,导致处理后的污水和污泥中仍含有大量抗生素直接排入环境中[2-3].我国作为一个农业大国,农药使用居世界第一,三唑类杀菌剂农药因具有广谱、低毒、高效等优点,被广泛应用于农作物及经济作物的病菌害防治[4].在农业生产过程中,农药易在食品、农作物、土壤和水体中残留甚至累积[5].已有研究发现农用地土壤中存在大环内酯类抗生素和杀菌剂残留污染[6].因此,抗生素和三唑类杀菌剂的大量使用不可避免地使其进入环境最终威胁人体健康.
污染物毒性大小的影响因素主要包括暴露组分、暴露剂量(浓度)、暴露顺序与暴露时间.研究表明污染物的毒性随浓度或时间的变化而变化[7-10].例如,3种氨基糖苷类抗生素对青海弧菌Q67与蛋白核小球藻的联合毒性[11],Cd2+与S-异丙甲草胺对斜生栅藻的联合毒性[12],土霉素、环丙沙星与戊唑醇及其混合污染物对羊角月牙藻的联合毒性[13],都具有明显的时间依赖性,且混合物的联合毒性作用与暴露时间以及混合物组分的浓度配比等有关.因此,污染物的毒性与暴露组分、暴露剂量(浓度)和暴露时间密切相关.
然而暴露在环境中的污染物通常是偶发的和重复的,生物体可能同时或相继暴露于多种污染物中.但目前大多数研究主要集中于同时暴露,较少涉及污染物的顺序暴露.当生物体按顺序接触两种或多种毒物时,如果顺序不同,毒性效应可能增强或减少.例如,在蚤状钩虾的毒性暴露实验中,按顺序暴露于西维因和毒死蜱的蚤状钩虾,先接触毒死蜱会导致随后的西维因暴露死亡率显著增加[14];四种作用于不同靶标的毒物(二嗪农,丙环唑,4,6-二硝基邻甲酚,4-硝基苄氯),其中两种毒物的暴露顺序相反,对蚤状钩虾的毒性有明显差异[15];受污染河流中的蚤状钩虾对农药暴露的敏感性比未受污染河流中的个体高是河流中农药顺序暴露的结果[16].因此,决定污染物的毒性大小的主要因素,除了暴露组分、暴露剂量(浓度)与暴露时间之外,暴露顺序同样也是一个关键的决定因素.人类以及其他有机体在环境中都是同时暴露或顺序暴露于多种有毒物质中,只考虑同时暴露可能会低估或高估其环境影响.因此,开展顺序暴露毒性研究具有重要的现实意义.
为了揭示污染物顺序暴露对蛋白核小球藻联合毒性大小的影响,本文选取3种抗生素和3种三唑类杀菌剂来探究其顺序暴露对蛋白核小球藻的联合毒性,运用等效应固定浓度比射线法(EECR)共设计9个抗生素-三唑类杀菌剂二元混合体系.以期为抗生素与杀菌剂顺序暴露的生态风险评估提供数据支撑.
1 材料与方法
1.1 目标污染物
研究选取被广泛应用于人类和动物疾病治疗的3种抗生素:盐酸强力霉素(Doxycycline hyclate, DOX,CAS号:24390-14-5)、红霉素(Erythromycin, ERY,CAS号:114-07-8)和土霉素(Oxytetracycline, OXY,CAS号:79-57-2);常应用于农业生产中的3种三唑类杀菌剂:腈菌唑(Myclobutanil,MYC,CAS号: 88671-89-0)、丙环唑(Propiconazole,PRO,CAS号: 60207-90-1)和戊唑醇(Tebuconazole,TCZ,CAS号: 107534-96-3).DOX、ERY、OXY和MYC标准品购买于CATO Research Chemicals Inc,PRO和TCZ标准品购买于Dr. Ehrenstorfer GmbH,所有污染物标准品的纯度均大于99%.
1.2 受试生物及藻种培养
指示生物蛋白核小球藻()购自中国科学院淡水藻种库,藻种编号为FACHB-5,使用BG11培养基进行培养[17].在灭菌超净工作台中将纯藻种转移至装有100mL新鲜配置的BG11培养基的250mL无菌锥形瓶内,封口,放置光照培养箱内培养,温度22℃,光照条件2000~3000Lux,光暗时间周期12h/12h[18].每天定时摇动3~4次,并随机调换位置,每隔96h接种一次,使藻种进行无菌繁殖和驯化,反复接种2~3次,接种时间应在藻类细胞代谢最旺盛时期(上午10:00左右)至藻基本达到同步生长[19],取对数生长期的藻进行试验,试验前在显微镜观察确保藻液没有被污染[20].
1.3 混合物暴露浓度设计
混合物的顺序暴露浓度设计采用等效应固定浓度比射线法(EECR)[21],将混合物中各组分按各自EC50/20、EC50/10、EC50/2、EC504个产生相同效应时的浓度比进行混合.由于混合物中各组分的剂量-效应曲线(CRC)在一定范围内具有平行关系,等效应浓度比混合在混合物浓度空间中对应的点,往往在一条直线上,从而可以类似将其看作上述均分射线法的一条射线,并可以将其看做是一个独立的物质.
1.4 顺序暴露实验设计及毒性测试
以96孔微孔板作为载体,开展二元混合物(含组分A与组分B)顺序暴露毒性实验,在微板四周共36个孔各加入300μL超纯水,防止产生边缘效应.余下60个孔的第2、6、7及11列共24个孔中分别是空白对照组,空白对照组加入50μL超纯水.第3列共6个孔以及第8列共6个孔分别加入按确定好的稀释因子设计的4个不同浓度的A组分50μL,第4和5列为第3列的平行实验,第9和10列为第8列的平行实验,然后在除四周外的60个孔中均加入100μL已稀释好的藻液,使各孔的试液总体积为150μL,每个浓度至少重复3块板,盖上透明盖板密封,静置15min后,将板置于多功能酶标仪中测定OD值,作为暴露时间=0h,然后将测完后的板置于光照培养箱中培养,培养条件不变,待达48h时再次测定其OD值作为A组分的OD48h,测完并立即对应地按确定好的稀释因子设计的12个不同浓度的B组分50μL加入实验组,并以之对应地在对照组加入50μL蒸馏水,此时除四周外的60个孔的总体积为200μL,盖上透明盖板密封,静置15min,将板置于多功能酶标仪中测定OD值,作为B组分的OD0h,然后将测完后的板置于光照培养箱中培养,并分别在96 与144h时测其OD值.并由此计算对应时间点的目标化合物对蛋白核小球藻的生长抑制率,抑制率计算公式如式(1)[22]:
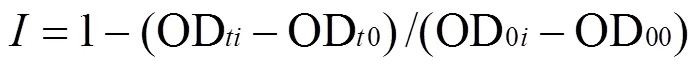
式中:OD为第(=0,48,96,144h)时刻污染物实验组的藻液OD值,OD0i为时刻空白对照组的藻液OD值.
1.5 毒性数据处理
毒性数据用抑制率平均值表示,应用Excel进行单因素方差分析,<0.05表示两组间存在显著差异.
单个化学物质或混合物组分对某生物靶的毒性可通过逐渐稀释的方法获得不同浓度水平进而进行毒性测试得到该物质的剂量-效应关系[23],采用两参数非线性函数Weibull(式(2))和Logit(式(3))对浓度-抑制率数据进行非线性最小二乘拟合,选择确定系数(2)最大或均方根误差(RMSE)最小者为最优拟合函数[24],得到剂量-效应曲线(CRC).根据CRC曲线可以计算出不同浓度下所对应的效应值,同时可以利用函数的反函数计算出不同效应下对应的浓度[25].
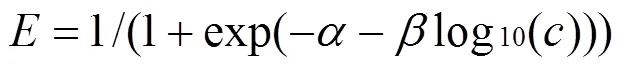
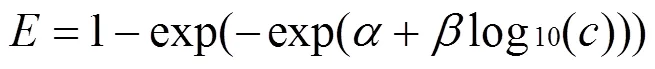
式中:是Weibull和Logit的位置与斜率参数,为效应即污染物对蛋白核小球藻的生长抑制率,是单个污染物或混合物的浓度.
1.6 联合毒性作用类型
在用混合物联合毒性效应系数判断联合毒性作用类型的基础上[26],改进采用的置信区间判断相互作用类型,运用Matlab计算,的置信区间下限:-Low=PEC/OEC_up,OEC_up为指定效应下,混合物实验效应浓度的上限;的置信区间上限-up=PEC/OEC_low,其中OEC_low为指定效应下,混合物实验效应浓度的下限.联合毒性作用类型判断:<-low为拮抗作用,-low<<-up为加和作用,>-up为协同作用.
2 结果与分析
2.1 单一目标污染物对蛋白核小球藻的毒性
6种目标污染物对蛋白核小球藻的毒性数据经Weibull或Logit函数拟合得到剂量-效应曲线(CRC)如图1,6种目标污染物对蛋白核小球藻在96h的毒性效应数据均表现为抑制作用,且浓度越大抑制率越大,呈现经典的S型.以半数效应浓度的负对数(EC50)为毒性大小指标,在96h的暴露下,6种目标污染物毒性大小为:PRO > DOX > TCZ > ERY > MYC > OXY,EC50值分别为5.737,5.483,5.041, 4.808,4.269,4.026mol/L.藻类对不同种污染物敏感程度差异很大,造成这种毒性差异的主要原因可能与污染物自身的结构性质有关[27].
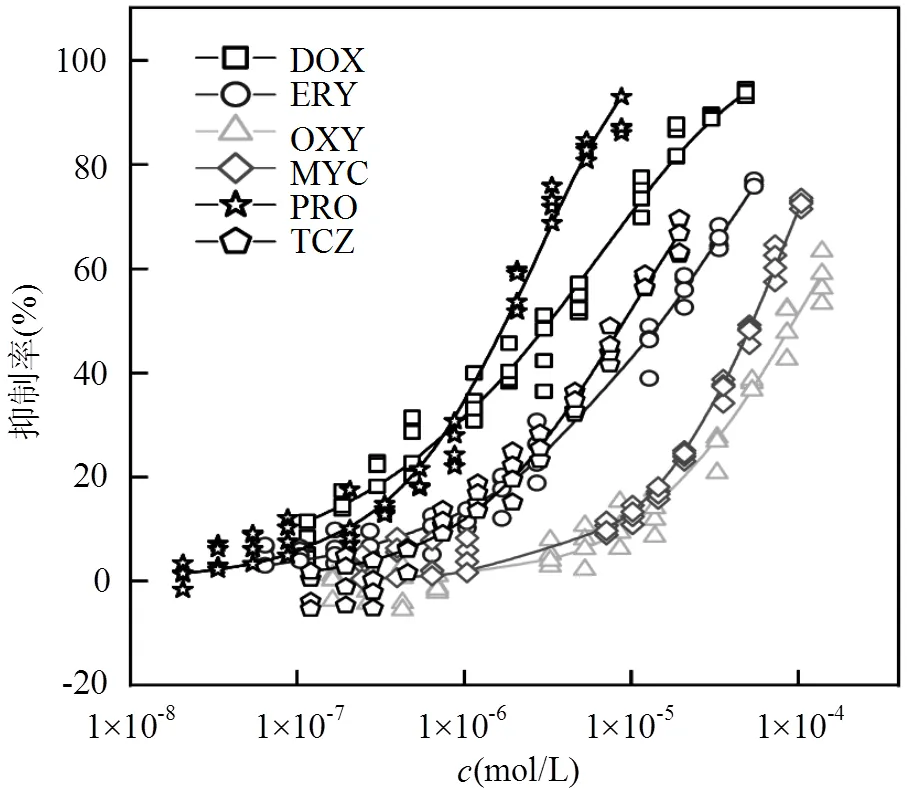
图1 6种目标污染物对蛋白核小球藻96h的剂量-效应关系
2.2 相同浓度下顺序暴露对蛋白核小球藻联合毒性
为了揭示污染物顺序暴露对蛋白核小球藻的联合毒性大小的影响,以抗生素-三唑类杀菌剂混合物为研究对象,在两种污染物保持相同EC50浓度下,调整暴露顺序,研究污染物按不同顺序暴露组成的混合物和同时暴露组成的混合物对蛋白核小球藻的联合毒性差异.
DOX与三唑类杀菌剂顺序暴露的混合物毒性随时间变化见图2,联合毒性效应系数均在-low、-up之间,为加和作用.DOX与任何一种三唑类杀菌剂顺序暴露于蛋白核小球藻,顺序相反后,毒性作用增强,这与Zhang的等[28]研究结果一致.在暴露时间96h下(图2C),DOX与TCZ体系毒性作用增强效果最明显,DOX-TCZ顺序暴露抑制率(73.16%)比TCZ-DOX顺序暴露抑制率(36.34%)高36.82%. DOX+PRO同时暴露毒性(64.08%)与DOX-PRO顺序暴露毒性(27.32%)差异最大(图2C),抑制率绝对差值为36.76%.DOX+TCZ同时暴露毒性(73.16%)与TCZ-DOX顺序暴露毒性(67.67%)差异最小(图2C),抑制率绝对差值为5.49%.在暴露时间144h下,顺序暴露明显低于同时暴露的抑制率.DOX+PRO同时暴露毒性(70.42%)与DOX-PRO顺序暴露毒性(24.59%)差异最大(图2b),抑制率绝对差值为45.83%.DOX+TCZ同时暴露毒性(77.27%)与TCZ- DOX顺序暴露毒性(71.57%)差异最小(图2C),抑制率绝对差值为5.7%.在暴露时间96h下,同时暴露和顺序暴露的抑制率差异为5.49%~36.76%.在暴露时间144h下,同时暴露和顺序暴露的抑制率差异为5.7%~45.83%.
ERY与三唑类杀菌剂顺序暴露的混合物毒性随时间变化见图3,联合毒性效应系数均在-low、-up之间,为加和作用.在暴露时间96h下,同时暴露的抑制率结果高于顺序暴露.ERY+TCZ同时暴露毒性(80.55%)与TCZ-ERY顺序暴露毒性(65.5%)差异最大(图3c),抑制率绝对差值为15.05%.ERY+PRO同时暴露毒性(73.90%)与PRO-ERY顺序暴露毒性(73.54%)差异最小(图3b),抑制率绝对差值为0.36%.在暴露时间144h下, ERY+MYC同时暴露毒性(92.36%)与MYC-ERY顺序暴露毒性(84.03%)差异最大(图3a),抑制率绝对差值为8.33%.ERY+PRO同时暴露毒性(88.13%)与PRO-ERY顺序暴露毒性(89.19%)差异最小(图3b),抑制率绝对差值为1.06%.在暴露时间96h下,同时暴露和顺序暴露的抑制率差异为0.36%~15.05%.在暴露时间144h下,同时暴露和顺序暴露的抑制率差异为1.06%~8.33%.
OXY与三唑类杀菌剂顺序暴露的混合物毒性随时间变化见图4,联合毒性效应系数均在-low、-up之间,为加和作用.在暴露时间96h下, OXY+ TCZ同时暴露毒性(68.58%)与OXY-TCZ顺序暴露毒性(59.24%)差异最大(图4C),抑制率绝对差值为9.34%.OXY+MYC同时暴露毒性(66.60%)与MYC- OXY顺序暴露毒性(67.63%)差异最小(图4a),抑制率绝对差值为1.03%.在暴露时间144h下, OXY+ TCZ同时暴露毒性(74.73%)与OXY-TCZ顺序暴露毒性(65.81%)差异最大(图4C),抑制率绝对差值为8.92%.OXY+MYC同时暴露毒性(74.58%)与MYC- OXY顺序暴露毒性(74.96%)差异最小(图4a),抑制率绝对差值为0.38%.在暴露时间96h下,同时暴露和顺序暴露的抑制率差异为1.03%~9.34%.在暴露时间144h下,同时暴露和顺序暴露的抑制率差异为0.38%~8.92%.
综上所述,在以抗生素-三唑类杀菌剂混合体系为研究对象的顺序暴露实验中,多数混合体系同时暴露的抑制率高于顺序暴露,抑制率最大可差45.83%(DOX-PRO体系),部分抗生素-三唑类杀菌剂混合体系顺序暴露对蛋白核小球藻影响不明显,抑制率最小相差0.38%(OXY-MYC体系).在暴露时间96h下,同时暴露和顺序暴露的抑制率差异为1.03%~36.76%.在暴露时间144h下,同时暴露和顺序暴露的抑制率差异为0.38%~45.83%.暴露时间96~144h,顺序暴露和同时暴露的抑制率差异变大.
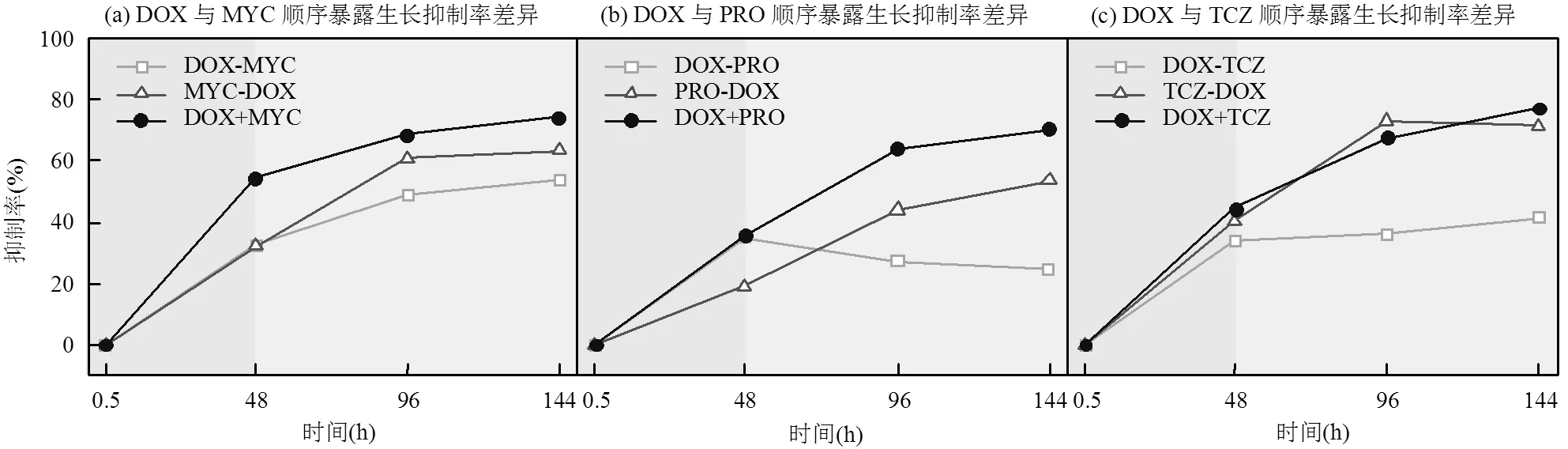
图2 DOX与三唑类杀菌剂EC50浓度下顺序暴露对蛋白核小球藻的生长抑制率
如(a)的图例说明:DOX-MYC:表示在0h时先加入DOX,48h时再加MYC;MYC-DOX:表示在0h时先加入MYC,48h时再加DOX; DOX+MYC:表示在0h时同时加入DOX与MYC;其它组的图例说明与其类似
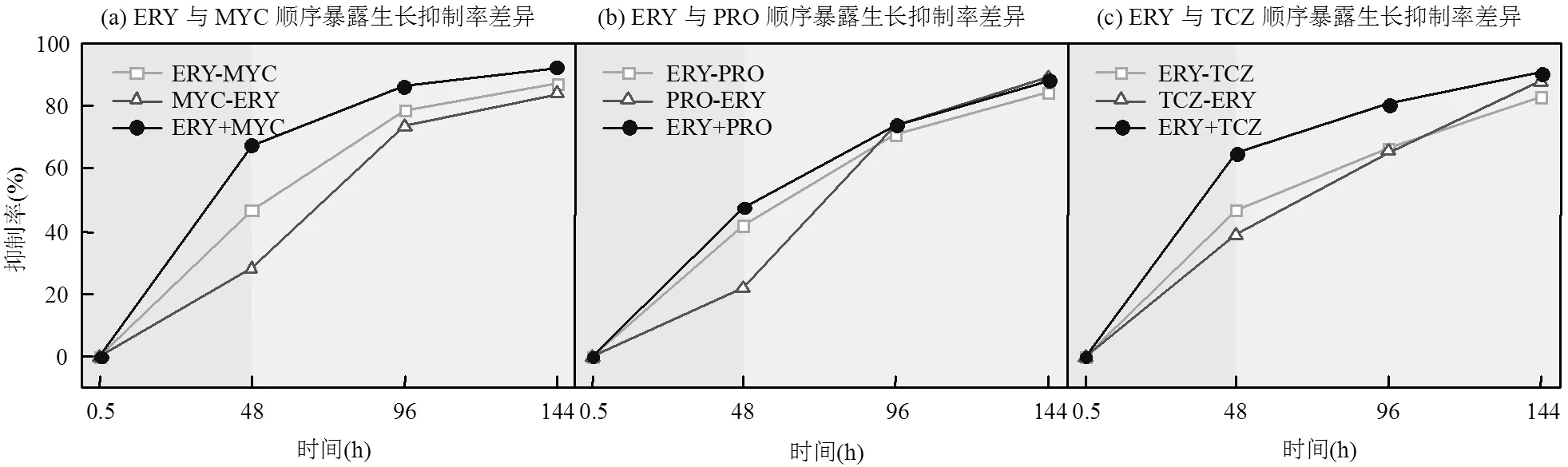
图3 红霉素(ERY)与三唑类杀菌剂EC50浓度下顺序暴露对蛋白核小球藻的生长抑制率
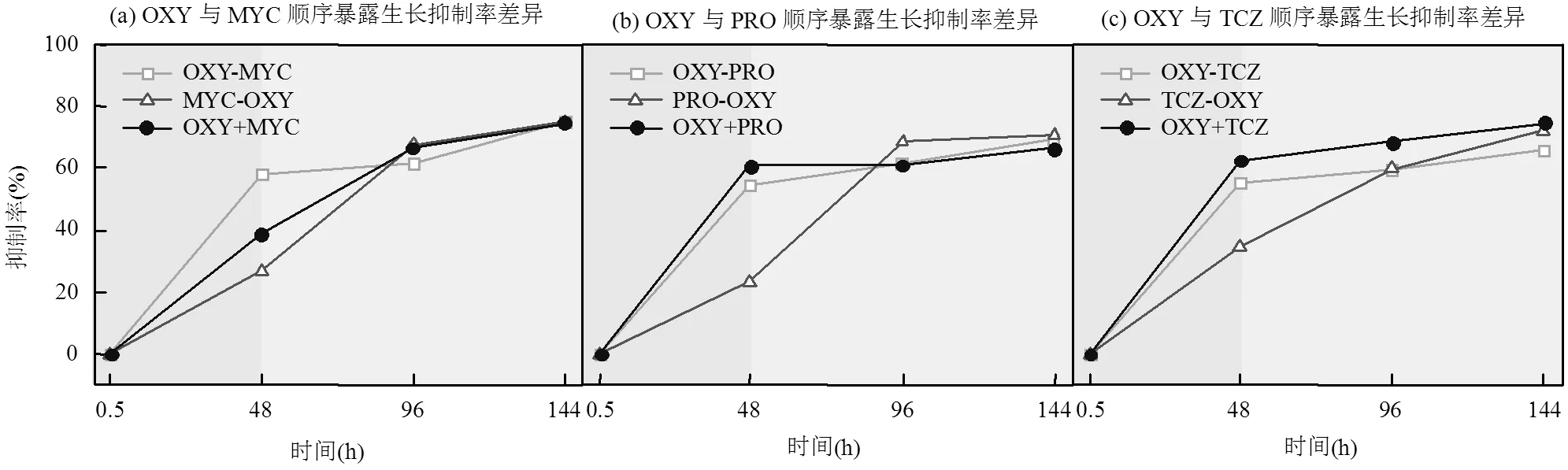
图4 土霉素(OXY)与三唑类杀菌剂EC50浓度下顺序暴露对蛋白核小球藻的生长抑制率
2.3 不同浓度下顺序暴露对蛋白核小球藻联合毒性
在两种污染物分别在EC50/20、EC50/10、EC50/2、EC50浓度下按不同顺序暴露,研究其混合物对蛋白核小球藻的联合毒性.
DOX与三唑类杀菌剂(MYC、PRO和TCZ)顺序暴露的研究结果见图5.在EC50/10暴露浓度下(图5(a)),DOX-MYC顺序暴露96h毒性(22.91%)显著大于MYC-DOX顺序暴露毒性(4.03%)(< 0.05);在暴露时间144h下,DOX-MYC顺序暴露毒性(16.69%)小于MYC-DOX顺序暴露毒性(20.25%) (<0.05),结果相反.在不同浓度与时间的影响下, PRO-DOX和TCZ-DOX顺序暴露毒性高于调整暴露顺序后的DOX-PRO和DOX-TCZ顺序暴露毒性,且浓度越高,不同暴露顺序的抑制率差值越大.在96h~144h暴露时间下,暴露浓度EC50/20的顺序暴露抑制率差异为0.65%~8.68%;暴露浓度EC50的顺序暴露抑制率差异为9.20%~36.93%.在暴露时间96h下,暴露浓度EC50/20~EC50的顺序暴露抑制率差异为0.29%~36.93%;在暴露时间144h下,暴露浓度EC50/20~EC50的顺序暴露抑制率差异为1.49%~30.09%.
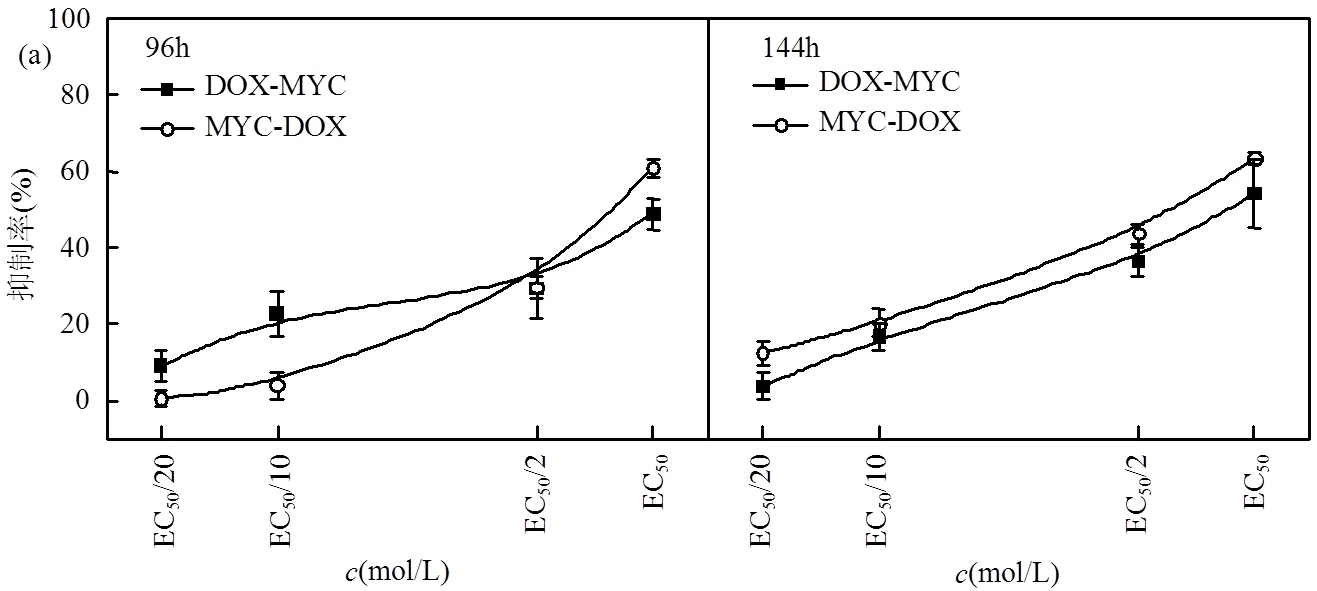
ERY与三唑类杀菌剂顺序暴露的研究结果详见图6.在EC50/10暴露浓度下(图6(a)),ERY-MYC顺序暴露的96h毒性(20.70%)小于MYC-ERY顺序暴露毒性(24.79%)(<0.05);在暴露时间144h下的抑制率呈现相反的结果,即ERY-MYC顺序暴露毒性(33.43%)大于MYC-ERY顺序暴露毒性(22.07%) (<0.05).在96~ 144h暴露时间下,暴露浓度EC50/20的顺序暴露抑制率差异为0.93%~11.57%;暴露浓度EC50的顺序暴露抑制率差异为1.37%~5.50%.在暴露时间96h下,暴露浓度EC50/20~EC50的顺序暴露抑制率差异为0.93%~11.56%;在暴露时间144h下,暴露浓度EC50/20~EC50的顺序暴露抑制率差异为1.36%~11.57%.
OXY与三唑类杀菌剂顺序暴露的研究结果详见图7.在EC50暴露浓度下(图7(a)),OXY-MYC顺序暴露96h毒性(61.93%)小于MYC-OXY顺序暴露毒性(67.63%)(<0.05);在暴露时间144h下,OXY- MYC顺序暴露毒性(75.11%)大于MYC- OXY顺序暴露毒性(74.96%)(<0.05),结果相反.在96~144h暴露时间下,暴露浓度EC50/20的顺序暴露抑制率差异为2.16%~10.89%;暴露浓度EC50的顺序暴露抑制率差异为0.15%~7.07%.在暴露时间96h下,暴露浓度EC50/20~EC50的顺序暴露抑制率差异为0.45%~ 14.73%;在暴露时间144h下,暴露浓度EC50/20~ EC50的顺序暴露抑制率差异为0.15%~10.94%.
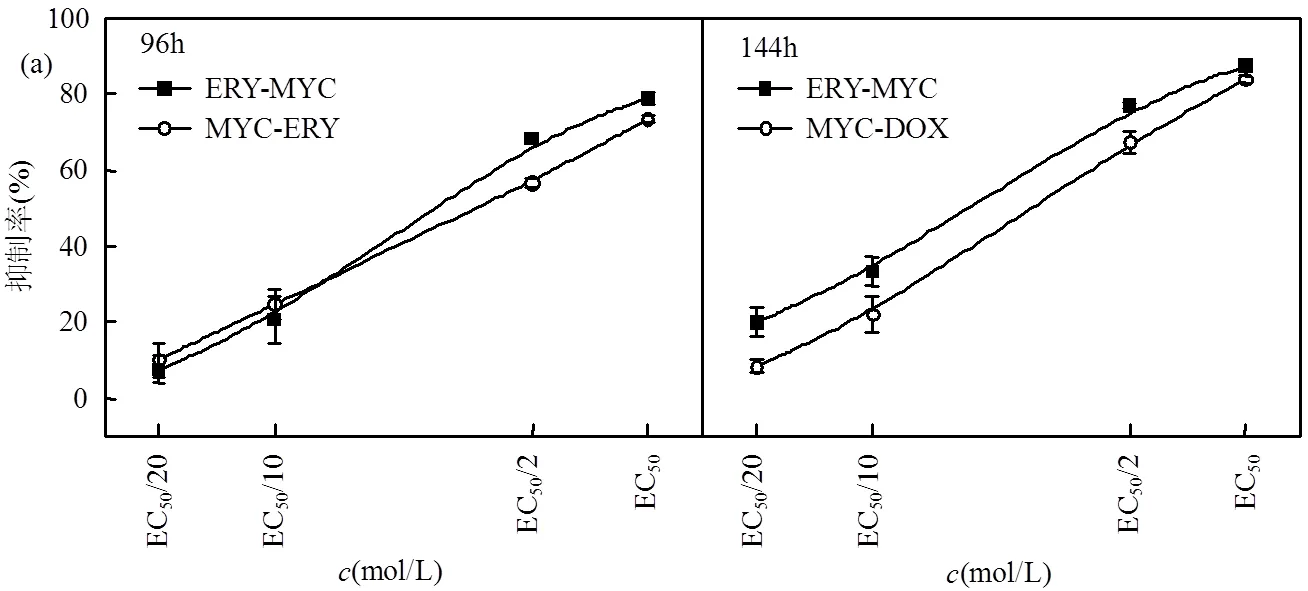
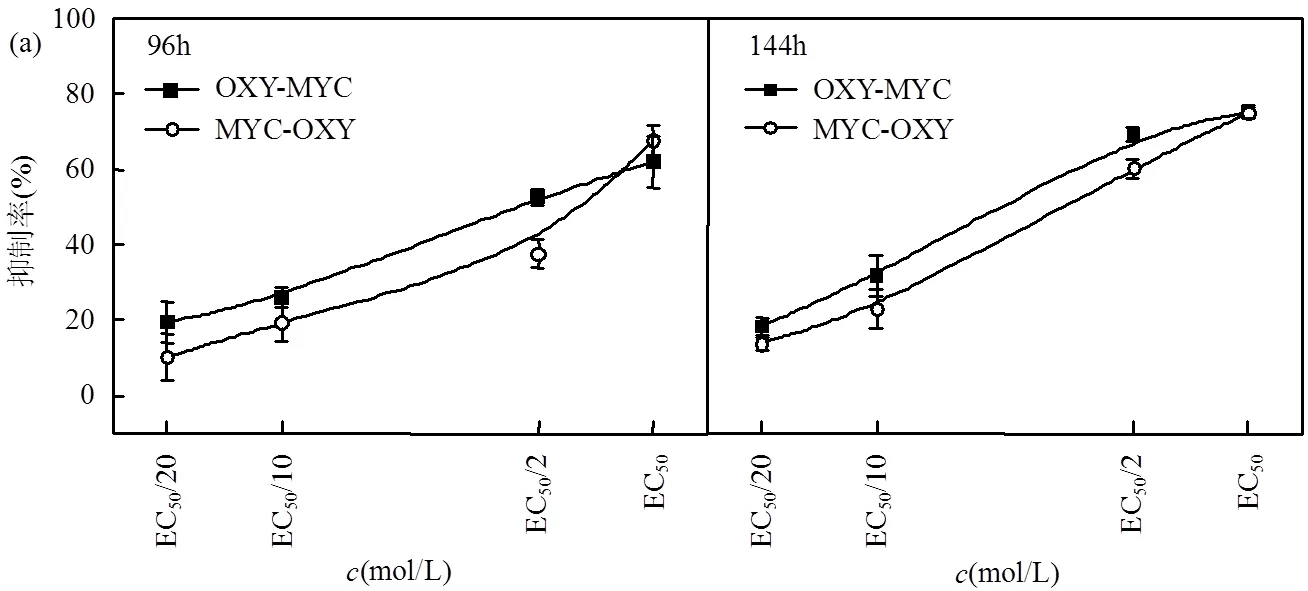
由上可知,浓度与时间的变化均对抗生素与三唑类杀菌剂的顺序暴露产生影响.暴露时间96h~ 144h,部分混合组分调整顺序前后抑制率大小呈相反结果;暴露浓度EC50/20~EC50,部分混合组分调整顺序前后抑制率大小也呈相反结果.在96h~144h暴露时间下,暴露浓度EC50/20的顺序暴露抑制率差异为0.65%~11.57%;暴露浓度EC50的顺序暴露抑制率差异为0.15%~36.93%.暴露浓度EC50/20~EC50,顺序暴露的抑制率差异范围随浓度增加变大.在暴露时间96h下,暴露浓度EC50/20~EC50的顺序暴露抑制率差异为0.29%~36.93%;在暴露时间144h下,暴露浓度EC50/20~EC50的顺序暴露抑制率差异为0.15%~ 30.09%.暴露时间96h~144h,顺序暴露的抑制率差异范围随时间增加变小.
3 讨论
为了揭示顺序暴露对蛋白核小球藻的联合毒性大小的影响.本文以抗生素-三唑类杀菌剂混合体系为研究对象,探究当蛋白核小球藻按顺序暴露于抗生素与三唑类杀菌剂两种毒物时,如果在保持相同浓度的情况下交换暴露顺序,此时这两种毒物对蛋白核小球藻的联合毒性变化规律,以及探究不同浓度与时间下对顺序暴露的影响.研究结果表明抗生素与三唑类杀菌剂按顺序暴露于蛋白核小球藻,顺序相反后,对蛋白核小球藻的联合毒性大小影响不同.多数混合体系同时暴露的抑制率高于顺序暴露,抑制率最高可差45.83%(DOX-PRO体系).部分抗生素-三唑类杀菌剂混合体系顺序暴露对蛋白核小球藻影响不明显.同时研究也发现顺序暴露、暴露时间和暴露浓度是影响混合物对蛋白核小球藻毒性作用大小的关键因素.
DOX与三唑类杀菌剂顺序暴露于蛋白核小球藻,顺序相反后,毒性作用增强,引起这类毒性差异的原因,可能与每种毒物本身的特性有关[29].当生物体受到毒性胁迫时,需要一定的时间来重建体内平衡,生物体恢复快与慢,取决于化合物本身[30].由于蛋白核小球藻对每种化合物所需的恢复时间可能不同,当其先接触的化合物损伤恢复时间较长[31],后接触另一种化合物时,蛋白核小球藻未完全恢复,体系中有较高的残留毒性,混合体系表现出毒性增大[32].而当生物体先接触的化合物损伤恢复时间较短,后接触的化合物损伤恢复时间较长,导致对生物体产生较少的残留毒性,使得顺序暴露对生物体产生较弱的毒性作用影响.
化合物的分子结构和理化性质在很大程度上决定了它们与环境的相互作用程度[33].盐酸强力霉素和土霉素同属于四环素类抗生素.作用机制在于药物能与细菌核糖体30S亚基的A位置结合,影响蛋白质的合成[34].红霉素属于大环内酯类抗生素,药物能与细菌核糖体50S亚基结合,抑制蛋白质合成[35].三唑类杀菌剂属于甾醇生物合成抑制剂,该物质通过与甾醇14a-脱甲基酶结合影响甾醇类生物合成,破坏细胞膜功能[36].分子结合过程中,分子氢键供体、氢键受体多,分子间便具备形成氢键的条件,污染物可能更容易与受体相结合.抗生素DOX、ERY、OXY氢键供体数分别为16、5、7,氢键受体数分别为20、14、10[37].三唑类杀菌剂MYC、PRO、TCZ氢键供体数分别为0、0、1,氢键受体数分别为3、4、3[38].抗生素氢键供体、受体个数均多于三唑类杀菌剂,可能更容易与受试生物间形成氢键相结合,引起抗生素-三唑类杀菌剂顺序暴露的毒性差异.
生物体本身存在共抗性及交叉抗性的现象[39],可能是部分抗生素-三唑类杀菌剂混合体系同时暴露和顺序暴露对蛋白核小球藻毒性影响不明显的原因.即某一抗生素的抗性基因与另一类三唑类杀菌剂的抗性基因位于同一质粒或染色体临近位置上而表现出共抗性, 或生物体使用相同机制排除不同结构的化合物而表现出交叉抗性[40].顺序暴露的两个污染物的抗性基因位点相近,或蛋白核小球藻运用相同的生物体排除机制排除污染物[41],导致两种污染物顺序暴露对小球藻的毒性影响差异不大.微藻对抗生素的去除也高度依赖于抗生素的类别[42].以往的研究表明,微藻直接引起的抗生素的去除主要包括生物吸附、生物蓄积、生物降解[43],生物降解被认为是大环内酯类抗生素主要贡献[44],微藻主要通过生物吸附去除四环素类抗生素[45],藻类对三唑类杀菌剂的去除机制可能与某一类抗生素相同,这也可能是导致两种污染物顺序暴露对小球藻毒性影响差异不大的原因.
4 结论
4.1 在96h的暴露下,6种目标污染物对蛋白核小球藻毒性效应均表现为抑制作用,且浓度越大抑制率越大,毒性大小为:PRO > DOX > TCZ > ERY > MYC > OXY.
4.2 在EC50浓度混合下,抗生素-三唑类杀菌剂混合体系同时暴露和顺序暴露的抑制率差异范围在0.38%~36.76%之间.
4.3 DOX与PRO、TCZ、MYC任何一种三唑类杀菌剂顺序暴露于蛋白核小球藻,顺序相反后,对蛋白核小球藻的毒性作用均增强,最大可增强36.82% (DOX-TCZ体系).
4.4 在不同浓度与时间的影响下,PRO-DOX和TCZ-DOX顺序暴露毒性高于调整暴露顺序后的DOX-PRO和DOX-TCZ顺序暴露毒性,且浓度越高,不同暴露顺序的抑制率差值越大.
4.5 浓度与时间的变化均对抗生素与三唑类杀菌剂的顺序暴露产生影响,在浓度和时间变化下部分混合组分调整顺序前后抑制率大小会呈相反结果.在96h~144h暴露时间下,暴露浓度EC50/20的顺序暴露抑制率差异为0.65%~11.57%;暴露浓度EC50的顺序暴露抑制率差异为0.15%~36.93%.暴露浓度EC50/20到EC50,顺序暴露的抑制率差异范围随浓度增加变大.在EC50/20~EC50暴露浓度下,暴露时间96h的顺序暴露抑制率差异为0.29%~36.93%,暴露时间144h的顺序暴露抑制率差异为0.15%~30.09%.暴露时间96h~144h,顺序暴露的抑制率差异范围随时间增加变小.
[1] 王 静,杨代蓉.浅谈兽用抗生素的应用现状及存在的问题[J]. 现代畜牧科技, 2018,37(5):132.
Wang J, Yang D R. Application status and problems of veterinary antibiotics [J]. Modern Animal Husbandry Technology, 2018,37(5): 132.
[2] Castiglioni S, Bagnati R, Fanelli R, et al. Removal of pharmaceuticals in sewage treatment plants in Italy [J]. Environmental Science & Technology, 2006,40:357-363.
[3] Liu J L, Wong M H. Pharmaceuticals and personal care products (PPCPs): A review on environmental contamination in China [J]. Environment International, 2013,59:208-224.
[4] 吴文铸,郭 敏,孔德祥,等.3种三唑类杀菌剂的环境降解特性[J]. 生态与农村环境学报, 2016,32(5):837-841.
Wu W Z, Guo M, Kong D X, et al. Environmental degradation characteristics of three triazole fungicides [J]. Journal of Ecology and Rural Environment, 2016,32(5):837-841.
[5] Tong Z, Dong X, Yang S, et al. Enantioselective effects of the chiral fungicide tetraconazole in wheat: Fungicidal activity and degradation behavior [J]. Environmental pollution, 2019,247:1-8.
[6] 宋桂芳,张世文,庄红娟,等.农用地大环内酯类抗生素与杀菌剂残留污染评价[J]. 环境化学, 2022,41(7):2309-2319.
Song G F, Zhang S W, Zhuang H J, et al. Pollution assessment of macrolide antibiotics and fungicides residues in agricultural land [J]. Environmental Chemistry, 2022,41(7):2309-2319.
[7] 刘 敏,覃礼堂,莫凌云,等.4种唑类杀菌剂对蛋白核小球藻的急性毒性及其致毒机理[J]. 生态毒理学报, 2021,16(4):301-312.
Liu M, Qin L T, Mo L Y, et al. Acute toxicity and mechanism of four azole fungicides toa [J]. Asian Journal of Ecotoxicology, 2021,16(4):301-312.
[8] Sui N, Zhang Z, Zhang J. Alteration between inhibition and stimulation in individual and mixture effects of [amim]Br and [apyr]Br on: Time and side-chain dependence[J]. Chemosphere, 2019,233(OCT.):292-299.
[9] Zhang J, Liu S S, Dong X Q, et al. Predictability of the time- dependent toxicities of aminoglycoside antibiotic mixtures to Vibriosp-Q67 [J]. RSC Advances, 2015,5(129):107076- 107082.
[10] 陶 敏,贺 锋,胡 晗,等.碳氧调控下人工湿地净化效果的协同与拮抗研究 [J]. 中国环境科学, 2015,35(12):3646-3652.
Tao M, He F, Hu H, et al. Synergistic and antagonistic effect of treatment performance of constructed wetlands under artificial aeration and external carbon source [J]. China Environmental Science, 2015,35(12):3646-3652.
[11] 丁婷婷,董欣琪,张 瑾,等.3种氨基糖苷类抗生素对水生生物的时间依赖联合毒性作用比较[J]. 生态毒理学报, 2018,13(1):126-137.
Ding T T, Dong X Q, Zhang J, et al. Comparison of time-dependent joint toxicity interaction of three aminoglycosides antibiotics between two aquatic organisms [J]. Asian Journal of Ecotoxicology, 2018,13 (1):126-137.
[12] 章小强,胡晓娜,陈彩东,等.镉与S-异丙甲草胺对斜生栅藻的联合毒性作用[J]. 环境科学, 2015,36(3):1069-1074.
Zhang X Q, Hu X N, Chen C D, et al. Combined toxicity of cadmium and S-metolachlor to[J]. Environmental Science, 2015,36(3):1069-1074.
[13] 农琼媛,覃礼堂,莫凌云,等.抗生素与三唑类杀菌剂混合物对羊角月牙藻的长期毒性相互作用研究[J]. 生态毒理学报, 2019,14(4): 140-149.
Nong Q Y, Qin L T, Mo L Y, et al. The toxic interactions of long-term effects involving antibiotics and triazole fungicides on[J]. Asian Journal of Ecotoxicology, 2019,14(4):140- 149.
[14] Ashauer R, Boxall A, Brown C. Modeling combined effects of pulsed exposure to carbaryl and chlorpyrifos on Gammarus pulex [J]. Environmental Science & Technology, 2007,41(15):5535-5541.
[15] Ashauer R, O’Connor, Isabel, Escher B I. Toxic mixtures in time-the sequence makes the poison [J]. Environmental Science & Technology, 2017,51(5):3084-3092.
[16] Russo R, Becker J M, Liess M. Sequential exposure to low levels of pesticides and temperature stress increase toxicological sensitivity of crustaceans [J]. The Science of the Total Environment, 2018,610- 611(jan.1):563-569.
[17] Supriya B, Krutika D. The enhanced lipid productivity ofandby carbon coupling nitrogen manipulation for biodiesel production [J]. Environmental Science and Pollution Research, 2019,26(4):3492-3500.
[18] Mo L Y, Zheng M Y, Qin M, et al. Quantitative characterization of the toxicities of Cd-Ni and Cd-Cr binary mixtures using combination index method [J]. BioMed Research International, 2016; 2016: 4158415.
[19] 袁 静,刘树深,王丽娟,等.蛋白核小球藻()微板毒性分析方法优化[J]. 环境科学研究, 2011,24(5):553-558.
Yuan J, Liu S S, Wang L J, et al. Optimization of microplate toxicity analysis method based on[J]. Research of Environment Science, 2011,24(5):553-558.
[20] Organization for Economic Co-operation and Development (OECD). Test No. 201: Alga, growth inhibition test [R]. Paris: OECD, 2006.
[21] Qin L T, Chen Y H, Zhang X, et al. QSAR prediction of additive and non-additive mixture toxicities of antibiotics and pesticide [J]. Chemosphere, 2018,198(5):122-129.
[22] Mo L Y, Zhao D N, Qin M, et al. Joint toxicity of six common heavy metals to[J]. Environmental Science & Pollution Research, 2017,26(30):30554-30.
[23] 刘树深.化学混合物毒性评估与预测方法[M]. 北京:科学出版社, 2017:4-9.
Liu S S. Assessment and prediction of toxicity of chemical mixtures [M]. Beijing: 2017:4-9.
[24] 郑乔峰,居 珍,刘树深.敌敌畏及其代谢产物对青海弧菌和秀丽线虫的联合毒性[J]. 化学学报, 2019,77(10):1008-1016.
Zheng Q F, Ju Z, Liu S S. Combined toxicity of dichlorvos and its metabolites tosp.-Q67 and[J]. Acta Chimica Sinica, 2019,77(10):1008-1016.
[25] Qin L T, Zhang X, Mo L Y, et al. Further exploring linear concentration addition and independent action for predicting non- interactive mixture toxicity [J]. Chinese Journal of Structural Chemistry, 2017,36(6):886-896.
[26] 钟才高,曹 壑,曾 明,等.农药三唑磷和杀虫单对小鼠的联合毒作用研究[J]. 实用预防医学, 2002,9(6):613-615.
Zhong C G, Cao H, Liu X M, et al. Study on the joint toxic action of pesticide triazophos and monosuitup in mice [J]. Practical Preventive M edicine , 2002,9(6):613-615.
[27] 王桂祥.低浓度混合抗生素对普通小球藻的联合毒性效应及机理[D]. 青岛:青岛科技大学, 2019:17-20.
Wang G X. Combined effects and mechanisms of low concentration mixed antibiotics on[D]. Qingdao: 2019:17-20.
[28] Zhang J, Yu Z Y. Transgenerational effects of different sequential exposure to 2,2¢,4,4¢-tetra-brominated diphenyl ether (BDE47) and lead (Pb) on Caenorhabditis elegans [J]. Environmental Sciences Europe, 2020,32(1):44.
[29] Nong Q Y, Liu Y A, Qin L T, et al. Toxic mechanism of three azole fungicides and their mixture to green alga[J]. Chemosphere, 2020,262:127793.
[30] Ashauer R, O’Connor I, Hintermeister A, et al. Death dilemma and organism recovery in ecotoxicology [J]. Environmental Science & Technology, 2015,49(7):10136-10146.
[31] Li H, Zhang Q, Su H, et al. High tolerance and delayed responses of daphnia magna to neonicotinoid insecticide imidacloprid: Toxicokinetic and toxicodynamic modeling [J]. Environmental Science & Technology, 2021,55(1):458-467.
[32] Ashauer R, Hintermeister A, Caravatti I, et al. Toxicokinetic and toxicodynamic modeling explains carry-over toxicity from exposure to diazinon by slow organism recovery [J]. Environmental Science & Technology, 2010,44(10):3963-3971.
[33] Roman D L,Voiculescu D I, Filip M, et al. Effects of triazole fungicides on soil microbiota and on the activities of enzymes found in soil: A review [J]. Agriculture, 2021,11(9):893.
[34] van Eijk E, Wittekoek B, Kuijper E J, et al. DNA replication proteins as potential targets for antimicrobials in drug-resistant bacterial pathogens [J]. Journal of Antimicrobial Chemotherapy, 2017,72(5): 1275-1284.
[35] Guo J , Bai Y , Chen Z , et al. Transcriptomic analysis suggests the inhibition of DNA damage repair in green algaexposed to roxithromycin [J]. Ecotoxicology and Environmental Safety, 2020,201:110737.
[36] 曹端韬.土壤中戊唑醇残留引致的烟曲霉对三唑类抗真菌药物抗药性及其机制[D]. 杭州:浙江大学, 2021:15-39.
Cao D T. Resistance and its mechanisms of aspergillus fumigatus to triazole antifungal agents induced by tebuconazole in soil [D]. Hangzhou: Zhejiang University, 2021:15-39.
[37] Sunghwan K, Chen J, Cheng T, et al. PubChem in 2021: new data content and improved web interfaces [J]. Nucleic Acids Research, 2021,49:D1388–D1395.
[38] Lewis K A, Tzilivakis J, warner D J, et al. An international database for pesticide risk assessments and management [J]. Human and Ecological Risk Assessment: An International Journal, 2016,22(4): 1050-1064.
[39] 王世豪,石明浩,刘 苏.顺序暴露场景下四环素和砷对斑马鱼的联合毒性效应[J]. 环境科学学报, 2020,40(12):4590-4597.
Wang S H, Shi M H, Liu S. Combined toxicity of tetracycline and arsenic on zebrafish in sequential exposure scenarios [J]. Acta Scientiae Circumstantiae, 2020,40(12):4590-4597.
[40] 薛喜枚,朱永官.土壤中砷的生物转化及砷与抗生素抗性的关联[J]. 土壤学报, 2019,56(4):763-772.
Xue X M, Zhu Y G. Biotransformation of arsenic in soil and the relationship between arsenic and antibiotic resistance [J]. Journal of soil, 2019,56(4):763-772.
[41] 陈 帅,邹海燕,高方舟,等.抗生素,重金属和杀生剂抗性共选择机制[J]. 生态毒理学报, 2020,15(2):1-10.
Chen S, Zou H Y, Gao F Z, et al. Co-selection mechanism of antibiotic, metal and biocide resistance [J]. Asian Journal of Ecotoxicology, 2020,15(2):1-10.
[42] Leng L J, Wei L, Xiong Q, et al. Use of microalgae based technology for the removal of antibiotics from wastewater: A review [J]. Chemosphere, 2020,238:124680.
[43] Hena S, Gutierrez L, Croue J P. Removal of pharmaceutical and personal care products (PPCPs) from wastewater using microalgae: A review [J]. Journal of Hazardous Materials, 2020,403:124041.
[44] Wang X, Dou X, Wu J, et al. Attenuation pathways of erythromycin and biochemical responses related to algal growth and lipid synthesis in a microalga-effluent system [J]. Environmental Research, 2021, 195(1):110873.
[45] Xiong Q, Hu L X, Liu Y S, et al. Microalgae-based technology for antibiotics removal: From mechanisms to application of innovational hybrid systems [J]. Environment international, 2021,155:106594.
Combined toxicity of sequential exposure of antibiotics and fungicides on green algae
LI Chao-jie1, NONG Qiong-yuan1, QIN Li-tang1,2,3*, MO Ling-yun2,3,4, LIANG Yan-peng1,2,3, ZENG Hong-hu1,2,3, DENG Zhen-gui5, LIU Liang5
(1.College of Environmental Science and Engineering, Guilin University of Technology, Guilin 541004, China;2.Guangxi Key Laboratory of Environmental Pollution Control Theory and Technology, Guilin University of Technology, Guilin 541004, China;3.Collaborative Innovation Center for Water Pollution Control and Water Safety in Karst Area, Guilin University of Technology, Guilin 541004, China;4.Technical innovation center of mine geological environment restoration engineering in Shishan area of South China, Ministry of natural resourcesn, Nanning 530022, China;5.Hengsheng Water Environment Management Co, LTD., Guilin 541199, China)., 2023,43(1):404~414
The mixture systems of three antibiotics (doxycycline hydrochloride (DOX), erythromycin (ERY), oxytetracycline (OXY)) and three triazole fungicides (myclobutanil(MYC), propiconazole (PRO) and tebuconazole (TCZ)) were selected as target pollutants. The primary producer green algae () in the ecosystem was used as the test organism to study the combined toxicity of sequential exposure to target contaminants. The results showed that the inhibitory toxicities of six single target pollutants towere: PRO>DOX>TCZ>ERY>MYC>OXY. The difference of inhibition rates between simultaneous exposure and sequential exposure of antibiotic triazole bactericide mixture system mixed at 50% effect concentration was 0.38%~36.76%. The toxicity toincreased up to 36.82% when DOX, PRO, TCZ, and MYC were exposed toin the reverse order. Under the influence of different concentrations and time, the sequential exposure toxicities of PRO-DOX and TCZ-DOX were higher than that of DOX-PRO and DOX-TCZ after adjusting the exposure sequence. The higher concentrations the greater difference of inhibition rates. At the exposure time of 96h~144h, the difference of sequential exposure inhibition rates of exposure concentration EC50/20 was 0.65%~11.57%. The difference of sequential exposure inhibition rates of exposure concentration EC50was 0.15%~36.93%. The range of sequential exposure inhibition rate increased with the increase of concentration. At the exposure concentration EC50/20 to EC50, the difference of sequential exposure inhibition rates of exposure time 96h was 0.29%~36.93%. The difference of sequential exposure inhibition rates of exposure time 144h was 0.215%~30.09%. The range of sequential exposure inhibition rate decreased with the increase of time. Therefore, sequential exposure changed the combined toxicity of antibiotics and triazole fungicides to. The sequential exposure, exposure time, and exposure concentration were the key factors affecting the toxicity.
antibiotic;triazole fungicides;;combined toxicity;sequential exposure
X503
A
1000-6923(2023)01-0404-11
李超杰(1996-),男,天津人,桂林理工大学硕士研究生,主要从事环境毒理学研究.
2022-05-09
国家重点研发计划项目(2019YFC0507504);广西科技重大专项(桂科AA20161001,桂科AA2016100403);国家自然科学基金资助项目(21866010)
* 责任作者, 教授,qinsar@163.com
