血清Apelin-13联合Rotterdam-CT评分对颅脑损伤患者病情及预后的评估价值
2023-02-01李志良李来兴刘启瑞
李志良, 李来兴, 刘启瑞
(山西省临汾市中心医院神经外科, 山西 临汾 041000)
颅脑损伤(TBI)是间接或直接暴力所致的神经外科急症,尽管近年来随着颅电刺激、磁刺激、高压氧治疗、大骨瓣开颅手术等方法进展,极大的改善了TBI患者预后,但TBI仍然是全球病残和病死的主要原因之一[1,2]。据统计显示,我国TBI患者超过1.39亿,死亡率约13例/10万人,给患者家庭乃至社会造成了巨大负担[3]。TBI患者的预后主要取决于创伤严重程度,因此,早期评估TBI患者病情和预后,对制定相关措施和改善预后至关重要。目前临床一般通过格拉斯哥昏迷量表(GCS)[4]评估病情严重程度,格拉斯哥预后量表(GOS)[5]评估预后,但单一指标的评价能力有限,并不能准确的评估TBI患者病情和预后。鹿特丹CT(Rotterdam-CT)评分是基于TBI患者CT影像特征得到的评分[6],但相关研究结论还停留在一个相关趋势的层面上,单独使用Rotterdam-CT评估TBI患者预后存在一定局限性[7]。TBI过程中涉及神经炎症、神经元凋亡、脑水肿和血脑屏障破坏等复杂的病理生理过程[8]。血管紧张素Ⅱ受体样1内源性配体13(Apelin-13)是一种血管活性肽,能通过激活血管紧张素域1型受体相关蛋白(APJ)发挥抑制神经炎症、减缓神经元凋亡、修复血脑屏障破坏等神经系统保护作用[9]。目前关于血清Apelin-13联合Rotterdam-CT评分对TBI患者病情及预后的评估价值尚无研究报道,基于此本研究报道如下。
1 资料与方法
1.1一般资料:选取2020年3月至2022年3月我院收治的153例TBI患者为TBI组,其中男93例,女60例;年龄18~76(44.84±14.04)岁;体质指数18.42~27.37(22.62±1.82)kg/m2;创伤原因:交通事故74例、高空坠落/摔倒61例、其他18例。纳入标准:①经颅脑CT/MRI确诊为TBI;②年龄≥18岁;③受伤至入院时间<12h;④具备完整的临床资料;⑤患者或家属知情并签署同意书。排除标准:①既往头部外伤史、颅脑手术史、脑血管疾病史;②合并其他部位骨折或脏器损伤;③合并免疫、造血系统损害;④恶性肿瘤;⑤合并严重心肝肾功能不全;⑥妊娠及哺乳期妇女;⑦吸毒史、药物滥用史;⑧合并癫痫、痴呆等神经疾病;⑨失访。另选取同期49名体检健康者为对照组,其中男30例,女19例;年龄18~72(43.15±8.99)岁;体质指数18.51~26.74(22.42±1.71)kg/m2;两组一般资料比较无差异(P>0.05)。本研究经医院伦理委员会批准。
1.2方 法
1.2.1资料收集:收集TBI患者基线资料,包括性别、年龄、体质指数、吸烟、饮酒、病史(高血压、糖尿病、高脂血症)、创伤原因、受伤至入院时间、颅脑CT表现(包括基底池异常、中线移位≥5mm、硬膜外血肿、硬膜下血肿、蛛网膜下腔出血、脑室内出血、脑内血肿、脑挫伤、颅腔积气、头盖骨骨折、颅底骨折等)。
1.2.2血清Apelin-13水平检测:收集TBI患者入院时和对照组体检时3mL静脉血,3000r/min离心15min(半径10cm)后采用酶联免疫吸附法检测血清Apelin-13水平(南京赛泓瑞生物科技有限公司,编号:CEB887Hu02)。
1.2.3颅脑CT检查:TBI患者入院后采用德国西门子SOMATOM Drive双源CT行颅脑CT检查,记录颅脑CT表现,并计算Rotterdam-CT评分:包括基底池(正常、受压、消失分别计0分、1分、2分)、中线移位(≥5mm与<5mm分别计0分、1分)、硬膜外血肿(有与无分别计0分、1分)、脑室或蛛网膜下腔出血(有与无分别计0分、1分),总分为所有项目之和再加1分,分值范围1~6分,得分越高表示TBI越严重[6]。
1.3病情和预后分组:TBI患者入院后进行GCS评分,包括运动(1~6分)、语言(1~5分)、睁眼(1~4分)3个部分,总分为所有项目之和,分值分为3~15分,得分越低表示病情越严重[4]。根据GCS评分将TBI患者分为轻度TBI组(13~15分,n=62)、中度TBI组(9~13分,n=52)、重度TBI组(3~8分,n=39)。对TBI患者随访90d,根据GOS评分[5]评估预后情况,包括死亡:1分;植物生存:2分;重度残疾:3分;轻度残疾:4分;恢复良好:5分。根据GOS评分将患者分为预后不良组(≤3分,n=42)和预后良好组(>3分,n=111)。
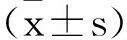
2 结 果
2.1TBI组与对照组血清Apelin-13水平比较 TBI组血清Apelin-13水平[28.65(16.54,38.50)]ng/mL低于对照组[65.92(42.35,89.12)ng/mL](U=7.924,P<0.001)。
2.2不同病情TBI患者血清Apelin-13水平和Rotterdam-CT评分比较 轻度TBI组、中度TBI组、重度TBITBI组血清Apelin-13水平依次降低,Rotterdam-CT评分依次升高(P<0.05)。见表1。

表1 不同病情TBI患者血清Apelin-13水平和Rotterdam-CT评分比较[M(P25,P75)]
2.3TBI患者血清Apelin-13水平和Rotterdam-CT评分与GCS评分的相关性 Spearman相关性分析显示,TBI患者血清Apelin-13水平与GCS评分呈正相关,Rotterdam-CT评分与GCS评分呈负相关(r=0.654、-0.675,P均<0.001)。见图1。

图1 TBI患者血清Apelin-13水平和Rotterdam-CT评分与GOS评分的线性散点图
2.4TBI患者预后不良的单因素分析 随访6个月,153例TBI患者GOS评分≤3分42例,预后不良发生率为27.45%(42/153)。预后不良组基底池异常比例、中线移位≥5mm比例、硬膜外血肿比例、Rotterdam-CT评分高于预后良好组,GCS评分、Apelin-13水平低于预后良好组(P<0.05)。见表2。

表2 TBI患者预后不良的单因素分析
2.5TBI患者预后不良的多因素Logistic回归分析:以基底池异常(是为“1”;否为“0”)、中线移位≥5mm(是为“1”;否为“0”)、硬膜外血肿(是为“1”;否为“0”)、GCS评分、Apelin-13、Rotterdam-CT评分为自变量,多因素Logistic回归分析显示,基底池异常、中线移位≥5mm、Rotterdam-CT评分增加为TBI患者预后不良的独立危险因素,GCS评分增加、Apelin-13升高为独立保护因素(P<0.05)。见表3。

表3 TBI患者预后不良的多因素Logistic回归分析
2.6血清Apelin-13水平和Rotterdam-CT评分对TBI患者预后不良的评估价值 ROC曲线分析显示,血清Apelin-13水平和Rotterdam-CT评分单独与联合评估TBI患者预后不良的曲线下面积分别为0.797、0.808、0.896。见表4和图2。

表4 血清Apelin-13水平和Rotterdam-CT评分评估TBI患者预后不良的价值

图2 血清Apelin-13水平和Rotterdam-CT评分评估TBI患者预后不良的ROC曲线
3 讨 论
随着交通事业、建筑业的迅速发展,交通事故、高空坠落/摔倒等导致的TBI日趋增加,作为一种严重的创伤形式,TBI患者多合并有意识障碍、吞咽障碍等神经功能损害和自主呼吸抑制,一旦发展至重度TBI,神经修复和再生会极为困难,患者常遗留神经结构损害,致残、致死率较高[10]。近年来基于颅脑CT影像学表现的评分系统被广泛应用于TBI病情和预后评估,马歇尔CT(Marshall CT)分级是最早出现的TBI分级系统,但其无法给出定量定值,存在一定局限性[7]。基于此Maas等[6]于2005年通过优化Marshall CT分级开发了Rotterdam CT评分,添加了基底池、硬膜外血肿、脑室或蛛网膜下腔出血变量,并可以做到具体分值量化评估。本研究结果显示,TBI患者Rotterdam-CT评分随着病情加重而升高,说明Rotterdam-CT评分可作为TBI患者病情评估指标。进一步分析显示,Rotterdam-CT评分增加为TBI患者预后不良的独立危险因素,提示Rotterdam CT评分可能成为TBI患者预后评估指标,分析是Rotterdam-CT评分能量化评估TBI患者颅脑损伤情况,其分值越高表示颅脑损伤更严重,因此预后更差。
TBI患者病情加重和预后不良与原发性脑损伤后继发脑损伤密切相关,其涉及的机制包括神经炎症、神经元凋亡、脑水肿和血脑屏障破坏等[8]。Apelin是一种神经介质和脂肪源性激素,Apelin-13是其最活跃的形式之一,广泛表达于神经元和少突胶质细胞,其N端可结合APJ的N端激活APJ下游信号发挥抑制神经炎、抑制神经细胞凋亡、促进脑血管舒张等作用[9,11]。在大脑中动脉阻塞小鼠模型中,Apelin-13能通过增加水通道蛋白-4表达保护血脑屏障免受缺血损伤,并能抑制神经细胞凋亡,减少脑梗塞体积和脑水肿,从而保护缺血脑组织[12,13]。本研究结果显示,TBI患者血清Apelin-13水平显著下调,考虑与TBI发生后内源性Apelin-13作为神经保护剂被大量消耗有关。结果还显示,TBI患者血清Apelin-13水平随着病情加重而降低,Apelin-13升高为TBI患者预后不良的独立保护因素,说明血清Apelin-13水平与TBI患者病情变化及预后密切相关。分析与Apelin-13能抑制神经元凋亡有关。有实验指出,Apelin-13能通过胰高血糖素样肽-1受体/磷脂酰肌醇-3-激酶/蛋白激酶B信号传导抑制神经元凋亡[14,15]。ROC曲线分析发现,Rotterdam-CT评分、血清Apelin-13及两者联合评估TBI患者预后不良的曲线下面积分别为0.808、0.797、0.896,说明二者联合评估TBI患者预后不良的价值较高。
综上所述,血清Apelin-13水平降低和Rotterdam-CT评分增加与TBI患者病情加重和预后不良密切相关,二者均能作为TBI患者预后不良的辅助评估指标,且二者联合评估TBI患者预后不良的价值较高。但本研究结果仍需扩大样本量进一步验证。