红花黄色素调节NF-κB/NLRP3信号通路对心肌梗死大鼠心肌细胞焦亡和炎性损伤的影响
2023-02-01陈瑞敏
赵 雯, 张 勇, 张 波, 安 笑, 陈瑞敏, 任 超
(解放军第九六〇医院, 山东 济南 250031)
心肌梗死(myocardial infarction,MI)是国内外发病率和死亡率最高的心脑血管系统疾病之一,其发病时,导致细胞坏死和组织损伤的心肌缺血是心源性猝死的原因之一[1]。临床上虽已采用ACEⅠ、ARB及β受体阻滞剂等药物来稳定或改善MI患者的心功能障碍,但其预后仍不理想,且长期应用带来的耐药性和不良反应也为临床应用带来挑战。因此,寻找药物减轻MI心肌细胞焦亡和炎性损伤具有重要意义。红花黄色素(Carthamin yellow,CY)是从菊科植物红花花瓣中提取而得,是一种可溶性查尔酮混合物,包括羟基CY A、CY A、CY B、槲皮素、山奈酚等。其中含量最高的是羟基SY A ,是主要的有效成分[2]。因羟基SY A需要对CY进行进一步分离、提纯、纯化等过程,且提取的单体易受到光照、温度而影响稳定性,本实验采用混合物CY作为研究对象。研究发现CY具有抑制血栓形成、抗心肌缺血、降血脂、抗氧化等药理作用[3]。刘广雁等[4]发现CY对心肌细胞H9C2具有保护作用。目前关于CY发挥生物学功能的机制尚不明确,对MI大鼠的心肌细胞焦亡与炎性损伤存在的影响值得研究和探讨。研究表明NF-κB/NLRP3信号通路与细胞焦亡与炎症反应相关,其过度激活可能导致炎症性疾病的发生[5],但在MI中的作用及其机制尚不清楚。本研究通过结扎左前降支法建立MI大鼠模型,给予CY干预,并予以腹腔注射NLRP3激活剂LPS,观察CY对MI大鼠心肌细胞焦亡和炎性损伤的影响,及NF-κB/NLRP3信号通路在其中的作用机制。
1 材料与方法
1.1实验动物:SPF级SD大鼠72只,雄性,250g~280g,购自博济医药科技股份有限公司,生产许可证号:SYXK(粤):2022-0279。实验前饲养于采光良好、通风的实验室,温度(22±1)℃,相对湿度40%~60%,自由饮水、进食。适应性饲养一周后开始实验,本实验已得到本院的动物伦理委员会批准。
1.2主要试剂:红花黄色素(CY)购自于广州威佳科技有限公司;戊巴比妥钠购自于Sigma公司;注射用青霉素钠购自瑞阳制药有限公司;2,3,5-三苯基氯化四氮唑(TTC)购自于北京索莱宝科技有限公司;伊文思蓝(EB)购自上海生工生物公司;NF-κB激活剂LPS购自于美国Peprotech公司;NLRP3、NF-κB、GSDMD-N、cleaved-caspase1、β-actin抗体及其二抗购自于Abcam公司;大鼠LDH、IL-1β、IL-18检测试剂盒购自于上海生工生物公司;RIPA裂解液购自于上海碧云天生物技术有限公司。
1.3MI大鼠模型的建立:参考文献[6]方法,随机选取60只大鼠通过冠状动脉左前降支结扎法建立大鼠MI模型。通过腹腔注射新鲜制备的2%戊巴比妥钠(10mL/kg)来麻醉大鼠。将大鼠固定于仰卧位置,行气管插管,并连接呼吸机,同时进行大鼠心电图监测。于胸骨左侧3~4个肋骨间以20~30度的角做一个1cm长的纵行切口,将胸肌逐层分离后,在大鼠胸部第3-4个肋骨间隙最宽处用眼睑器固定,暴露心脏。随后迅速在大鼠平左心耳底部用6-0号线结扎左前降支近端。最后关闭胸腔,缝合肌肉层,排除胸腔内空气,手术部位用注射用青霉素钠浸润,缝合皮肤。当观察到手术过程中结扎区周围心肌组织发白,心电图J点位置抬高时,说明MI大鼠模型建立成功。共造模成功48只大鼠,随机分为4组,分别是MI模型组(Model组)、低剂量CY组(CY-L组,20mg/kg)、高剂量CY组(CY-H组,40mg/kg)和高剂量CY+NF-κB激活剂组(CY-H+LPS组,CY 40mg/kg+LPS 10mg/kg[7]),每组12只。另取12只大鼠作为对照组(Control组),12只大鼠作为假手术组(Sham组)。Control组只进行麻醉操作,Sham组麻醉后开胸腔暴露心脏,只穿线不结扎。手术后灌胃给药,CY-L组腹腔注射CY 20mg/kg,CY-H组腹腔注射CY 40mg/kg,CY-H+LPS组注射CY 40mg/kg和LPS 10mg/kg,Control组、Sham组和Model组腹腔注射同等体积的生理盐水。每日一次,共给药28d。
1.4大鼠心电图检查:末次给药后,腹腔麻醉大鼠后行心电图检查。观察并记录各组大鼠左室射血分数(left ventricular ejection fraction,LVEF)、左室收缩压(LV systolic pressure,LVSP)、左室收缩末期容积(LV end-systolic volume,LVESV)、左室短轴缩短率(LV fractional shortening,LVFS)、左室舒张压(LV end-diastolic pressure,LVEDP)、左室舒张末期容积(LV end-diastolic volume,LVEDV),每个指标均观察并测量3个心动周期,计算出均值。
1.5TTC-EB染色法测定大鼠心肌梗死面积:给药结束后,每组选取6只大鼠处死,经颈总动脉逆行注射0.5% EB溶液1mL,摘除心脏,PBS洗涤后放入-20℃冻存过夜。次日横向将左心室切成厚度越2mm的切片共5片,切片浸入1% TTC溶液(37℃)并孵育20min,之后用多聚甲醛固定,使用ImageProPlus软件计算大鼠心脏切片的梗死面积。染色后观察切片,其中正常心肌呈蓝色,梗死心肌呈白色,缺血心肌呈红色。
1.6苏木精-伊红(HE)和Masson染色观察各组大鼠心肌组织病理学变化:处死剩余大鼠并解剖取出心脏,将小于结扎线 0.5mm 的心肌组织浸于10%甲醛溶液中固定,酒精脱水、石蜡包埋、切片机切片,HE和Masson染色后于观察各组大鼠心肌组织的病理学和纤维化变化。另取余下梗死处及边缘心肌组织剪碎,储存于-80℃。
1.7免疫荧光法检测各组大鼠心肌细胞焦亡:取出1.6中制备的心肌切片,经去石蜡、抗原修复、透化后,然后用2%山羊血清封闭,加入一抗cleaved-caspase1(1∶300)和NLRP3(1∶200),在4℃环境下孵育过夜。次日于暗处加入相应的二抗溶液(1∶500)并孵育45min,之后在暗处再加入DAPI试剂孵育10min,在荧光显微镜下观察记录焦亡状态的心肌细胞数量,计算焦亡心肌细胞百分比。
1.8检测各组大鼠心肌组织中IL-1β、IL-18和LDH水平:取1.6中冻存的心肌组织,加入冰生理盐水于超声匀浆机中3000 r/min制备10%心肌组织匀浆液。按IL-1β、IL-18和LDH试剂盒说明书检测各组大鼠心肌组织中IL-1β、IL-18和LDH水平。
1.9Westren blot检测各组大鼠心肌组织中NF-κB、NLRP3、GSDMD-N、cleaved-caspase1蛋白的表达:取1.6中冻存的心肌组织,研磨后加入RIPA裂解缓冲液提取心肌组织总蛋白,BCA试剂盒对蛋白定量,经过凝胶电泳、转膜、脱脂奶粉封闭,将膜与一抗NF-κB(1∶2000)、NLRP3(1∶4000)、GSDMD-N(1∶2000)、cleaved-caspase1(1∶3000)及β-actin(1∶5000)4℃孵育过夜;次日摇床复温,清洗膜,加入相应二抗接着孵育2h。使用ECL显色剂进行显色,经Image Lab软件分析计算各个蛋白条带灰度值,以β-actin作为内参,计算NF-κB、NLRP3、GSDMD-N、cleaved-caspase1蛋白相对表达水平。
2 结 果
2.1各组大鼠心功能指标:与Control组相比,Sham组无统计学意义(P>0.05)。与Sham组相比,Model组大鼠LVEF、LVSP及LVFS降低,LVEDV、LVESV和LVEDP升高,具有统计学差异(P<0.05)。与Model组相比,CY-L、CY-H组大鼠LVEF、LVSP及LVFS显著升高,LVEDV、LVESV和LVEDP显著降低(P<0.05)。与CY-L组相比,CY-H组大鼠LVEF、LVSP及LVFS显著升高,LVEDV、LVESV和LVEDP显著降低(P<0.05)。与CY-H组大鼠相比,CY-H+LPS组大鼠LVEF、LVSP及LVFS显著降低,LVEDV、LVESV和LVEDP显著升高(P<0.05)。见表1。

表1 各组大鼠心功能指标比较
2.2各组大鼠心肌梗死面积比较:Control组和Sham组大鼠无心肌梗死。与Sham组相比,Model组大鼠心肌梗死面积显著增加(P<0.05);与Model组相比,CY-L、CY-H组大鼠心肌梗死面积显著减少(P<0.05);与CY-L组相比,CY-H组大鼠心肌梗死面积显著减少(P<0.05);与CY-H组相比,CY-H+LPS组大鼠心肌梗死面积显著增加(P<0.05)。实验结果见表2、图1。

表2 各组大鼠心肌梗死面积比较

图1 各组大鼠心肌组织TTC-EB染色
2.3各组大鼠心肌组织病理学变化:HE染色和Masson染色切片图如图2、图3所示。Control组和Sham组大鼠心肌细胞排列规则,形态完整,无坏死和炎性细胞浸润,极少量的胶原纤维沉积;Model组大鼠心肌细胞肿大、排列紊乱,片状坏死,可见大量炎性细胞浸润,大量胶原纤维沉积;与Model组比较,CY-L组和CY-H组大鼠心肌组织病理损伤减轻,心肌细胞坏死数量减少,炎性浸润减轻,胶原纤维沉积减少;与CY-H组相比,CY-H+LPS组心肌组织病理损伤严重,细胞大量水肿坏死,胶原纤维沉积增多。

图2 各组大鼠心肌组织HE染色(×200)

图3 各组大鼠心肌组织Masson染色(×200)
2.4各组大鼠心肌细胞焦亡情况比较:Control组和Sham组基本无焦亡心肌细胞。与Sham组相比,Model组心肌细胞焦亡比例显著增加(P<0.05);与Model组相比,CY-L组、CY-H组大鼠心肌细胞焦亡比例显著降低(P<0.05);与CY-L组相比,CY-H组大鼠心肌细胞焦亡比例显著降低(P<0.05);与CY-H组相比,CY-H+LPS组大鼠心肌细胞焦亡比例显著增加(P<0.05)。结果见表3、图4。

图4 大鼠心肌免疫荧光结果(DAPI,×200)注:箭头所指为各组大鼠焦亡心肌细胞

表3 各组大鼠心肌细胞焦亡比例
2.5各组大鼠心肌组织中IL-1β、IL-18及LDH水平比较:与Control组相比,Sham组无统计学差异(P>0.05)。与Sham组比,Model组大鼠IL-1β、IL-18及LDH水平显著升高(P<0.05);与Model组相比,CY-L、CY-H组大鼠IL-1β、IL-18及LDH水平显著降低(P<0.05);与CY-L组相比,CY-H组大鼠IL-1β、IL-18及LDH水平显著降低(P<0.05);与CY-H组相比,CY-H+LPS组大鼠IL-1β、IL-18及LDH水平显著升高(P<0.05)。实验结果见表4。

表4 各组大鼠心肌组织中IL-1β IL-18及LDH水平比较
2.6各组大鼠心肌组织中NF-κB/NLRP3通路相关蛋白表达的比较:与Control组相比,Sham组无统计学差异(P>0.05)。与Sham组相比,Model组大鼠NF-κB、NLRP3、GSDMD-N、cleaved-caspase1蛋白表达水平显著升高(P<0.05)。与Model组相比,CY-L组、CY-H组大鼠NF-κB、NLRP3、GSDMD-N、cleaved-caspase1蛋白表达水平显著降低(P<0.05)。与CY-L组相比,CY-H组大鼠NF-κB、NLRP3、GSDMD-N、cleaved-caspase1蛋白表达水平显著降低(P<0.05);与CY-H组相比,CY-H+LPS组大鼠NF-κB、NLRP3、GSDMD-N、cleaved-caspase1蛋白表达水平显著升高(P<0.05)。实验结果见表5、图5。
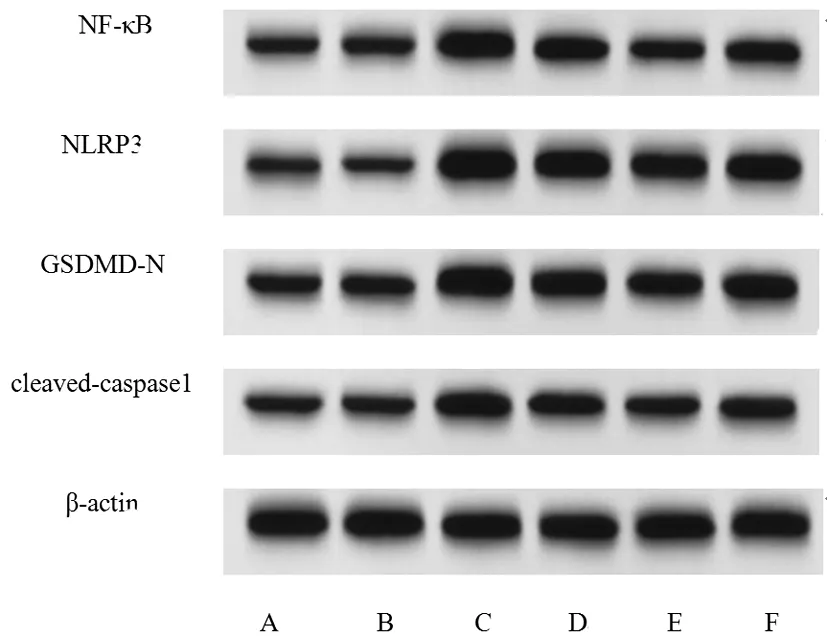
图5 各组大鼠心肌组织中NF-κB/NLRP3通路相关蛋白表达的比较注:A:Control组;B:Sham组;C:Model组;D:CY-L组;E:CY-H组;F:CY-H+LPS组

表5 各组大鼠心肌组织中NF-κB/NLRP3通路相关蛋白表达的比较
3 讨 论
MI是一种严重的冠心病临床类型,在发达国家导致每年超过1/3的患者死亡,是全球死亡和残疾的主要原因之一,给人们生命健康带来威胁[8]。本研究采用冠状动脉左前降支结扎法建立大鼠MI模型,该种模型在传统的徐氏方法基础上进行改良,大大提高了造模成功率。结果显示MI模型组大鼠LVESV、LVEDP、LVEDV升高,LVEF、LVSP、LVFS降低,切片显示心肌梗死面积约为(43.28±3.79)%,提示MI模型大鼠心肌缺血、心功能下降。
细胞焦亡是新定义的一种细胞死亡方式,其与炎症相关。当细胞发生焦亡时,细胞体积增加,细胞膜破裂穿孔,内容物流出,形成活化的焦亡小体,释放炎症因子进而加重炎症反应,致组织损伤和病理学变化[9]。有研究显示,心肌细胞焦亡参与了心衰的发生发展,也在心肌缺血/再灌注损伤中发挥了重要的作用[10]。而关于心肌细胞焦亡是否也参与了MI,目前研究较少。本研究建立MI大鼠模型后发现,Model组大鼠心肌组织中LDH水平增加,说明损伤了心肌细胞膜;大鼠心肌组织中细胞焦亡所占百分比显著升高(P<0.05),炎症因子IL-1β、IL-18增多,这些可能引起心肌组织坏死,造成心肌组织炎性损伤。HE染色和Masson染色结果显示心肌细胞肿大、排列紊乱,有大量炎性细胞浸润,并出现大量胶原纤维沉积,这些都是明显的炎性损伤特征。结果说明心肌细胞焦亡在MI发生、发展过程中发挥了重要的作用,且炎性损伤有可能导致了MI和心功能的下降。
目前,中医药因其毒副作用较小,治疗MI疗效确切,将其与西医结合应用于MI已成为医药界研究热点与趋势。CY作为红花的有效成分,市售的注射用红花黄色素在活血化瘀方面的临床效果优于红花。Lu等[11]研究发现CY能通过减少活性氧的释放和炎症反应来保护心脏免受缺血/再灌注损伤;Guo等[12]发现CY能通过减轻大鼠炎症反应和铁死亡来改善脑缺血/再灌注损伤。但CY在MI中对心肌细胞焦亡和炎性损伤的作用还鲜有报道。本研究结果显示,与Model组大鼠相比,CY-H组大鼠心功能明显改善,心肌组织的炎症损伤和细胞焦亡减弱,IL-1β、IL-18和LDH释放减少,说明CY能减轻MI的炎性损伤。
NLRP3是一种炎症小体复合物,在细胞焦亡中发挥了重要的作用。当细胞受到危险信号后,NLRP3、ASC和pro-caspase1相互组装导致pro-caspase1分解为活性cleaved-caspase1[13]。cleaved-caspase1促进IL-1β的成熟和分泌,诱导了组织炎性损伤。GSDMD被催化裂解为GSDMD-N和GSDMD-C,其中GSDMD-N能导致与炎症相关的细胞焦亡,且GSNMD受到NF-κB的调控。本研究结果显示,与Sham组相比,Model组大鼠心肌组织中NF-κB、NLRP3、GSDMD-N、cleaved-caspase1蛋白表达显著升高(P<0.05),诱导了心肌细胞炎性损伤和细胞焦亡。与Model组相比,CY-H组大鼠心肌组织中NF-κB、NLRP3、GSDMD-N、cleaved-caspase1蛋白表达显著降低,且减轻了心肌组织炎性损伤和细胞焦亡。推测CY可能通过抑制NF-κB/NLRP3通路减轻MI导致的心肌细胞焦亡和炎性损伤。为了验证此猜想,本研究利用NF-κB的激活剂LPS来干预高剂量CY处理的MI大鼠。结果显示,LPS减弱了高剂量CY对MI大鼠心肌细胞焦亡和炎性损伤的抑制作用。证实了CY可能抑制NF-κB/NLRP3通路,抑制MI大鼠的心肌细胞焦亡,减轻炎性损伤。
综上所述,CY可能通过抑制NF-κB/NLRP3通路,抑制MI大鼠的心肌细胞焦亡,减轻炎性损伤。该研究为开发用于MI临床治疗的新型药物提供了新的思路和方法。然而,该项研究还存在不足之处,NLRP3介导的细胞焦亡可能还涉及了其他通路,还需进一步设计实验进行研究。