基于mTOR/p70S6K信号通路探究紫丁香苷对高糖诱导的小鼠足细胞MPC5损伤的影响
2023-02-01姚春红李国红
姚春红, 李国红, 周 波, 徐 佳
(湖北省武汉市东西湖区人民医院综合医疗科, 湖北 武汉 430040)
糖尿病肾病(diabetes nephropathy,DN)是糖尿病的主要微血管病,是导致肾脏疾病终末期的重要诱因之一;DN在中国的患病率仅次于糖尿病性心血管疾病。DN被认为主要与代谢紊乱、血液动力学紊乱、氧化应激损伤、炎症和遗传因素有关。最近,大量研究表明,DN发病机理与足细胞损伤密切相关,足细胞参与肾小球滤过屏障[1]。紫丁香苷是一种苯丙醇苷类化合物,具有增强免疫力、降糖降脂、保肝、抗肿瘤、抗炎镇痛等药理作用[2]。有研究显示,紫丁香苷可抑制脑缺血再灌注损伤大鼠炎症反应,保护其神经功能,对缺血性中风具有治疗作用[3]。研究表明,足细胞的损伤和丧失通常是由哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)激活引起的,这可能导致肾小球疾病的进展[4]。p70核糖体蛋白S6激酶(p70 ribosomal protein S6 kinase,p70S6K)作为mTOR下游信号因子,可与mTOR共同作用影响多种疾病的进展[5]。牛晓静等[6]研究显示,mTOR/p70S6K信号通路可调控DN大鼠足细胞自噬,从而修复足细胞损伤。但紫丁香苷是否可通过mTOR/p70S6K信号通路影响足细胞损伤介导的DN尚未有研究报道。基于此本研究拟探究紫丁香苷对高糖诱导的足细胞损伤及mTOR/p70S6K信号通路的影响,为DN的防治提供理论依据。
1 材料与方法
1.1材 料
1.1.1细胞:小鼠足细胞MPC5购自北京龙跃生物科技发展有限公司,批号SJ19102。
1.1.2药物及试剂:紫丁香苷(纯度≥98%,原料药,货号134-19-7)购自江苏永健医药科技有限公司;重组小鼠干扰素-γ(IFN-γ)试剂(货号JN0913L)、化学发光试剂盒(货号JN1514L)购自广州威佳科技有限公司;RPMI 1640培养基(货号CK6017-5)、四甲基偶氮唑盐(MTT)试剂(货号CK7193-3)、细胞凋亡检测试剂盒(Annexin V-FITC)(货号CK1923-7)、TRIzol试剂(货号CK2635-1)、RIPA裂解缓冲液(货号CK3617-9)、兔抗鼠二抗(货号CP5319-5)均购自北京百灵威科技有限公司;鬼笔环肽染色试剂(货号JT91347)、荧光定量PCR(qRT-PCR)试剂盒(货号JT10091)、鼠源mTOR(货号JT11352)、p70S6K(货号JT11573)、GAPDH(货号JT10014)一抗均购自郑州金图生物科技有限公司。
1.1.3仪器:酶标仪(型号DR3700)、流式细胞仪(型号iQue 3)、qRT-PCR仪(型号Q2000C)均购自上海然哲仪器设备有限公司;共聚焦显微镜(型号RCM200)、凝胶成像仪(型号CL750)均购自北京森西赛智科技有限公司。
1.2方 法
1.2.1MPC5细胞培养及分组给药:将MPC5细胞置于RPMI 1640培养基中进行培养,培养基中添加10%胎牛血清,1%青霉素和链霉素,以及10U/mL重组小鼠IFN-γ。当MPC5细胞生长到70%~80%融合时,将它们转移至无IFN-γ的RPMI 1640培养基中,在37℃培养诱导分化2周。然后进行后续实验。依据文献[7,8]进行浓度设置,将MPC5细胞分为:对照组(5.5mmoL/L葡萄糖)[7]、高糖诱导组(30mmoL/L葡萄糖)[7]、紫丁香苷低浓度组(2.5μmoL/L紫丁香苷+30mmoL/L葡萄糖)、紫丁香苷中浓度组(5μmoL/L紫丁香苷+30mmoL/L葡萄糖)、紫丁香苷高浓度组[8](10μmoL/L紫丁香苷+30mmoL/L葡萄糖)。各组向RPMI 1640培养基中加入上述浓度的相应试剂或药物,培养72h。每组设置8个重复。
1.2.2MPC5细胞增殖能力测定:收集1.2.1中给药结束后的各组MPC5细胞,将细胞接种到96孔板中(2000个/孔),然后将20μL MTT(5mg/mL)添加到每个孔中,4h后,弃去上清液,加入150μL二甲基亚砜,振荡细胞悬液,并使用酶标仪测量480 nm波长处的吸光度值,计算细胞活力(细胞活力=各处理组吸光度值/对照组吸光度值×100%)。
1.2.3MPC5细胞凋亡能力测定:收集1.2.1中给药结束后的各组MPC5细胞,将细胞以1×106个/mL的密度重悬于800μL结合缓冲液中,加入10μL Annexin V-FITC和10μL碘化丙啶,在黑暗中于25℃孵育25min,然后采用流式细胞仪分析MPC5细胞凋亡情况。
1.2.4MPC5细胞骨架形态观察:收集1.2.1中给药结束后的各组MPC5细胞,多聚甲醛固定细胞25min,PBS清洗,然后添加鬼笔环肽染色试剂(红光)150μL,避光染色60min,置于共聚焦显微镜下观察MPC5细胞骨架形态。
1.2.5MPC5细胞mTOR、p70S6K信使核糖核酸(mRNA)表达测定:收集1.2.1中给药结束后的各组MPC5细胞,使用TRIzol试剂提取MPC5细胞中总RNA,逆转录为cDNA,随后进行qRT-PCR反应。热循环条件如下:在93℃下初始变性57s;然后39个循环(93℃变性,16s、57℃退火,22s、71℃延伸,13s)。使用2-ΔΔCt法定量mTOR、p70S6K mRNA在细胞内的表达水平。引物序列如下:mTOR正向5'-GAGACCGAGTCGCTCAAGTCCTA-3'和反向5'-AGTCGGGATGTCTGCTGGTA-3';p70S6K正向5'-GTACGTCGATCGATCGTAGCTCGATCGATGAGAGTC-3'和反向5'-CACTAGAGAGCTGCATGTAGCTAGCTGCTAGCTCGAT-3';GAPDH正向5'-ACCTGACCTGCCGTAGAA-3'和反向5'-TCCACCCTGTTGCTGTA-3'。GAPDH被用作内部参考,北京密码子生物科技有限公司负责引物的设计合成。
1.2.6MPC5细胞mTOR、p70S6K蛋白表达测定:收集1.2.1中给药结束后的各组MPC5细胞,PBS洗涤两次,将细胞在RIPA裂解缓冲液中裂解分离蛋白质,定量蛋白浓度后,取100μg的蛋白质进行电泳分离,转移蛋白质到聚偏二氟乙烯膜上,脱脂奶封闭后,添加鼠源mTOR(1∶380)、p70S6K(1∶380)、GAPDH(1∶480)一抗于4℃孵育12h,添加兔抗鼠二抗(1∶1700)于25℃孵育1.5h,化学发光试剂盒对蛋白条带进行显色,ImageJ软件进行定量分析。
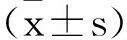
2 结 果
2.1紫丁香苷对MPC5细胞增殖能力的影响:与对照组比较,高糖诱导组MPC5细胞吸光度值、细胞活力显著降低(P<0.05);与高糖诱导组比较,紫丁香苷低、中、高浓度组MPC5细胞吸光度值、细胞活力依次升高(P<0.05)。见表1。
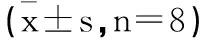
表1 紫丁香苷对MPC5细胞吸光度值和细胞活力的影响
2.2紫丁香苷对MPC5细胞凋亡能力的影响:与对照组比较,高糖诱导组MPC5细胞凋亡率显著升高(P<0.05);与高糖诱导组比较,紫丁香苷低、中、高浓度组MPC5细胞凋亡率依次降低(P<0.05)。见表2、图1。
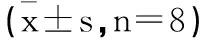
表2 紫丁香苷对MPC5细胞凋亡率的影响

图1 不同浓度紫丁香苷对MPC5细胞凋亡率的影响
2.3紫丁香苷对MPC5细胞骨架形态的影响:对照组MPC5细胞骨架形态正常,细胞长轴呈线性分布,荧光染色明显;高糖诱导组MPC5细胞骨架断裂,细胞萎缩,荧光染色黯淡;紫丁香苷低、中、高浓度组MPC5细胞骨架结构恢复清晰,荧光强度逐渐变亮,足突趋于明显;见图2。
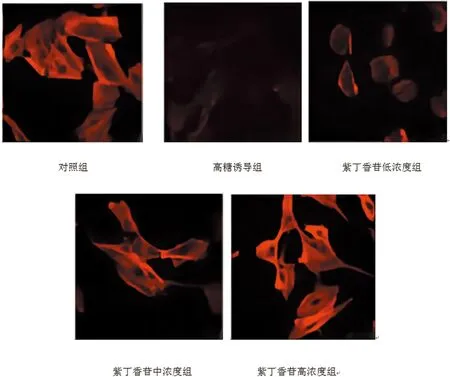
图2 不同浓度紫丁香苷对MPC5细胞骨架形态的影响(鬼笔环肽染色,×400)
2.4紫丁香苷对MPC5细胞mTOR、p70S6K mRNA表达水平的影响:与对照组比较,高糖诱导组MPC5细胞mTOR、p70S6K mRNA表达水平显著升高(P<0.05);高糖诱导组比较,紫丁香苷低、中、高浓度组MPC5细胞mTOR、p70S6K mRNA表达水平依次降低(P<0.05)。见表3。
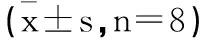
表3 紫丁香苷对MPC5细胞mTOR p70S6K mRNA表达水平的影响
2.5紫丁香苷对MPC5细胞mTOR、p70S6K蛋白表达水平的影响:与对照组比较,高糖诱导组MPC5细胞mTOR、p70S6K蛋白表达水平显著升高(P<0.05);高糖诱导组比较,紫丁香苷低、中、高浓度组MPC5细胞mTOR、p70S6K蛋白表达水平依次降低(P<0.05)。见表4、图3。
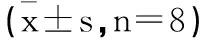
表4 紫丁香苷对MPC5细胞mTOR p70S6K蛋白表达水平的影响

图3 各组MPC5细胞mTOR、p70S6K蛋白印迹图注:A:对照组;B:高糖诱导组;C:紫丁香苷低浓度组;D:紫丁香苷中浓度组;E:紫丁香苷高浓度组
3 讨 论
足细胞是高度分化的上皮细胞,是肾小球滤过屏障功能的基本组成部分。足细胞损伤和凋亡是大量蛋白尿和肾小球硬化的原因,已成为DN的中心因素。因此,探索足细胞凋亡和损伤的机制将为DN的治疗提供重要的方法。研究发现,DN中足细胞的增殖和再生是有限的,其异常凋亡与DN的发生和进展有关[9]。本研究发现,高糖诱导组MPC5细胞骨架断裂,细胞萎缩,荧光染色黯淡,吸光度值、细胞活力显著降低,凋亡率显著增高,与Han等[10]的研究一致,表明高糖诱导的足细胞损伤模型建立成功。紫丁香苷具有多种药理作用,研究显示,紫丁香苷不仅能够抑制乳腺癌进展,还能改善骨关节炎大鼠软骨组织病理损伤[11,12]。此外,紫丁香苷还能通过改善β淀粉样肽诱导的人神经母细胞瘤细胞的神经毒性,恢复细胞活力、抑制细胞凋亡治疗阿尔茨海默病[13]。但目前未有紫丁香苷对足细胞损伤影响的文献报道。本研究结果显示,经紫丁香苷处理后,高糖诱导的MPC5细胞损伤减轻,细胞活力升高,凋亡率降低,且紫丁香苷浓度越高,效果越明显。提示紫丁香苷可能通过促进细胞增殖、抑制凋亡进而改善高糖诱导的MPC5细胞损伤。
mTOR/p70S6K信号通路可参与多种生理病理过程,影响细胞生长、分化、代谢等过程。研究显示,抑制mTOR/p70S6K信号通路可降低mTOR、p70S6K蛋白表达,从而抑制Caco-2细胞凋亡,减轻脂多糖诱导的Caco-2细胞屏障损伤[14]。文献表明小檗碱能抑制mTOR/p70S6K信号通路激活足细胞自噬,从而减轻高糖诱导的足细胞凋亡[15]。本研究结果发现,高糖诱导的MPC5细胞中mTOR、p70S6K mRNA和蛋白表达显著升高,与Li等[15]的研究结果一致,提示高糖环境可导致MPC5细胞中mTOR/p70S6K信号通路被激活。而高糖诱导的MPC5细胞经紫丁香苷处理后,mTOR、p70S6K mRNA和蛋白表达降低,且紫丁香苷浓度越高,降低幅度越大,表明紫丁香苷可抑制MPC5细胞中mTOR/p70S6K信号通路的激活。本研究结合上述结果推断紫丁香苷对高糖诱导的MPC5细胞损伤的保护作用可能与其能抑制mTOR/p70S6K信号通路的激活有关。
综上所述,紫丁香苷对高糖诱导的MPC5细胞损伤具有保护作用,能明显促进MPC5细胞增殖,抑制其凋亡,其机制可能与抑制mTOR/p70S6K通路的激活有关。本研究的不足之处在于未设置mTOR通路激活剂组,下一步将采用mTOR通路激活剂进一步验证本研究的结果。