儿童血管相关性咯血影响咯血量及术后复发高危因素分析
2023-01-31吕铁伟
谢 磊 吕铁伟
重庆医科大学附属儿童医院心血管内科 国家儿童健康与疾病临床医学研究中心 儿童发育疾病研究教育部重点实验室 儿科学重庆市重点实验室(重庆 400014)
咯血(hemoptysis)是指喉以下呼吸道部位的出血,并经咳嗽动作从口腔排出的过程,属于临床常见的疾病症状之一。有研究显示,成年人中因咯血或合并咯血住院治疗的占所有住院患者的0.2%,儿童咯血发病率较成人高,但病因有一定差异,儿童病因主要包括呼吸道感染、特发性肺含铁血黄素沉着症(IPH)、肺结核、支气管扩张及心肺血管异常[1-2]。由于儿童咳嗽反射弱且不能及时将血液咯出,通常在大量咯血或反复发作时才被发现,易引起窒息、呼吸衰竭、休克甚至死亡。血管相关性咯血作为儿童咯血的少见病因,由于咯血量大、临床症状重、病死率高而日益得到重视,但目前对于其咯血量影响因素鲜有文献报道。自从1974年Remy等[3]应用支气管动脉栓塞(bronchial artery embolization,BAE)替代外科手术治疗咯血以来,介入封堵即被认为是一种安全的治疗方案,但在治疗后的中长期随访中发现复发并不少见[4-7],如何降低复发率是亟待解决的问题。本研究对因血管畸形导致咯血并行侧支血管封堵术的患儿进行分析,观察介入治疗咯血的疗效,并分析影响咯血量及术后咯血复发的危险因素。
1 对象与方法
1.1 研究对象
选取2012年1月至2020年1月重庆医科大学附属儿童医院呼吸及心血管内科诊断为血管相关性咯血并接受介入治疗的患儿。纳入标准:①年龄<18岁;②有明确咯血病史;③术前经胸部血管增强CT(CTA)、心血管造影(DSA)确定存在异常血管(包括异常支气管动脉、非支气管动脉系统侧支、肺动-静脉瘘)明确诊断为血管相关性咯血[8];④单纯行侧支血管介入封堵术。排除标准:①合并有肺多血性先天性心脏病、肺动脉高压、心力衰竭、心肌病;②有明确支气管扩张、肺结核,支气管镜高度怀疑有IPH证据;③有明确血液肿瘤系统疾病;④病历资料不完整。
本研究获本院医学伦理委员会的批准,审批号为(2022)年伦审(研)第(302)号。
1.2 方法
1.2.1 分组及相关定义 目前对于咯血量的评估尚无统一标准,通常规定24 h内咯血量>500 mL或一次咯血量>100 mL 为重度咯血,24 h 内咯血量100~500 mL 为中度咯血,≤100 mL 为轻度咯血。但在儿童中,为消除体质量对咯血量的影响,根据每公斤体重24 h内失血量建立了咯血严重程度的相对标准:<0.7 mL/(kg·24 h)为轻度,0.7~3.5 mL/(kg·24 h)为中度,>3.5 mL/(kg·24 h)为重度,>8.0 mL/(kg·24 h)为致命性咯血[9]。本研究按咯血量大小将重度及致命性咯血归为大咯血组,轻度及中度咯血归为非大咯血组。复发定义为血管相关性咯血患儿经介入封堵治疗后再次出现任何形式的咯血发作(如血痰,或从气管切开或气管插管中抽出血液等)[10],并符合血管相关性咯血诊断标准者。肺炎支原体(Mycoplasma pneumoniae,MP)近期感染以血清MP抗体滴度(MP-PA)≥1:320为诊断依据[8]。
1.2.2 临床资料收集 一般信息包括姓名、性别、年龄、体质量、身高、籍贯、临床表现、诊断、住院时长、咯血量等;实验室检查包括常规血液检查、生化、痰(痰培养、呼吸道病原检测)或胃液检查(找抗酸杆菌、铁巨噬细胞)、MP-PA;影像学检查包括纤维支气管镜、经胸超声心动图(TTE)、胸部影像学(X线、CTA)、DSA 等;介入治疗信息包括咯血相关异常血管类型、起源、走行、数量及内径,介入手术时长等。
1.2.3 随访 患儿出院后通过门诊和电话进行规范定期随访,记录临床表现、胸片和超声心动图等复查结果。对于咯血复发患儿,记录复发时间、咯血量、实验室随访结果,追踪异常血管类型及数量等手术资料。
1.2.4 手术情况 ①术前检查:所有患儿完善常规术前准备,包括血常规、肝肾功能、电解质、凝血功能、心肌酶、心电图、TTE 等,行胸部CTA 检查初步筛查病变血管部位及明确是否存在血管畸形,对提示存在异常血管者行DSA检查。②手术方法:麻醉后行股动静脉穿刺,上行造影导管分别进行肺动脉造影、主动脉造影和选择性血管造影。肺动脉造影明确肺动静脉瘘,主动脉造影明确异常支气管动脉及其他侧支血管情况,选择性造影是将导管置于异常血管处再次手推造影,进一步明确异常血管的类型、起源、大小、走向及瘘口位置等。确认目标血管后,通过输送轨道将合适大小的封堵器放置在瘘口处,再次心脏彩超和造影检查评估堵闭效果,确认堵闭器位置良好稳定且造影剂分流消失则释放封堵器。对于存在一条以上异常血管的患儿,根据血管特点将能进行封堵的异常血管全部堵闭。术后使用压迫止血器局部加压包扎止血,保持穿刺侧肢体制动18 h。
1.3 统计学分析
采用SPSS 25.0统计软件进行数据分析。以P<0.05为差异有统计学意义。非正态分布计量资料以M(P25~P75)表示,组间比较采用Wilcoxon秩和检验。计数资料以例数(百分比)表示,组间比较采用χ2检验或Fisher精确概率法检验。采用二分类logistic回归分析咯血量以及咯血复发的影响因素。以P<0.05为差异有统计学意义。
2 结果
2.1 一般情况
共纳入41例血管相关性咯血患儿,男19例、女22例,中位年龄为8.9(6.9~11.2)岁。28例患儿伴有乏力、胸闷、胸痛、腹痛、面色苍白、活动后气促等表现,其中8例表现为胸痛、胸闷,9例以腹痛、呕吐等消化道症状为主,11 例主要表现为乏力、面色苍白、大汗。6例(14.6%)为轻度咯血,17例(41.5%)为中度咯血,18 例(43.9%)为重度咯血,无致命性咯血。
所有患儿均进行胸部CTA 检查,其中32 例异常血管与右肺交通,以右肺下叶为主,3 例为双肺,1 例为左肺,余5 例提示阴性结果。DSA 显示37 例患儿异常血管起源于平胸4~7 椎体的降主动脉,另外有源于平胸12椎体的降主动脉(n=1)、主动脉弓(n=7)、锁骨下动脉(n=2)、右侧甲状颈干(n=1)、肾动脉(n=1)、桥静脉-左肺动脉瘘(n=1)。异常血管中位数为2.0(1.0~2.0)支,异常血管数量为1、2、3 支的患儿分别为17 例、19 例、5 例;异常血管内径范围为1.2~10.0 mm,异常血管中位内径2.3(1.6~3.3)mm。所有患儿的手术时长为1.0(0.7~1.5)h,术后即刻成功率为95.1%,有2 例术后24 h 内再次发生咯血,经内科治疗后好转。
2.2 咯血量影响因素
大咯血组患儿18 例,非大咯血组23 例。与非大咯血组相比,大咯血组血红蛋白较低、MPPA≥1:320的比例较高、内径较大、手术时间较长、住院时间较短,差异均有统计学意义(P<0.05)。见表1。

表1 大咯血组与非大咯血组临床特征比较
结合临床和单因素分析结果,将MP-PA ≥1:320、异常血管内径纳入二分类logistic回归分析,发现异常血管内径大、MP-PA ≥1:320 是影响咯血量的独立危险因素(P<0.05)。见表2。

表2 二分类logistic回归分析咯血量影响因素
2.3 咯血复发危险因素
共13例接受介入治疗的患儿出现咯血复发,女6例、男7例,中位复发年龄10.5(8.4~13.2)岁,复发时间为术后1~24 个月,复发时间中位数为4.5(3.0~8.3)月,总体复发率31.7%。复发组中10例(76.9%)患儿MP-PA≥1:320。
与非复发组相比,复发组血红蛋白较低,MPPA≥1:320的比例较高,异常血管数量较多,差异有统计学意义(P<0.05)。见表3。
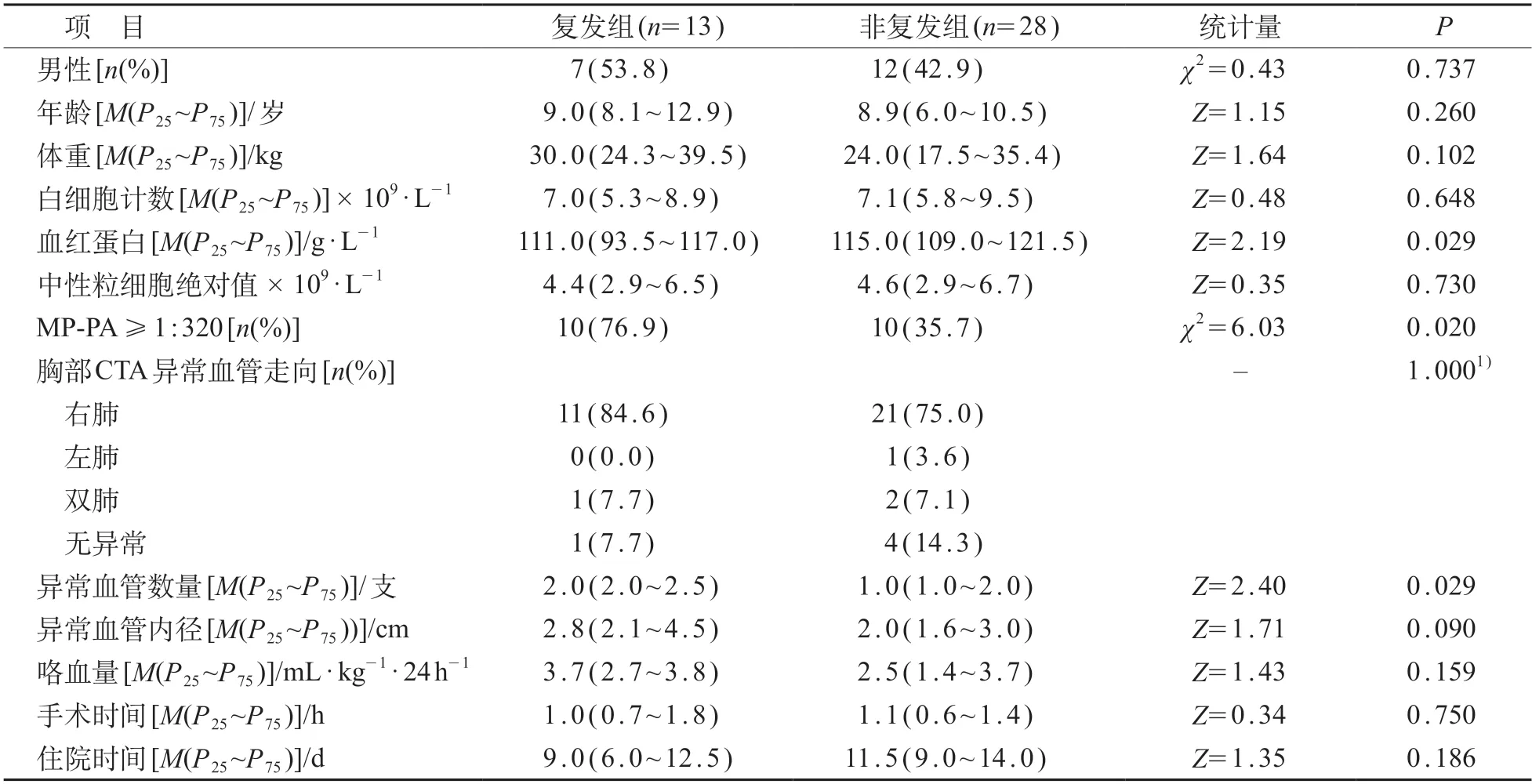
表3 咯血复发组与非复发组临床特征比较
结合临床和单因素分析结果,将血红蛋白、MPPA≥1:320、异常血管数量纳入二分类logistic回归分析,发现异常血管数量多是咯血复发的独立危险因素(P<0.05)。见表4。

表4 二分类logistic回归分析咯血复发的影响因素
3 讨论
咯血属于呼吸系统常见的临床急症,约5.0%~15.0%的咯血会危及生命,大咯血的死亡率超过50.0%[11-12]。临床上咯血病因众多,其中血管相关性咯血是近年逐渐重视的病因。DSA作为诊断异常血管的金标准,证实90.0%的咯血供血动脉来自于支气管动脉系统,异常支气管动脉主要来源于平胸5~6椎体的降主动脉[13],也有部分起源于主动脉弓、腹主动脉;同时非支气管动脉系统的供血血管如锁骨下动脉、甲状腺动脉、肋间动脉、膈下动脉、内乳动脉等也扮演了重要角色[14],这与本研究结果相仿。
血管相关性咯血可有不同程度的出血量。本研究显示,血清MP-PA ≥1:320、粗大的血管是引起大咯血的独立危险因素,并且咯血量越大,手术难度越大。众所周知,越粗的靶血管代表血流量越多,一旦血管发生破裂,出血量通常较大。MP 作为介于病毒和细菌之间的小型原核微生物,可黏附于肺泡上皮、血管内皮等组织,产生社区获得性呼吸窘迫综合征毒素(community acquired respiratory distress syndrome toxin,CARDS TX),诱导机体产生TNF-α、IL-1β等促炎细胞因子加剧炎性反应,加重对血管内皮的浸润导致大量咯血[15]。同时MP 激活免疫系统后会诱导血管扩张,血流量急剧增加,且肺组织中发生的炎症反应导致血氧传递功能障碍造成肺通气障碍,低氧可促进血管生成基因表达的调节,如激活血管内皮生长因子(VEGF)导致异常血管的扩张性变化,从而导致流向肺组织的血流增加[8,16]。值得注意的是,本研究显示咯血量越小住院时间反而越长。回顾这部分患儿的临床资料发现,少-中量咯血患儿临床症状较轻,往往导致临床医师放松对血管病因的寻找,只有在发生反复咯血时才会完善胸部血管CTA或者DSA检查,而胸部血管CTA 检查对引起少-中量咯血的异常血管显示敏感度较低,从而延长了诊断流程,导致住院时间延长。
自从1974年Remy等[3]将BAE替代外科手术用于危及生命的咯血中后,介入治疗因具有较高的技术成功率和临床成功率已成为大咯血的一线治疗手段。然而,相关研究在对介入术后大咯血患者(包括支气管扩张、肺结核、肺血管畸形等)的长期随访中发现,其复发率较高,各研究显示为9.8%~57.5%[6,17-19]。本研究中,41例因血管畸形导致咯血患儿介入术后的即刻成功率为95.1%,随访过程中无死亡以及严重不良事件发生,说明介入治疗在儿童血管畸形相关性咯血中是安全有效的,但在1~8 年的随访中共有13例复发,复发率为31.7%。对复发患儿的临床资料、影像资料和手术资料进行分析,胸部影像学及DSA结果显示复发部位几乎均位于右肺下叶,同时发现复发患儿MP感染率为76.9%。有文献报道,MP的常见感染部位在右肺,它具有体积小、复制迅速、侵袭力强等特点[20-22],侵入呼吸道黏膜后借助P1蛋白等黏附蛋白黏附于上皮细胞[23],可抑制呼吸道纤毛运动、介导上皮细胞损伤甚至死亡、引起呼吸系统免疫炎症反应,从而破坏血管内皮细胞引起血管破裂而导致咯血复发[22]。
本研究显示,异常血管数量是咯血复发的独立危险因素,异常血管数量越多,术后咯血复发的概率越高。究其原因,多条异常血管对咯血的发生均有“贡献度”,且贡献度与血管的内径呈正相关,细小的侧支血管开口小,操作空间小,难以成功建立堵闭器的输送轨道,介入封堵仅能堵闭直径>1 mm的异常血管。此外,在进行DSA 造影时由于造影窗口小亦易遗漏罕见部位来源的异常血管,导致术后存在部分未堵闭的细小血管,而这些细小血管在粗大血管被封堵后,在富含营养、压力高的动脉血流供应下,随着时间的延长会逐渐变粗变长,使瘘口增大从而导致咯血复发。
综上,血管相关性咯血是儿童少见但重要的咯血病因,异常血管内径以及血清MP-PA ≥1:320 与咯血量大小密切相关。介入治疗作为一线治疗方式,具有较高的安全性及有效性,但在中长期随访中仍有一定的复发率,异常血管数量已被确认为复发的重要预测因子,早期咯血复发可能与封堵不完全有关,晚期复发多与未堵细小侧支血管增粗有关。因此,熟练掌握血管相关性咯血的特点和介入封堵技术,规范定期随访,尽早发现大咯血和复发的高危因素,及时进行医患沟通和干预措施才能提高大咯血治疗效果并降低咯血复发率。
