基于转录组测序对剑白香猪黑色素生成相关基因的筛选与分析
2023-01-31覃海,陈伟*,毕欢,袁巍,周萍
覃 海,陈 伟*,毕 欢,袁 巍,周 萍
(1.贵州大学 高原山地动物遗传育种与繁殖教育部重点实验室,贵州 贵阳 550025; 2.贵州省动物遗传育种与繁殖重点实验室,贵州 贵阳 550025;3.贵州大学 动物科学学院,贵州 贵阳 550025)
剑白香猪是我国的二级稀有保护动物,原产于贵州省剑河县,剑白香猪体型特点总体上比较矮小、体长较短、腹部下凹,在毛色上头部和尾部是黑色、中部为白色。剑白香猪皮薄肉嫩且风味独特,但其毛色沉积的机制如何,至今未见有报道。毛色是动物重要的品种特征之一,可以为养猪生产及猪的育种提供很多便利,它能为确认品种纯度、杂交组合、亲缘关系以及评价产品的质量提供参考[1]。随着肉质好、生产率高、生长速度快等优良性状猪的杂种优势被广泛应用,生活中会出现“一猪多色”的情况。在杂交过程中,为使商品猪具有理想的毛色,在选择后备种猪时,毛色也成为需要认真考虑的性状。因而,揭示猪毛色遗传机制及其影响毛色相关基因的遗传规律,对于剑白香猪的开发和育种具有重要意义[2]。
哺乳动物的毛发颜色有所不同,是因为它们体内含有的色素含量及比例不同,主要代表是黑色素及其衍生物[3]。黑色素主要为两种类型,一种为真黑色素呈棕黑色或深色;另一种为褐黑色素呈红黄色。黑色素是由黑色素细胞合成,主要位于皮肤真皮层中的基底层。黑色素的形成是一个复杂的过程,从黑色素细胞的分化、增殖、迁移和成熟,以及合成黑色素的过程中,都伴随着很多功能基因的参与,通过这些基因的互作进而形成了黑色素合成的复杂调控网[4]。黑色素生成后,由黑素小体通过黑色素细胞的突触转运到周围的角质细胞及毛囊。最后,毛发的颜色会因真黑色素和褐黑色素的比例与含量不同而存在差异[5]。如长白猪、杜洛克猪、剑白香猪、东北花猪和莱芜黑猪等,毛色各异,差别很大。哺乳动物的毛色是由多个基因决定的,这些基因影响着黑色素的生成或黑色素细胞的生成、增殖和迁移,随着生物技术的发展,已逐渐发现在哺乳动物中的毛色主效基因,如MC1R、TYR家族(TYR、TYRP1、DCT)、KIT、MLANA、MITF和EDNRB等基因可以通过调节黑色素的沉积而决定动物毛发的颜色。因此,不同的毛色可以理解为基因调控的结果。
本研究采用全转录组测序技术对剑白香猪的黑色被毛皮肤和白色被毛皮肤的差异表达基因进行筛选和分析,通过香猪不同毛色皮肤组织的转录组比较,筛选可能与剑白香猪被毛颜色形成相关的基因,以期为进一步探究这些基因调控剑白香猪毛色性状的遗传机制奠定基础。
1 材料与方法
1.1 样品采集采集贵州剑白香猪的头部和尾部黑色被毛皮肤和中部背上白色被毛皮肤,用DEPC水处理后放入无RNA酶的冻存管中,液氮中冷冻带回实验室,转入-80℃的超低温冰箱储存,备用。
1.2 RNA的提取与检测利用TRIzol法提取剑白香猪皮肤组织样本的总RNA,Nanodrop检测RNA的纯度,Qubit 2.0对RNA浓度定量,Aglient 2100检测RNA的完整性,对检测合格的样品进行测序。
1.3 RNA文库的构建利用Epicentre Ribo-ZeroTM试剂盒去除RNA样品中的tRNA和rRNA等一些不编码的RNA,加入片段缓冲液使rRNA-depleted RNA被随机打断,通过Oligo磁珠法将rRNA-depleted RNA反转录成cDNA并纯化。将纯化的双链cDNA末端做修复和加A处理,再连接测序接头,最后降解U链,通过PCR富集得到cDNA文库。
1.4 文库测序和质量控制由百迈克公司用Illumina HiSeq平台进行测序。过滤Raw Data数据后,得到Clean Data。将Clean Data与指定参考基因组进行序列比对,从而得到Mapped Data。在对插入片段长度检验和随机性检验等测序文库质量进行评估。原始数据(raw reads)通过质量控制获得优化的数据(clean reads)。
1.5 剑白香猪转录组数据中SNP位点的发掘使用GATK软件识别测序样品与参考基因组间的单碱基错配,识别出SNP位点。用SNPEff软件对识别出的SNP进行注释。
1.6 差异表达使用edgeR[6]软件分别对剑白香猪黑色被毛皮肤和白色被毛皮肤转录组数据进行差异分析,并利用DESeq[7]软件分析基因的差异表达情况。
1.7 差异表达基因的功能注释和富集分析利用goseq1.22.0软件(http://bioconductor.org /packages/goseq/) 对差异表达基因进行GO注释[8]。
KEGG是有关通路的主要公共数据库。利用 KOBAS[9]软件找出与整个基因组背景相比错误发现率(FDR)≤0.05的通路,即为差异表达基因显著富集通路。
1.8 荧光定量PCR试验PCR反应体系(25.0 μL):10 μmol/L上、下游引物各0.5 μL,cDNA 1.0 μL,SYBR®Premix Ex TaqTM(2×) (ABI,美国) 13.0 μL,补水至25.0 μL。反应条件:95℃ 10 min预变性;95℃ 10 s变性,58℃ 30 s退火,反应40个循环。使用Primer Premier 5.0软件设计引物,在擎科生物技术有限公司合成,所用引物序列见表1。以5S做内参基因,采用2-ΔΔCt法计算基因的相对表达量。
1.9 免疫组化染色对前期制备的剑白香猪的石蜡切片进行组织化学染色,一抗选用兔抗MITF单克隆抗体和鼠抗TYR单克隆抗体(北京安诺伦生物科技有限公司),二抗选用酶标山羊抗兔lgG聚合物和酶标山羊抗小鼠lgG聚合物(北京安诺伦生物科技有限公司)。阴性对照用1×PBS替代进行孵育;空白对照既不滴加单克隆抗体进行孵育,也是用1×PBS替代进行孵育。染色结束后再显微镜下观察MITF和TYR的蛋白定位。

表1 qRT-PCR引物序列
2 结果
2.1 转录组测序数据质量检测由表2可知,Clean Data中Pair-end Reads总数为66 011 819,总碱基数目为19 630 484 846,每个样品均获得了16 645 506 106个以上的碱基,6个样品平均GC含量为51.95%,N为0.00%,Q30均在94.37%以上。利用HISAT2作为比对工具,发现平均92.50%的Mapped Reads数据可比对到猪参考基因组上,其中平均 81.11% 的数据可比对至猪参考基因组唯一位置,表明测序数据质量较好。

表2 样品测序数据评估统计表
2.2 SNP 分析对各样品Reads与参考基因组序列进行比对,由表3可知L13、L14、L15样品上共得到6 070 559个SNP位点,5 121 227个基因区SNP位点,949 332个基因间SNP位点;其中转换型SNP总数占SNP位点总数的73.01%,颠换型SNP总数占SNP位点总数的26.98%。L12、L16、L17样品上共得到5 144 981个SNP位点,4 284 209个基因区SNP位点,860 772个基因间SNP位点;其中转换型SNP总数占SNP位点总数的72.40%,颠换型SNP总数占SNP位点总数的27.60%,由此可见,碱基的转换型显著高于颠换型。6种单核苷酸变异中,C/T和A/G发生的频率最高(图1)。从图2和图3可看出SNP主要分布于intron和intergenicr区, 而non synonymous coding在白色皮肤组织和黑色皮肤组织中分别有43 699和45 594个SNP。对各样品的SNP用SNPEff软件注释之后分析发现,在剑白香猪白色被毛皮肤组织测序结果中,有2个与黑色素合成相关的差异基因存在错义突变的SNP,SLC45A2有2个错义突变的SNP位点:Exon1-g.229 G>A,由甘氨酸突变为精氨酸、Exon1-g.13499 A>G,由丝氨酸突变为甘氨酸;TYRP1有1个错义突变的SNP位点:Exon7-g.17261 A>G,由组氨酸突变为精氨酸。
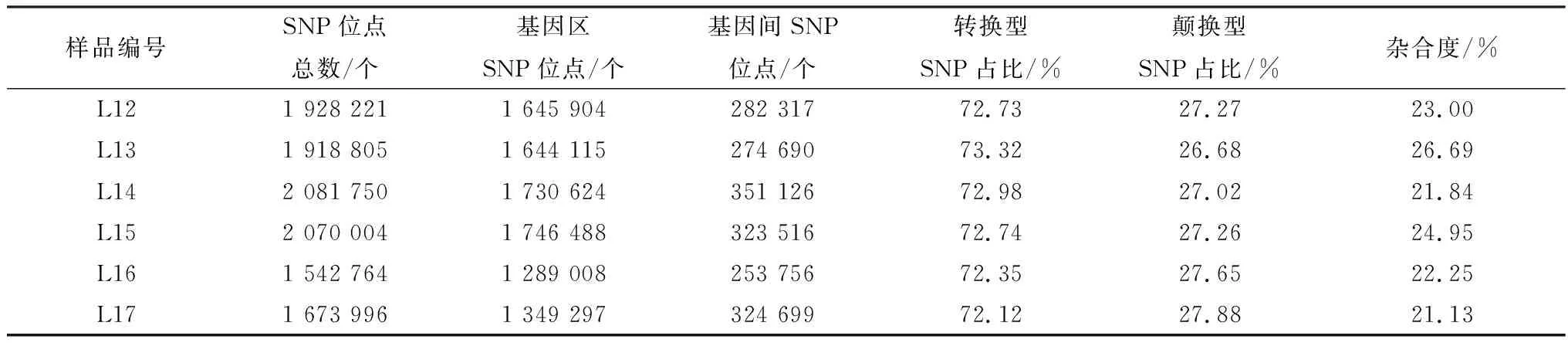
表3 SNP位点统计表

图1 SNP突变类型分布图

图2 L13、L14、L15 SNP注释分类图
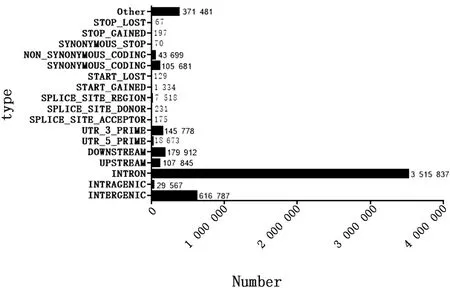
图3 L12、L16、L17 SNP注释分类图
2.3 差异表达筛选及聚类分析通过计算各样本所有基因的表达值FPKM,共发现10 463个基因表达(FPKM≥1),其中10 294个基因 FPKM 位于1~100之间。从箱线图(图4)中可以看出单个样品基因表达分布的离散程度,还可以比较不同样品的整体基因表达水平。
图4 各样品FPKM箱线图
利用edgeR软件筛选差异表达基因,筛选的条件为差异倍数(fold change,FC)和错误发现率(false discovery rate,FDR)。将差异倍数大于等于2 且P<0.05 作为筛标准,共鉴定出1 230个显著差异表达基因,其中相较于白色被毛皮肤,在黑色被毛皮肤中显著上调基因有738个,下调基因有492个。通过火山图(图5)可直观地显示2组样本间基因差异表达的分布情况。通过注释后发现显著性差异表达基因中包含一些与黑色素合成过程相关的基因,例如MLANA、PMEL、DCT、TYRP1、TYR和SLC45A2参与黑色素合成调控。根据显著性差异表达基因进行聚类分析,发现同一颜色皮肤组织的生物学重复聚集在一起,同一皮肤组织出现分离(图6),表明本研究所用样本组间生物学重复性较好。

图中的虚线为筛选差异基因的阈值,每一个点都代表一个基因;绿色.下调差异表达基因;红色.上调差异表达基因;黑色.非差异表达基因

不同颜色代表了基因在样品中的表达量水平log10(FPKM+0.000 001)
2.4 差异表达基因GO和KEGG富集分析对所有差异表达基因GO富集,图7可以看出有13个基因显著富集于生物刺激反应(response to biotic stimulus)、细胞外的细胞器(extracellular organelle)、小分子结合(small molecule binding)和精子部分(sperm part)。利用GO数据库对差异表达基因进行生物过程(biological process)、细胞组成(cellular component)、分子功能(molecular function) 3方面的注释,分析表明共有1 070个差异表达基因显著富集于9个GO term(表4),生物过程包含6个功能亚分类,分别为RNA聚合酶Ⅱ启动子转录调控(positive regulation of transcription from RNA polymerase Ⅱ promoter)、蛋白降解(proteolysis)、生物调节(regulation of biological quality)、细胞连接复合体(extracellular matrix organization)、蛋白自磷酸化(protein autophosphorylation)、单生物代谢过程(single-organism metabolic process)等过程;细胞组成功能过程及显著的只含有2个功能亚分类即细胞质(cytoplasm)和细胞核(nucleus);分子功能过程只包含了1个功能亚分类即ATP结合(ATP binding)。

红色和蓝色分别表示高表达与低表达的term;小括号里面是该term包含的显著性差异的基因数量

表4 差异表达基因topGO富集结果
以q值<0.05作为显著性富集的阈值对显著性差异表达基因进行通路富集分析,结果显示共有 70个差异表达基因富集到30条通路中,2条通路显著富集(q值<0.05):酪氨酸代谢 (tyrosine metabolism)和黑色素合成(melanogenesis)通路(表5)。结果显示黑色素合成与酪氨酸代谢通路与剑白香猪毛色性状的形成有着紧密的关系。

表5 差异表达基因显著富集的KEGG通路列表
2.5 荧光定量PCR验证转录组测序随机选择了TYR、TYRP1、DCT、MLANA、PMEL、SLC7A11、SLC24A5、SLC45A2、SLC7A5基因通过qRT-PCR 验证转录组测序数据的准确性。试验结果表明有8个基因在黑色被毛皮肤与白色被毛皮肤组织间表达变化模式和与转录组测序结果的趋势一致(图8),表明本研究中基于转录组测序的数据是准确可靠的。
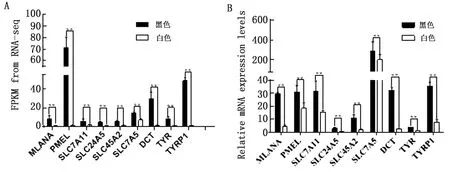
A.全转录组测序各基因的FPKM值;B.qRT-PCR检测各基因的mRNA表达量
2.6 MITF蛋白在香猪皮肤组织中的表达分析通过免疫组织化学染色方法观察香猪不同颜色被毛皮肤组织中MITF蛋白的表达定位情况,图9结果显示MITF蛋白在黑色被毛皮肤和白色被毛皮肤中均有阳性表达,且阴性对照组未见阳性反应;观察发现,主要在毛囊外根鞘部位以及表皮的颗粒层、棘细胞层和基层有阳性表达。白色被毛皮肤和黑色被毛皮肤相比,阳性反应着色较浅,说明MITF蛋白在香猪黑色被毛皮肤中的表达量高于白色被毛皮肤。
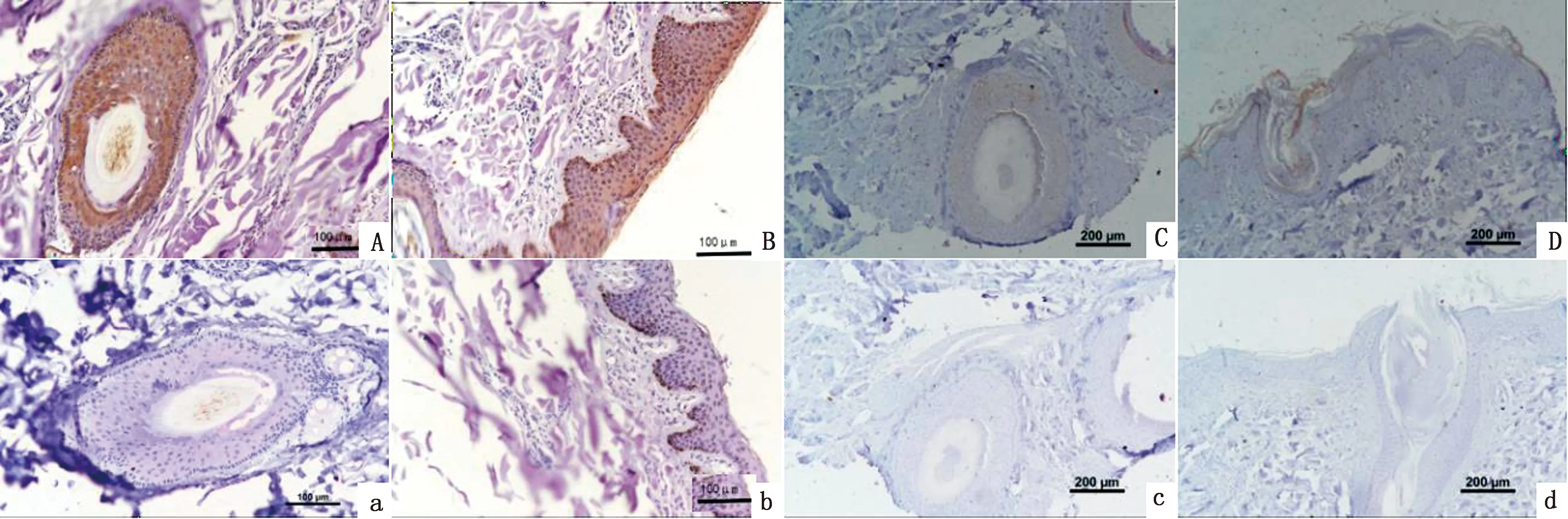
A、B、a、b.黑色被毛皮肤组织,A、a为横切,B、b为纵切,A、B为阳性结果,a、b为阴性对照;C、D、c、d.为白色被毛皮肤组织,C、c为横切,D、d为纵切,C、D为阳性结果,c、d为阴性对照
2.7 TYR蛋白在香猪皮肤中的表达分析免疫组织化学染色结果显示(图10),在剑白香猪黑色被毛皮肤组织毛囊的纤维层、外根鞘、真皮层、表皮的颗粒层、棘细胞层、基底层以及毛囊周围都有TYR蛋白的阳性表达,白色被毛皮肤只在毛囊的外根鞘部位以及表皮的颗粒层、棘细胞层和基层有TYR蛋白的阳性表达,阴性对照组未见阳性反应。白色被毛皮肤与黑色被毛皮肤相比,阳性反应着色较浅,说明TYR蛋白在香猪黑色被毛皮肤中的表达量高于白色被毛皮肤。
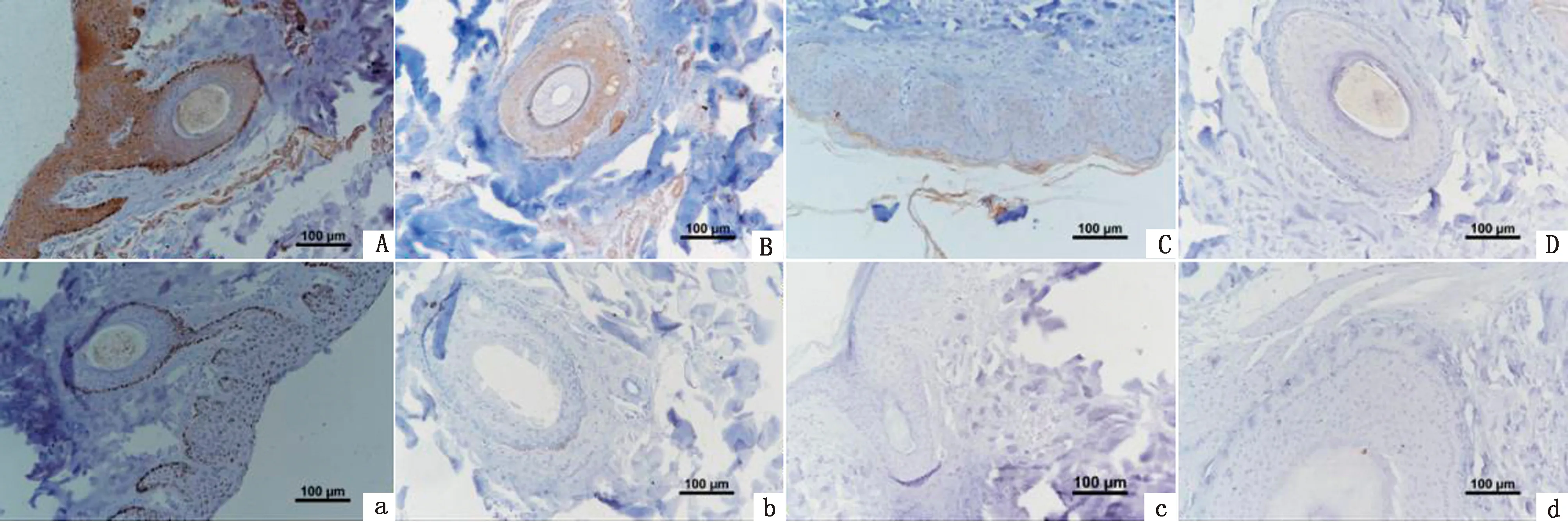
A、B、a、b.为黑色被毛皮肤组织,A、a为横切,B、b为纵切,A、B为阳性结果,a、b为阴性对照;C、D、c、d为黑色被毛皮肤组织,C、c为横切,D、d为纵切,C、D为阳性结果,c、d为阴性对照
3 讨论
哺乳动物的肤色和毛色主要由2种黑色素:真黑素(eumelanin)和褐黑素(pheomelanin)决定[10]。MADELAINE等[11]提出只有在黑色素的作用下才能产生复杂的毛色。神经嵴细胞通过迁移分化为成熟的黑色素细胞并产生黑色素,而黑色素则转移到皮肤角质细胞和毛发上,进而产生不同的毛色和肤色,因此,皮肤和毛囊组织是研究毛色性状的理想材料。本研究采用全转录组测序技术,获得剑白香猪黑色被毛皮肤和白色被毛皮肤转录组信息,通过差异分析,结果发现所有试验样本测序质量值Q30碱基百分比均高于94.37%,SNP分析发现SLC45A2和TYRP1基因在白色被毛皮肤中存在错义突变的SNP,SLC45A2有2个错义突变的SNP位点:Exon1-g.229 G>A,由甘氨酸突变为精氨酸、Exon1-g.13499 A>G,由丝氨酸突变为甘氨酸;TYRP1有1个错义突变的SNP位点:Exon7-g.17261 A>G,由组氨酸突变为精氨酸。经qRT-PCR对TYR、TYRP1、DCT、SLC45A2、MLANA等部分差异基因进行验证,发现基因表达变化情况与转录组测序结果一致,说明测序质量较好。测序结果发现很多与黑色素合成的主效基因无显著性差异,如MITF、MC1R、KIT等基因,在测序结果中挑选1个显著性差异基因TYR和1个非显著性差异基因MITF,对剑白香猪皮肤组织中MITF和TYR基因进行组织化学染色方法检测其蛋白表达,发现MITF和TYR蛋白在香猪黑色被毛皮肤中的表达量均高于白色被毛皮肤,在一定程度上说明了黑色素合成的主效基因在剑白香猪的黑色素合成中也同样扮演着重要角色。对剑白香猪差异表达基因进行KEGG通路分析,发现黑色素合成通路与酪氨酸代谢通路在猪毛色形成过程中发挥了重要作用,除此之外还有很多差异表达基因与色素沉积相关。
在合成黑色素过程中,多个基因协同作用,共同调控黑色素的分布和沉积[12]。本研究发现,很多和黑色素合成相关的显著性差异表达基因,如:酪氨酸酶(tyrosinase,TYR)是黑素细胞中唯一表达的酶,能催化黑素生成并限制其生成速率[13]。TYR主要作用于黑色素合成开始的前两个阶段,作用于酪氨酸,合成多巴和多巴醌;由于是代谢的限速步骤,因此决定了黑色素合成的种类和数量[14]。酪氨酸酶相关蛋白1(tyrosinase-related protein1,TYRP1)是第1个成功克隆的色素基因[15]。酪氨酸酶在黑色素合成的初始反应中起重要作用,酪氨酸酶相关蛋白1 (TYRP1)能调控远端步骤所产生黑色素[16-17]。SARANGARAJAN等[18]对TYRP1 的研究表明,TYRP1 是黑素细胞的特异性产物,参与真黑色素的合成。郑会芹[19]在山羊TYRP1基因中发现1个SNP位点:g.1263 A>C,与其深色表型有关。GRATTEN等[20]研究索艾绵羊TYRP1基因发现,exon 4上的1个错义突变c.869 T>C与其浅色表型极显著相关,而且不同毛色个体中TYRP1基因表达量不同。多巴色素异构酶(dopachrometautomerase,DCT)具有TYR和TYRP1相似的蛋白一级结构,是酪氨酸酶相关蛋白家族的成员,被称为酪氨酸酶相关蛋白2(TYRP2),是黑色素合成过程中的限速酶[21],能催化多巴色素转化为 5,6-二羟基吲哚羧酸(DHICA),从而促进黑色素生成[3]。TYR、TYRP1、DCT同属酪氨酸酶蛋白家族,是黑色素合成过程的3种催化酶,TYRP1蛋白与TYRP2蛋白在调节TYR活性功能上具有拮抗作用,以此调控黑色素合成[22]。阳离子交换体(solute carrier family 24 member 5,SLC24A5)属于溶质载体家族,最初发现与斑马鱼的表型调控有关[23]。余陆伟等[24]证实,斑马鱼的金色表型是由于SLC24A5突变,导致黑色素细胞和视网膜色素上皮细胞黑色素小体体积变小和密度下降,黑色素沉积延迟和减少;水溶载体45家族成员2(solute carrier family 45,SLC45A2) 是由530个氨基酸构成的多肽,包含12个跨膜区,分布于黑素体膜[25]。SLC45A2又被称为膜相关转运蛋白(membrane- associated transporter protein,MATP),可以调节黑色素合成[26-27]。SLC45A2蛋白参与酪氨酸酶TYR、TYRP1、TYRP2在细胞内精确地加工和运输[28]。SLC45A2基因突变可导致青鏘鱼[29]、鼠[30]和鸡[31]等多种动物的色素沉着发生变化,从而影响动物的肤色、毛色等。王海东等[32]通过qRT-PCR检测SLC45A2转录水平、Western blot验证及免疫组织化学,证实了SLC45A2通过调控色素的生成,进而影响毛色的形成。SLC7A11基因属于溶质载体家族,编码胱氨酸或谷氨酸[33-34]。半胱氨酸是合成抗氧化剂GSH的原料[35],SLC7A11基因将细胞外的半胱氨酸运送到细胞内,使细胞内抗氧化剂GSH得到提高[36]。而褐黑素的合成需要GSH的参与,如果SLC7A5基因表达量增加,那细胞中的GSH会大量合成,从而使毛色或肤色变黑[37]。CÉLINE等[38],发现siRNA介导的SLC7A5基因敲除可降低B16F10细胞的色素沉着。黑色素主要在黑素细胞的黑素小体(MLANA)中合成,MLANA通过维持GPR143的稳定性来参与黑色素小体的生成,对黑色素细胞蛋白PMEL的表达、稳定、转运和加工至关重要[39]。前黑素小体蛋白 (premelanosome protein,PMEL)由Sliver基因编码[40],只在皮肤黑色素细胞、视网膜色素上皮细胞和眼色素层黑素细胞中表达[41]。PMEL对黑素小体的发育具有重要作用,黑素小体可以合成黑色素,还参与黑色素的转运[42]。SCHMUTZ等[43]发现,PMEL的1个碱基缺失和PMEL与MCIR之间的相互作用会影响高原牛的毛色。已经报道了小鼠[44]、马[45]、牛[46]、猫[47]、鸡[48]等家畜的PMEL突变可以形成颜色表型。
本研究中筛选到的调控剑白香猪黑色素合成过程相关的差异表达基因如TYR、TYRP1、DCT、MLANA、PMEL、SLC7A11、SLC24A5、SLC45A2和SLC7A5等,同时SNP分析发现SLC45A2和TYRP1基因在白色被毛皮肤中存在错义突变的SNP,这些差异基因及SLC45A2和TYRP1基因的突变可能导致了剑白香猪毛色的形成,为后续研究猪毛色性状的遗传机制提供了线索。对剑白香猪差异表达基因进行KEGG通路分析,发现黑色素合成通路与酪氨酸代谢通路显著富集,筛选到参与黑色素合成通路上的基因TYR、TYRP1、DCT、WNT16、WNT3、CREB3L2、ADCY2、TCF7L2等12个差异表达基因,酪氨酸代谢通路参与基因有TYRP1、TYR、DCT、AOX1,可见这2条通路在猪毛色形成过程中发挥了重要作用,进一步表明 TYRP1、TYR、DCT 等基因在黑色素合成过程中的重要性。
