褪黑素对LPS诱导的犊牛睾丸支持细胞氧化应激和凋亡的影响
2023-01-31王子铭黄富硕李玉龙张贵学
冯 瑞,王子铭,黄富硕,李玉龙,张贵学
(东北农业大学 动物科学技术学院,黑龙江 哈尔滨 150030)
在疾病或感染期间,睾丸会受到损伤,会影响机体生育能力[1-2]。氧化应激是导致不育的一个因素,主要是由活性氧 (ROS) 产量过多引发,表现为精子数量和质量下降[3-4]。睾丸发育和精子发生过程中精原细胞凋亡是必须的[5],所以异常的凋亡会影响到生殖障碍。睾丸支持细胞 (SCs) 保障精子发生和成熟,生长在各级生精细胞周围,参与血睾屏障的形成,具有多种生理功能,起到支撑、保护和提供营养的作用[6-7]。Connexin43是血睾屏障重要组成蛋白,在睾丸内细胞之间相互交流和精子发生过程中发挥重要作用[8]。研究已经证明,SCs是各种毒物、感染剂的靶细胞,也是测定雄性生殖系统毒性的模型[9-10]。所以,在犊牛生殖系统发育过程中,研究其SCs受到感染和应激损伤还是非常有意义的。
脂多糖(LPS) 是革兰阴性细菌外膜的主要成分,可以造成不同细胞的氧化应激和凋亡[11-12]。Nrf2/HO-1信号通路参与调控氧化应激反应[13]。当氧化应激发生时,Nrf2会进入细胞核内激活超氧化物歧化酶 (SOD)、谷胱甘肽 (GSH) 以及血红素加氧酶-1 (HO-1) 的转录,抵抗氧化应激带来的损伤[13-14]。细胞凋亡途径有很多,p53的激活和Caspase3表达增多都是诱发细胞凋亡的重要因素[15]。
褪黑素 (N-乙酰基-5甲氧基色胺) 主要由哺乳动物的松果腺产生,参与调控抗氧化、抗凋亡和抗炎等应激反应[16-17]。已经有研究证实,褪黑素可以减弱氧化应激和DNA损伤保护小鼠睾丸,缓解脂毒性造成精子发生和生育能力下降[18],还可以减轻睾丸中镉诱导的细胞应激和生殖细胞凋亡[19]。
因此,本试验利用体外模型,探究褪黑素对LPS诱导的犊牛SCs氧化应激、细胞凋亡和Connexin43表达下调的保护作用。
1 材料与方法
1.1 SCs细胞培养实验室先前冻存的犊牛SCs复苏后[20],使用含有89% DMEM/F12 (Sigma,USA)、10% FBS (Sigma) 和1%双抗 (Biosharp,China) 的培养液,在5% CO2、37.5℃的环境条件下进行培养,等待细胞生长密度达到90%左右进行传代和后续试验。褪黑素 (Sigma,USA)使用DMSO (Sigma,USA) 配置 (DMSO浓度小于0.01%),LPS (Sigma,USA) 使用无菌水配置。
1.2 CCK-8分析使用CCK-8试剂盒 (Bimake,USA) 进行细胞活力测定,按照说明书操作。将状态好的细胞以2×104的密度传代到96孔板中,培养12 h后,加入褪黑素(50 μmol/L)和 LPS(5 mg/L)进行培养,等待24 h后加入10 μL CCK-8试剂,在5% CO2、37.5℃的环境条件下进行孵育2 h,最后用酶标仪在450 nm处测定吸光度,计算细胞活力。
1.3 RT-PCR分析使用TRIzol (Invitrogen) 试剂提取各处理组的细胞的总RNA,通过计算调平后使用TaKaRa (Japan) 试剂盒进行反转录得到cDNA,最后用DEPC水稀释cDNA用于后续试验。
引物详细信息如表1所示,在QuantStudioTM设计分析软件 (Applied Biosystems,USA)上检测基因。反应混合物 (10 μL) 由5 μL FastStart Universal SYBR Master (ROX) (Roche,USA) 组成,正、反向引物各0.3 μL。PCR条件95.0℃ 10 min,然后融化曲线程序用于40周期在95.0℃,持续15 s,60.0℃ 1 min和95.0℃ 15 s (增加温度从60.0到95.0℃,保持1.0℃条件下每10 s上升0.5℃),并执行连续荧光测量。比较2-ΔΔCt方法用于定量mRNA表达,β-actin作为对照。
1.4 Western blot分析将各处理组的细胞溶解在比例为100∶1的RIPA (Santa Cruz,USA) 和蛋白酶抑制剂 (Santa Cruz,USA) 混合液中,放置室温裂解10 min,4℃、12 000 r/min离心10 min,随后去除底部沉淀,吸取上清。根据制造商的说明,用BCA试剂盒 (biyutian,China) 测量蛋白浓度,随后按比例加入上样缓冲液进行煮沸5 min得到蛋白样品,进行电泳。用10%和12%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳 (SDS-PAGE) 分离,将蛋白转移到PVDF膜 (Roche,USA) 上,然后在室温下用5%脱脂牛奶封闭液封闭PVDF膜2 h。封闭后,与一抗在4℃孵育过夜,用TBST洗3次,用二抗在室温下洗2 h,之后用TBST洗3次,然后用增强ECL显色液曝光。蛋白条带采用ECL Western blot检测系统 (SmartchemiTMImage Analysis System,Beijing Sage Creation Science Co.LTD.China)。采用Image J软件 (NIH,Bethesda,MD) 分析条带密度。试验所用抗体均购于Proteintech (China)。
1.5 ROS分析使用ROS检测试剂盒 (南京建成) 进行性检测,DCFH-DA用DMEM/F12稀释,稀释倍数为1∶1 000,最终浓度为10 μmol/L。等待处理细胞24 h后,吸出各处理组培养皿中的培养液,PBS洗涤3次,加入稀释的DCFH-DA,在5% CO2、37.5℃的环境中孵育30 min,孵育后使用PBS洗涤3次,在免疫荧光显微镜下进行拍照,得到的图片使用Image J 软件进行荧光强度分析,计算ROS,每个组重复3次。
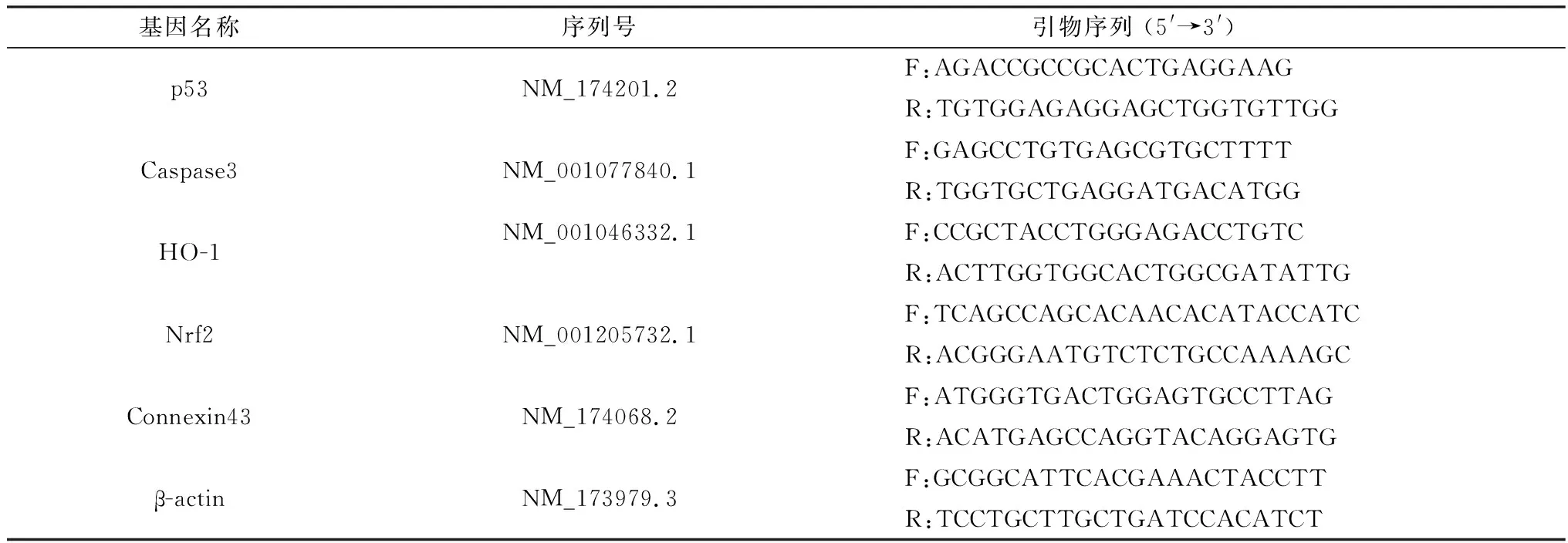
表1 引物信息
1.6 SOD活性和GSH表达分析根据SOD和GSH试剂盒 (南京建成) 说明书进行操作,配置好需要的工作液。处理完细胞后,使用PBS轻轻洗涤3次,进行消化和离心,收集细胞沉淀到EP管中,随后使用超声破碎仪进行破碎。加入GSH工作液,混匀后,37℃孵育20 min,室温静置5 min,使用酶标仪在405 nm处检测吸光度;加入SOD工作液,混匀后,37℃孵育20 min。使用酶标仪在450 nm处检测吸光度。最后根据说明书的公式计算各组的酶活性,每个组重复3次。
2 结果
2.1 褪黑素和LPS对SCs活率的影响使用50 μmol/L 褪黑素和5 mg/L LPS处理检测细胞活率(图1)。与对照组相比,LPS细胞活率显著下降(P<0.01);与LPS组相比,共处理组细胞活率显著上调 (P<0.01)。
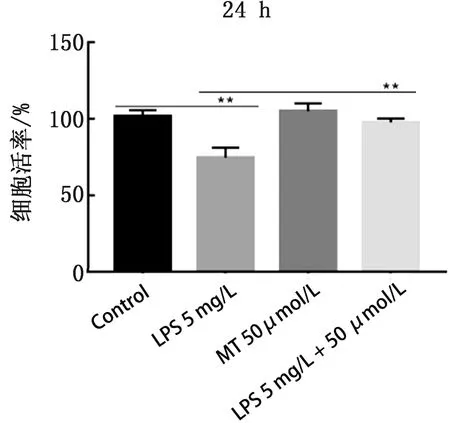
图1 褪黑素和LPS对SCs活率的影响
2.2 褪黑素和LPS对SCs氧化应激的影响使用50 μmol/L褪黑素和5 mg/L LPS处理SCs细胞检测ROS、GSH表达量和SOD活性。与对照组相比,LPS处理细胞后,显著增加ROS的表达量 (图2 A、B) (P<0.01);与LPS组相比,共处理组显著降低ROS的表达量 (P<0.01)。
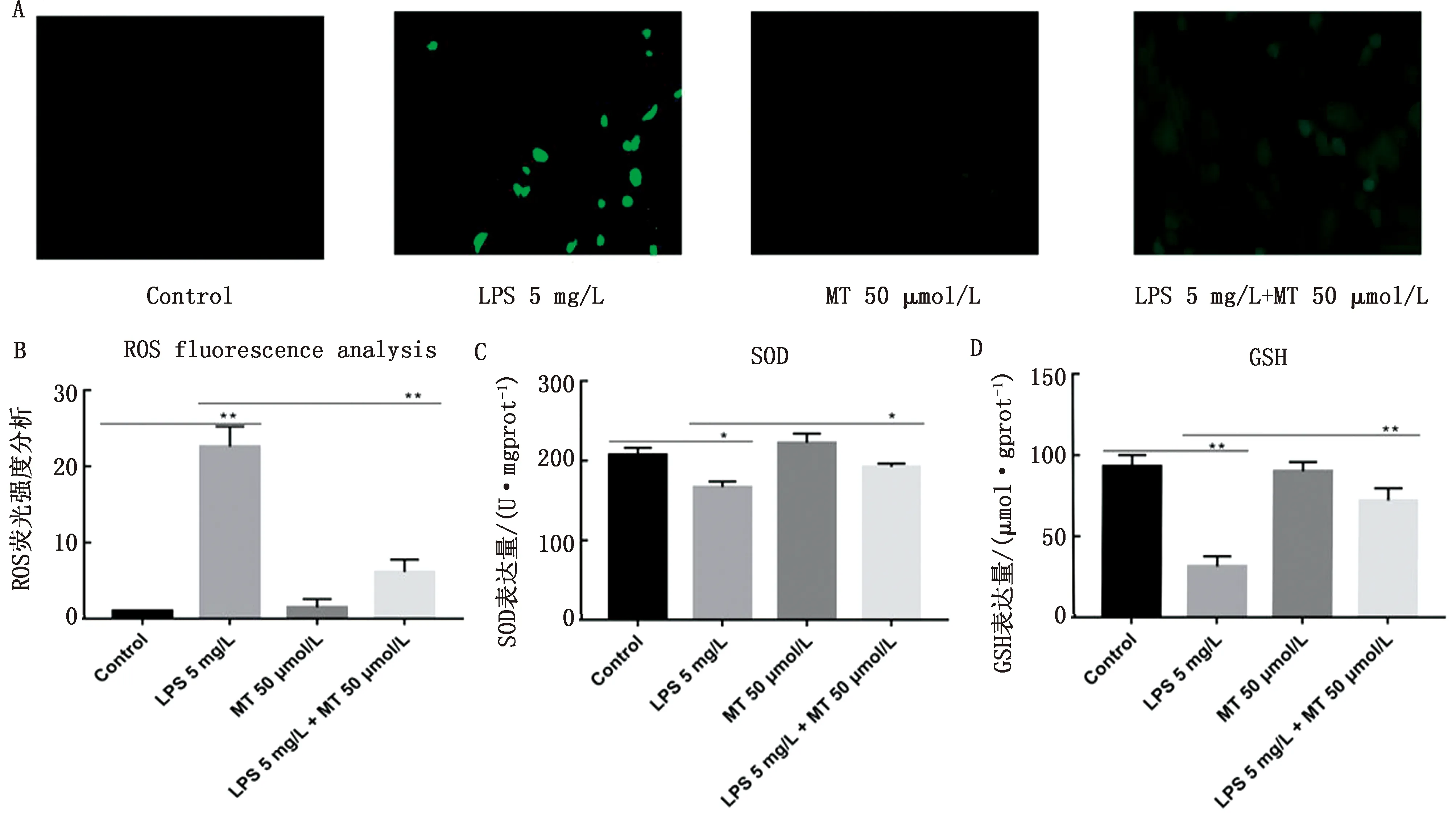
A.ROS免疫荧光图;B.ROS荧光强度分析;C.SOD表达量;D.GSH表达量
与对照组相比,LPS处理细胞后,显著降低SOD (图2C) (P<0.05) 的活性和GSH (图2D)(P<0.01) 的表达;与LPS组相比,共处理组显著升高SOD(P<0.05) 的活性和GSH(P<0.01) 的表达。
2.3 褪黑素和LPS对Nrf2/HO-1信号通路的影响使用50 μmol/L褪黑素和5 mg/L LPS处理SCs细胞检测Nrf2和HO-1的mRNA和蛋白表达量。与对照组相比,LPS处理细胞后,显著下调Nrf2 mRNA和蛋白的表达量 (图3A、C、D) (P<0.05),显著下调HO-1 mRNA和蛋白的表达量 (图3B、D、E) (P<0.01);加入50 μmol/L褪黑素后,显著上调Nrf2 mRNA (P<0.01) 和蛋白 (P<0.05) 的表达量,显著上调HO-1 mRNA (P<0.01) 和蛋白 (P<0.05) 表达量,恢复至正常水平。

A.Nrf2 mRNA表达量分析;B.HO-1 mRNA表达量分析;C.Nrf2/β-actin蛋白灰度比值分析;D.Nrf2和HO-1蛋白条带;E.HO-1/β-actin蛋白灰度比值分析
2.4 褪黑素和LPS对凋亡基因的影响使用50 μmol/L 褪黑素和5 mg/L LPS处理细胞检测p53和Caspase3 mRNA和蛋白的表达量。与对照组相比,LPS处理细胞后,显著上调p53 mRNA和蛋白的表达量(图4A、C、D) (P<0.01),显著上调Caspase3 mRNA和蛋白的表达量(图4B、D、E)(P<0.01);加入50 μmol/L褪黑素后,显著下调p53 mRNA (P<0.01) 和蛋白 (P<0.05) 的表达量,显著下调Caspase3 mRNA和蛋白的表达量(P<0.01)。
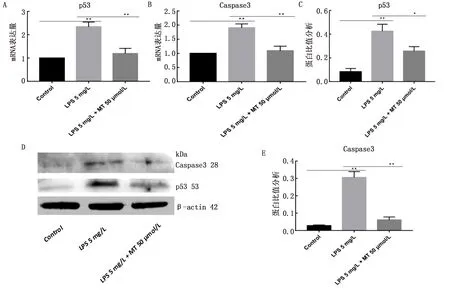
A.p53 mRNA表达量分析;B.Caspase3 mRNA表达量分析;C.p53/β-actin蛋白灰度比值分析;D.p53和Caspase3蛋白条带;E.Caspase3/β-actin蛋白灰度比值分析
2.5 褪黑素和LPS对Connexin43的影响使用50 μmol/L 褪黑素和5 mg/L LPS处理细胞检测Connexin43 mRNA和蛋白的表达量。与对照组相比,LPS处理细胞后,显著下调Connexin43 mRNA和蛋白的表达量(图5A、C) (P<0.05);加入50 μmol/L褪黑素后,抑制Connexin43 mRNA和蛋白的表达量 (P<0.01) 的下调。

A.Connexin43 mRNA表达量分析;B.Connexin43/β-actin蛋白灰度比值分析;C.p53和Caspase3蛋白条带
3 讨论
氧化应激是细胞抗氧化系统不能抵抗ROS过量产生的状态,而且SCs含有较高活性的SOD和GSH保护免受氧化应激的损伤[21]。已有研究表明,LPS可以降低SOD和GSH的活性,诱导大鼠睾丸SCs产生氧化应激[22]。在本研究中,5 mg/L LPS可以显著增加ROS的表达量,显著降低SOD活性和GSH表达量,这说明LPS破坏了ROS含量的动态平衡,降低了SOD的活性和GSH清除自由基的能力,造成细胞的氧化应激。氧化应激的发生和Nrf2/HO-1信号通路有密切的关系[23]。本研究中,LPS可以上调Nrf2和HO-1的表达量显著降低,这说明LPS可以调控Nrf2/HO-1信号通路的转导,诱导氧化应激的发生。所以,LPS诱导犊牛SCs产生氧化应激的机制可能是通过Nrf2/HO-1信号通路实现的,这也可能是细胞ROS过量产生,SOD活性下降和GSH表达减少的主要原因。
细胞凋亡是程序性细胞死亡的形式之一,对生理内环境的稳态至关重要[24]。已有研究证明,睾丸中的生殖细胞的数量和SCs的数量直接相关[25]。在本研究中,5 mg/L LPS可以显著增加p53和Caspase3的表达量,这说明LPS激活了细胞凋亡途径。p53的激活会进入线粒体促进凋亡因子的表达[26],Caspase3的激活会导致SCs (TM4) DNA损伤发生,促进细胞凋亡数量增多[27]。所以,LPS可以诱导犊牛SCs凋亡途径的激活,并且造成细胞凋亡,这也可能是本试验SCs活力减少的主要原因。
已有研究证明,LPS可以降低大鼠星形胶质细胞中Connexin43表达,并且小鼠支持细胞缺失Connexin43会抑制精子的发生[28-29]。本研究中,LPS处理SCs后,Connexin43的表达量也会降低,但是LPS导致Connexin43下调的具体原因还不能确定,可能是通过氧化应激或者细胞凋亡引起的,需要进一步研究证实。由此可见,犊牛睾丸细菌感染后很可能会对生精过程,细胞之间的交流以及血睾屏障的形成有严重的影响。
LI等[30]研究发现,褪黑素可以降低ROS和Caspase3的表达量,提升SOD和GSH的含量,从而缓解猪SCs的氧化应激和细胞凋亡;KUMAR等[31]研究发现使用褪黑素可以抑制Bisphenol S (BPS) 激活Nrf2/HO-1信号通路发挥抗氧化作用,并且抑制Connexin43的下调,从而缓解睾丸损伤。在本研究中,50 μmol/L褪黑素可以显著降低ROS的表达量,提高SOD活性和GSH的表达量,抑制Nrf2/HO-1信号通路的激活,从而降低细胞的氧化应激;降低p53和Caspase3的表达量,从而缓解细胞凋亡和细胞活力的下降,并且对Connexin43的表达下调也有缓解作用。这些结果可以证明,褪黑素对犊牛SCs受到细菌感染带来的损伤具有积极的保护作用,起到抗氧化和抗凋亡的作用。
综上所述,褪黑素可以缓解LPS诱导犊牛SCs的氧化应激和凋亡,其机制可能通过Nrf2/HO-1和凋亡信号通路实现的,并且对细胞Connexin43的表达也有保护作用。
