索马鲁肽原料中N⁃羟基琥珀酰亚胺残留量反相高效液相色谱检测方法的建立及验证
2023-01-30杨庆马鲁南刘忠张贵民
杨庆,马鲁南,刘忠,张贵民
1.山东新时代药业有限公司山东省蛋白类药物工程实验室,山东 临沂 273400;2.鲁南制药集团股份有限公司哺乳动物细胞高效表达国家工程实验室,山东 临沂 276006
糖尿病严重威胁人类健康,2019年全球20~79岁糖尿病患者约4.63亿,预计2045年将增长至7亿,其中Ⅱ型(非胰岛素依赖型)糖尿病患者占患者总数的90%以上[1]。研究发现,胰高血糖素样肽⁃1(glu⁃cagon like peptide⁃1,GLP⁃1)在Ⅱ型糖尿病的治疗上效果显著,能够在较低副作用的前提下降低血糖水平,但其在体内的半衰期非常短,极易被清除[2⁃5]。因此,研究人员开发了多种长效的GLP⁃1 类似物,包括利拉鲁肽(liraglutide)、杜拉鲁肽(dula⁃glutide)、索马鲁肽(semaglutide)等,其中利拉鲁肽和索马鲁肽均是通过氨基酸替换和脂肪酸链修饰技术来达到长效[6⁃7]。随着口服索马鲁肽的上市,其应用将越来越广泛[8⁃12]。
索马鲁肽在结构上将GLP⁃1(7⁃37)链上第 8 位丙氨酸替换为α⁃氨基异丁酸,第34 位赖氨酸被精氨酸取代,第26 位赖氨酸进行了酰化修饰。酰化剂结构中包含2个8⁃氨基⁃3,6⁃二氧杂辛酸基团,1个γ⁃谷氨酸基团,1 个 1,18⁃十八烷脂肪二酸[13]。在酰化反应过程中,修饰剂中的N⁃羟基琥珀酰亚胺(N⁃hydroxysuccinimide,NHS)作为离去基团,成为索马鲁肽原料中的一个工艺杂质。《中国药典》三部(2020版)明确指出[14],生物制品应对工艺相关杂质进行控制,而且NHS 毒理学作用尚不明确,因此有必要对其进行深入研究,并对其在产品中的残留量进行控制。
有文献报道采用分子排阻色谱法测定聚乙二醇化重组人干扰素 α2b 注射液中 NHS 含量[15]。分子排阻色谱法是根据样品的分子大小进行分离,NHS的分子量较小,与样品中常用的缓冲盐分子量非常接近,因此,在检测时易造成干扰。本文建立了测定索马鲁肽原料中NHS残留量的反相高效液相色谱法(reverse phase⁃high performance liquid chromatogra⁃phy,RP⁃HPLC),并对方法进行验证,以期避免缓冲盐干扰。
1 材料与方法
1. 1 主要试剂及仪器 NHS 购自美国Sigma⁃Aldrich公司(批号:MKBG2519V,含量98.0%);索马鲁肽原料药为山东新时代药业有限公司自制(批号:F027⁃201203、F027201204、F027201205);乙腈(色谱纯)购自德国Merck 公司;磷酸二氢钾(分析纯)购自西陇科学股份有限公司;U3000 高效液相色谱仪购自美国 Thermo Fisher 公司;CAPCELL PAK ADME 色谱柱(4.6 mm × 150 mm,3 μm)购自日本OSAKA SODA 公司;Symmetry Shield RP8 色谱柱(4. 6 mm × 150 mm,3. 5 μm)购自美国 Waters 公司;Jupiter C18 色谱柱(4.6 mm×150 mm,3 μm)购自美国Phenomenex公司。
1.2 色谱条件的优化
1. 2. 1 色谱柱 分别采用Symmetry Shield RP8、Ju⁃piter C18 及 CAPCELL PAK ADME 色谱柱,流动相 A为0.05 mol/L 磷酸二氢钾溶液⁃乙腈(98∶2),流动相B 为70%乙腈溶液。考察不同色谱柱对NHS 检测的影响。
1.2.2 流动相 配制不同浓度磷酸二氢钾(0.02、0.05和0. 1 mol/L),并调整流动相中磷酸盐溶液与乙腈比例(90∶10、95∶5 和98∶2)。考察不同盐浓度和不同有机相比例对NHS检测的影响。
1.3 方法的验证
1. 3. 1 专属性 取NHS,用水稀释至10 μg/mL,作为对照品储备液,稀释2 倍作为NHS 对照品溶液;取索马鲁肽原料样品(F027201203 批),用水稀释至2. 0 mg/mL,作为供试品储备液,将供试品储备液与NHS 对照品储备液按1∶1(v∶v)比例混匀,作为混合样品溶液。取水、NHS 对照品溶液及混合样品溶液,按优化后的色谱条件进行检测,记录色谱峰保留时间。
1.3.2 系统适用性 取NHS对照品储备液,用水稀释至1. 0 μg/mL,作为系统适用性溶液,按优化后的色谱条件进行检测,连续测定6 次,计算主峰理论塔板数和拖尾因子,记录主峰保留时间和峰面积,并计算其相对标准偏差(RSD)。
1.3.3 线性范围 取NHS对照品储备液,用水分别稀释至3.0、2.0、1.0、0.6、0.4、0.2 μg/mL,按优化后的色谱条件进行检测,记录主峰峰面积。以NHS 对照品储备液浓度为横坐标,峰面积为纵坐标,绘制标准曲线,计算相关系数。
1.3.4 准确度 分别取供试品溶液8 mL置量瓶中,分别加入NHS 对照品储备液1.0、0.6、0.4 mL,加水定容至刻度,摇匀,制成浓度为1.0、0.6、0.4 μg/mL的加样回收率样品,每个浓度平行操作3 次,按优化后的色谱条件进行检测。
1.3.5 定量限及检测限 取NHS 对照品储备液,2倍连续稀释,记录S/N 约为3 和10 时的浓度,即为检测限和定量限浓度。
1.3.6 重复性 同一操作人员配制NHS 对照品溶液1 份和含 0. 6 μg/mL NHS 的供试品溶液 6 份,按优化后的色谱条件进行检测,记录色谱图,按外标法计算NHS含量,并计算RSD。
1. 3. 7 溶液稳定性 将含0. 4 μg/mL NHS 的供试品溶液 25 ℃放置 0、4、8、12、16、20 和 24 h,按优化后的色谱条件进行检测,计算主峰面积的RSD。
1.4 方法的初步应用 用建立的方法检测3 批(F0⁃27201203、F027201204、F027201205)索马鲁肽原料中NHS含量。
2 结果
2.1 色谱条件的确定
2.1.1 色谱柱 采用 Symmetry Shield RP8 和 Jupi⁃ter C18 色谱柱均无法对NHS 形成较好的保留(保留时间均 <4 min);采用CAPCELL PAK ADME 色谱柱的保留时间约7.5 min。因此选则CAPCELL PAKADME色谱柱进行后续试验。
2.1.2 流动相 随着有机相比例的增加,NHS保留时间逐渐减小,当磷酸盐溶液与乙腈比例分别为98∶2、95∶5 和 90∶10 时,NHS 保留时间分别为 7 ~ 8、4 ~5 和2 ~ 3 min。流动相中磷酸二氢钾浓度变化对NHS 保留时间影响不大,均为6~8 min。综合考虑,选择 0. 05 mol/L 磷酸二氢钾溶液⁃乙腈(98∶2)作为流动相A,70%乙腈溶液作为流动相B。
确定的色谱条件:色谱柱为CAPCELL PAK ADME(4.6 mm × 150 mm,3 μm);流动相A 为0.05 mol/L磷酸二氢钾溶液⁃乙腈(98∶2),流动相B 为70%乙腈溶液;洗脱梯度为0 min 0% B,10 min 0% B,19 min 90% B,19. 1 min 0% B,25 min 0% B;流速为0. 8 mL/min;检测波长为260 nm;柱温为30 ℃;进样量为100 μL。
2.2 方法的验证
2. 2. 1 专属性 结果表明,NHS保留时间约7.5 min,峰对称性良好,拖尾因子为1. 05,空白溶剂不干扰NHS的检测,见图1。
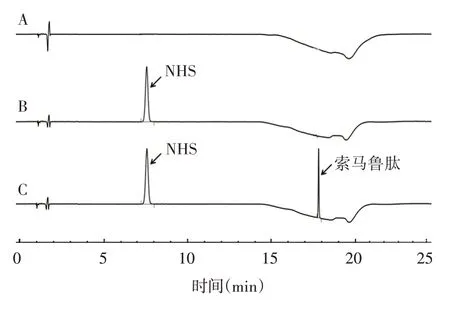
图1 索马鲁肽中NHS RP⁃HPLC色谱图Fig.1 RP⁃HPLC profile of NHS in semaglutide
2. 2. 2 系统适用性 结果显示,NHS 系统适用性溶液连续测定6 次,主峰理论塔板数为12 840,拖尾因子为1.06,主峰保留时间和峰面积RSD均为0.1%,表明系统适用性良好。
2.2.3 线性范围 结果显示,NHS 对照品在0. 2 ~3.0 μg/mL 范围内,线性关系良好,回归方程为Y=1.010 6X-0.009 8,R2=1.000 0。
2. 2. 4 准确度 结果显示,3 种不同浓度(1. 0、0. 6、0.4 μg/mL)NHS 加样样品,平均加样回收率分别为98.35%、98.73%和99.60%,所有样品加样回收率的RSD为0.58%,见表1。表明该方法准确度良好。
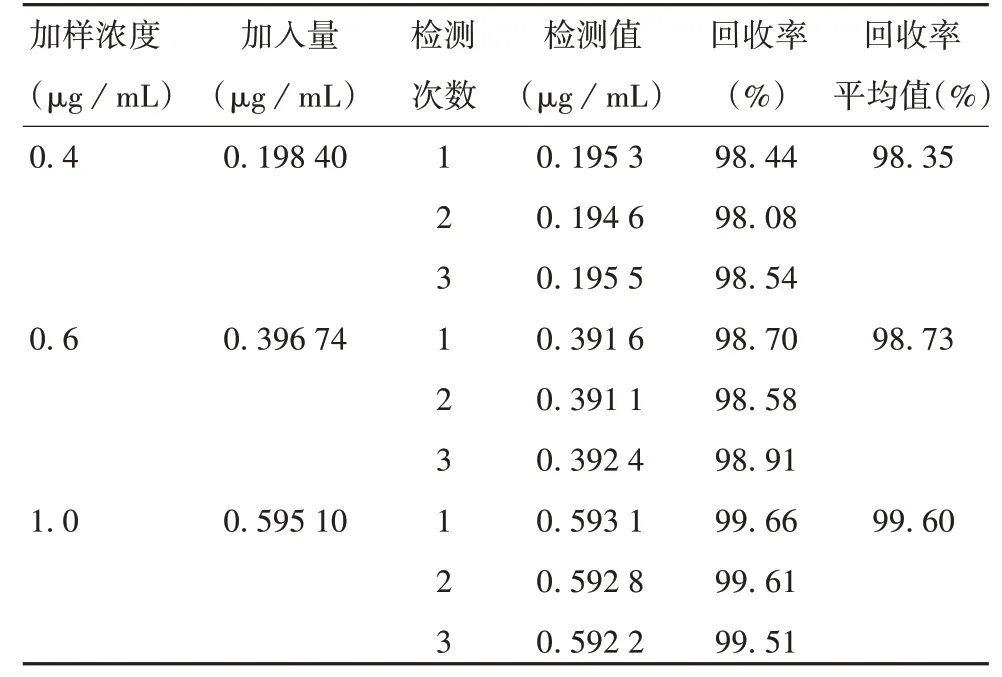
表1 准确度验证结果Tab.1 Validation for accuracy
2. 2. 5 定量限及检测限 结果显示,NHS 浓度为0.048 μg/mL 时S/N 约为3,浓度为0.096 μg/mL时 S/N 约为10,按进样量 100 μL 换算,该方法检测限为4.8 ng,定量限为9.6 ng。
2.2.6 重复性 结果显示,平行制备的6份供试品溶液中NHS含量的RSD为0.16%,表明该方法重复性良好。
2. 2. 7 稳定性 结果显示,在 0、4、8、12、16、20 和24 h 检测的NHS 峰面积的RSD为0. 34%,表明样品溶液在室温下24 h内稳定。
2.3 方法的初步应用 结果显示,3批样品中均未检出NHS,表明样品中NHS含量均低于0.048 μg/mL。
3 讨论
本研究首先比较了3 个不同厂家的色谱柱,即CAPCELL PAK ADME(4. 6 mm × 150 mm,3 μm)、Symmetry Shield RP8(4. 6 mm × 150 mm,3. 5 μm)和Jupiter C18(4. 6 mm × 150 mm,3 μm)色谱柱。结果显示,在相同条件下,Symmetry Shield RP8 和Jupiter C18 色谱柱对 NHS 保留较弱,均 < 4 min,只有 CAP⁃CELL PAK ADME 色谱柱对其保留较好,保留时间7~8 min。因此在建立的方法中选择该色谱柱。
本研究还考察了流动相中的盐浓度与有机相比例对NHS 保留的影响,结果显示,流动相中磷酸二氢钾的浓度对NHS 的保留时间影响不大,有机相比例越高保留时间越小。在此基础上,确定了最适色谱条件并进行了方法的验证。结果显示,NHS 在0. 2 ~3.0 μg/mL 范围内,线性关系良好,回归方程为Y=1.010 6X- 0.009 8,R2= 1.000 0;检测限和定量限分别为4.8和9.6 ng;高中低浓度下的平均加样回收率分别为98.35%、98.73%和99.60%。
本研究成功建立了索马鲁肽中NHS 残留量的RP⁃HPLC 检测方法,该方法专属性强、灵敏度高、重复性好,可进行快速检测,且样品检测结果准确可靠。本研究为索马鲁肽原料药的质量控制提供了参考。
