饲料中黄曲霉毒素B1对克氏原螯虾幼虾生长、饲料利用和肝胰腺组织结构的影响
2023-01-30郭雅哲娄格格葛汝祥朱晓鸣陈新华
黄 莹 郭雅哲 娄格格 满 洲 葛汝祥 朱晓鸣 向 勇 陈新华
(1.福建农林大学海洋学院, 福建省海洋生物技术重点实验室, 福州 350002; 2.中国科学院水生生物研究所淡水生态与生物技术国家重点实验室, 武汉 430072)
霉菌毒素是天然存在的一类毒性物质, 特别是黄曲霉毒素(AFT), 系真菌曲霉的有毒代谢产物, 具有强致癌性[1]。根据荧光分析, AFT分为B族和G族两大类及其衍生物, 目前已分离鉴定出20多种。饲料原料中常见的AFT主要有AFB1、AFB2、AFG1和AFG2, 其中AFB1的毒性作用最强[2], 广泛存在于霉变的食物和饲料中。长期摄入含有AFT的饲料可引发动物发生肝癌, AFB1目前被公认为致癌能力最强的天然毒素, 已被证实还具有致畸、致细胞突变等作用[3]。AFB1污染是一个全球性的问题, 尤其以热带及亚热带地区最为严重, 而这些地方的水产养殖量约为全球年产量的80%[4]。王倩等[5]对全国471份饲料原料及饲料的调查报告中显示, 所有样品中AFB1检出率为87.69%, 检出最高值为107.27 μg/kg; 其中配合饲料中AFB1检出率为79.31%, 检出最高值为67.12 μg/kg。根据《无公害食品渔用配合饲料安全限量》的规定, 我国渔用配合饲料中AFB1含量不得高于10 μg/kg[6]。
国内外已有关于AFB1对部分水生动物影响的报道[7—10], 不同品种对AFB1的敏感性差异较大[4]。有研究表明AFB1可直接攻击虾的肝胰腺, 对肝胰腺消化、代谢和解毒功能造成损伤, 进而破坏营养物质的吸收和储存功能[11—14]。用含有AFB1<20 μg/kg的饲料饲喂南美白对虾(Litopenaeus vannamei)10d, 结果发现虾死亡数量显著升高[15]。用含AFB150 μg/kg的饲料饲喂南美白对虾14d后, 肝胰腺组织出现异常; 当AFB1浓度达到400 μg/kg时, 虾的生长速度明显被抑制; 当AFB1浓度高达900 μg/kg时, 虾的消化率水平明显降低[16]。当饲料中天然AFT含量为1000 μg/kg时, 南美白对虾幼虾存活率显著降低[13]。另有研究表明, 斑节对虾(Penaeus monodonFabricius)稚虾摄食AFB1水平超过75 μg/kg的饲料2个月后体重显著降低[17]。与此相对, Boonyaratpalin等[18]对斑节对虾研究发现, AFB1在50—100 μg/kg时, 虾生长不受影响; 而当AFB1浓度高达500 μg/kg以上时, 幼虾死亡率才会增加。
克氏原螯虾(Procambarus clarkii), 是一种深受消费者欢迎的养殖虾类, 其肉质爽嫩, 味道鲜美。近几年, 克氏原螯虾产业呈几何式增长, 现已成为我国最火爆的餐饮食品之一, 而关于它的食品安全问题也引起我国消费者的高度重视[19]。克氏原螯虾产业的发展同时促进了克氏原螯虾配合饲料的飞速增长, 推进克氏原螯虾产业继续升温的关键在于其专用饲料的开发[20]。大豆、玉米和花生等谷物是克氏原螯虾养殖生产中常用的饲料原料[21], 而这些原料容易霉变产生高浓度的AFB1[7], 且饲料运输和保存不当也容易发生霉变。有报道表明在水产养殖业中, 受AFB1污染的饲料可能不会被丢弃而仍然可能用于饲养动物[11]。AFB1污染已被确定为水产养殖面临的一个重要问题, 不仅会造成经济损失, 还会引起各种鱼病并发症[7], 此外AFB1在水产动物中的残留可能会通过食物链的富集作用对人类健康产生威胁。目前有关水产AFB1的研究主要集中在鱼类和部分海水虾类上[22], 对淡水虾类的相关探究较少, 鲜见AFB1对克氏原螯虾的相关报道。本文旨在研究AFB1对克氏原螯虾的生长、饲料利用、抗氧化能力、肝胰腺组织学和毒素积累的影响, 探讨饲料中AFB1对克氏原螯虾养殖产业的潜在危害。
1 材料与方法
1.1 养殖系统
实验养殖系统由16个矩形塑料(pp)养殖箱(100 cm×50 cm×50 cm) 组成, 养殖水深15 cm。每天上午和晚上各测1次水温和室温, 每2周测1次水体溶氧和氨氮水平。在整个养殖过程, 水温保持在19—22℃。养殖用水经充分曝气, 溶氧含量6 mg/L以上, 氨氮含量<0.4 mg/L。光照周期为8﹕30到20﹕30。
1.2 实验饲料及实验设计
实验基础饲料的配方和常规化学成分如表1所示。按设计浓度0、10、100和1000 μg/kg添加相应量AFB1母液制成4种实验饲料, 各组饲料中AFB1的实际测定值分别为2.53、13.25、99.73和966.36 μg/kg。毒素梯度的设计参考已有的黄曲霉毒素对其他水产动物的有关报道[12,13,23,24]。添加的AFB1购自美国Sigma公司, 首先溶于鱼油配制成浓度为500 μg/mL的母液, 然后按照设计值添加相应量到各组实验饲料中。将所有饲料原料过40目筛后, 按照从小到大的顺序逐次添加并混匀, 之后使用饲料机(SLP-45, 上海华夏渔业机械仪器工贸公司)制作成直径1 mm大小的颗粒, 并在60℃环境中烘干后放置在–20℃冰箱备用。
1.3 实验鱼与饲养实验
克氏原螯虾虾苗采购于湖北省莱克集团小龙虾良种选育中心。在正式实验开始前, 克氏原螯虾虾苗放到室内养殖系统中暂养3周后进行正式实验,暂养期间投喂实验基础饲料(饲料配方见表1)。在正式实验开始时, 先让克氏原螯虾幼虾禁食24h, 挑取外观健壮、体格相近的克氏原螯虾幼虾[平均体重(0.382±0.005) g]随机放入16个养殖水箱, 每箱16尾。共设置4个实验组, 每组设置4个平行。实验期间, 每天分别于9:00、17:00和22:00 投喂饲料。每天记录摄食量, 实验持续42d。每天用虹吸管清除残饵和排泄物, 换水1/3。清理死虾, 记录其体长和体重。
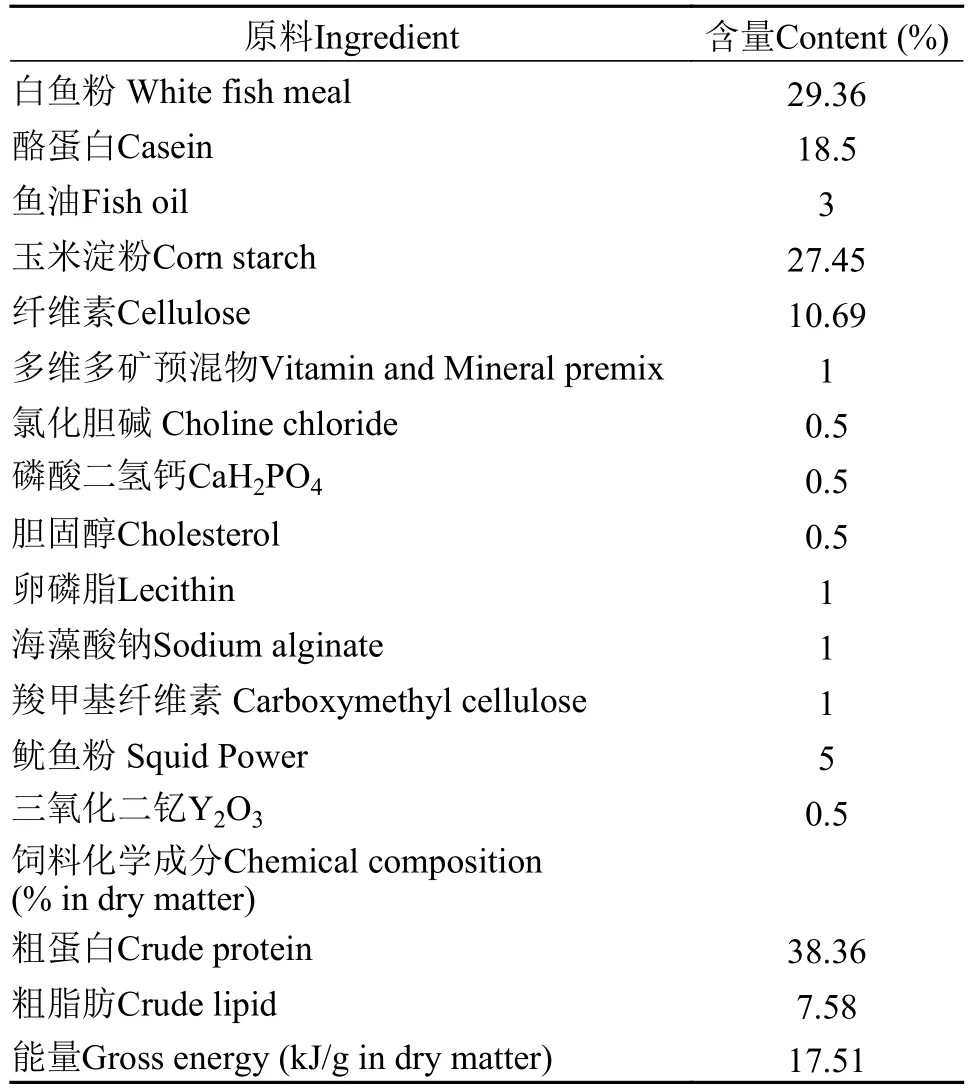
表1 实验基础饲料配方及化学组成(%干物质)Tab.1 Diet formulation and chemical composition of experimental diets (% in dry matter)
1.4 实验取样
在实验结束时, 克氏原螯虾禁食24h, 称取每缸虾的体重并记录。每缸随机取3尾在冰盘上解剖出肝胰腺, 放入冻存管中经液氮急冻, 然后转移到–80℃冰箱中保存, 用作酶的测定。取肝胰腺分别用中性甲醛和戊二醛固定后进行组织切片制作。剩余所有幼虾冷冻干燥后用于AFB1含量分析。
1.5 样品的测定
本实验基础饲料中干物质、粗蛋白、粗脂肪和灰分的含量测定参照文献[25]的方法进行。饲料干物质在105℃下烘干至恒重, 通过失重法测定。饲料粗蛋白含量使用凯氏定氮仪(Kjeltec8400,FOSS)测定。饲料粗脂肪含量使用索氏抽提仪(ST243, FOSS)进行测定。饲料样品在马福炉中550℃燃烧3h, 以失重法测定灰分。
采用南京建成生物工程研究所的试剂盒测定肝胰腺中碱性磷酸酶(AKP)、谷丙转氨酶(ALT)、谷草转氨酶(AST)、过氧化氢酶(CAT)、谷胱甘肽过氧化物酶(GSH-Px)、超氧化物歧化酶(SOD)、谷胱甘肽S转移酶(GST)活性和丙二醛(MDA)含量。实验饲料和克氏原螯虾幼虾全虾AFB1含量经甲醇水溶液(55﹕45)和石油醚(沸程为60—90℃)提取后采用ELISA法[4,25,26]进行测定(试剂盒购自北京百灵康源生物公司)。取剩余所有克氏原螯虾幼虾全虾虾体冷冻干燥, 干燥后的全虾样品和饲料均研磨成粉末, 每组样品测定3次。饲料和全虾虾体中的AFB1的提取方法如下: 取样品置于带塞锥形瓶中,加入甲醇水溶液和石油醚, 加塞水封后振荡30min,并用快速滤纸过滤。加入三氯甲烷, 将提取液一并滤于蒸发皿中, 65℃水浴蒸干。分3次准确加入20%甲醇-PBS将凝结物充分溶解后得到AFB1提取液, 4℃保存。取稀释后的抗体与AFB1提取液在小管内混合后(样品反应液)静置待用, 取试剂盒中的酶标板分别加入阴性对照、样品反应液及空白对照液, 37℃孵育箱中恒温孵育, 120min取出酶标板,倒掉反应液, 用PBST洗液洗板后加入经稀释后的酶标二抗, 37℃孵育60min后取出酶标板, 倒掉反应液, 用PBST洗板。将显色液加入酶标板, 37℃孵育15min后加入终止液。用酶标仪(Power-Wave XS,BioTek Instruments, Inc., VT, USA)在490 nm下准确读取吸光值, 根据OD值及标准曲线求出AFB1含量。AFB1检测限为0.1 μg/kg。
取小块固定后的肝胰腺组织, 将其放于常规梯度酒精中脱水, 使用二甲苯作为透明剂, 使用石蜡进行包埋, 切片的厚度为7 μm, 进行HE染色后脱水后使用中性树胶进行封片。使用光学显微镜(Leica, DM 1000, GERMENY)和显微镜用科学数码照相机(SPOT Insight 4 mp CCD scientific color digital camera, USA)获取图像。将固定在戊二醛固定液中的组织取出, 使用冷的0.1 mol/L浓度磷酸缓冲液洗涤3次, 放入1%锇酸中固定2h后, 再进行丙酮梯度脱水, 使用618环氧树脂对其进行包埋, 切片采用的是瑞典LKB-5型超薄切片机, 之后将切片转移至铜网使用醋酸铀-枸橼酸铅进行双重染色, 最后采用日本JEM-100X透射电镜进行观察并拍摄照片。
1.6 数据处理
利用以下公式计算存活率、摄食率、饲料效率和特定生长率:

式中,W1为平均初始体重(g),W2为平均终末体重(g),t为实验天数(d),I为摄食量(g)。实验数据使用SPSS Statistics 17.0进行统计分析。实验结果经一元方差分析(One-way ANOVA)后, 用Duncan’s 进行多重比较, 当P<0.05时, 为差异显著。
2 结果
2.1 饲料中AFB1水平对克氏原螯虾幼虾存活和生长的影响
如表2所示, 对照组克氏原螯虾幼虾存活率为87.50%, 10 μg/kg毒素组存活率与对照组无显著差异(P>0.05), 100和1000 μg/kg毒素组存活率均显著低于对照组(P<0.05)。克氏原螯虾幼虾摄食率随AFB1浓度增加呈下降趋势, 10 μg/kg毒素组克氏原螯虾幼虾摄食率与对照组无显著差异(P>0.05),100和1000 μg/kg毒素组克氏原螯虾幼虾摄食率显著低于对照组和10 μg/kg毒素组(P<0.05)。10 μg/kg毒素组克氏原螯虾幼虾终末体重、特定生长率和饲料效率与对照组无显著差异(P>0.05), 100和1000 μg/kg毒素组终末体重、特定生长率和饲料效率显著低于对照组和10 μg/kg毒素组(P<0.05)。
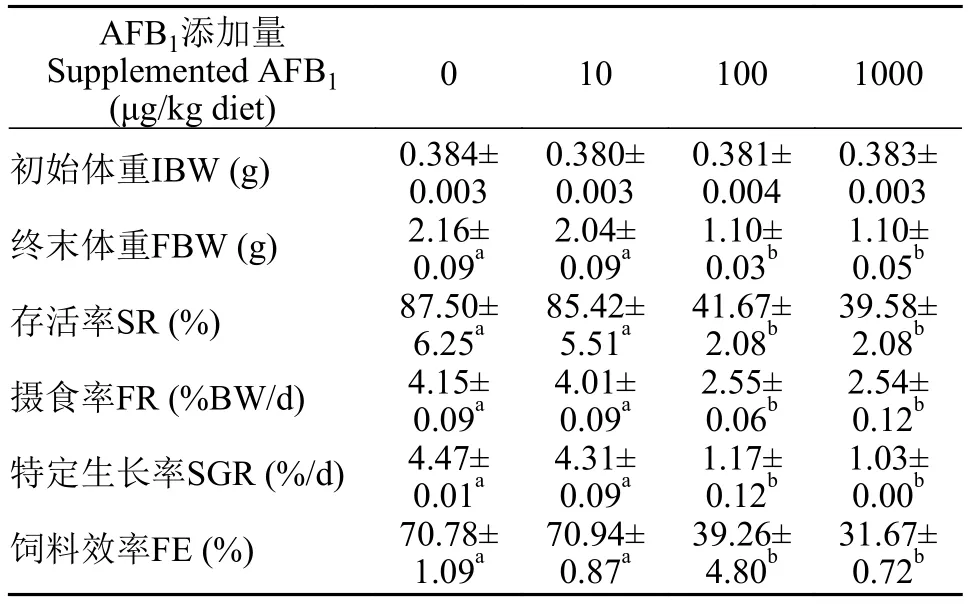
表2 饲料AFB1水平对克氏原螯虾幼虾生长和饲料利用的影响(平均值±标准误)*Tab.2 Effects of dietary AFB1 on growth performance and feed utilization of juvenile red swamp crayfish (mean±SE) *
2.2 饲料AFB1水平对克氏原螯虾幼虾抗氧化指标的影响
如表3所示, 克氏原螯虾幼虾AKP活性随着饲料中AFB1水平升高呈上升趋势, 10 μg/kg毒素组克氏原螯虾幼虾AKP活性与对照组无显著差异(P>0.05),100和1000 μg/kg毒素组AKP活性均显著高于对照组和10 μg/kg毒素组(P<0.05), 1000 μg/kg毒素组AKP活性显著高于100 μg/kg毒素组(P<0.05)。100和1000 μg/kg毒素组ALT和AST活性显著高于对照组和10 μg/kg毒素组(P<0.05), 10 μg/kg毒素组ALT和AST活性与对照组间无显著差异(P>0.05)。10 μg/kg毒素组克氏原螯虾幼虾CAT、GSH-Px、GST活性和MDA含量与对照组无显著差异(P>0.05), SOD活性显著低于对照组(P<0.05); 100和1000 μg/kg毒素组CAT、SOD、GSH-Px和GST活性均显著低于对照组(P<0.05) , MDA含量显著高于对照组(P<0.05)。

表3 饲料AFB1水平对克氏原螯虾肝胰腺生化指标的影响(平均值±标准误)Tab.3 Effects of dietary AFB1 on biochemical indexes of juvenile red swamp crayfish (mean±SE)
2.3 饲料中AFB1水平对克氏原螯虾幼虾肝胰腺组织学的影响
如图1所示, 对照组克氏原螯虾幼虾肝胰腺外观正常, 肝细胞排列整齐, 肝小管管腔星状结构清晰, 基底膜和上皮细胞连接紧密, 细胞间连接致密。10 μg/kg AFB1毒素组B细胞略微增大, R细胞数量减少, 星状管腔与对照组相似。100 μg/kg毒素组肝小管部分管腔星状结构消失, 肝细胞排列不规则, R细胞萎缩且数量进一步减少, B细胞明显增大,部分细胞溶解。1000 μg/kg毒素组肝小管失去正常结构, 部分管腔变性, 星状结构消失, R细胞数量减少, B细胞进一步增大且数量明显增多, 部分肝细胞肿胀和破裂, 基膜部分区域溶解, 细胞碎片和内容物漏出, 出现明显病变特征。

图1 饲料中AFB1对克氏原螯虾幼虾肝胰腺组织学的影响(H&E)Fig.1 Hepatopancreas of juvenile red swamp crayfish fed with diets containing AFB1 (H&E)
2.4 饲料中AFB1水平对克氏原螯虾幼虾肝胰腺超微结构的影响
如图2所示, 饲喂不同浓度AFB1的克氏原螯虾的肝胰腺细胞超微结构有明显区别, 且随浓度的增加病变愈为明显。对照组细胞核完整, 粗面内质网规则均匀地排列在细胞核边缘, 线粒体正常, 油滴均匀分布。10 μg/kg毒素组部分线粒体肿胀, 溶酶体增多。100 μg/kg毒素组内质网扩张、肿胀, 出现很多白色囊泡, 核膜扩张, 核染色质聚在细胞核一侧, 内质网肿胀扩张严重, 线粒体肿胀, 脂滴融合变大。1000 μg/kg毒素组油滴聚集把细胞核挤到一侧, 内质网断裂, 油滴巨大, 囊泡多, 细胞崩解, 细胞核消失, 自噬体聚集, 溶酶体聚集在自噬体周围, 囊泡增多变大, 聚集在一起; 基本无完整的细胞核结构, 线粒体肿胀。

图2 饲料中AFB1对克氏原螯虾幼虾肝胰腺超微结构的影响Fig.2 Ultrastructure of hepatopancreas of juvenile red swamp crayfish fed with diets containing AFB1
2.5 饲料AFB1水平对克氏原螯虾幼虾积累水平的影响
在实验结束时, 摄食AFB1≤100 μg/kg的克氏原螯虾幼虾虾体均未检测出AFB1(AFB1检测限为0.1 μg/kg), 仅在1000 μg/kg毒素组中检测出(1.65±0.22) μg/kg的AFB1。
3 讨论
3.1 饲料中AFB1水平对克氏原螯虾幼虾存活和生长的影响
AFB1是一种剧毒物质, 高剂量AFB1对水生动物有致癌、致畸和致突变等基因毒性, 易导致动物死亡; 而低剂量AFB1会因累积效应导致水生动物机体慢性中毒, 阻碍生长发育, 造成水产动物体表黄化、行为异常、食欲下降和体重减轻等[25,27,28]。
存活率下降和生长抑制被认为是AFB1对水生动物的主要毒性作用[29]。饲料中2500 μg/kg AFB1会显著降低斑节对虾的存活率和生长性能, 其含量与存活率、平均末重和体重增加呈高度负相关[18]。不同AFB1浓度(19—1641 μg/kg)对罗非鱼(Oreochromis niloticus×O.aureus)20周的存活率无显著影响, 仅在AFB1高剂量组(>380 μg/kg)观察到厌食、体表黄变、体重减轻和饲料效率降低[4]。饲喂含AFB1饲料的头石脂鲤(Brycon cephalus) 180d, 对照组、10、20和50 μg/kg组的存活率分别为98.9%、99.1%、99.8%和98.0%。推测50 μg/kg高含量组存活率较低是由于AFBO与DNA或RNA之间形成加合物, 抑制蛋白质合成, 从而对免疫系统造成了损害, 但各毒素组的摄食率与对照组无显著差异[30]。饲料中AFB1达1.0 mg/kg时降低了杂交条纹鲈(Morone chrysops×M.saxatilis)的生长性能, 其中增重率和消化率分别降低了80%和60%[7]。草鱼(Ctenopharyngodon idella)摄食25、50、75和100 μg/kg AFB1饲料49d未出现死亡, 但与对照组相比, 显著降低了其增重率和特定生长率。该研究认为, AFB1降低了草鱼的生产性能, 造成了经济损失[31]。暴露于AFB1的眼斑拟石首鱼(Sciaenops ocellatus)表现出“倒U型”的毒物兴奋效应, 即AFB1在高剂量时对眼斑拟石首鱼表现出负面影响, 而低剂量时则表现为有益的现象。在该研究中, AFB1为0.01 mg/kg时增重率、饲料效率和存活率与对照组相比显著降低, AFB1为0.5 mg/kg时, 增重率和饲料效率在各毒素组中最高; 当AFB1≥1 mg/kg时, 增重率和饲料效率开始呈现下降趋势[32], 这与Han等[33]对异育银鲫(Carassius auratus gibelio)幼鱼的研究结果相似。在本实验中, 与对照组相比, 饲料AFB1浓度为100和1000 μg/kg时, 克氏原螯虾幼虾的存活率、摄食率、终末体重、特定生长率和饲料效率均显著低于10 μg/kg组和对照组, 推测饲料中高剂量的AFB1会降低饲料适口性, 导致动物食欲和采食量下降[34],损伤机体的消化机能, 减少吸收利用营养物质的能力, 进而降低生长性能[27]。
不同虾类对AFB1的敏感性不同。用含有25 μg/kg AFB1的饲料饲喂初始体重为0.52 g的南美白对虾幼虾, 会对其生长性能造成不良影响[35]。斑节对虾幼虾对饲料中的AFB1的耐受水平为52.3 μg/kg[36]。而在对斑节对虾成虾的实验中, 当饲料中AFB1含量达到2500 μg/kg时才会降低其增重率和存活率[18]。当饲料中AFB1含量达到10 μg/kg时可显著降低非洲沼虾(Macrobrachium vollenhovenii)的特定生长率和存活率[37]。在本实验中, 饲料中AFB1含量≥100 μg/kg时显著降低了克氏原螯虾的生长性能。这可能是因为实验动物对AFB1的耐受程度受物种、年龄、性别、暴露时间长短、饵料、实验条件等因素的影响, 幼年比成年更容易受到影响[3,4,35]。有研究表明, 物种对AFB1的易感性程度不同, 基本上取决于物种的遗传易感性, 这在很大程度上取决于生物转化过程中酶的不同编码基因模式的表达[38]。
3.2 饲料AFB1水平对克氏原螯虾幼虾抗氧化指标的影响
需氧生物体内抗氧化防御系统主要是由一系列抗氧化酶构成的, 而酶活性的高低能够在一定程度上反映生物体的健康状况[25,28]。肝脏中的抗氧化酶主要由CAT、SOD和GSH-Px等构成, 抗氧化酶可清除或中和自由基以及活性氧(ROS)。CAT是一种通过催化H2O2分解来保护细胞免受氧化损伤的抗氧化酶。SOD可以催化超氧阴离子自由基的分解进而缓解细胞内DNA的损伤。GSH-Px在生物体内普遍存在, 对于肝脏的保护和抗肝脏生成过量氧自由基都有一定的作用[29]。GST是与肝脏解毒功能相关的酶, 当AFB1进入肝脏后, GST催化其与谷胱甘肽结合, 并随胆汁或尿液排出体外[39]; 丙二醛(MDA)作为脂质过氧化的产物, 可诱导氧化应激[29]。花鳗鲡(Anguilla marmorata)幼鱼摄入1000 μg/kg AFB1后, 肝脏SOD、CAT、GSH-Px和GST活性均显著降低, MDA含量显著升高, 说明AFB1可显著影响花鳗鲡幼鱼的抗氧化能力[25]。南美白对虾幼虾1600 μg/kg毒素组肝胰腺中ROS和MDA含量显著高于对照组, 而SOD活性显著低于对照组, 肝胰腺中MDA含量与SOD活性呈负相关, 肝胰腺细胞抗氧化与清除自由基的能力随饲料中AFB1的增加而减弱[40]。在短期饲喂15 mg/kg AFB1后, 与对照组相比, 南美白对虾肝胰腺中SOD、GST、GSHPx和CAT活性均显著升高, 表明AFB1诱导了肝胰腺的脂质过氧化, 激活了肝胰腺的抗氧化酶系统, 进而清除过量的ROS并维持细胞内的氧化还原平衡[41],这与Peng等[29]的结论相似。虹鳟摄入AFB1后(Oncorhynchus mykiss)血清和肠道的CAT及总SOD活性显著降低, 这与AFB1诱导的氧化应激期间产生的自由基和H2O2的破坏作用有关[42]。ALT和AST活性是组织损伤和功能障碍的良好生物指示物。喂食AFB112周后, 1000 μg/kg组的鲤(Cyprinus carpio)肝脏AST和ALT活性与对照组相比显著升高[43]。AKP是肝脏中具有解毒功能的酶, 当肝脏中进入大量有毒物质时, AKP活性升高发挥解毒功能[44]。与对照组相比, 南美白对虾AFB1组AKP活性明显升高, 这可能是由于AFB1引发了肝胰腺细胞损伤[45]。饲料中加入AFB1会增加花鲈AKP和溶菌酶(LZM)活性[8]。在本实验中, 100和1000 μg/kg组克氏原螯虾幼虾的AKP、ALT、AST活性及MDA含量显著高于10 μg/kg组和对照组, 而CAT、SOD、GSH-Px和GST活性显著低于对照组。表明AFB1造成了克氏原螯虾幼虾肝胰腺损伤和抗氧化机能失衡。
3.3 饲料中AFB1水平对克氏原螯虾幼虾肝胰腺组织学及超微结构的影响
肝脏是AFB1的主要靶器官, 饲喂AFB1污染的饲料会导致水产动物肝脏发生严重的组织病理学变化[25,29,46]。肝脏荧光转基因斑马鱼(Danio rerio)幼鱼在暴露于AFB124h后荧光面积显著降低, 荧光强度在0.4 mg/mL AFB1处理组显著降低, 说明AFB1在进入幼鱼体内后迅速作用于肝脏器官, 并抑制了肝脏的生长发育[47]。饲喂AFT的鲤肝细胞脂肪变性、浑浊肿胀、细胞质空泡形成、肝细胞坏死、门静脉组织纤维化、胆管细胞过度增殖和胰腺细胞坏死的情况, 这些损伤可影响鱼类的生理平衡[48]。用80 μg/kg AFB1饲喂的杂交鲟(Acipenser ruthenus♂×A.baeri♀)幼鱼, 肝脏组织出现嗜碱性肝细胞和多核的肿大肝细胞, 这是肝脏肿瘤的征兆[49]。用100、500和1000 μg/kg AFB1饲料喂养的南美白对虾的肝胰腺出现了明显的变化, 包括萎缩和不规则的管状结构, R细胞和B细胞的减少[35]。R细胞和B细胞的减少可以被视为虾类受到AFB1毒性损伤的可靠生物标志[50]。饲料中AFB1含量的增加导致南美白对虾肝胰腺细胞坏死程度加剧, 细胞的空泡数量显著高于对照组。AFB1通过破坏对虾肝胰腺结构诱发器官炎症, 从而破坏器官正常机能以及抑制其吸收和分泌的功能[51]。
AFB1作用于细胞会使胞内ROS含量及线粒体膜通透增加。由于线粒体是ROS的主要产生部位,同时也对ROS极其敏感, 因此ROS的增加会对线粒体造成氧化损伤, 进而引起细胞凋亡[52]。随着AFB1浓度的增加, 对锦鲤(Cyprinus carpio haematopterus)肝细胞细胞密度及生长状态的影响逐渐增大, 从而造成锦鲤肝细胞死亡[53]。斑节对虾在饲喂AFB18周后, 肝胰腺超微结构发生了改变, 如细胞器丧失、线粒体和细胞核结构崩解、囊泡形成、细胞自噬和坏死[54]。在AFB1感染的斑马鱼胚胎中, 约有86%的肝脏体积缩小, 肝细胞结构被破坏。TUNEL染色表明AFB1引发了胚胎肝细胞的凋亡[55]。在本实验中, 随AFB1浓度的增加, 克氏原螯虾幼虾肝胰腺R细胞数量减少, B细胞明显增大和数量增多, 肝小管内腔星状结构消失, 肝细胞逐步崩解, 内质网肿胀且断裂加剧, 油滴和囊泡增多, 100和1000 μg/kg组克氏原螯虾幼虾肝胰腺严重病变。R细胞数量减少,B细胞数量增加, 预示肝胰腺解毒功能受损[56], 肝细胞的崩解导致肝脏功能不足并趋于衰竭[57]。
3.4 饲料AFB1水平对克氏原螯虾幼虾积累水平的影响
AFB1在胃肠道被吸收后分布到肌肉、肾脏和脂肪组织, 主要分布到肝脏。影响AFT代谢的因素包括种类、性别、年龄、健康状况、染毒时间和饲料中的毒素水平[30]。AFB1在黄河鲤(Cyprinus carpio var)组织中的积累与饲料中AFB1的含量密切相关, 而肝脏中AFB1的含量远高于肌肉中含量,这也反映了肝胆系统是AFB1及其代谢物积累和排泄的重要场所[58]。鲤幼鱼摄入100 μg/kg AFB1肝胰脏残留浓度最高[59]。饲养3个月的异育银鲫肝胰脏中AFB1残留量明显增加, 并与饲料中AFB1含量呈对数关系, 其残留量远高于肌肉和卵巢[33]。大菱鲆(Scophthalmus maximus)500 μg/kg AFB1饲料组血清中AFB1残留量高于肌肉中[46]。在整个AFB1暴露期头石脂鲤肝脏中仅能检测到水平很低的AFB1, 而在肌肉中则没有AFB1的积累[30]。Barany等[60]在AFB1对大西洋鲷(Sparus aurata)的影响研究显示,尽管验证了饲料中存在AFB1, 但肝脏和肌肉样品均未检出AFB1。饲喂含AFB1饲料的中国对虾(Penaeus Chinensis)体内均未检出AFB1[61]。Su等[11]研究发现, 饲喂含AFB1饲料的南美白对虾肌肉中没有检测到AFB1, 这意味着食用南美白对虾的肌肉不会增加消费者接触AFB1的风险。饲喂含AFB1饲料4周后发现斑节对虾肌肉中的残留量最高, 第6周开始降低, 在整个实验期间, 头部和外壳中残留物均较少[18]。在本实验中, 仅在1000 μg/kg组幼虾虾体中检测出(1.65±0.22) μg/kg的AFB1, 低于FDA食品中AFB1的安全限量标准(5 μg/kg)[62], 该结果与草鱼的报道相似, 草鱼摄食10、20、100、1000和1000 μg/kg AFB1后肌肉中均未检测出AFB1, 摄食5000 μg/kg AFB1的草鱼肌肉中检测出1.21 μg/kg AFB1[28]。AFB1的主要清除途径为胆和排泄系统。AFB1在体内较快地转化成AFL而非AFBO, 并且迅速被解毒酶作用而生成水溶性物质, 最后通过其胆汁、尿液等排出体外[63]。异育银鲫摄食AFB1达1000 μg/kg时粪便中的AFB1仅34 μg/kg, 比率仅为0.034, 而肝胰脏和肌肉中积累比率也仅为0.012和0.002, 大部分AFB1未被吸收或经排泄系统排出体外[44]。在本实验中, 摄食AFB1≤100 μg/kg的克氏原螯虾幼虾虾体均未检测出AFB1, 但100 μg/kg组在生长、抗氧化和组织学方面跟对照组均有显著差异, 类似的结果在其他AFB1对虾类的研究中已有报道。南美白对虾饲料中添加129.1 μg/kg AFB1显著降低了对虾的生长性能和体脂含量, 抑制了抗氧化能力和免疫力, 增加了脂质过氧化, 并造成肝胰腺组织损伤, 但仅在肝胰腺中检测到极低的AFB1残留, 肌肉中则未检出[12]。另有研究表明, 南美白对虾持续8周摄入含1600 μg/kg AFB1的饲料后, 对虾的肝胰腺受损且MDA、SOD和ROS等抗氧化指标均受到不同程度的影响, 但其肌肉中未检测到AFB1残留。当对虾摄入AFB1后, 在肝胰腺中代谢产生AFM1, 实验中检测了对虾肝胰腺、肠道和肌肉中的AFM1残留量, 证明AFB1的代谢主要在肝胰腺中, 排泄时有极小的一部分在肠道中吸收,肌肉中则不存在AFM1残留[40]。推测克氏原螯虾可能是以肝胰腺和排泄系统作为其主要的AFB1清除途径, 但是还需要进一步的药物动力学分析。
