池蝶蚌HsPif基因的克隆及表达分析
2023-01-30熊雅萍马慧妹胡蓓娟邱齐骏洪一江
熊雅萍 马慧妹 胡蓓娟 邱齐骏 洪一江
(1.南昌大学生命科学学院, 南昌 330031; 2.江西省水产动物资源与利用重点实验室, 南昌 330031;3.抚州市水产科学研究所, 抚州 334000)
软体动物是海洋生物中最大、物种最丰富的门之一[1]。几个世纪以来, 软体动物贝壳的进化起源、结构、模式和物理性质一直是科学家关注的焦点。而贝壳是由95%—99%的碳酸钙晶体和少于5%的有机质物质(如蛋白质、糖蛋白、多糖和脂质)组成的多层结构(棱柱层和珍珠层), 由贝类外套膜分泌的有机质基质和碳酸钙晶体结合而成, 珍珠是倒转过来的贝壳[2,3]。Cuif等[4]在对珍珠的结构观察后发现, 棱柱层位于珍珠核部分, 珍珠层在外部, 碳酸钙和不同的基质蛋白形成不同的结晶, 其中棱柱层由方解石晶体构成, 珍珠层由文石晶体构成。外套膜分泌的有机质基质在碳酸钙生物矿化中具有奇特的调节作用[5], 且珍珠层具有有序规则的平面隔室结构, 几乎每个隔室中的文石晶体都垂直珍珠层平面的C轴方向[6], 虽然对珍珠形成的研究颇多[7—9], 但具体调控过程仍不清楚。
珍珠形成过程从中参与珍珠质形成的基因有很多, 包括PIF、MSI60和Pearlin等[9]。其中, Pif是一种酸性基质蛋白, 是珍珠形成的关键大分子, 参与文石的形成、珍珠层中文石片的结晶和随后的堆积[10,11]。Suzuki等[7]发现在合浦珠母贝(Pinctada fucata)中PifcDNA编码一个前体蛋白, 经翻译后裂解生成Pif 97和Pif 80。Pif 97具有两个保守的功能域, 即血管性血友病因子A型(VWA)域和几丁质结合域, 它们可以结合几丁质微纤维并与其他蛋白质相互作用,而Pif 80具有一些文石结合活性[7]。含有VWA蛋白质的相互作用调节功能可能是形成贝壳基质蛋白复合物的关键机制[12], 而Pif基因同时具有VWA结构域和几丁质结合域共同作用, 可以将Pif97和Pif80、N16等其他与珍珠层形成相关的蛋白相互结合排列沉积, 从而形成有机框架, 并形成层状珍珠层[13]。有研究表明Pif除了与珍珠层的形成有关外, 该基因的表达水平跟分泌珍珠质的速率密切相关[14]。池蝶蚌中缺乏对Pif基因的研究, 影响了我们对池蝶蚌中Pif基因在形成珍珠过程中其功能的理解。
池蝶蚌(Hyriopsis schlegelii)是一种淡水育珠蚌, 具有生长快、外套膜厚、抗病能力强等特点,所产珍珠优珠率高, 是我国主要的淡水育珠蚌之一[15]。目前关于池蝶蚌育珠机制研究较少, 本实验通过对池蝶蚌中的Pif基因进行分子全长的克隆和其表达分析, 探讨HsPif的序列特征及其相关功能, 为今后池蝶蚌的养殖与育珠提供更多科学参考。
1 材料与方法
1.1 实验动物
实验中所用未进行植核的、张闭有力的3龄健康池蝶蚌取自江西省抚州市水产科学研究所国家级池蝶蚌良种场, 从良种场取回后放入已曝气的水箱中暂养1周, 以适应新环境, 每2天换1次水。植核池蝶蚌取自于江西万年夏清华珠宝有限公司。
1.2 总RNA的提取和cDNA的合成
以TRIzol提取法从池蝶蚌的外套膜中提取总RNA, 用于qPCR的RNA则需从池蝶蚌的10个组织获得, 10个组织分别为血细胞、性腺、肝胰腺、肾脏、鳃、闭壳肌、外套膜、斧足、肠道和心脏; 根据Prime Script™ RT reagent Κit with gDNA Eraser(TaKaRa)试剂盒说明书要求合成qPCR所需的cDNA模板。
1.3 HsPif基因的全长克隆和测序
根据高通量转录组测序数据中筛选出HsPif基因的部分片段, 利用Primer 5.0设计中间片段扩增引物(F:5′-CAATGTCTCTCTGTCTCAAT-3′; R:5′-AT TCCAAGATTCAACTCCGT-3′)。随后用各组织模板进行PCR扩增, 琼脂凝胶电泳检测后, 按照DNA回收试剂盒(OMEGA)说明书进行切胶回收,将得到的产物与pMD19-T载体连接, 于含Apm+培养基中培养, 送至上海生物工程技术有限公司测序。比对分析获得HsPif基因中间序列, 再根据该序列设计RACE-PCR引物(5′-RACE 1: 5′-CGGTG AGAACAATTCCAATCTG-3′; 5′-RACE 2: 5′-AGACT CCGTAATCCAAGATAAG-3′; 3′-RACE1: 5′-AATT CGCTTGTGTCTGTCTTCG-3′; 3′-RACE 2: 5′-GCCGA GTCATCAAGTTCAGACG -3′)。根据SMARTer®RACE 5′/3′ Kit User Manual试剂盒的要求合成HsPif基因5′端和3′端序列, 再与HsPif基因中间序列进行拼接, 从而获得HsPif基因全长cDNA序列。
1.4 生物信息学分析
生物信息学在线工具分析池蝶蚌HsPif基因,使用Clustal W1.81进行氨基酸序列的比对, NCBI(ORF finder, https://www.ncbi.nlm.nih.gov/orffin der/)上查找开放阅读框, 分析蛋白结构, 推导氨基酸序列和比对氨基酸同源性。系统进化树用软件MEGA7.0中的NJ法构建。
1.5 池蝶蚌各组织中HsPif的表达分析
分别提取池蝶蚌血细胞、性腺、肝胰腺、肾脏、鳃、闭壳肌、外套膜、斧足、肠道和心脏10个组织的总RNA, 按照PrimeScript™ RT reagent Κit with gDNA Eraser(TaKaRa)试剂盒说明书将所提RNA反转为cDNA。根据获得的池蝶蚌HsPif基因设计荧光定量引物(F: 5′-CAATGTCTCTCTGT CTCAAT-3′; R: 5′-ATTCCAAGATTCAACTCCGT-3′), 以池蝶蚌β-actin(F: 5′-AAGGTTACGCCCT TCCTCAT-3′; R: 5′-GCCATTTCCTGCTCAAAGTC-3′)内参基因, 进行荧光定量PCR(qPCR)反应检测HsPif基因在10个不同组织中的表达水平。数据处理采用2–∆∆Ct方法, 利用Excel 和 GraphPad Prism 8.3.0分析作图。
1.6 珍珠囊形成过程中HsPif的表达分析
筛选张口有力、个体差异小的健康2龄池蝶蚌进行植核手术, 挑选大小、重量差异较小的由贝壳制成的圆形纽扣和由1龄池蝶蚌外套膜制成的1 mm方形小片, 插入池蝶蚌外套膜内, 植核手术完成后,将其放入同一水环境中养殖, 并在植核手术进行的0、7d、15d、30d、60d、90d和120d进行外套膜/珍珠囊取样, qPCR检测HsPif的表达量的变化。
制备探针: 设计HsPif基因的特异性引物F和R,其中R包含T7启动子序列, 提取HsPif基因的重组质粒, 以F(5′-TAATACGACTCACTATAGGGCAAT GTCTCTCTGTCTCAAT-3′)、R(5′-ATTCCAAG ATTCAACTCCGT-3′)为反应引物, 以HsPif基因的重组质粒模板进行PCR反应。PCR反应结束后进行琼脂糖凝胶电泳检测反应, 将切胶回收纯化得到的产物作为体外转录的模板, 转录反应根据T7 High Efficiency Transcription Kit和DIG RNA Labeling Kit(Roche) 说明书进行, 纯化按照Easy RNA Purification Kit 试剂盒说明书进行。
取池蝶蚌外套膜, 在通用型组织固定液中固定1h, 经常规脱水、浸蜡、包埋, 切片厚度6—8 μm,切片脱蜡至水。杂交反应参考Enhanced Sensitive ISH Detection KitⅡ (AP)(BOSTER)说明书稍作改正进行, 将杂交操作完成的切片置于荧光导致显微镜下观察, 标记其杂交反应发生位置和放大标尺。
1.7 数据统计
数据处理采用2–∆∆Ct方法计算, 以SPSS软件进行差异性分析, 用GraphPad Prism进行作图。
2 结果
2.1 HsPif基因蛋白氨基酸组成分析
将测序得到的中间片段、5′端和3′端的序列进行拼接, 得到HsPif基因的cDNA全长为3457 bp,5′端非翻译区(5′UTR)为485 bp, 3′端非翻译区(3′UTR)为363 bp, ORF框3072 bp, 共编码1023个氨基酸, 推测编码HsPif97和HsPif80两种蛋白。预测分子量为110.484 kD, 理论等电点为4.67, 该蛋白为酸性蛋白。运用生物信息学预测其氨基酸组成成分, 结果表明天冬氨酸(Asp)含量最高, 占12.5%, 组氨酸(His)含量最低, 占1.32%。
2.2 HsPif蛋白的亲水性和疏水性分析
将得到的HsPif氨基酸序列于ExPASY网站进行亲疏水性的分析, 结果显示, 疏水氨基(Ala、Cys、Ile、Met、Leu、Phe、Val)占30.4%, 亲水性氨基酸(Arg、Asn、Asp、Gln、Glu、Gly、His、Lys、Pro、Ser、Thr、Trp、Tyr)占69.6%, 总平均亲水性指数为–0.566, 故HsPif为亲水性氨基酸。
2.3 HsPif蛋白结构预测分析
使用NCBI网站中的SMART程序来对池蝶蚌Pif氨基酸序列进行结构域分析, 在N端从32到207位氨基酸中存在1个VWA, N端从536到733位氨基酸中有三个ChtBD2(几丁质结合结合域), 三个ChtBD2长度从左到右依次为85、53和48个氨基酸。
2.4 HsPif蛋白的二级结构和三级结构分析
使用Prabi程序对Pif氨基酸的二级结构进行预测和分析, 发现HsPif中α螺旋(Alpha helix, Hh)含量占19.63%, β折叠(Beta turn, Tt)占8.43%, 无规则卷曲(Random coil, Cc)占55.09%, 延伸链(Extended strand, Ee)占16.86%, 其中β折叠、延伸链和无规则卷曲均匀的分布在HsPif蛋白质中, 而α螺旋则主要分布在蛋白质的前中部。
使用SWISS MODLE网址对HsPif蛋白三级结构进行预测, 发现HsPif三级蛋白结构模型中的α螺旋的分布与二级结构中的分布情况一致, 主要分布在前中部, 说明其三级结构预测是相对正确的(图1)。

图1 HsPif蛋白的三维结构Fig.1 The three-dimensional structure of HsPif protein
2.5 HsPif的同源比对和系统进化树
将得到的HsPif序列于NCBI网站上进行蛋白比对, 结果显示HsPif与三角帆蚌(Hyriopsis cumingii)的同源性最高, 为97.97%, 其次是同源性为37.71%的厚壳贻贝(Mytilus coruscus), 同大珠母贝(Pinctada maxima)、黑蝶贝(Pinctada margaritifera)和虾夷扇贝(Mizuhopecten yessoensis)的同源性分别为36.18%、35.92%和31.10%。HsPif蛋白序列与其他贝类的同源对比, 池蝶蚌含有保守的VWA结构域和相对保守的ChtBD2(几丁质结合结合域)。
HsPif和其他含有Pif基因的其他贝类构建系统进化树, 结果显示贝类中的Pif主要分为两大支,HsPif与三角帆蚌聚为一支, 其他贝类聚为另一支,如图2说明HsPif在进化的过程中趋向保守。

图2 池蝶蚌及其他物种Pif的系统进化树Fig.2 The phylogenetic tree of HsPif from Hypriosis schlegelii and other species
2.6 组织荧光定量分析
通过qPCR检测池蝶蚌各个组织HsPif基因的表达水平,HsPif基因在性腺的表达水平设为1, 外套膜套膜区表达量最高, 肝胰腺、外套膜中央膜区和外套膜边缘膜区较高, 而心脏、血细胞和肾脏表达水平较低(图3)。这说明HsPif基因主要表达场所为外套膜, 而外套膜是珍珠质分泌的主要场所, 推测HsPif基因与珍珠的形成有一定关系。
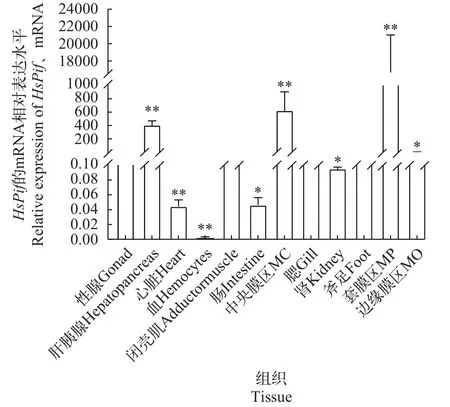
图3 HsPif mRNA在池蝶蚌不同组织中的相对表达水平Fig.3 The relative expression level of HsPif mRNA in different tissues of Hypriosis schlegelii
2.7 分子原位杂交
为了进一步确定HsPif基因的确切表达位置,确定其在珍珠形成中的作用, 进行原位杂交反应,结果显示, 主要在池蝶蚌外套膜的缘膜部上皮细胞发生杂交反应, 表明HsPif基因与珍珠质的形成有关(图4)。

图4 HsPif基因在池蝶蚌外套膜中原位杂交结果Fig.4 Results of in situ hybridization of HsPif gene in the mantle of Hypriosis schlegelii
2.8 珍珠形成早期HsPif基因在珍珠囊中的表达分析
取池蝶蚌植核手术后0、7d、15d、30d、60d、90d和120d七个时间点珍珠囊样品, 采用qPCR技术对HsPif基因进行表达量分析, 结果表明, 植核后第7天显著降低, 随后升高, 在第60天达到最高,第90天Pif的表达量显著降低, 随后表达量升高(图5)。

图5 池蝶蚌进行植核手术后不同时期HsPif的表达量变化Fig.5 Changes in the expression of HsPif in different periods after nucleus grafting
3 讨论
贝类Pif基因由Suzuki等[7]在合浦珠母贝珍珠层中首次分离并报道, Pif是珍珠质中的一种酸性基质蛋白, 该基因经转录翻译后形成Pif97和Pif80, 参与文石的形成与堆积。本实验对池蝶蚌Pif基因(HsPif)进行全长克隆和功能鉴定, 分析HsPif基因的全长序列发现: 该基因含有VWA和ChtBD2结构域, 在各种细胞外基质蛋白中, VWA结构域的功能通常与蛋白质之间的相互作用的调节有关[16], 且Pif可与其他珍珠层形成相关的蛋白相互结合[16], 推测该基因与珍珠层的形成有关。这与其他贝类中的Pif基因及其同系物都具有VWA和ChtBD2结构域相似[7,13],说明了Pif基因的保守性较高。分析HsPif基因的同源比对性和构建进化树结果显示:HsPif与三角帆蚌Pif在同一支上, 说明池蝶蚌与三角帆蚌有较近的亲缘关系, 且与其他贝类在同一大支上, 这也验证了Pif基因保守性较高。HsPif基因可能与其同系物具有相似的珍珠层生物矿化机制。
在贝类中, 生物矿化主要发生在外套膜, 钙离子和碳酸氢钙离子结合, 达到饱和状态后发生结晶、沉积[17]。贝类的外套膜可分为边缘膜区(Marginal zone, MO)、套膜区(Pallial zone, MP)和中央膜区(Central zone, MC) 3个部分[18,19]。边缘膜区负责分泌形成棱柱层的大分子物质, 中央膜区和套膜区主要是负责分泌形成珍珠层的有机质[19,20]。本实验对3龄池蝶蚌的组织表达检测中可发现:HsPif基因在各组织均有表达, 该基因在套膜区、中央膜和边缘膜区膜较高, 而心脏、血细胞和肾脏表达水平较低, 且HsPif基因在套膜区中显著高表达, 说明该基因与珍珠层的形成相关。在本实验中, 除了组织表达分析外, 为了了解HsPif基因在外套膜中的确切表达位置, 进行了分子原位杂交实验, 结果显示, 主要在外套膜缘膜上皮细胞检测到杂交信号,进一步表明HsPif有可能参与珍珠层的形成过程。
珍珠是由软体动物分泌的生物矿物而形成的珠粒, 是由软体动物外套膜受外来刺激或自身病变形成的珍珠囊分泌形成。在珍珠产业中, 外套膜移植物与宿主外套膜的结缔组织融合形成完整的珍珠囊, 珍珠囊细胞开始分泌基质蛋白来控制晶体生长, 最终形成珍珠[21]。因此, 珍珠囊在珍珠层的生物矿化中类似于外套膜。本研究分析了珍珠形成过程中HsPif在珍珠囊中的表达, 结果显示HsPif在第7天表达量极低, 植核后的7d内, 植核手术伤口还未愈合, 处于外套膜小片与蚌体自身外套膜组织相互融合的过程, 未分泌珍珠质, 这与王烈华等[22]的研究结果相似, 在珍珠囊扁平细胞出现时才开始(植核后7—15d)分泌珍珠质; 在15d后HsPif表达水平上升, 说明珍珠囊已初步形成, 开始有少量珍珠质; 30d时,HsPif的表达水平降至对照组水平, 表达量相对较低, 这可能是处于珍珠形成的不规则碳酸钙沉积阶段, 珍珠囊内基质蛋白表达低[4]。HsPif在第30至第60天显著表达, 表明HsPif为CaCO3提供了成核位点, 珍珠层已形成[4,23]。理论上, 形成珍珠层后HsPif应该是稳定表达的。而在植核第90天后出现显著降低, 这可能是受天气或者其他外部条件的刺激而导致蚌体发生其他免疫反应, 阻碍珍珠质的稳定分泌。总之, 本文首次从池蝶蚌中克隆出Pif基因的cDNA全长序列, 且池蝶蚌植核手术后珍珠囊中Pif基因的表达说明其与珍珠层的形成有关, 为进一步研究珍珠的形成提供参考。
