miR-27b-3p对主动脉血管平滑肌细胞和单核细胞功能的影响及机制研究
2023-01-30肖远扬李良学
肖远扬,李良学
(武汉科技大学附属普仁医院 血管外科,湖北 武汉 430081)
腹主动脉瘤(abdominal aortic aneurysm,AAA)是常见的主动脉慢性炎症扩张性疾病,发病率和病死率高,未破裂的AAA 无明显特异性症状,而破裂的AAA 是影响中老年人健康的重要因素[1-2]。AAA 发病机制与主动脉血管平滑肌细胞(vascular smooth muscle cells,VSMC)增殖活性降低、凋亡增加、巨噬细胞浸润引起炎症反应和细胞外基质代谢异常密切相关[3]。尽管如此,VSMC 增殖和凋亡及主动脉局部炎症浸润的复杂分子调控机制尚未完全阐明[4]。AAA 病变组织中异常表达的微小RNA(miRNA)与疾病发生和进展密切相关[5-6]。如,miR-194 在人和小鼠腹主动脉瘤模型中低表达,并通过靶向组蛋白去甲基化酶抑制平滑肌细胞凋亡和细胞外基质降解,对主动脉瘤发挥保护作用[7-8]。miR-27b-3p 是最新鉴定的miRNA 分子,文献[9]报道miR-27b-3p 在动脉粥样硬化斑块中表达增加,且可能参与动脉粥样硬化中巨噬细胞和平滑肌细胞增殖和凋亡。通过大数据基因芯片数据[10]分析发现,在AAA 组织和血清中miR-27b-3p 表达显著上调。尽管如此,miR-27b-3p 在主动脉VSMC 中的功能及机制尚不清楚。基于前人研究基础,本研究旨在体外VSMC 中探讨miR-27b-3p 的功能、对单核巨噬细胞及细胞外基质的影响和作用机制,为AAA 的治疗提供潜在靶点和实验基础。
1 材料与方法
1.1 实验材料与试剂
人主动脉VSMC 和人单核巨噬细胞THP-1 购自中国科学院典型培养物细胞库,细胞培养基RPMI-1640 购自美国Thermo Fisher 公司。细胞培养基DMEM 购 于美国Gibco 公司。pcDNA3.1-PTEN 质粒 和阴性对照质粒、miR-27b-3p 抑制物(miR-27b-3p inhibitor)和模拟物(miR-27b-3p mimics)购自上海吉玛生物公司。TRIzol 试剂盒购自美国Invitrogen 公司。LipofectamineTM3000 和反转录试剂盒购于日本TaKaRa 公司,ELISA 试剂盒购自美国Sigma Aldrich公司。磷酸酶及张力蛋白同源物(phosphatase and tensin homologue,PTEN)、GAPDH、基质金属蛋白酶抑制剂1(tissue inhibitor of metalloproteinase 1,TIMP-1)和基质金属蛋白酶 9(matrix metalloproteinase 9,MMP-9)抗体均由美国Cell Signaling Technology 公司购买。上海碧云天生物技术有限公司提供BCA 蛋白定量试剂盒、CCK-8 试剂盒。美国Promega 公司购买双萤光素酶报告基因试剂盒。
1.2 方法
1.2.1 细胞培养和转染 VSMC 置于DMEM 培养基中培养,而THP-1 置于RPMI-1640 培养,均在37 ℃、5%CO2的培养箱中培养。待细胞生长密度达到80%时,接种到6 孔板(2×105个/孔)中,置于培养箱中培养。当细胞单层密度达到50%~60%时进行转染。将VSMC 或THP-1 分别转染miR-27b-3p 抑制物、miR-27b-3p 模拟物和pcDNA3.1-PTEN。转染后放入培养箱培养48 h,收集细胞用于后续实验。
1.2.2 细胞分组 为测定miR-27b-3p 敲低对VSMC增殖、凋亡的影响,将VSMC 分别转染miR-27b-3p抑制物(miR-27b-3p 敲低组)、miR-27b-3p 模拟物(miR-27b-3p 过表达组)、对照序列(对照组)。为研究miR-27b-3p 敲低对THP-1 培养基中炎症因子和细胞基质相关蛋白表达影响,对THP-1 转染miR-27b-3p 抑制物后,分成miR-27b-3p 敲低组和对照组。为研究miR-27b-3p 靶向PTEN 抑制VSMC 增殖和诱导凋亡,将VSMC 分成对照组、PTEN 过表达组、miR-27b-3p+PTEN 组(同时上调miR-27b-3p 和PTEN)。
1.2.3 qRT-PCR 检测miR-27b-3p 表达水平 收集各组处理后的细胞,采用TRIzol 提取细胞中总RNA,并采用NanoDrop 检测RNA 浓度。采用一步法反转录试剂盒将RNA 反转录为cDNA,严格按照qPCR试剂盒说明书检测miR-27b-3p 表达水平,以U6 为内参。miR-27b-3p 上游引物为5'-CTG GAG TAT GTG CAA CTA TGC-3',下游引物为5'-GTG CCG AAG GGT CGG T-3';U6 上游引物为5'-CTC GCT TCG GCA GCA CAT ATA CT-3',下游引物为5'-ACG CTT CAC GAA TTT GCG TGT C-3'。实验重复3 次。
1.2.4 Western blot 检测蛋白表达水平 收集生长良好VSMC 和THP-1,采用RAPI 裂解液提取细胞中总蛋白,检测蛋白质浓度。取40 μg 蛋白,采用10% SDS-PAGE 分离蛋白、电转膜法将目的条带转移至PVDF 膜上,室温封闭1 h 后(5%脱脂奶粉),然后分别加入PTEN 一抗(1∶400)、TIMP1一抗(1∶300)、MMP-9 一抗(1∶300)、GAPDH 一抗(1∶500),并孵育过夜(4 ℃),加入山羊抗鼠二抗(1∶800)室温孵育2 h,ECL 染色,凝胶成像仪采集图像,通过Image J 分析灰度值。所有实验均重复3 次。
1.2.5 CCK-8 检测VSMC 增殖活力 将处于对数生长期经miR-27b-3p 转染的VSMC 接种于96 孔板中(2×104个/孔),每孔中加入100 μL DMEM 培养基,置于37 ℃、5%CO2的培养箱中培养,分别在4 个时间点(0、24、48、72、96 h)于每孔中加入CCK-8溶液10 μL,继续置于培养箱中孵育4 h 后,酶标仪采集每孔光密度(A450 nm)值。
1.2.6 流式细胞术检测VSMC 凋亡情况 将处于对数生长期经miR-27b-3p 转染的VSMC 接种于96 孔板中(1×105个/孔)中,培养24 h 后,将细胞经过胰蛋白酶消化并洗涤重悬于300 μL PBS 液体中,分别加 入Annexin V-FITC(10 μ L)和PI 溶液(5 μL),混合均匀后避光孵育5 min,流式细胞仪检测细胞凋亡百分比。
1.2.7 双萤光素酶报告基因验证miR-27b-3p 和PTEN 的靶向关系 构建PTEN 基因3'UTR,插入pGL3-Promoter 质粒载体中,并命名为pGL3-PTEN-3'UTR WT,基因定点突变获得PTEN 突变型载体,并命名为pGL3-PTEN-3'UTR MUT。将miR-27b-3p 过表达序列和对照序列、PTEN 野生型载体、PTEN 突变型载体共转染于HEK 293T 细胞中,常规培养36 h,采用双萤光素酶报告基因检测试剂盒检测萤光素酶活性。实验重复3 次。
1.2.8 ELISA 检测炎性因子的表达水平 将经转染miR-27b-3p 的THP-1 培养于RPMI-1640 培养基,加入含有50%巨噬细胞培养上清液,继续培养24 h后,采集培养上清液,检测上清液中TNF-α、IL-12、IL-4 和IL-10 浓度,严格按照ELISA 试剂盒说明书操作,实验重复3 次。
1.3 统计学处理
SPSS 22.0 软件对所有数据进行统计学分析。计量资料以均数±标准差()表示,两组比较采用t检验,多组比较采用单因素方差分析,两两比较采用SNK-q检验。P<0.05 为差异有统计学意义。
2 结果
2.1 miR-27b-3p敲低对VSMC增殖和凋亡的影响
qRT-PCR 结果显示,miR-27b-3p 敲低可降低VSMC 中miR-27b-3p 表达水平(4.33±0.44vs.9.25±1.24,P<0.05),miR-27b-3p 过表达可增加VSMC 中miR-27b-3p 表达水平(15.33±1.44vs.9.05±1.08,P<0.05),提示转染成功,具有较好转染效率(图1A)。CCK-8 结果显示,miR-27b-3p 敲低后A450 nm 值在48、72、96 h 3 个时间点高于对照组(均P<0.05)(图1B),流式细胞术结果显示,miR-27b-3p 敲低后VSMC 凋亡率降低(2.13±0.11%vs.10.58±0.35 %,P<0.05)(图1C)。
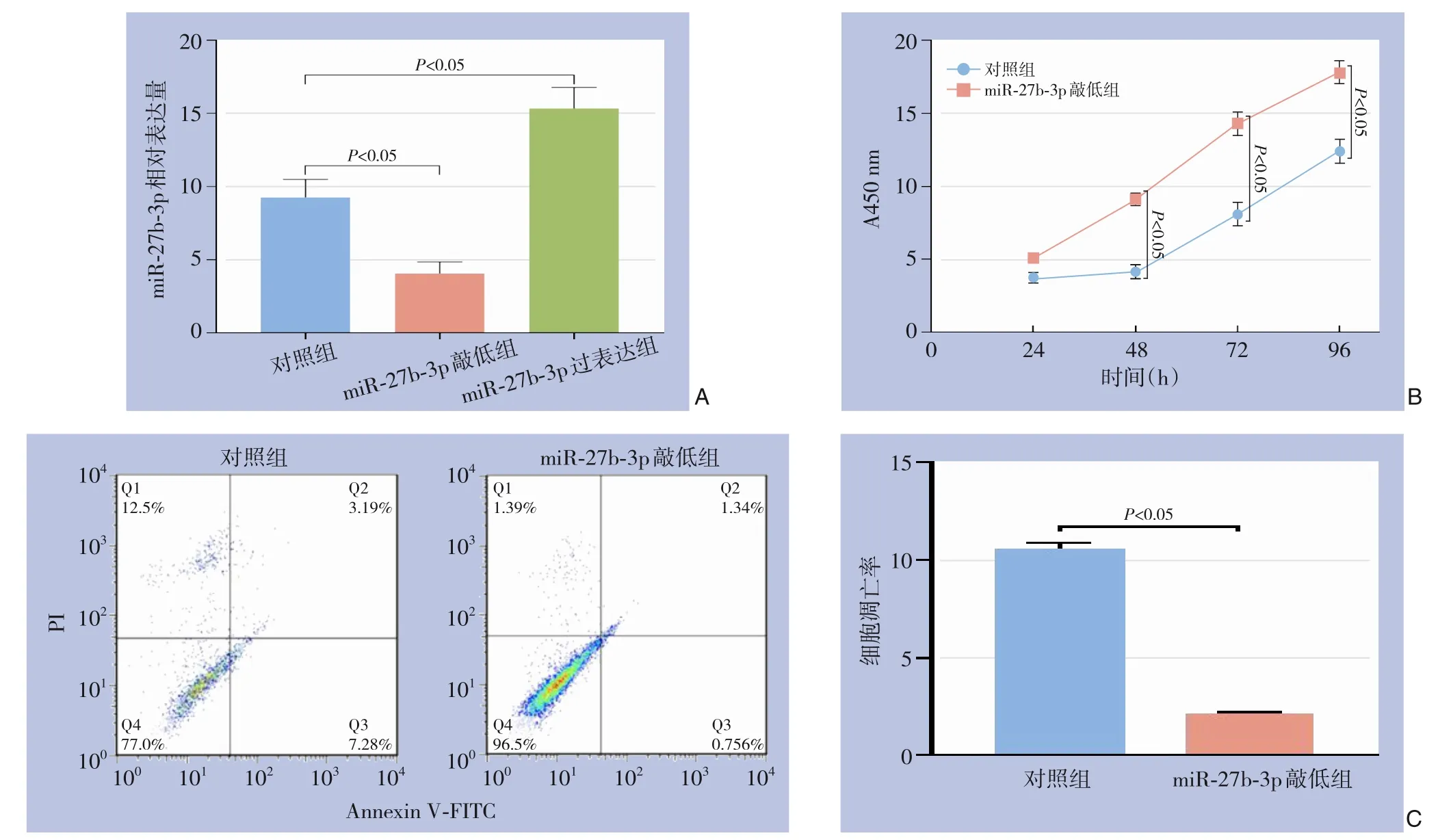
图1 miR-27b-3p敲低对VSMC增殖和凋亡的影响 A:转染效率测定;B:CCK-8实验;C:细胞凋亡检测Figure 1 Effects of miR-27b-3p knockdown on proliferation and apoptosis of VSMCs A: Determination of transfection efficiency;B: CCK-8 asaay;C: Apoptosis assay
2.2 miR-27b-3p 敲低对THP-1 培养基中炎症因子和细胞基质相关蛋白表达影响
miR-27b-3p 敲低后,THP-1 培养基中促炎因子(TNF-α、IL-12)表达水平低于对照组,而THP-1 培养基中抑炎症因子(IL-4、IL-10)表达水平高于对照组(均P<0.01)(表1),上述结果提示miR-27b-3p敲低可抑制THP-1 相关炎症反应。Western blot 结果显示,miR-27b-3p 敲低后,THP-1 的MMP-9 表达水平低于对照组,而TIMP-1 表达水平高于对照组(均P<0.01)(图2)。
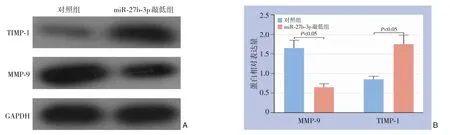
图2 TPH-1细胞中细胞基质相关蛋白表达水平检测 A:Western blot结果;B:表达量比较Figure 2 Determination of expression levels of cell matrix-related proteins in TPH-1 cells A: Western blot;B: Comparison of expression levels
表1 miR-27b-3p敲低对THP-1培养基中炎症因子的影响()Table 1 Effect of miR-27b-3p knockdown on inflammatory factors in THP-1 cell culture medium ()

表1 miR-27b-3p敲低对THP-1培养基中炎症因子的影响()Table 1 Effect of miR-27b-3p knockdown on inflammatory factors in THP-1 cell culture medium ()
2.3 miR-27b-3p直接靶基因为PTEN
查阅TargetScan 数据库发现PTEN 存在和miR-27b-3p 结合位点,是其潜在的靶基因(图3A),双萤光素酶报告基因结果显示,同对照组相比,miR-27b-3p 过表达可明显减少野生型PTEN 质粒萤光素酶活性(P<0.05),但对突变型PTEN 质粒萤光素酶活性几乎无影响(P>0.05)(图3B)。
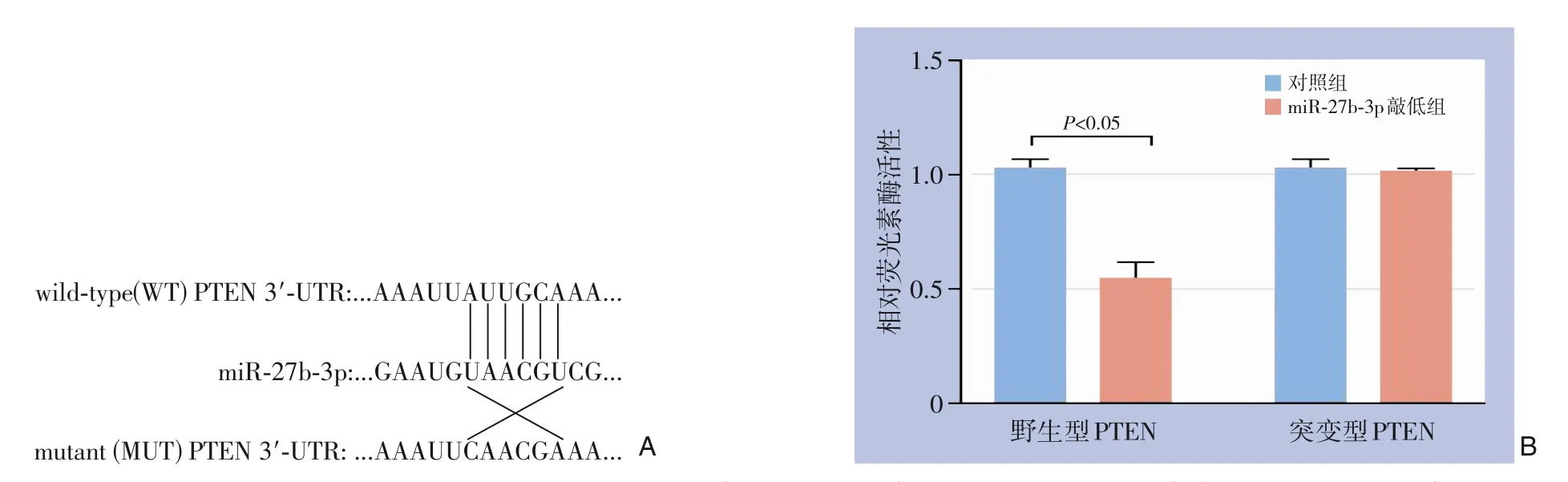
图3 miR-27b-3p靶基因分析 A:TargetScan数据库发现PTEN存在和miR-27b-3p结合位点;B:双萤光素酶实验Figure 3 Analysis of the target gene of miR-27b-3p A: TargetScan database showing the existence of the binding site for PTEN and miR-27b-3p;B: Double luciferase assay
2.4 miR-27b-3p过表达下调VSMC中PTEN表达
Western blot 结果显示,miR-27b-3p 过表达可下调 VSMC 中 PTEN 蛋白表达水平(P<0.05)(图4)。

图4 miR-27b-3p过表达对VSMC中PTEN表达的影响Figure 4 Effect of miR-27b-3p overexpression on PTEN expression in VSMCs
2.5 miR-27b-3p 靶向PTEN 抑制VSMC 增殖并诱导凋亡
CCK-8 结果显示,PTEN 过表达可显著促进VSMC 增殖活力(P<0.05);拯救实验显示,PTEN和miR-27b-3p 同时过表达后可减缓由PTEN 过表达对VSMC 增殖的促进作用及对细胞凋亡的抑制作用(P<0.05)(图5)。
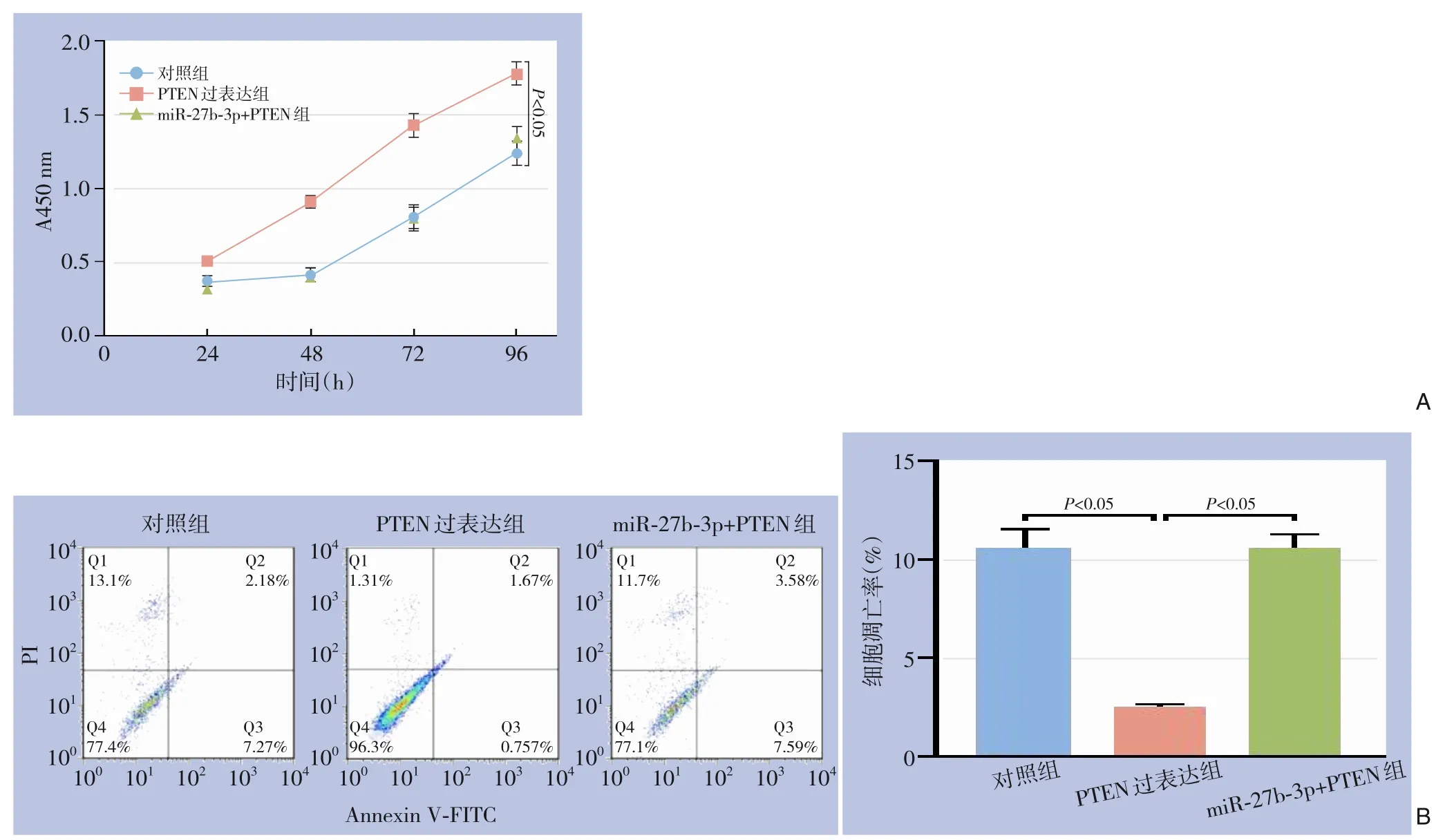
图5 miR-27b-3p与PTEN对VSMC增殖与凋亡的影响 A:CCK-8;B:细胞凋亡检测Figure 5 Effects of miR-27b-3p and PTEN on proliferation and apoptosis in VSMCs A: CCK-8;B: Apoptosis assay
2.6 miR-27b-3p 靶向PTEN 下 调THP-1 炎症反应和细胞基质蛋白表达
ELISA 结果显示,PTEN 过表达后,与对照组相比,THP-1 培养基中TNF-α、IL-12 表达水平下调(P<0.05),同时IL-4、IL-10 浓度上调(P<0.05);miR-27b-3p 和PTEN 同时过表达后促炎因子(TNF-α、IL-12)和抗炎因子(IL-4、IL-10)表达水平与对照组相比差异无统计学意义(P>0.05)(表2)。Western blot 检测显示,PTEN 过表达可抑制MMP-9蛋白表达和促进TIMP-1 蛋白表达(P<0.05),miR-27b-3p 和PTEN 同时过表达后MMP-9 蛋白和TIMP-1 表达水平与对照组相比差异无统计学意义(P>0.05)(图6)。

图6 细胞基质蛋白表达检测Figure 6 Determination of cell matrix protein expressions
表2 TPH-1细胞培养基中炎症因子水平比较()Table 2 Comparison of inflammatory factors in TPH-1 cell culture medium ()

表2 TPH-1细胞培养基中炎症因子水平比较()Table 2 Comparison of inflammatory factors in TPH-1 cell culture medium ()
注:1)与对照组比较,P<0.05Notes:1) P<0.05 vs.control group
3 讨论
AAA 是一种严重危及中老年人健康的大血管扩张性疾病,患者常缺乏及时治疗导致病死率高,手术和腔内治疗是主要治疗手段[11-13]。AAA 发病机制尚未完全阐明,血流动力学、血管周围脂肪组织、外膜成纤维细胞、血管滋养管重塑、管腔内血栓和巨噬细胞亚型分布异常是其常见发病机制[14]。近年来研究[15]显示miRNA 参与调控AAA 发生、发展过程,可作为AAA 潜在的诊断和监测进展的分子标志物。
本研究首先基于文献[10]报道在AAA 病变组织中miR-27b-3p 表达水平上调,通过在体外培养的VSMC 中敲低miR-27b-3p 后发现miR-27b-3p 敲低后可增加VSMC 增殖,并抑制其凋亡,可发挥抑制和延缓AAA 进展作用。miR-27b-3p 在心脑血管疾病中发挥重要作用,缺血性休克患者循环中表达水平增加,其高表达来源于损伤的血管内皮细胞和平滑肌细胞,而抑制miR-27b-3p 表达后血管内皮细胞凋亡比例降低,可作为缺血性休克炎症和内皮细胞损伤的诊断分子标志物[16]。在小鼠心肌纤维化模型中miR-27b-3p 高表达可促进小鼠心肌细胞纤维化和心肌细胞凋亡[17]。文献[18]报道在体外培养的经过不同浓度的血管紧张素Ⅱ诱导的VSMC 中,其miR-199a-5p 表达水平显著上调,且下调miR-199a-5p后,VSMC 增殖能力增强,而凋亡比例减少,显示其延缓AAA 的发生和进展。最新研究[7]显示miR-194在小鼠的腹主动脉瘤模型中表达水平显著下调,同时上调miR-194 表达后可抑制VSMC 增殖和促进凋亡,增加小鼠AAA 模型中病变动脉中巨噬细胞数目、加重炎症反应和氧化应激程度,提示其高表达可促进AAA 的发生和进展。文献[19]报道miR-155过表达可抑制VSMC 增殖并诱导VSMC 凋亡而促进动脉瘤的进展,上述结果均提示miRNA 可作为VSMC 增殖和凋亡功能的重要调节分子,参与AAA发生和进展。
本研究发现敲低miR-27b-3p 表达后,在体外培养THP-1 培养基中,促炎因子(TNF-α、IL-12)表达水平较对照组降低,而抑炎因子(IL-4、IL-10)表达水平较对照组增加,提示在THP-1 中敲低miR-27b-3p 后可抑制细胞炎症反应。文献[20]报道AAA 发病机制与单核巨噬细胞聚集和慢性炎症反应密切相关,局部慢性炎症反应和氧化应激反应越严重,越易导致动脉壁内血栓形成,越易导致AAA 快速进展和破裂。文献[21]报道miR-146 在AAA小鼠模型中高表达,miR-146 敲低表达后,THP-1中炎症反应降低,主要表现为促炎因子(TNF-α、IFN-γ)表达水平降低,而抑炎因子(IL-10)表达水平增加。在小鼠AAA 模型[22]中,miR-155 敲低表达后,THP-1 中促炎因子(TNF-α、IL-6 和IL-1β)显著降低,提示miR-155 可能通过抑制单核巨噬细胞炎症反应减轻和延缓血管紧张素Ⅱ所致的小鼠AAA 的形成和进展。本研究通过Western blot 实验发现,敲低miR-27b-3p 表达后,THP-1 表达的MMP9 表达水平降低,而TIMP-1 表达水平增加,前者在AAA 形成和进展中发挥破坏动脉壁细胞外基质和动脉壁弹力纤维作用,进而加速AAA 形成,而后者功能正好相反,对AAA 发挥保护作用[23]。
本研究进一步探讨miR-27b-3p 调控VSMC 和THP-1 参与AAA 发生和进展机制,生物信息学分析发现PTEN 是miR-27b-3p 的靶基因,通过双荧光素报告基因实验证实,在VSMC 中miR-27b-3p 过表达可抑制PTEN 表达,上述实验证实miR-27b-3p 直接调控PTEN 表达。PTEN 是常见的抑癌基因,其在多种癌症中表达水平降低[24]。文献[25]报道miR-17-5p 可促进血管内皮前体细胞增殖,从而加速对动脉瘤血管修复功能,其分子机制是miR-17-5p 通过调节PTEN/PI3K/AKT/VEGFA 信号通路而实现。文献[26]报道对过氧化氢诱导的平滑肌细胞损伤,miR-26a 可通过激活PTEN/AKT/mTOR 信号通路而发挥抑制作用。文献[27]报道miR-29a-3p 可通过靶向调节PTEN 而调节AAA 发生和进展。
本研究探讨miR-27b-3p 靶向PTEN 后是否可影响VSMC 和THP-1 功能。VSMC 中过表达PTEN 后细胞增殖能力增强、凋亡减少。在THP-1 中过表达PTEN 后,炎症严重程度减轻、TIMP-1 表达增加,而MMP-9 表达降低,上述结果均显示PTEN 表达增加,可以延缓和抑制AAA 发生和进展。尽管如此,当PTEN 和miR-27b-3p 同时过表达时,PTEN 过表达对AAA 发生和进展的延缓和抑制作用则可被miR-27b-3p 过表达所抵消。上述结果证实miR-27b-3p靶向PTEN 后影响VSMC 和THP-1 功能而参与AAA发生和进展。文献[28]报道在小鼠动脉瘤模型中miR-126 高表达可通过激活PI3K/AKT/mTOR 信号通路抑制VSMC 增殖并促进凋亡。文献[29]报道在小鼠腹主动脉瘤模型中,miR-144-3p 表达可发挥启动子作用,促进p21 基因表达而诱导VSMC 凋亡,抑制其增殖活性和迁移能力,促进THP-1 炎症作用,从而加速AAA 动脉瘤发生和进展。
值得一提的是,由于本研究是基于前人在对组织行基因芯片测序及大数据分析得出miR-27b-3p在AAA 组织和血清中miR-27b-3p 表达显著上调,故本研究未在AAA 组织及血清中重复检测miR-27b-3p的表达水平,而直接在前人的基础上在VSMC 和THP-1 中行功能和机制研究,不可避免地存在一定的不足,后期值得进一步在组织标本中验证。另外,miR-27b-3p 在动物实验中的作用也值得进一步研究。
综上所述,本研究发现miR-27b-3p 可通过靶向PTEN 参与调节VSMC 和THP-1 功能,miR-27b-3p 表达抑制或PTEN 过表达均可促进VSMC 增殖和抑制凋亡、抑制THP-1 炎症反应和细胞外基质蛋白表达,可能参与延缓AAA 发生和进展。miR-27b-3p/TPEN 分子轴可能在AAA 发生和进展过程发挥重要作用,可能成为AAA 潜在治疗靶点。
利益冲突:所有作者均声明不存在利益冲突。
