血浆脂蛋白相关磷脂酶A2水平与颅内动脉粥样硬化斑块稳定风险的HR-MRI研究
2023-01-29严雪娇张东升张小玲
严雪娇,高 洁,张东升,张小玲,汤 敏
(陕西省人民医院MRI室,陕西 西安 710068)
动脉粥样硬化(atherosclerosis ,AS)已被证实是一种炎症免疫调节性疾病[1]。脂蛋白相关磷脂酶A2(lipoprotein-associated phospholipase A2,Lp-PLA2)水平升高与血管内皮功能障碍、斑块炎症等不稳定因素有关[2]。研究显示Lp-PLA2水平升高增加亚洲人群缺血性不良事件风险[3],但Lp-PLA2水平异常与发生不良事件患者潜在的斑块特征相关的报道较少[4-5],这可能与颅内动脉斑块成像技术的局限性有关。近年来,快速发展的高分辨率核磁共振成像(high resolution nuclear magnetic resonance imaging,HR-MRI)能够分析斑块成分,被认为是目前唯一可对颅内血管壁进行成像的无创性检查技术[6]。斑块强化[7]、斑块表面不规则[8]以及T1高信号[9]是反映斑块不稳定相对直观可靠的特征。因此,本研究旨在评估lp-PLA2浓度水平与颅内斑块稳定特征的相关性。
1 资 料 与 方 法
1.1一般资料 选取2017年8月—2021年9月本院HR-MRI数据库中急性缺血性卒中患者130例。纳入标准:①患者于发病2周内行HR-MRI检查;②狭窄动脉为大脑动脉(middle crebrol artery,MCA)/基底沙胺(basilar arrtery,BA),并且可见HR-MRI上确诊的MCA/BA斑块;③患者有一种或多种传统的动脉粥样硬化危险因素,包括糖尿病、高血脂症、高血压、吸烟。排除标准:①并存>50%同侧颅外颈内动脉狭窄及双侧椎动脉狭窄;②患有非动脉粥样硬化性血管病,例如夹层,血管炎,烟雾病及可逆性脑血管收缩综合征;③患有较高的心脏栓塞危险因素,如心脏瓣膜病、心房颤动及卵圆孔未闭等;④图像质量差,无法进一步分析。纳入的研究对象分为低Lp-PLA2水平组(Lp-PLA2≤175 g/L)及高Lp-PLA2水平组(Lp-PLA2>175 g/L)。
本研究经医院伦理委员会批准。
1.2临床资料和实验室测量 在本院Hospital Information System(HIS)系统中收集患者临床资料:包括年龄、性别、身高、体重、血压、吸烟、既往卒中病史、冠心病史及用药情况。入院患者空腹6 h后进行的实验室检查包括:Lp-PLA2浓度、血脂全项、肌酐、尿酸、同型半胱氨酸及糖化血红蛋白。Lp-PLA2浓度测定:将空腹采集的静脉血样在4 ℃环境下放置30 min后,以1 500 r/min速度进行离心10 min,收集上清液,在450 nm波长的酶联免疫分析仪上使用酶联免疫吸附测定试剂盒(天津康格生物技术公司,天津)对血清Lp-PLA2浓度进行定量分析,在α=0.05检验标准下,单侧95%医学正常值为175 g/L。
1.3传统动脉粥样硬化危险因素的定义 ①肥胖:BMI=体重(kg)/身高(m2),肥胖≥28.0[10]。②高血压:平均收缩压≥140 mmHg(1 mmHg=0.133 kPa)和/或平均舒张压≥90 mmHg和/或有高血压病史或使用抗高血压药物[11]。③糖尿病:糖化血红蛋白水平>6.0%,或有糖尿病史或服用降糖药[12]。④血脂异常(总胆固醇>5.18 mmol/L,三酰甘油>1.7 mmol/L,低密度脂蛋白(low density lipoprotein,LDL)>3.37 mmol/L,正在服用降脂药的患者被诊断为血脂异常)。⑤高同型半胱氨酸血症(hyper homo cysteinemia,HHcy):同型半胱氨酸水平>15 μmol/L。⑥当前吸烟。
1.4MRI数据采集 所有患者均接受常规弥散加权成像。使用Philips Ingenia 3.0 T MRI扫描仪(Ingenia,Philips Medical Systems,荷兰)上32通道的头颈联合线圈进行数据采集。HR-MRI协议包括:包括3D-TOF MRA、3D T1WI-VISTA,T1WI-VISTA+C。3D-TOF MRA获取血管狭窄信息,详细参数为:TR/TE=20 ms/3.6 ms,FOV=180×180 mm2,矩阵=256×256,层厚=5 mm;3D T1WI-VISTA垂直及平行狭窄管腔,获取斑块长轴及短轴位,详细扫描参数为:TR/TE=700 ms/14 ms,FOV=80×80 mm2,矩阵=256×256,层厚=2 mm,层间距=0.5 mm;在静脉内给予0.1 mmol/kg造影剂(Gadobutrol Injection,Bayer Pharma AG)后,延迟约5 min重复T1WI-VISTA序列获得增强图像;全序列扫描时间约25 min。
1.5斑块数据后处理分析 动脉粥样硬化斑块在HR-MRI图像上多表现为管壁偏心性增厚(动脉管壁最薄处直径不足最厚处直径的50%);纳入分析的斑块包括中风同一血管区域唯一或存在多个斑块时最狭窄的病变[13]。利用半自动化软件计算管腔狭窄程度,管腔狭窄率=(1-狭窄管腔面积/参考管腔面积)×100%,参考管腔为正常管腔((狭窄部位的远端或近端)),由2名影像科主治医师(具有6年影像诊断经验及4年影像诊断经验)分别测量,结果取平均值,用以后续分析。RadiAnt DICOM Viewer用于观察斑块特征,包括:①斑块强化,以对比扫描前序列作为参考,对比扫描后的T1WI VISTA图像未见高信号为无强化,显示斑块内高信号影为强化;②斑块表面是否规则,规则为斑块表面光滑/不规则为斑块表面边缘的不连续性;③T1WI高信号,T1WI序列上斑块内检测到高信号,所有的图均在结果中提现,方法中不得体现被认为可能为斑块内出血(intraplaque hemorrhage,IPH)阳性,高信号定义为高于临近肌信号[14]。由上述2名影像科主治医师在不知晓临床资料的情况下进行独立阅片,结合多平面重组影像及横断面影像进行分析,对意见不一致的病例,另一位高级神经放射科医生(具有10年影像诊断经验的TM)重新评估图像并协助达成共识。
1.6再现性评估 管腔狭窄率及斑块特征的读者间一致性是使用基于2个读者的所有检测的病变的重复数据评估。
1.7统计学方法 应用SPSS 24.0统计软件分析数据。计量资料比较采用t检验和秩和检验。计数资料比较采用χ2检验。Spearman相关分析检验Lp-PLA2水平与血脂指标的相关性;为评估颅内动脉斑块的风险,构建二分类Logistic回归模型分析Lp-PLA2与颅内斑块稳定特征的关系。P<0.05为差异有统计学意义。
2 结 果
2.1人群特征 在排除动脉瘤7例,血管炎5例,夹层7例及烟雾病3例,颈内动脉及椎动脉管腔闭塞13例,卵圆孔未闭7例,HR-MRI图像上有明显运动伪影5例患者后,最终,纳入本研究患者83例,其中男性63例,女性20例,平均年龄(58.94±13.10)岁,其中大脑中动脉M1段狭窄者49例,基底动脉狭窄者34例,纳入斑块83例。本研究人群平均Lp-PLA2浓度水平为167.12(67.00)。高Lp-PLA2组血清总胆固醇及LDL水平高于低Lp-PLA2组,血脂异常患病率高于低Lp-PLA2组,差异有统计学意义(P<0.05)。见表1。Lp-PLA2浓度水平与LDL-C(r=0.310,P=0.004)及血脂异常(r=0.230,P=0.037)呈正相关。
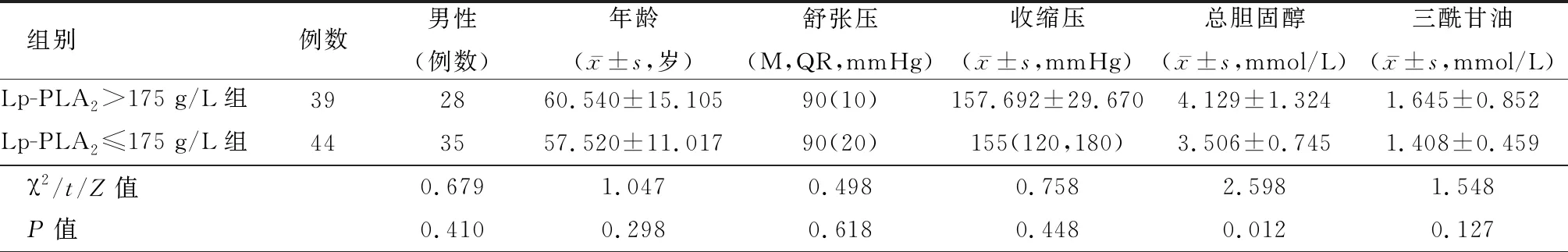
表1 不同浓度人血浆脂蛋白相关磷脂酶A2水平患者临床资料比较

表1 (续)
2.2Lp-PLA2水平与颅内斑块特征间的关系 高Lp-PLA2组中患者斑块强化患病率高于低Lp-PLA2组(P=0.017),组间狭窄率、T1WI高信号及斑块表面不规则差异无统计学意义(P>0.05)。斑块特征显示见图1,图2 ,见表2 。在二分类回归模型中,自变量(LDL ,TC 及血脂异常)间的多重共线性诊断显示方差膨胀因子(variance inflation factor,VIF)分别为3.036,2.476,1.419。以Lp-PLA2>175 g/L=1,Lp-PLA2≤175 g/L=0为因变量,以年龄(连续变量)、性别(赋值女性=0,男性=1)、LDL-C(连续变量)、TC(连续变量)及血脂异常(赋值正常=,0,异常=1)为自变量,回归结果显示Lp-PLA2水平升高与斑块强化(P=0.005,OR=21.347 , 95%CI:2.6~177.6)及斑块表面不规则(P=0.044,OR=3.0,95%CI:1.0~8.7)独立相关。见表3。
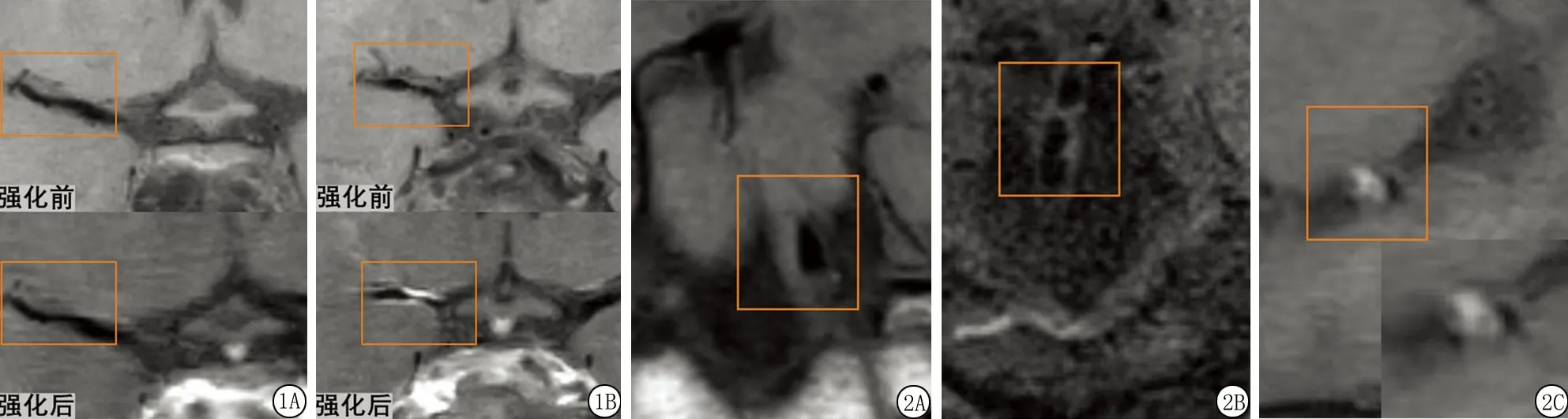
图1 斑块强化
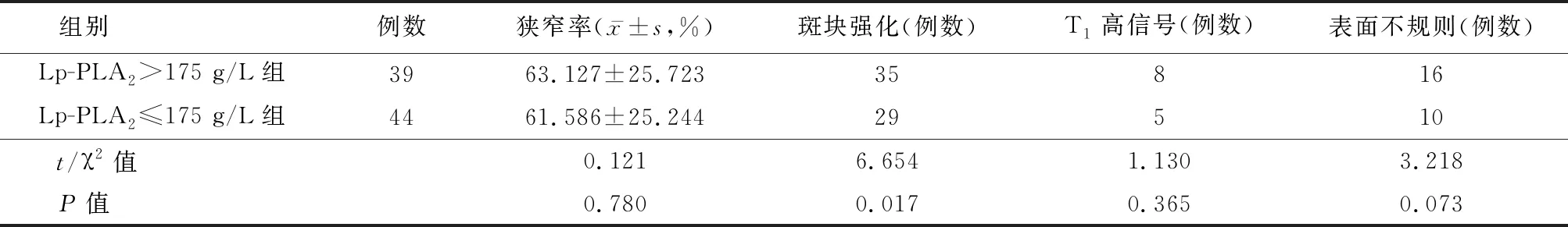
表2 不同浓度人血浆脂蛋白相关磷脂酶A2水平患者斑块特征比较
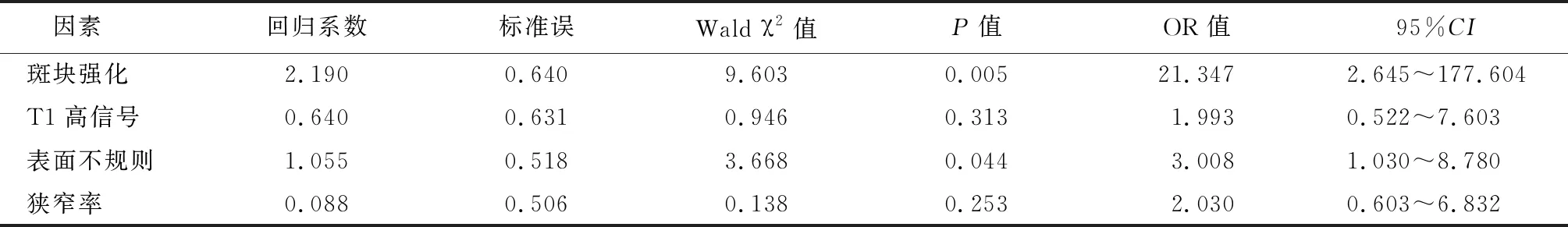
表3 Lp-PLA2与颅内斑块特征的的关系
2.3HR-MRI测量数据再现性 在识别斑块强化(Kappa=0.901,P<0.001)和存在T1高信号(Kappa=0.915,P<0.001)和斑块表面不规则(Kappa=0.729,P<0.001)以及测量狭窄程度[ICC=0.873,95%CI:(0.812,0.915),P<0.001]方面,存在极好的一致性。
3 讨 论
本研究显示,Lp-PLA2浓度水平升高与颅内斑块强化及斑块表面不规则有关。通过对冠状动脉节段进行Lp-PLA2免疫定位,Kolodgie等[15]研究显示相对于早期斑块,晚期斑块如破裂斑块及易损斑块的坏死核心及周围巨噬细胞中有较强的Lp-PLA2表达。Mannheim等[16]在颈动脉上研究显示了类似的现象,提示Lp-PLA2可能具有促进斑块不稳定的潜在作用。本研究评估了颅内斑块的几个特征,其中斑块强化可能是评价颅内斑块稳定性最有价值的影像学指标[17]。本研究中高Lp-PLA2浓度水平与颅内斑块强化独立相关。先前的研究表明Lp-PLA2浓度或活性水平升高可促进颈动脉斑块形成和内膜中层增厚[4,18],是颈动脉斑块进展和不稳定的高风险因素[5]。选择性抑制Lp-PLA2可以减少晚期冠状动脉粥样硬化的发展,表现为斑块面积减小及斑块内坏死核心显著减少,提示抑制Lp-PLA2可以降低斑块不稳定的表型特征[19]。本研究进一步加强现有证据,并将这一联系扩展至颅内动脉,即Lp-PLA2浓度水平可能是提示颅内斑块稳定的可变危险指标。从生化上讲,Lp-PLA2可水解氧化LDL(oxidized LDL,ox-LDL)并产生溶血磷脂酰胆碱(lysophosphatidylcholine,lyso-PC)和氧化游离脂肪酸(oxidized free fatty acid,ox-FFA)2种产物,被认为具有促炎和促动脉粥样硬化斑块生成作用[20],其中lyso-PC被认为与动脉内膜炎症反应的发展有关[15],并通过与炎症相关的途径参与动脉粥样硬化的形成并加重斑块不稳定[21]。一项关于磁共振血管壁成像与组织病理学验证的荟萃研究表明颅内斑块强化可能与斑块内脉管血管(vasa vasorum,VV)形成有关[22]。VV可能在动脉粥样硬化炎症过程中起着导管作用,将炎症细胞输送到斑块中,进而促进动脉粥样硬化的发展[23]。斑块强化可能反映血管壁炎症的程度[24]。因此,颅内斑块强化有可能为斑块炎症和Lp-PLA2浓度水平之间的关系提供新的思路。
值得注意的是,本组高Lp-PLA2浓度水平人群中,LDL及TC水平相应升高,且Lp-PLA2与LDL及血脂异常呈正相关,与Lin等[25]的研究结果相似。有意思的是,当LDL、TC及血脂异常进入模型(Model 2)后,观察到Lp-PLA2水平与斑块强化间的相关性增加。进一步,高Lp-PLA2水平与斑块表面不规则的相关性显示边缘显著性,提示血脂因素引起Lp-PLA2水平升高与斑块稳定之间的风险增加。LDL充当了循环中Lp-PLA2的功能性储存库。如前所述,Lp-PLA2主要与循环中的LDL结合,并以ox-LDL为水解活性底物生成致炎物质。随着LDL浓度增加,Lp-PLA2活性相应增加[26],引起更多的炎性因子释放,刺激斑块内巨噬细胞产生更多的Lp-PLA2,使斑块不稳定性明显增加。
高Lp-PLA2水平与缺血性中风和心肌梗死风险的持续增加有关[27]。近期一项荟萃分析表明Lp-PLA2质量或活性增加可作为缺血性中风的独立危险因素[3]。本研究显示Lp-PLA2浓度水平升高可能在一定程度上影响斑块稳定性。因此,Lp-PLA2水平升高与大动脉粥样硬化风险机制有关,这可能能够解释卒中风险增加的原因。
本研究存在一定局限性。首先,本研究仅测量了Lp-PLA2的质量而不是活性。虽然有研究指出Lp-PLA2活性可能更加敏感,但是Lp-PLA2的质量与其活性相关,近期多个荟萃分析显示在缺血性卒中发生或是复发的相关风险研究中,Lp-PLA2的质量和活性起到了相似的作用[28];其次,本研究纳入的人群中有一小部分患者有既往脑梗死病史,无法获取当时患者颅内斑块情况(如斑块是否强化)。关于斑块强化持续时间的研究指出脑梗死患者斑块强化在7个月后强化程度降低[29],本研究,不能除外对于斑块强化的评估可能整体有所高估;最后,本研究为回顾性横断面研究,患者来自单一医疗机构,并且样本量相对较小,经过多项排除标准,最终纳入的被试可能存在一定的选择偏倚。由于回顾性研究,无法确定Lp-PLA2与斑块强化间的因果关系,还需后期相关的前瞻性研究进行验证。
综上所述,Lp-PLA2水平升高与颅内动脉粥样硬化斑块稳定性具有一定的相关性,是颅内动脉粥样硬化的危险因素,并在一定程度上受LDL、TC等因素的影响。
