二甲双胍通过miR-194-5p/RBM6通路抑制肝细胞癌细胞的恶性细胞表型的机制研究
2023-01-29王义刚汪俊州唐荣幸
王义刚,黄 婷,汪俊州,唐荣幸,栗 粟,熊 勇*
(1.四川省攀枝花市中心医院肝胆外科,四川 攀枝花 617000;2.四川省攀枝花市中心医院内分泌科,四川 攀枝花 617000)
肝细胞癌(hepatocellular carcinoma,HCC)是癌症相关死亡的常见原因,全球病死率不断上升[1]。二甲双胍是一种双胍衍生物,是治疗2型糖尿病最常用的一线降血糖药物之一。流行病学研究表明,二甲双胍治疗可降低某些癌症的风险,如肝癌、乳腺癌、结直肠癌和胰腺癌[2-3]。但是其发挥抗癌作用的分子机制仍未清楚。微小RNA(miRNA)在肿瘤中的功能得到国内外很多研究的认可。二甲双胍在抗癌效应中涉及选择性调节miRNA功能的发生[4]。miR-194-5p在HCC中失调,参与HCC的发展[5-6],但是miR-194-5p是否与二甲双胍的抗癌作用有关系,尚未可知。本研究拟以HepG2细胞为研究对象,观察二甲双胍、miR-194-5p对HepG2细胞增殖、凋亡的调控,揭示二甲双胍与miR-194-5p/RBM6通路之间的关系。
1 资料与方法
1.1一般资料 选择2018年1月—2019年5月期间在攀枝花市中心院肝胆外科实施HCC手术治疗的患者100例,取患者癌组织及对应的癌旁组织,-80 ℃保存。随机将患者分为2组,每组50例,设为对照组、试验组。对照组患者术后,口服安慰剂,试验组术后口服500 mg二甲双胍缓释片,连续给药3个月。患者术后服用二甲双胍前,停药后均外周静脉采血,取血清,-20 ℃保存。所有患者均签署知情同意书。
1.2纳入标准与排除标准 纳入标准:①按美国国立综合癌症网络(2017版)推荐标准诊断为HCC的病例;②无严重心脑血管疾病,无严重肝肾功能损害,无放化疗禁忌证,预计生存期>3个月;③年龄≥18周岁;④能独立完成本研究调查问卷者,试验前经充分告知;⑤自愿配合医务人员的指导和安排。排除标准: ①本研究经过医院伦理委员会批准通过。不愿意参加临床试验或不能签署《知情同意书》;②有严重合并症不能耐受手术等有创治疗的病例; ③选择肝移植、靶向药物或合并远处转移的病例;④合并糖尿病的病例; ⑤配合性差,不愿意听从医务人员的指导和安排;初产妇伴有精神障碍 或沟通障碍者;本研究药物过敏者;⑥术后病理证实为非肝细胞肝癌的患者。
1.3材料 正常肝细胞LO2、肝细胞癌细胞HepG2购自中国上海科学研究院细胞库;Taqman MicroRNA反转录试剂盒购自美国Thermo Fisher scientific公司;膜联蛋白-V(Annexin V)-藻红蛋白(Phycoerythrin,PE)/ 7-氨基放线菌素(7-AAD)荧光双染细胞凋亡检测试剂盒购自武汉普诺赛生命科技有限公司;3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐[3-(4,5)-dimethylthiahiazo(-z-y1)-3,5-di-phenytetrazoliumromide,MTT]细胞增殖及细胞毒性检测试剂盒、双荧光素酶报告基因检测试剂盒购自上海碧云天生物科技有限公司;5-乙炔基-2′-脱氧尿苷(5-ethynyl-2′ -deoxyuridine,EdU)细胞增殖检测试剂盒购自广州锐博生物技术有限公司;Lipofectamine 3000购自美国Invitrogen公司;antagomiRNA、antagomiR-194-5p、pcDNA 3.1、pcDNA 3.1-RBM6、si-NC、si-RBM6及引物的设计合成均由上海吉玛基因完成。
1.4方法
1.4.1细胞培养 LO2、HepG2细胞使用改良洛克式培养基(dulbecco′s modified eagle medium,DMEM)培养基培养,该培养基中含有10%的胎牛血清和1%的青链霉素。将细胞置于37 ℃、5%二氧化碳(carbon dioxide,CO2)的饱和湿度恒温细胞培养箱中培养。每2 d更换一次培养基。
1.4.2分组与处理 将antagomiRNA、antagomiR-194-5p 转染HepG2细胞并孵育24 h,用于降低HepG2细胞中miR-194-5p的表达。pcDNA 3.1、pcDNA 3.1-RBM6转染HepG2细胞,用于升高HepG2细胞RBM6的表达。si-NC、si-RBM6分别联合二甲双胍、antagomiR-194-5p转染HepG2细胞,用于观察降低RBM6对二甲双胍、antagomiR-194-5p处理的HepG2细胞增殖、凋亡的影响。将细胞稀释至2×105个细胞/孔,接种在新的培养皿中,并培养至70%~80%的融合度。使用Lipofectamine 3000将antagomiRNA、antagomiR-194-5p、pcDNA 3.1、pcDNA 3.1-RBM6、二甲双胍+si-NC、二甲双胍+si-RBM6、antagomiR-194-5p+si-NC、antagomiR-194-5p+si-RBM6与HepG2共转染8 h,换新培养基继续样48 h。
1.4.3荧光定量逆转录聚合酶链式反应(fluorescence quantitative reverse transcriptase polymerase chain reaction,RT-qPCR)实验检测血清、组织或细胞中miR-194-5p、RBM6的表达 用总RNA抽提试剂(total RNA extraction reagent,TRIzol)提取细胞总RNA。通过Taqman MicroRNA反转录试剂盒将RNA反转录为互补DNA(cDNA)。在cDNA合成过程中使用新的靶向特异性颈环引物进行qPCR,确定miR-194-5p的表达。miR-194-5p的参照标准为小核RNA(U6)。RBM6的检测为:对提取的总RNA进行逆转录、扩增和qPCR,通过熔融曲线对PCR产物RBM6进行定量。2-△△Ct计算结果。RBM6的参照标准为β-actin。所用引物的核苷酸序列如下:miR-194-5p(5-CTAGTACCTAGAGGAACCTTTGAAGACT-GTTACAGCTCAGCA-3′,5′-AGCTTGCTGAGC-TGTAACAGTCTTCAAAGGTTCCTCTAGGTA-3′,退火温度61.2 ℃);U6(正向5′-GTGGACCGC-ACAAGCTCGCT-3′,5′-TTGTTGAACGGCAC-TGTGTATAGCA-3′,退火温度59.8 ℃);RBM6(正向5′-TGGAGTATGTATCAAGCCTGGA-3′,5′-ATGAAC AGGAAGATCGGTGCC-3′,退火温度61.0 ℃);β-actin(正向5′GGTGTCTGTGAG-AGGACGAGGAG-3′,反向5′-TCTGGTGATGG-AGCCTCTTACTGG-3′,退火温度60.0 ℃)。
1.4.4MTT法检测细胞活性 胰酶消化培养48 h的细胞,接种96孔培养板,每孔1 000个细胞。再向孔中添加终浓度为500 ng/L的MTT溶液,37 ℃下孵育4 h。再加入100 μL/孔的二甲基亚砜(Dimethyl sulfoxide,DMSO),使晶体完全溶解后,在酶标仪上以490 nm波长的光度读取吸光值(A490)。每个样本做3个复孔,实验重复3次。
1.4.5EdU染色检测细胞增殖 准备1 000倍稀释的EdU溶液,配置成50 μmol/L EdU培养基,取100 μL与细胞用培养2 h,标记细胞。将细胞接种在96孔板,并用4%多聚甲醛溶液固定,用0.5%Triton X-100孵育10 min。1×Apollo染色液100 μL/孔,避光孵育30 min。0.5%Triton X-100渗透10 min。磷酸缓冲盐溶液 (phosphate buffered saline,PBS)冲洗,1×4′,6-二脒基-2-苯基吲哚(4′,6-diamidino-2-phenylindole,DAPI)进行核染色,避光,室温反应30 min。PBS再次冲洗,用倒置荧光显微镜观察并记录EdU阳性染色。EdU阳性率(%)=红色荧光细胞数(EdU染色)/蓝色荧光细胞数(DAPI染色)×100%。
1.4.6流式细胞术检测细胞凋亡 按照Annexin V-PE/7-AAD荧光双染细胞凋亡检测试剂盒制造商的说明书要求操作。收集细胞,用预冷PBS缓冲液洗涤2次,用500 μL的Annexin V Binding Buffer工作液重悬细胞。取5 μL的Annexin V-PE和5 μL的 7-AAD加入细胞,室温避光孵育细胞15 min,上流式细胞仪检测分析细胞凋亡。
1.4.7双荧光素酶报告基因检测细胞荧光活性 将含有3′非编码区(untranslated region,UTR)结合位点的野生型RBM6和不含有假定结合位点的突变型RBM6插入到萤火虫荧光素酶报告载体psiCHECK-2。利用Lipofectamine 3000将构建的荧光素酶报告基因载体(野生型或突变型RBM6)与agomiRNA、agomiR-194-5p、antagomiRNA、antagomiR-194-5p共转染HepG2细胞。48 h后,根据双荧光素酶报告基因检测试剂盒制造商的说明要求操作,使用双荧光素酶报告分析系统测定细胞的荧光素酶活性。
1.4.8蛋白免疫印迹(western blot,WB)实验检测细胞RBM6蛋白表达 胰酶消化并收集细胞,RIPA裂解,再超声裂解1 min。4 ℃下12 000 g离心10 min,获得总蛋白。采用聚氰基丙烯酸正丁酯(bicinchoninic acid,BCA)法分析样品蛋白浓度,沸水浴变性蛋白。用10%的十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate - polyacrylamide gel electrophoresis,SDS-PAGE)分离每个样品中的蛋白,然后将蛋白转移到聚偏二氟乙烯(polyvinylidene difluoride,PVDF)膜(200 mA,2 h)。室温下用5%脱脂奶粉封闭膜2 h,在4 ℃下与一抗溶液(1 500倍稀释的兔抗RBM6多抗)孵育过夜。用含吐温-20 的磷酸盐缓冲液(phosphate buffered solution,PBST)洗涤3次,PVDF膜在37 ℃下与二抗(2 000倍稀释的辣根过氧化物酶(horseradish peroxidase,HRP标记的山羊抗兔二抗)孵育2 h。蛋白质条带通过凝胶成像系统进行观察,利用Quantity One软件对各条带的灰度值进行分析。
1.5统计学方法 应用Graphpad Prism统计软件进行统计分析,并组织绘图。计量资料比较用单因素方差分析、LSD-t检验、独立样本t检验。使用K-M法绘制患者的DFS生存曲线。P<0.05为差异有统计学意义。
2 结 果
2.1二甲双胍治疗对肝癌患者血清miR-194-5p的调控及预后的影响 试验组患者2年内的DFS为92%,对照组为64%,试验组患者的2年DFS显著高于对照组(图1)。试验组、对照患者的性别、肿瘤大小差异无统计学意义,见表1。对照组、试验组患者血清miR-194-5p均显著降低。治疗后试验组患者血清miR-194-5p显著低于对照组(P<0.05)。见表2。
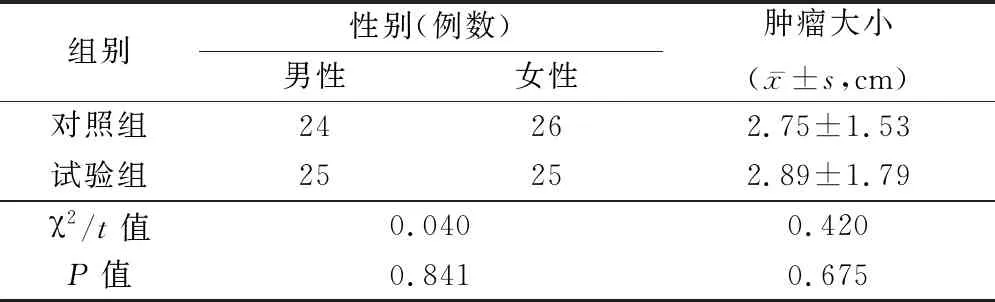
表1 2组性别、肿瘤大小比较
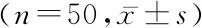
表2 肝癌患者血清miR-194-5p相对表达
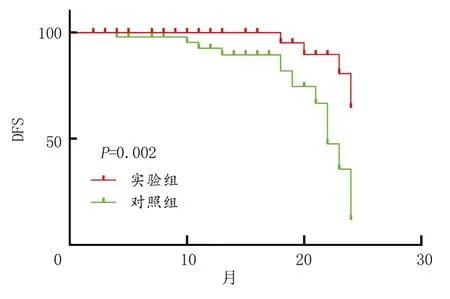
图1 肝癌患者2年DFS分析
2.2二甲双胍调控肝癌细胞中miR-194-5p的表达及细胞存活 二甲双胍组HepG2细胞miR-194-5p表达显著低于空白组,A490值、EdU阳性率均显著低于空白组,凋亡率显著高于空白组(P<0.05)。见表3。
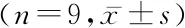
表3 二甲双胍处理的HepG2细胞增殖、凋亡情况
2.3miR-194-5p在肝癌组织、细胞中的表达 与癌旁组织或LO2细胞相比,癌组织、HepG2细胞中miR-194-5p表达显著升高(P<0.05)。见表4,5。
表4 miR-194-5p在肝癌组织中的表达
表5 miR-194-5p在细胞中的表达
2.4抑制miR-194-5p对肝癌细胞存活的影响 与antagomiRNA相比,antagomiR-194-5p HepG2细胞中miR-194-5p表达显著降低,A490值、EdU阳性率均显著降低,凋亡率显著升高(P<0.05),见表6。
表6 抑制miR-194-5p的HepG2细胞增殖、凋亡情况
2.5miR-194-5p靶向RBM6 生物信息学在线预测网站Starbase预测到RBM6的3′UTR端与miR-194-5p有连续的互补结合位点(图2A)。转染agomiR-194-5p的野生型RBM6(RBM6 3′UTR-WT)细胞的荧光活性显著降低,转染antagomiR-194-5p的RBM6 3′UTR-WT细胞的荧光活性显著升高(图2B)(P<0.05)。与agomiRNA相比,agomiR-194-5p细胞RBM6蛋白表达显著降低,与antagomiRNA相比,antagomiR-194-5p细胞RBM6蛋白表达显著升高(图2C)(P<0.05)。肝癌组织中RBM6的表达显著低于癌旁组织(图2D),癌组织中RBM6的表达与miR-194-5p之间呈显著的负相关(P<0.05)(图2E)。
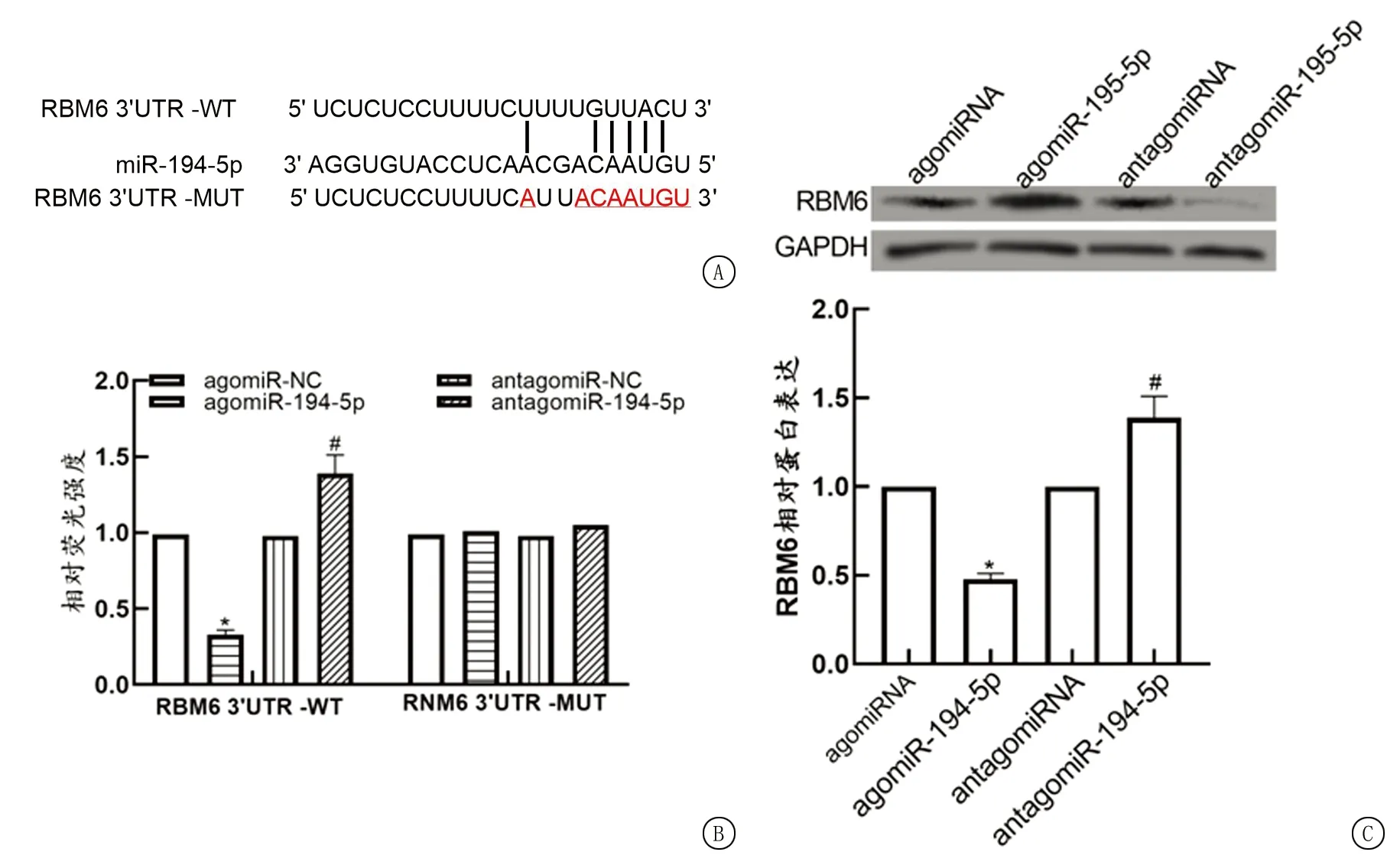
图2 miR-194-5p靶向调节RBM6
2.6过表达RBM6对肝癌细胞存活的影响 与pcDNA 3.1相比,pcDNA 3.1-RBM6细胞RBM6表达明显升高,A490值、EdU阳性率均显著降低,凋亡率显著升高(P<0.05),见表7。
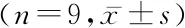
表7 过表达RBM6的HepG2细胞增殖、凋亡情况
2.7敲减RBM6对二甲双胍、抑制miR-194-5p的抗肝癌细胞存活作用的影响 与二甲双胍+si-NC相比,二甲双胍+si-RBM6细胞RBM6表达降低,A490值、EdU阳性率均显著升高,凋亡率显著降低(P<0.05)。与antagomiR-194-5p+si-NC相比,antagomiR-194-5p+si-RBM6细胞RBM6表达降低,A490值、EdU阳性率均显著升高,凋亡率显著降低(P<0.05)。见表8~9。
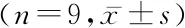
表8 敲减RBM6联合二甲双胍的HepG2细胞增殖、凋亡情况
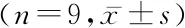
表9 敲减RBM6联合抑制miR-194-5p的HepG2细胞增殖、凋亡情况
3 讨 论
最近,多项研究表明,二甲双胍对抑制癌症(包括肝细胞癌)的生长[7-8],预防癌症复发有益[9],但是其潜在的作用机制尚未清楚。Zhao等[10]发现,二甲双胍抑制了白细胞介素22(interleukin-22,IL-22诱导小鼠肝癌模型的发生率和肿瘤的生长;体外研究显示,二甲双胍可抑制IL-22诱导的肝癌细胞增殖、迁移和侵袭,并促进细胞凋亡,IL-22的过表达使肝癌更具侵袭性,而二甲双胍在体外和体内对其作用有很大影响,二甲双胍产生这种抗癌作用的机制与蛋白激酶Hippo信号通路有关。Shen等[11]研究也报道,二甲双胍可抑制体内肝细胞癌肿瘤的生长,抑制体外癌细胞的增殖,诱导凋亡和焦亡,其潜在的作用机制为上调叉形头转录因子的O亚型3(forkhead box O-3,FOXO3)进而激活NOD样受体热蛋白结构域相关蛋白3(NOD-like receptor thermal protein domain associated protein 3,NLRP3)转录。此研究通过对100例术后的肝癌患者研究发现,术后给予二甲双胍后,患者的无病生存期(disease-free survival,DFS) 显著升高,血清miR-194-5p水平明显降低,并且体外用二甲双胍处理肝癌细胞后,癌细胞miR-194-5p也下调,并且癌细胞的增殖能力受到抑制,凋亡能力得到显著增强,这些实验结果说明了二甲双胍能够延长肝癌患者术后的2年无瘤生存期,有助于抵抗肿瘤的生存。由于二甲双胍抑制miR-194-5p表达,此研究进一步检测了肿瘤组织中miR-194-5p的表达发现,miR-194-5p在癌组织、癌细胞中表达均上调,暗示了二甲双胍可能是通过抑制miR-194-5p发挥的抗肝癌功能。
据报道,miR-194-5p通过调控RNA结合蛋白(polyrimidine tract binding protein 1,PTBP1)、FOXA1、长链非编码RNA 微小染色体维持基因3AP-反向序列(long strand non coding RNA minichromosome mantenance 3AP-inverted sequence,MCM3AP-AS1)参与HCC的发展[12-14]。Niu等[15]研究报道,miR-194在HCC中高表达并且与HCC的恶化密切相关,具有促进癌细胞的增殖、侵袭、迁移,阻滞细胞周期的作用;体内裸鼠异种移植肿瘤显示,miR-194促进肿瘤的生长,揭示了miR-194在HCC预后中的治疗价值。Fan等[16]发现,miR-194-5p在HCC中表达上调,可诱导肝癌的免疫抑制,增强程序性死亡受体的表达及功能。本研究结果显示,miR-194-5p在肝癌组织、细胞中高表达,抑制miR-194-5p明显的降低了癌细胞的增殖能力,促进癌细胞凋亡,呈现出抗癌功能。深入研究显示,miR-194-5p靶向负调控RBM6,二者在癌组织中的表达呈负相关。
RBM6在多种癌症中失调,发挥肿瘤抑制作用[17-18],但是其在HCC中的功能研究十分罕见。Ye等[19]在肝癌的研究中发现,RBM6在肝癌组织中的表达明显下调,与肿瘤大小、肿瘤分期系统(tumor node metastasis classification,TNM)分期和组织学分级密切相关,高表达组的生存率高于低表达组;体外细胞实验表明,过表达RBM6显著降低了细胞活力和侵袭能力,增强了细胞凋亡能力,揭示了RBM6的肿瘤抑制基因功能。本研究结果显示,RBM6在肝癌组织中表达下调,过表达RBM6抑制了HepG2细胞的增殖,促进凋亡,这与Ye的实验结果相一致,再次证实了RBM6在肝癌中的抑癌作用。深入研究发现,敲减RBM6削减了二甲双胍、抑制miR-194-5p对肝癌细胞的增殖抑制和凋亡促进作用。
综上所述,二甲双胍抑制肝细胞癌细胞增殖,促进凋亡,延长患者的无瘤生存期,产生这种作用的机制与抑制miR-194-5p进而上调RBM6有关,为二甲双胍在肝细胞癌治疗中的应用提供支持。
