颅底孤立性纤维性肿瘤1例
2023-01-28童程琳夏威夷赵志光
童程琳,夏威夷,赵志光
温州医科大学附属第二医院,浙江 温州 325027,1.病理科;2.骨科
孤立性纤维性肿瘤(solitary fibrous tumor, SFT)是罕见的梭形细胞间叶源性肿瘤,由KLEMPERER等[1]于1931年首次报道。SFT最常见于脏层胸膜,也有报道见于胸膜外部位,如胸壁、纵隔、腹腔和四肢深部软组织,但很少发生在中枢神经系统 (central nervous system, CNS)。据报道,大多数中枢神经系统孤立性纤维性肿瘤(central nervous system solitary fibrous tumor, CNSSFT)是基于硬脑膜的肿块,起源于矢状旁区、脑室内区和椎管[2]。现将温州医科大学附属第二医院经病理确诊的1例颅底SFT患者的临床表现、影像学改变、病理特点及治疗方案报告如下。
1 病例资料
患者,女,72岁,因“阵发性意识障碍1年余”入院。患者入院时意识障碍呈阵发性,伴胡言乱语,每次持续数秒至数分钟不等,可自行缓解,无恶心呕吐,无四肢抽搐,无发热寒战等。查体:神志清,精神软,双侧瞳孔等大等圆,直径约3 mm,对光反射灵敏;四肢活动可,肌张力正常。辅助检查:头颅MRI示前颅窝底部中线区见一大小约8.1 cm× 6.9 cm×4.2 cm巨大肿块,跨中线生长,肿块向下生长侵犯左侧额窦及筛窦,邻近额叶、双侧脑室前脚受压、推移,增强扫描明显强化,内部见小囊状及条状无强化区,病灶周围见弧形无强化影,双侧侧脑室旁前脚及双侧额叶明显受压。中线结构稍向右滑移,余脑实质未见明显异常强化;考虑神经源性肿瘤。见图1。

图1 术前影像学显示颅前窝卵圆形肿块
2021年8 月20 日全麻下行前颅底肿瘤切除术。术中见肿瘤质地较韧,颜色偏灰白,血供一般。病理结果示肿瘤灰红灰白破碎一堆,大小7 cm×6 cm× 1.5 cm,切面灰红灰白质脆实性。病理诊断:SFT(WHO II级),免疫组化染色显示S-100(-),SOX-10(-);SMA(-);Ki-67(5%+);CK(-);Dog-1(-);CD34(+);CD117(-);CgA(-);Syn(-);CD56(少量散在+);GFAP(-);EMA(-);Vim(+);PR(-);STAT6(+);Bcl-2(+);CD99(+);α-Inhibin(-);CR(-);SSTR(-)。考虑为颅底SFT,见图2和图3。临床诊断为颅内肿瘤,予以手术切除,经Demicco风险评分表评估(见表1)[9],肿瘤总评分为3分,转移复发风险较低,暂不考虑辅助治疗,住院30 d后好转出院;1年后复查MRI,未见肿瘤复发,见图4。

表1 颅内SFT Demicco风险评分表
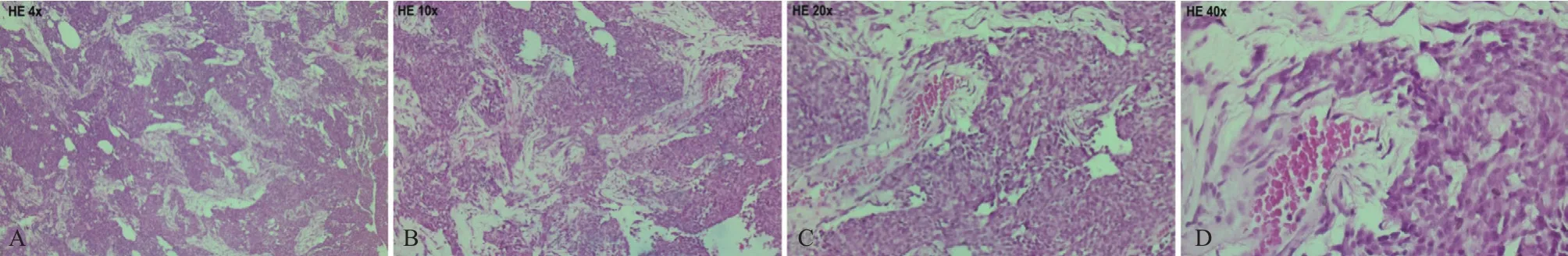
图2 光镜下肿瘤细胞组织学表现
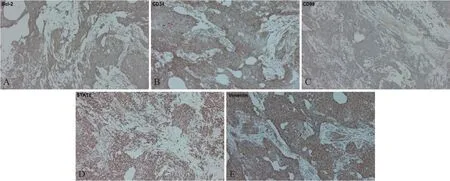
图3 肿瘤细胞免疫组化阳性指标(免疫组织化学染色,×10)
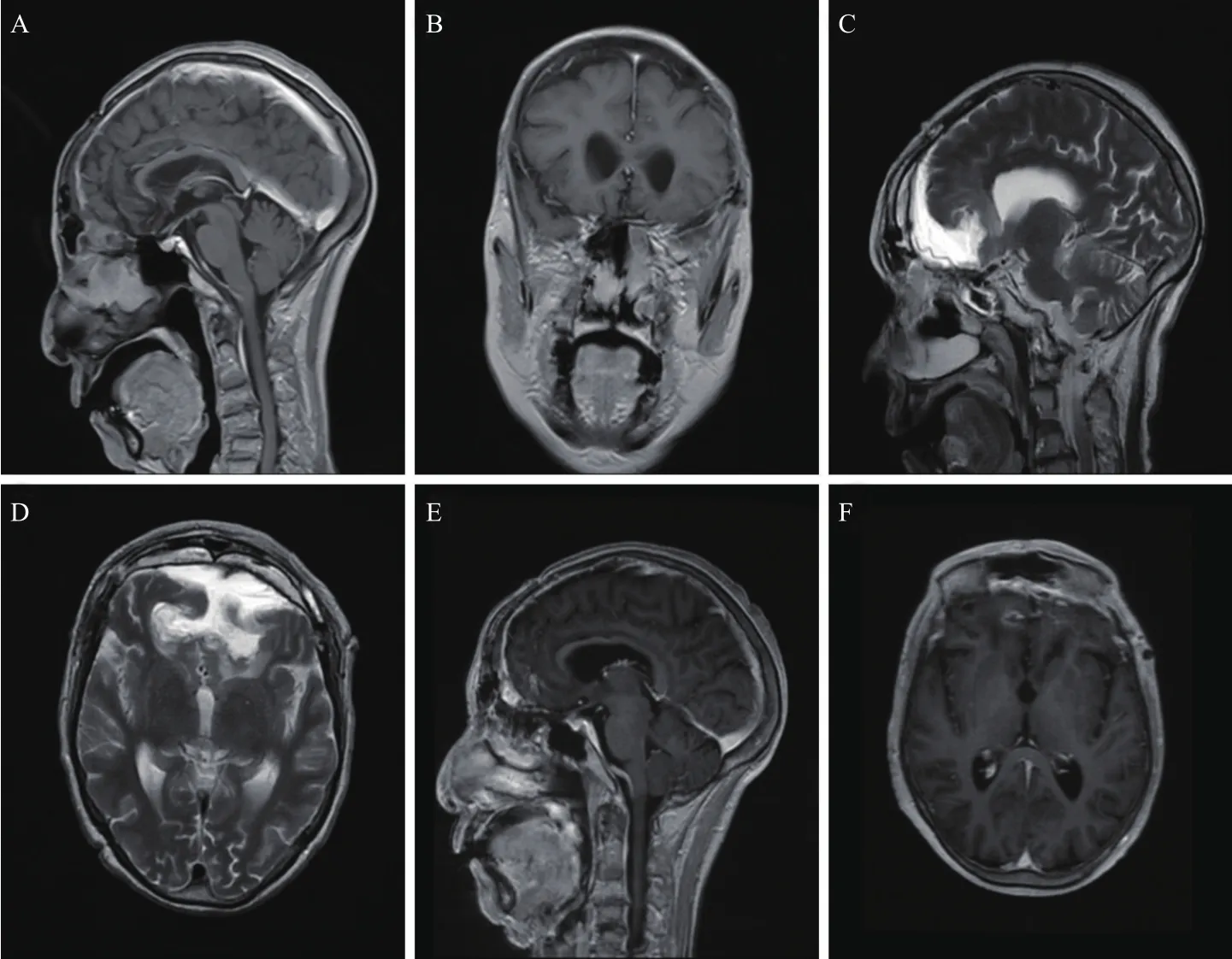
图4 术后门诊随访影像学复查显示未见肿瘤复发
2 讨论
SFT是一种罕见的梭形细胞肿瘤,起源于一种CD34阳性的树突状间叶细胞,具有向纤维母细胞、肌纤维母细胞分化的特征,生物学特征为良性或低度恶性。2007版WHO神经系统肿瘤分类将SFT和血管周细胞瘤(haemangiopericytoma, HPC)分别作为颅内间叶组织源性肿瘤的两个独立疾病[3],随着越来越多的病例被报道,发现二者组织形态学有重叠,免疫组化表达谱基本一致,且这两类肿瘤均多在12q13位点发生NAB2和STAT6基因融合,从而出现STAT6蛋白核转位表达[4]。2016版WHO神经系统肿瘤分类将颅内SFT及HPC划分为一类[5]。2020年4月发布的第5版WHO根据患者年龄、肿瘤大小、核分裂象将SFT细分为三类:良性(局部侵袭性)、未特指类型(not otherwise specified, NOS)(很少转移)和恶性。高达10%~40%局部SFT会发生复发[6]。
临床上SFT多见于成年人,无明显男女差异,任何年龄段均可发病[7]。通常无典型阳性体征,发生于深部和体积较大的肿块,可表现为副肿瘤综合 征[8],症状最多见的表现为副肿瘤性低血糖症(亦称Doege-Potter综合征),其他可表现为脂溢性角化病、杵状指、肥大性骨关节病和关节痛,以及血清β-人绒毛膜促性腺激素水平升高(最罕见)[9]。
据统计大多数颅内SFT表现为硬膜起源,常发生于小脑幕,其次是额凸、桥小脑角,病灶的最大直径平均为4.9 cm[10-12]。本例患者是第一例位于颅前窝的巨大SFT,并且肿瘤侵犯相邻的额窦、筛窦和嗅神经,造成骨折破坏和神经损伤。
影像上SFT计算机断层扫描通常显示一个边界清楚的肿块与骨骼肌组织等密度影,具有突出的血管和不均匀的对比度增强。在MRI上SFT在T1加权成像上始终表现出均匀的低至中等信号强度,在T2加权成像上表现出非均匀信号强度。由于纤维化、出血、坏死、黏液样和囊性变性或钙化,较大或恶性患者可表现为肿块不均匀密度影。
病理上孤立性纤维性肿瘤大体常表现为无包膜,或可有纤维假包膜,边界尚清,切面灰白或灰褐色,质地中等,实性;大小可从<1 cm到>30 cm不等,与肿瘤发生部位有关;体积较大者可有囊性变,恶性者可伴有坏死,质地稍软。通常由于术式原因,送检组织常破碎,因此巨检诊断时应重点描述肿瘤切面、质地是否有包膜、坏死,取材是否有代表性等帮助诊断。镜下显示肿瘤通常由大小相对一致的梭形细胞和多少不等的胶原间质或偶有黏液性基质组成,也可出现上皮样细胞[13]。本例可见镜下肿瘤细胞排列成短束状,细胞丰富区和细胞稀疏区交替排列,其中见宽大的胶原纤维。STF以镜下见较大的不规则分枝状及鹿角型扩张的薄壁血管,瘤细胞环绕血管外壁呈血管外皮瘤样排列为特征性改 变[13],但本例未见明显的特征性血管改变。肿瘤细胞胞浆稀少,核卵圆形,核仁不明显,大多核分裂象稀少(<2~3个/10 HPFs),恶性者>4个/10 HPFs。
经典的STF常表达CD34与STAT6,与经典的SFT相比,去分化型STF中CD34和STAT6的表达常常减少,从而增加了诊断的复杂性。由此可见,即便STAT6不表达,也不能排除SFT的诊断。去分化型可能过度表达p53和p16[14]。去分化SFT更多见于老年患者(中位年龄60岁),表现更具侵袭性,复发、转移和病死率更高。
治疗上首选手术完整切除,恶性程度较高者常辅以放疗。据统计良性和恶性SFT完全切除后5年生存率分别为96%和68%。这些SFT的复发率分别为2%和16%,复发时常发生恶性转化。HUANG等[9]主张将高Ki-67(>5%)作为评估中枢神经系统SFT预后不良的参数。但本案例Ki-67为5%,术后1年肿瘤未有复发征象,因此在临床中可能更倾向通过Demicco风险评分表来评估SFT转移复发风险,就像本次报道的患者,经评估转移复发风险较小,因此行颅内肿瘤全切手术后,暂不考虑辅助治疗。另有研究表明,抗血管生成疗法在晚期/转移性环境中显示出对SFT的显著疗效。然而,还需要进一步的临床研究来验证。虽然免疫疗法的治疗方案有待商榷,但可考虑使用抗血管生成药物作为一线治疗[6]。
