二维斑点追踪技术预测急性心肌梗死患者PCI后1年发生主要心脏不良事件的价值
2023-01-28翁文超杨道玲陈静婉
翁文超,杨道玲,陈静婉
金华市中心医院 浙江大学医学院附属金华医院 超声医学科,浙江 金华 321000
早期血运重建是恢复急性心肌梗死(acute myocardial infarction, AMI)受损心肌的靶向冠状动脉血液灌注、延缓心室重构、降低心血管不良事件和提升患者生活质量的主要途径。心脏超声是评估AMI患者经皮冠状动脉介入(percutaneous coronary intervention, PCI)治疗后生存情况的重要工具[1]。斑点追踪技术(speckle tracking imaging, STI)能够更加精准、客观地评估心脏各节段的运动情况,尤其在评估心肌缺血和心肌梗死后左心室节段矛盾性运动方面有重要价值,是反映心脏重塑和心脏功能的重要依据[2-3]。心室各节段的不协调运动是导致主要心脏不良事件(major adverse cardiac events, MACE)的结构基础[4],我们推测STI在预测MACE方面有重要价值。目前,关于STI在评估AMI患者短期生存预后方面的报道还较少。本研究将阐述二维超声STI技术和定量参数对AMI患者PCI后1年MACE发生风险的预测价值,为推广STI技术和寻找高效预后评估指标提供依据。
1 对象和方法
1.1 对象 随机选择2019年1月至2021年7月在金华市中心医院接受PCI治疗的91例AMI患者。纳入标准:①年龄>18岁;②根据国际指南和中国专家共识进行AMI诊断和PCI操作[5];③超声图像清晰可保存;④患者签署研究同意书,研究需要的各项资料无丢失。排除标准:①重症心肌炎、心肌病;②恶性肿瘤、严重肝肾功能障碍;③既往PCI或者外科手术病史;④出院后不能遵医嘱用药和随访;⑤同时参与其他研究。本研究经我院医学伦理委员会批准,批件号: (2018)伦审第(258)号。
1.2 研究方法 所有患者由我院经验丰富的心内科医师和护理团队完成PCI,围术期根据指南推荐进行药物管理,所有患者均康复出院。术后1周接受常规超声和二维STI检查,出院后随访1年,记录MACE[6](主要包括再发心绞痛、再发心梗、新发心衰、恶性心律失常、再次住院以及心源性猝死)以及发生时间。
统计资料包括患者性别、年龄、基础疾病、AMI类型[ST段提高型心肌梗死(ST segment elevation myocardial infarction, STEMI)和非ST段提高型心肌梗死(non-ST-elevation myocardial infarction, NSTEMI)]、PCI方式(急诊和择期)、靶病变狭窄率、植入支架数目和长度和术后用药,常规超声检测左心室射血分数(left ventricular ejection fraction, LVEF)、左心室舒张末内径(left ventricular end diastolic diameter,LVEDd)和左室舒张末容积(left ventricular end diastolic volume, LVEDV)、左室收缩末内径(left ventricular end systolic diameter, LVESd)和左室收缩末容积(left ventricular end systolic volume, LVESV),STI参数包括整体纵向应变(global longitudinal strain, GLS)、整体径向应变(global radial strain, GRS)和整体圆周应变(global circumferential strain, GCS),血生化包括脑利钠肽前体(N-terminal pro-brain natriuretic peptide, pro-BNP)、肌钙蛋白I(troponin I, cTnI)和肌酸激酶同工酶(creatine kinase isoenzyme,CK-MB)。
1.3 超声检查 应用GE Vivid E95型彩色超声诊断仪,配有二维M5Sc探头。指导患者左侧卧位,同步连接12导联心电图,固定胸骨旁切面测量超声参数,双平面Simpon法计算LVEF值。至少连续采集3个心动周期的左室心尖四腔、两腔、三腔切面以及短轴二尖瓣水平、乳头肌和心尖切面,保持相同的帧频(40~92帧/s)和图像深度,嘱患者呼气末时屏气,存储图像进行脱机分析。使用EchoPAC插件,在舒张末期手动描记心内膜边界,跟踪自动获得应变曲线。手动分析应变-时间曲线[7],软件自动生成STI参数。排除不合格的心肌节段,如果不合格节段多于3个则不计算整体应变值。超声检查和分析由2名经验丰富的专科医师独立完成,取3个心动周期的平均值作为最终结果。典型病例GLS、GRS和GCS测量界面图见图1。
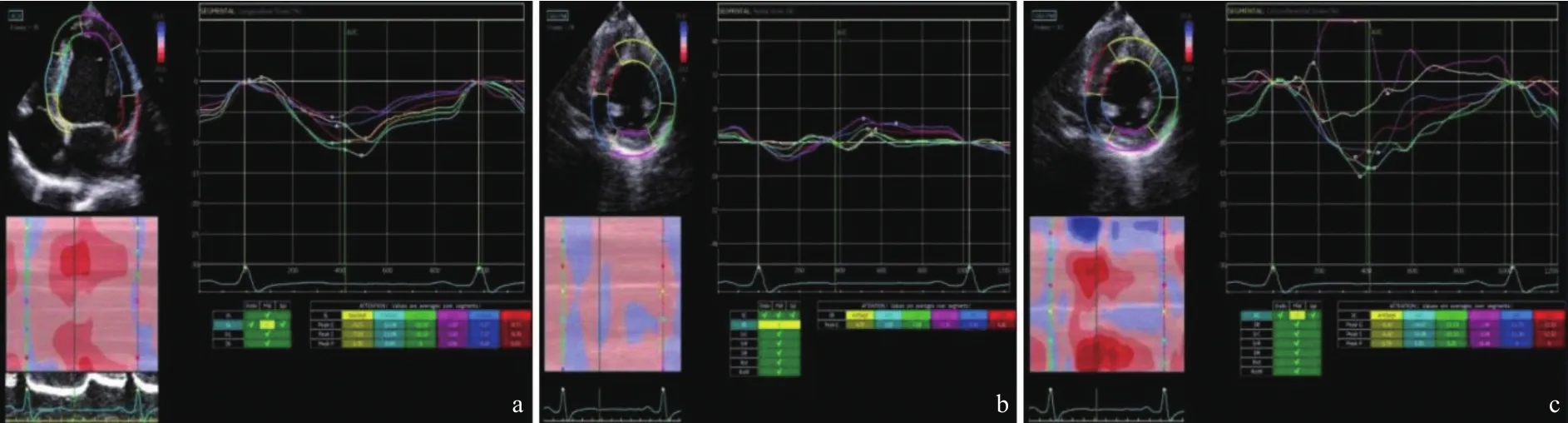
图1 65岁AMI患者PCI后采用STI测量参数图
重复性检测:随机挑选10例患者分别由2名超声科医师独立检测GLS、GRS和GCS,计算观察者间的一致性;同1例患者间隔1个月由同1名检查者再次测量GLS、GRS和GCS,计算观察者内的一致性;结果以组内相关系数(intro-group correlation coefficient, ICC)表示。
1.4 统计学处理方法 采用SPSS20.0软件进行统计学分析。正态分布计量资料以±s表示,两组间比较采用独立样本t检验,计数资料以例数或百分比表示,比较采用χ2检验;多因素Logistic回归模型筛选危险因素,采用逐步后退法;受试者工作特征(receiver operating characteristic, ROC)曲线计算曲线下面积(area under the curve, AUC)、敏感度和特异度;Kaplan-Meier生存曲线绘制累积MACE发生率,采用log-rank χ2检验进行组间比较。P<0.05为差异有统计学意义。
2 结果
2.1 两组患者一般资料比较 随访共18例(19.78%) 发生MACE,发生时间为出院后37.5(12~46)周。91例患者分为MACE组和无MACE组,两组性别、年龄、AMI类型、PCI方式、靶病变狭窄率、植入支架数目和长度、术后用药等比较差异均无统计学意义(P>0.05)。见表1。

表1 两组患者一般临床资料的比较
2.2 两组超声指标和血生化的比较 MACE组术后1周LVEF显著低于无MACE组,血清pro-BNP显著升高(P<0.05);但两组LVEDd、LVEDV、LVESd、LVESV、血清cTnI和CK-MB比较差异均无统计学意义(P>0.05)。MACE组STI参数GLS、GRS和GCS均显著低于无MACE组(P<0.05)。见表2。
表2 两组超声指标和血生化的比较(±s)
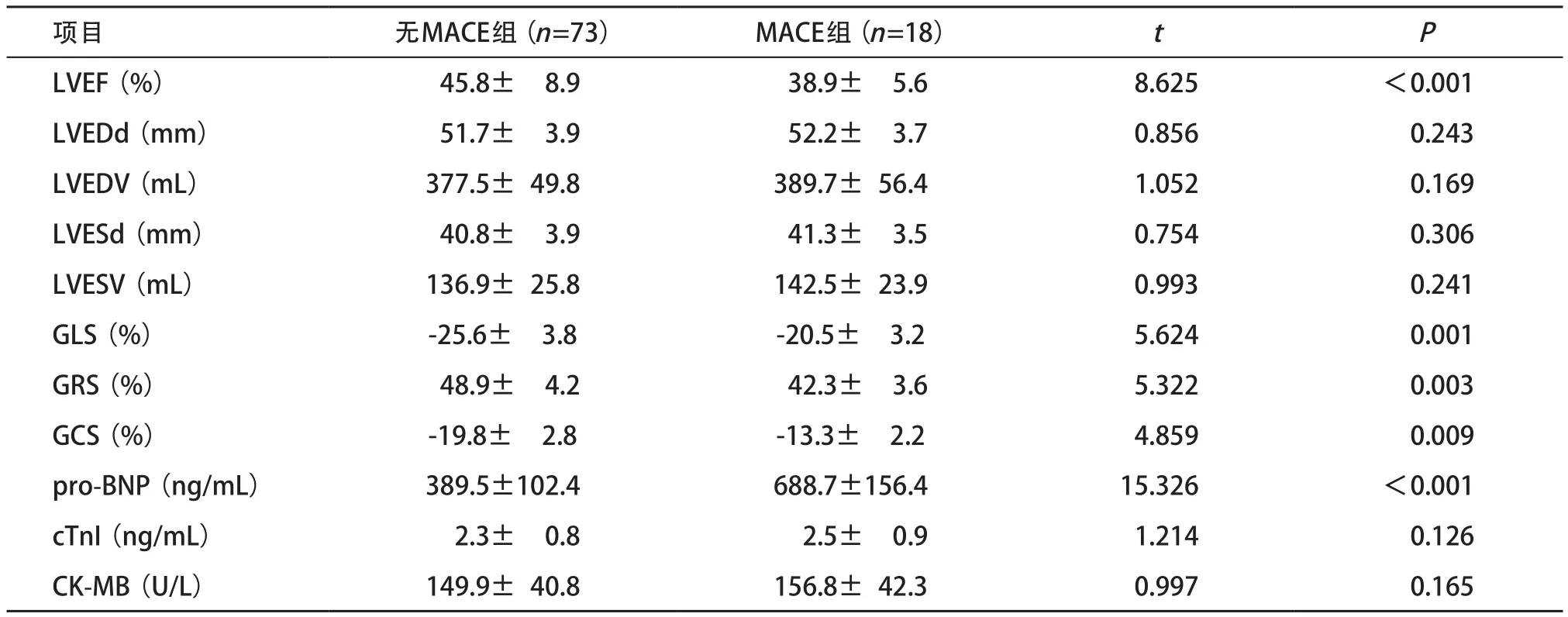
表2 两组超声指标和血生化的比较(±s)
项目 无MACE组(n=73) MACE组(n=18) t P LVEF(%) 45.8± 8.9 38.9± 5.6 8.625 <0.001 LVEDd(mm) 51.7± 3.9 52.2± 3.7 0.856 0.243 LVEDV(mL) 377.5± 49.8 389.7± 56.4 1.052 0.169 LVESd(mm) 40.8± 3.9 41.3± 3.5 0.754 0.306 LVESV(mL) 136.9± 25.8 142.5± 23.9 0.993 0.241 GLS(%) -25.6± 3.8 -20.5± 3.2 5.624 0.001 GRS(%) 48.9± 4.2 42.3± 3.6 5.322 0.003 GCS(%) -19.8± 2.8 -13.3± 2.2 4.859 0.009 pro-BNP(ng/mL) 389.5±102.4 688.7±156.4 15.326 <0.001 cTnI(ng/mL) 2.3± 0.8 2.5± 0.9 1.214 0.126 CK-MB(U/L) 149.9± 40.8 156.8± 42.3 0.997 0.165
2.3 MACE发生的危险因素Logistic回归分析 将上述资料作为自变量,MACE(无=0,有=1)作为因变量纳入多因素Logistic回归模型,自变量赋值情况见表3。分析显示,年龄≥70岁、LVEF≤40%、pro-BNP≥500 ng/mL、GLS≥-22%、GRS≤44%和GCS≥ -16%均是MACE的危险因素(P<0.05)。见表4。
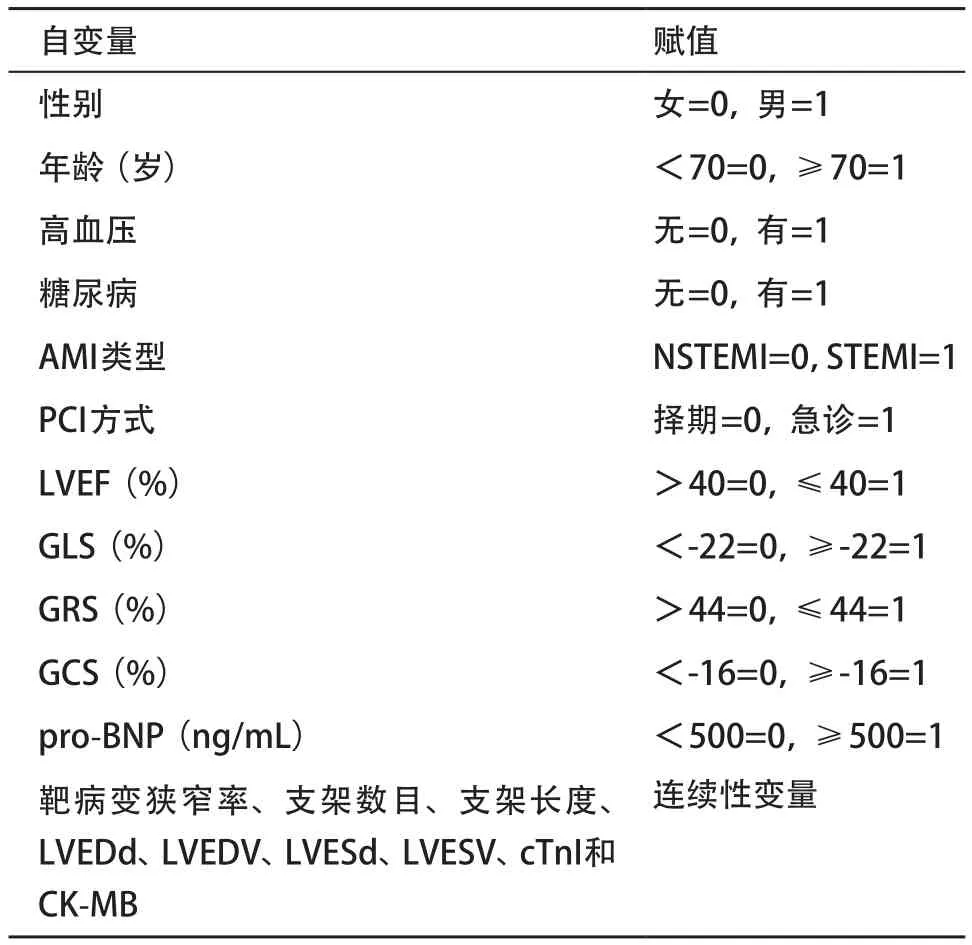
表3 自变量赋值

表4 MACE发生的危险因素Logistic回归分析
2.4 GLS、GRS和GCS预测MACE发生的ROC分析 ROC显示,GLS、GRS和GCS预测MACE发生的AUC分别为0.842、0.803和0.756。见表5和图1。
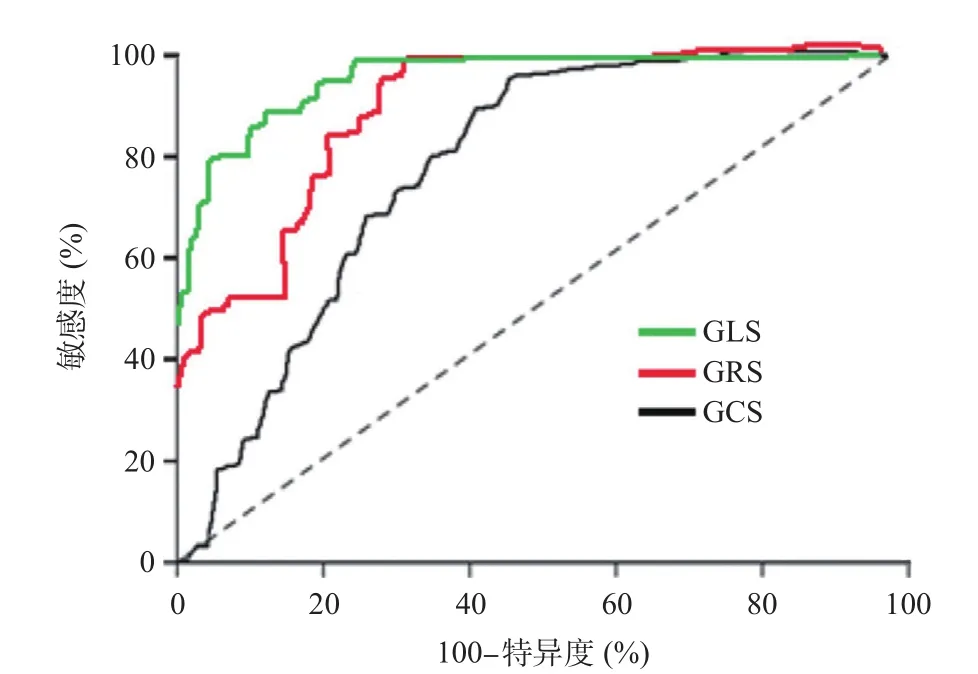
图1 GLS、GRS和GCS预测MACE发生的ROC曲线
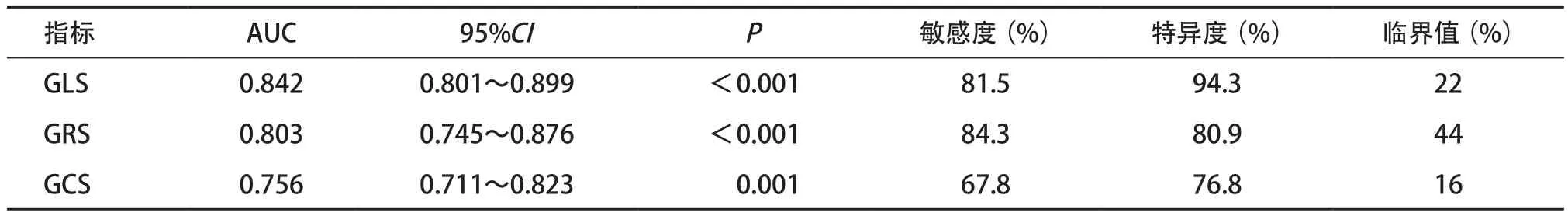
表5 GLS、GRS和GCS预测MACE发生的ROC曲线分析
2.5 GLS、GRS和GCS分层与累积MACE发生率的关系 Kaplan-Meier生存曲线显示,GLS≥-22%患者累积MACE发生率显著高于GLS<-22%患者,GRS≤44%患者累积MACE发生率显著高于GRS>44%患者,GCS≥-16%患者累积MACE发生率显著高于GCS<-16%患者,差异均有统计学意义(P<0.05)。见表6和图2。

图2 GLS、GRS和GCS分层与累积MACE发生率的Kaplan-Meier生存曲线

表6 GLS、GRS和GCS分层与累积MACE发生率的关系
2.6 GLS、GRS和GCS的重复性检验 经计算,GLS、GRS和GCS的观察者间和内的ICC值均较高,见表7。
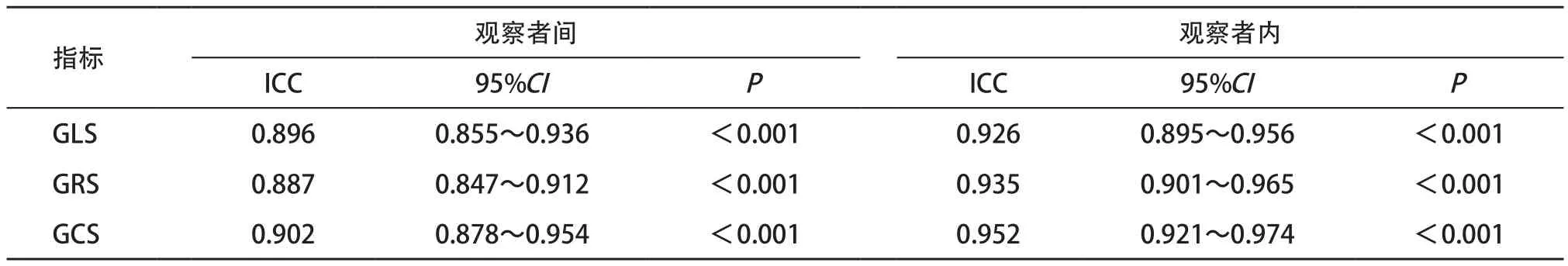
表7 GLS、GRS和GCS的重复性检验
3 讨论
AMI仍然是全球发病率和死亡率的主要原因之一,左心室重构是进展性心力衰竭的重要病理生理学机制[8]。本研究显示,1年MACE发生率为19.78%,发生中位时间37.5周。MACE直接反映了PCI效果和患者预后,降低MACE发生风险是AMI患者康复预后的关键。深入探讨影响MACE发生的关键因素并筛选敏感性预测指标是临床的重要课题。MACE组LVEF显著低于无MACE组,血清pro-BNP显著升高;但两组LVEDd、LVEDV、LVESd、LVESV、血清cTnI和CK-MB比较差异无统计学意义。提示,术后LVEF越低,pro-BNP越高往往提示MACE发生风险增加。
MACE组GLS、GRS和GCS显著低于无MACE组,提示STI参数降低与MACE发生密切相关。二维STI的优点是不受检查体位、脏器切面和角度的限制,患者体型和呼吸运动对检查精准度的干扰也大大下降,显著降低了对超声检查医师临床经验和图像分析能力的依赖度,结果的客观性和稳定性大大提升[9]。BASTAWY等[10]对首次AMI患者PCI后随访6个月发现,左室重构组LVESd和LVESV均显著增加,而LVEF显著降低;收缩期峰值GLS显著升高,最佳临界值>-12.5(敏感度87%,特异度85%),扭转显著降低,最佳临界值<9.5°(敏感度91%,特异度85%)。左室重构的独立预测因素有基线室壁运动评分指数>1.8、基线LVEF<40%、GLS>-12.5%、左室扭转<9.5°、CK-MB>500 U/L,基线TIMI血栓分级>4和总缺血时间。本研究则进一步探讨了二维STI在预测AMI患者PCI后随访1年MACE发生中的应用价值。
本研究发现年龄≥70岁、LVEF≤40%、pro-BNP ≥500 ng/mL、GLS≥-22%、GRS≤44%和GCS≥-16%均是MACE发生的独立危险因素。TAO等[11]应用三维STI评估了前壁AMI患者自发再灌注(spontaneous reperfusion, SR)对心肌应变的影响,发现SR组LVEF和左室三维应变指数均显著高于非SR组;随访1年后,SR组LVEDd显著低于非SR组,LVEF和左室三维应变指数显著高于非SR组。GLS、GRS、GCS和LVEF之间存在良好的相关性(r值分别为-0.620、-0.674和0.723,P<0.001),认为3D-STI可准确评估心肌梗死后心室重构的进程。本研究采用ROC曲线分析显示,GLS、GRS和GCS预测MACE发生的AUC分别为0.842、0.803和0.756,临界值分别为22%、44%和16%,敏感度和特异度均较好。GRABKA等[12]对40例前壁首次STEMI患者中位随访3.4年的结果发现,15例(37.5%)患者在随访3个月后证实出现左心室反向重构,肌钙蛋白降低、ST段抬高总和、最大ST段抬高幅度、左室壁运动评分指数和前壁GLS下降是反向重构的独立预测因子。但是,反向重建组无事件生存率无明显改善。最后,本研究根据GLS、GRS和GCS的临界值进行亚组比较发现,GLS≥-22%患者累积MACE发生率显著高于GLS<-22%患者,GRS≤44%患者累积MACE发生率显著高于GRS>44%患者,GCS≥-16%患者累积MACE发生率显著高于GCS<-16%患者。再次证实,STI参数在预测AMI患者MACE发生方面有重要潜力[13]。
综上所述,除了常规指标年龄、LVEF和pro-BNP,二维超声STI参数GLS、GRS和GCS对预测AMI患者PCI后1年发生MACE也有较好的应用价值。
