丁酸盐对糖尿病肾病小鼠肾损伤的保护作用及机制
2023-01-28叶凯丽黄诗琴胡婷赵艳玲
叶凯丽,黄诗琴,胡婷,赵艳玲
温州医科大学附属第二医院 肾内科,浙江 温州 325027
糖尿病肾病(diabetic nephropathy, DN)是糖尿病最常见的死亡原因及常见的微血管并发症,目前普遍认为慢性炎症、氧化应激、糖脂代谢紊乱是DN进展的最主要因素[1-2]。研究表明[3-4]DN小鼠与正常小鼠相比肠道菌群结构存在显著差异,并出现不同程度的能量代谢异常,YANG等[5]认为肠道微生物代谢物可作为一种特殊的信号分子通过肠道屏 障-肠黏膜进入血液循环而影响机体重要器官的功能,包括心、脑、肾等器官,其中短链脂肪酸尤为重要。丁酸盐是一种重要短链脂肪酸,它可通过肠道屏障进入血液循环影响肠外器官的功能,如调控胰岛素敏感性、抗炎、抗氧化等[6-7]。目前,越来越多的研究表明肠道菌群可以通过其代谢产物影响肾脏疾病的发生发展。本研究以db/db小鼠为研究对象,从GLP-1R/AMPK途径来探讨肠道菌群代谢物丁酸盐对2型DN小鼠肾脏的保护作用及其机制。
1 材料和方法
1.1 主要仪器及试剂 罗氏血糖仪购自德国Roche Diagnostics GmbH公司,丁酸钠购自上海Macklin公司(CAS号:156-54-7),苏木精-伊红(HE)染色试剂盒、过碘酸-希夫(PAS)染色试剂盒均购自北京索莱宝生物科技有限公司,尿素氮(blood urea nitrogen, BUN)、血肌酐(serum creatinine, SCr)、甘油三酯(triglyceride, TG)、血清总胆固醇(total cholesterol, TC)试剂盒购自南京建成生物工程研究所,白细胞介素-6(interleukin-6, IL-6)酶联免疫吸附检测试剂盒购自江苏酶免实业有限公司;尿微量白蛋白、尿肌酐酶联免疫吸附检测试剂盒购自上海抚生实业有限公司。Phospho-AMPKα(Thr172)Rabbit mAb(#2535)、AMPKα Rabbit mAb(#5831)抗体购自美国Cell Signaling Technology公司;胰高血糖素样肽(glucagon-like peptide-1, GLP-1)受体(GLP-1R)抗体(ab218532)购自英国Abcam公司。
1.2 实验动物 24只13周龄SPF级雄性db/db小鼠,体质量(45±7)g,10只同周龄雄性db/m小鼠,体质量(27±2)g,均购自常州卡文斯实验动物有限公司,实验动物许可证号:SCXK(苏)2016-0010,动物质量合格证号:202118368。所有实验小鼠饲养于温州医科大学实验动物中心SPF级实验动物房,温度(22 ℃±2 ℃),相对湿度(55%±10%),光照/黑暗周期为12 h,小鼠可自由饮水和进食,普通饲料喂养,定期更换垫料。该研究通过温州医科大学动物伦理委员会的批准(wydw2021-0336)。
1.3 实验分组 实验前所有小鼠适应性喂养2周,尾静脉采血测定空腹血糖(fasting blood glucose, FBG)(禁食6 h),连续3 d测得小鼠空腹血糖≥16.7 mmol/L即认为模型复制成功。将db/db小鼠随机分为3组:糖尿病肾病组(DN组)、丁酸钠500 mg·kg-1·d-1组(NaB1组)和丁酸钠 1 000 mg·kg-1·d-1组(NaB2组),选取同周龄的10只雄性db/m小鼠为空白对照组(NC组)。根据之前研究,丁酸钠的灌胃剂量和给药时间在此基础上确 定[6-8]。DN组和NC组各10只,NaB1和NaB2组各7只。
1.4 药物制备及给药 按500 mg·kg-1及1 000 mg·kg-1剂量精密称取丁酸钠粉末溶于适量无菌0.9%氯化钠溶液中,在振荡器中震荡至完全溶解,用0.22 μm微孔滤膜抽滤,现配现用,避光保存。NaB1组和NaB2组小鼠每日予0.3 mL丁酸钠溶液灌胃,DN组和NC组小鼠予等体积的0.9%氯化钠溶液灌胃,每天1次,灌胃持续8周后处死小鼠。
1.5 实验取材及测定 实验结束前24 h,小鼠禁食不禁水,收集24 h尿液后处死,留取小鼠尿液标本低温高速离心后取上清液于-80 ℃保存。摘除小鼠眼球取血,室温静置2 h后离心取上清液,用于生化分析;小鼠心脏灌流后取肾组织,部分进行石蜡包埋用于HE、PAS染色,部分组织-80 ℃冷冻保存用于Western blot检测和RT-qPCR实验。
1.6 小鼠一般情况、体质量及肾脏质量 实验过程中观察各组小鼠的精神状态、饮食饮水量、尿量、行为学变化等情况,每两周监测小鼠体质量变化并计算平均值,绘制各组小鼠体质量变化的趋势图;去除小鼠肾脏包膜后称量小鼠肾脏质量,并计算肾肥大指数(肾肥大指数=肾质量/体质量×100%)。
1.7 小鼠血糖及尿白蛋白肌酐比值(urine albumin creatine ratio, UACR)测定 罗氏血糖仪检测各组小鼠给药前(0w)及灌胃8周后尾静脉空腹血糖浓度,并绘制血糖柱形图;收集小鼠24 h尿液,4 ℃离心取上清液。按照制造商的说明,分别用尿微量白蛋白试剂盒、尿肌酐试剂盒检测小鼠尿白蛋白、尿肌酐水平,并计算尿白蛋白和肌酐的比值,即UACR=尿白蛋白/尿肌酐。
1.8 小鼠血液生化分析及肾组织IL-6浓度测定 眼 球取血后分离血清,使用相应试剂盒检测血清样本中的BUN、SCr、TG、TC、谷丙转氨酶(alanine aminotransferase, ALT)、谷草转氨酶(aspartate aminotransferase, AST)水平。分别取30 mg肾组织加入到200 μL PBS溶液里面,充分匀浆后离心收集上清液,用BCA蛋白浓度测定试剂盒测定上清液总蛋白水平;同时按照ELISA试剂盒的说明测定肾组织中的IL-6水平,绘制标准曲线并求得上清液IL-6水平,组织上清液IL-6水平=IL-6数值/相应蛋白浓度。
1.9 Western blot检测 取适量肾组织在含有磷酸酶及蛋白酶抑制剂混合物的RIPA裂解缓冲液中剪碎后匀浆,离心提取蛋白上清液,置于-80 ℃冷冻保存。按BCA蛋白定量试剂盒说明方法操作并绘制标准蛋白曲线,依据样本OD值计算出样本蛋白浓度并配制蛋白体系。SDS-PAGE电泳分离样品[每个样品取等量蛋白上样(40 μg)],转移至PVDF膜,用5% BSA溶液封闭2 h后TBST洗涤,将PVDF膜与不同的一抗在4 ℃条件下孵育过夜。TBST洗膜后与特异性HRP偶联的二抗室温孵育2 h,洗去二抗,随后用Omni-ECLTM超灵敏化学发光检测试剂盒显影条带,然后通过Image-Lab软件测量条带强度并进行光密度分析。以β-actin为内参计算蛋白的相对表达量。
1.10 RT-qPCR检测 取适量肾组织按照TRIzol法提取肾脏组织总RNA,按照Prime ScriptTMRT Master mix试剂盒说明书进行反转录,并配制RT-qPCR反应体系。其循环反应条件如下:95 ℃ 30 s, 95 ℃ 5 s和60 ℃ 30 s,反应40个循环。以GADPH为内参基因,采用2-ΔΔCT方法定量分析小鼠肾组织中PGC-1α、MFN1及OPA1 mRNA的表达。引物由上海生工生物工程股份有限公司合成,引物序列见表1。

表1 目的基因引物序列
1.11 肾脏组织病理学评价 将石蜡包埋后的肾脏组织4 μm切片后置于60 ℃的烘箱2 h,经二甲苯脱蜡,梯度乙醇水化后用苏木素、伊红染液行常规HE染色,高倍镜(×400)下观察肾脏病理形态变化;脱蜡水化后肾脏切片依次使用氧化剂、Schiff染色液、苏木素染色液和分化液处理行PAS染色,每张切片高倍镜(×400)下随机选择5~10个视野,应用image-pro plus 6.0软件测定并计算,肾小球系膜基质相对面积=肾小球内PAS阳性染色面积/肾小球毛细血管袢总面积×100%。
1.12 统计学处理方法 采用SPSS26.0统计软件及Graphpad prism 9.0进行数据处理和绘制图片。计量资料用±s进行描述。多组间比较采用单因素方差分析,组间两两比较用LSD-t检验和Dunnett’s T3法检验。P<0.05为差异有统计学意义。
2 结果
2.1 丁酸钠对小鼠一般情况、体质量和肾质量的影响 NC组小鼠一般状况良好,毛色正常、反应灵敏;DN组均表现为典型的DN症状,包括多饮、多食、多尿,精神萎靡,反应迟钝或行动缓慢;经丁酸钠治疗8周后小鼠多饮多食多尿症状改善,活动较前增多。灌胃期间每2周监测一次小鼠体质量,DN组、NaB1组和NaB2组小鼠体质量均显著高于NC组,差异有统计学意义(P<0.05);与DN组比,NaB1组及NaB2组小鼠体质量下降,差异有统计学意义(P<0.05),见图1。与NC组比,DN组、NaB1组和NaB2组小鼠肾脏质量增加,肾肥大指数减小,差异有统计学意义(P<0.05);与DN组比,NaB1组和NaB2组肾质量及肾肥大指数减小;且这种差异在NaB2组更加明显,差异有统计学意义(P<0.05)。见表2。
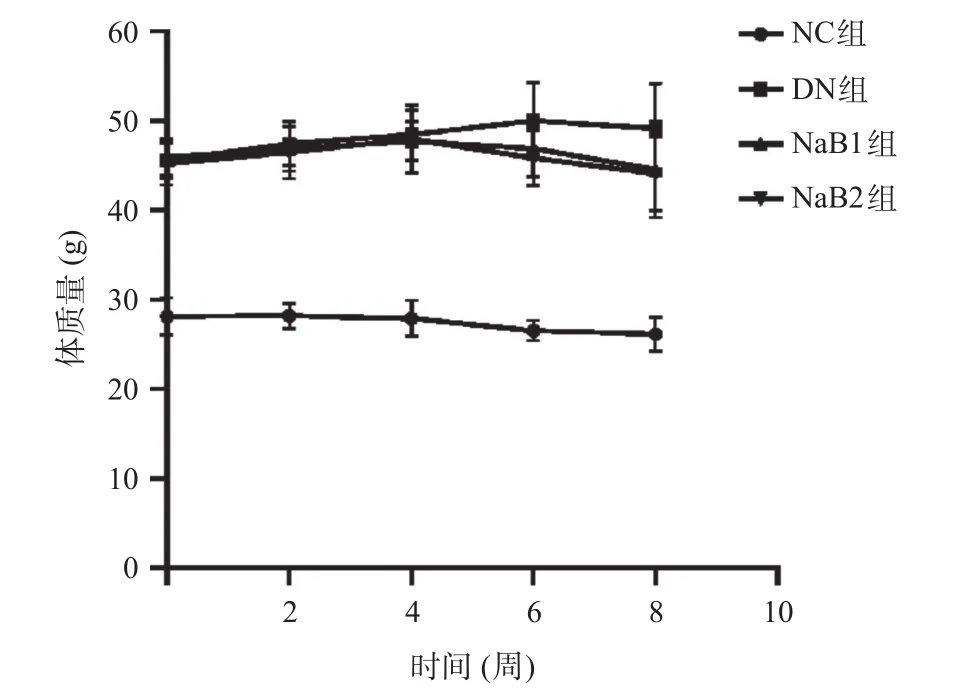
图1 丁酸钠降低db/db小鼠体质量
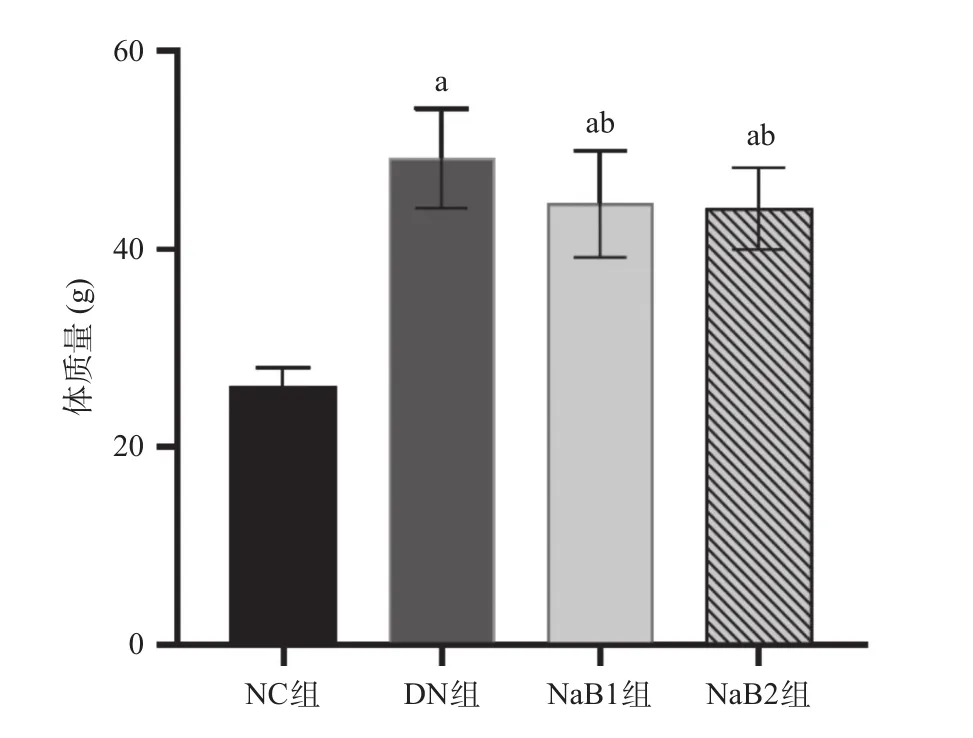
表2 丁酸钠对DN小鼠肾质量的影响(±s)
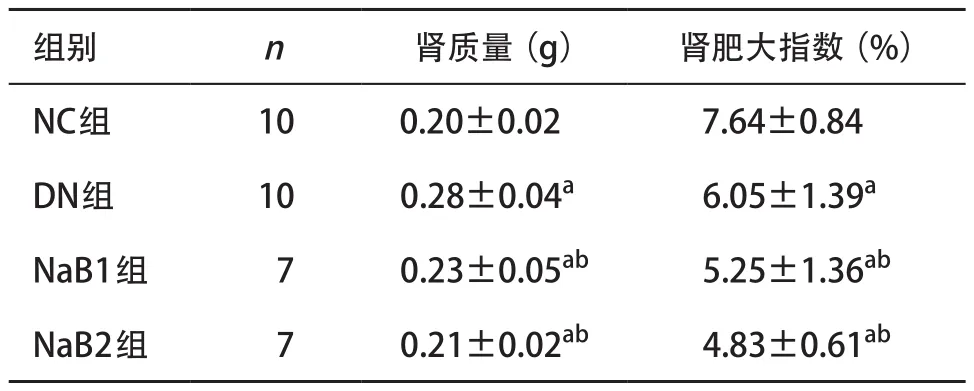
表2 丁酸钠对DN小鼠肾质量的影响(±s)
与NC组比:aP<0.05;与DN组比:bP<0.05
组别 n 肾质量(g) 肾肥大指数(%)NC组 10 0.20±0.02 7.64±0.84 DN组 10 0.28±0.04a 6.05±1.39a NaB1组 7 0.23±0.05ab 5.25±1.36ab NaB2组 7 0.21±0.02ab 4.83±0.61ab
2.2 丁酸钠对小鼠UACR、血糖及肾组织IL-6水平的影响 与DN组比,NaB1组及NaB2组小鼠UACR值下降显著,差异具有统计学意义(P<0.05),但两治疗组之间的UACR值差异无统计学意义(P>0.05)。DN组血糖明显高于NC组,经丁酸钠8周灌胃治疗后,NaB1组及NaB2组小鼠血糖浓度下降显著,差异具有统计学意义(P<0.05);且与NaB1组比,NaB2组血糖下降更加明显,差异具有统计学意义(P<0.05)。连续给予8周丁酸钠溶液灌胃治疗,检测小鼠肾组织IL-6的变化,DN组小鼠肾脏IL-6水平较NC组显著升高,差异具有统计学意义(P<0.05);经丁酸钠8周治疗后,NaB1组及NaB2组的肾脏IL-6水平较DN组下降,且与NaB1组比,NaB2组IL-6水平下降显著,差异具有统计学意义(P<0.05)。见图2。

图2 各组UACR、血糖浓度及肾脏IL-6水平
2.3 丁酸钠对小鼠血液BUN、SCr、TC、TG等指标的影响 与DN组比,NaB1组及NaB2组的ALT、AST水平差异无统计学意义(P>0.05),提示这两种剂量下的丁酸钠对两治疗组小鼠的肝功能无明显损伤作用。NC组小鼠血BUN、SCr与DN组比差异有统计学意义(P<0.05);经过8周治疗后两治疗组均出现不同程度的下降,差异具有统计学意义(P<0.05)。DN组小鼠TC和TG值高于NC组(P<0.05),经8周丁酸钠治疗后,两治疗组小鼠血TC、TG值下降但差异无统计学意义(P>0.05)。见表3。
表3 丁酸钠对各组小鼠血液生化指标的影响(±s)

表3 丁酸钠对各组小鼠血液生化指标的影响(±s)
与NC组比:aP<0.05;与DN组比:bP<0.05
项目 NC组(n=10) DN组(n=10) NaB1组(n=7) NaB2组(n=7)TC(mmol/L) 1.92± 0.53 3.46± 1.32a 3.06± 0.44a 2.87± 1.20 TG(mol/L) 0.65± 0.27 1.77± 0.66a 1.63± 0.51a 1.41± 0.43a BUN(mmol/L) 7.06± 1.33 11.51± 2.77a 7.91± 1.10b 6.91± 1.00b SCr(umol/L) 29.04± 6.91 129.63±18.67a 103.36±11.61ab 106.44± 6.18ab ALT(U/L) 27.81± 6.56 63.87±23.06a 45.39±13.52a 46.96±17.26a AST(U/L) 49.12±14.55 94.50±31.18a 74.02±18.57 79.84±20.83
2.4 丁酸钠对DN小鼠肾脏病理的影响 与NC组比较,肉眼见DN组小鼠肾组织体积明显增大。对各组小鼠肾组织进行HE及PAS染色,DN组小鼠出现典型的DN病理改变,表现为肾小球肿胀肥大,肾小管上皮排列紊乱且伴有管腔扩张,基底膜增厚,系膜基质相对面积增加,NaB1和NaB2组小鼠的肾小球面积减小,肾小管扩张程度减轻,系膜基质糖原沉积面积减小,且在NaB2治疗组减少更加显著,差异具有统计学意义(P<0.05)。见图3。
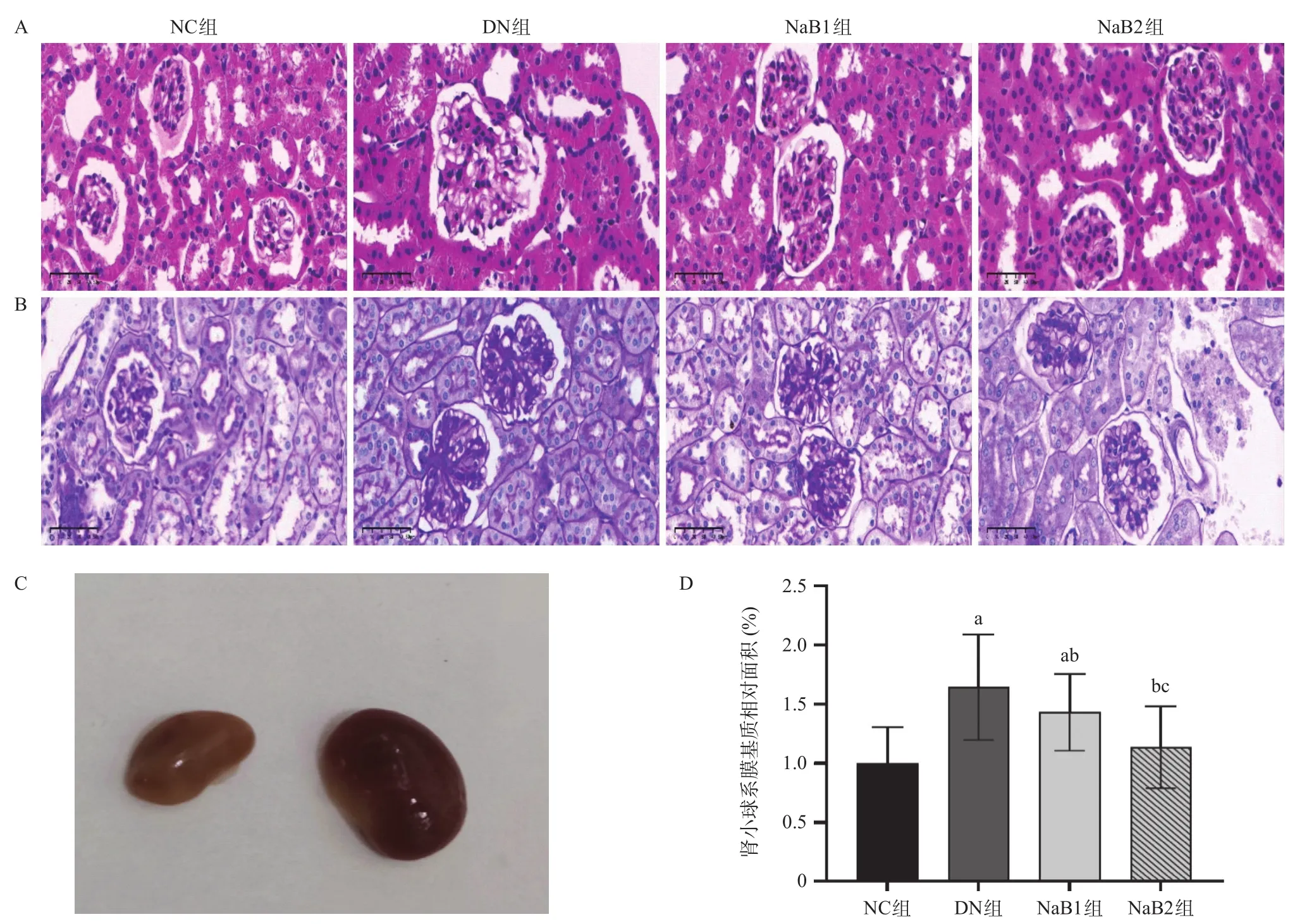
图3 各组小鼠肾组织病理改变
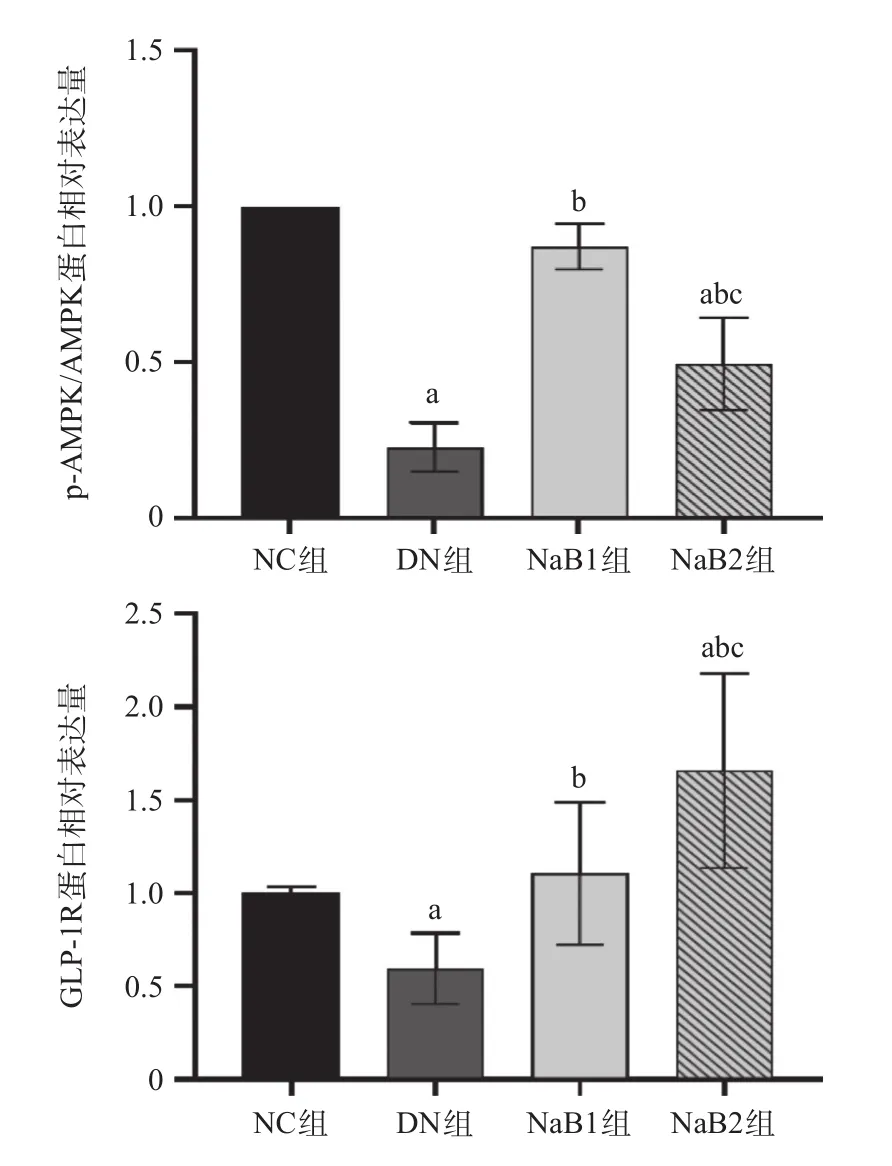
2.5 丁酸钠对肾脏GLP-1R、p-AMPK/AMPK蛋白的表达的影响 DN组小鼠中的p-AMPK/AMPK比值明显低于NC组、NaB1组及NaB2组,差异有统计学意义(P< 0.05);且与NaB1组比,NaB2组P-AMPK/AMPK蛋白水平明显降低,差异有统计学意义(P<0.05)。GLP-1R 蛋白在NC组、NaB1组及NaB2组中均有丰富的表达,在DN组小鼠中可见蛋白表达减少,差异有统计学意义(P<0.05);且与NaB1组比,GLP-1R蛋白在NaB2组显著上调,差异有统计学意义(P<0.05)。见图4。
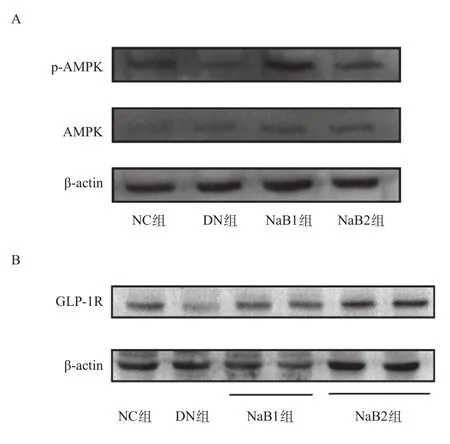
图4 各组p-AMPK/AMPK及GLP-1R蛋白表达水平
2.6 丁酸钠对肾组织PGC-1α、MFN2及OPA1 mRNA表达的影响 与NC组比,DN组肾小球PGC-1α、MFN2及OPA1 mRNA明显减少,差异有统计学意义(P<0.05)。治疗8周后,NaB1组及NaB2组的PGC-1α、MFN2及OPA1 mRNA水平明显上升;且NaB2组PGC-1α、MFN2及OPA1 mRNA水平升高更加显著,差异有统计学意义(均P<0.05)。见图5。
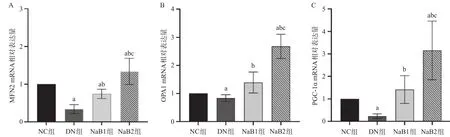
图5 各组小鼠PGC-1α、MFN2及OPA1 mRNA表达水平
3 讨论
DN是糖尿病常见的慢性微血管并发症之一,研究发现其发生发展可能与GLP-1作用受抑制有关。DN发生时肠道内分泌L细胞释放的GLP-1减少[9],同时机体内NF-κB及其介导的炎症级联反应激活,导致各种炎症因子在体内蓄积,尤其是IL-6[10]。有研究证实小鼠发生DN时,肾小球内皮细胞上的GLP-1R通过泛素化或血管紧张素II介导的降解机制被激活,导致GLP-1R降解增多,GLP-1不能与GLP-1R结合发挥生物学功能[11]。在本研究中,我们发现在DN小鼠中,血糖血脂和炎症因子IL-6水平显著升高,肾功能受损,肾脏GLP-1R蛋白表达显著降低。
相关研究报道丁酸盐不仅能上调肠道细胞紧密连接蛋白1(recombinant tight junction protein 1, TJP1)的表达,改善肠道黏膜屏障功能,还能进一步降低慢性肾脏病患者血液中IL-1、TNF-α的水平,减轻肾脏的氧化应激和纤维化损伤,降低尿白蛋白排泄,改善肾功能[8,12-13],同时还抑制了组蛋白去乙酰化酶(histone deacetylase inhibitor,HDAC)活性。除此之外,丁酸与细胞表面G蛋白偶联蛋白41(GPR41)和GPR43结合促进远端回肠及结肠L细胞分泌释放GLP-1,从而提高机体对GLP-1R敏感性,发挥降血糖、抗炎及抗氧化作用。本研究中,经丁酸盐治疗后小鼠的一般情况改善,血糖、体质量及UACR显著下降,SCr、BUN和肾组织IL-6水平降低,但小鼠肝功能无明显损伤,表明丁酸盐能减轻DN小鼠体质量,降低血糖浓度,抑制DN小鼠发生发展过程中伴随的炎症反应,减轻肾组织损伤。还发现与500 mg·kg-1·d-1丁酸钠治疗量相比, 1 000 mg·kg-1·d-1丁酸钠治疗量在降低DN小鼠血糖浓度及肾组织IL-6水平方面疗效更加显著,或许为寻找适宜丁酸钠治疗浓度提供了证据。
AMPK是细胞重要的能量感受器,能调节细胞能量代谢[14]。既往的大量研究证实DN小鼠存在能量代谢失衡,肾脏中AMPK磷酸化水平在不同程度上被抑制,应用5-氨基咪唑-354-甲酰胺-1-β-d-呋喃核糖核苷(AICAR)或白藜芦醇等AMPK激动剂可以减轻DN小鼠尿蛋白和肾脏纤维化,减少肾细胞凋亡并改善肾脏肥大[15-16]。研究发现DN组小鼠p-AMPK/AMPK蛋白表达显著降低,补充丁酸盐治疗后小鼠p-AMPK/AMPK蛋白表达增加,因此推测丁酸盐与AMPK激动剂有类似的效果,能促进AMPK磷酸化从而影响肾脏功能,但具体的通路和机制还有待进一步研究。
线粒体是生物发生合成、脂肪酸氧化和能量代谢的重要场所,KANG等[17]证实DN时脂肪酸氧化过程被抑制,肾小球PGC-1α mRNA表达明显减少,而PPAR与PGC-1α是影响脂肪酸吸收氧化相关蛋白转录的关键[18]。OPA1蛋白及用于编码线粒体的融合基因MFNl、MFN2作为PGC-1α的重要下游因子对线粒体功能维持至关重要,研究表明PGC-1α表达下降可导致线粒体功能障碍和结构异常,同时生成过量的活性氧作用于生物膜及大分子物质发生脂质过氧化损伤,从而促进DN的进展。丁酸盐可在一定条件下活化AMPK,AMPK具有促进下游因子PGC-1α合成的功能,从而调控PGC-1α及其下游信号因子进而影响线粒体的功能,且这种效应可以被AMPK抑制剂Compound C抑制[19]。为了研究丁酸盐对线粒体功能的影响,进一步分析了线粒体内融合基因表达,本研究发现PGC-1α mRNA和线粒体融合基因MFN2和OPA1 mRNA表达在DN小鼠中受到抑制,而在丁酸盐治疗组中小鼠PGC-1α、MFN2和OPA1 mRNA表达抑制得到一定程度的缓解。推测丁酸盐可能是通过AMPK/PGC-1α信号通路恢复损伤线粒体的功能,增加线粒体代谢产物,干预机体代谢,减少肾脏脂肪酸堆积,减轻肾组织损伤。
DN小鼠中普遍存在肠道菌群失衡,主要表现为产丁酸的细菌的减少,机体内丁酸含量下降,本研究证实补充外源性的丁酸盐能抑制DN小鼠炎症反应,促进GLP-1R蛋白合成,激活AMPK信号通路改善线粒体结构及能量代谢障碍,表明丁酸钠可作为连接“肠-肾”轴的重要介质参与DN发生发展,同时还探究了丁酸钠对肾脏起保护作用的适宜浓度,为治疗DN提供新证据及思路。
