miRNA-1在大鼠心搏骤停心肺复苏后心肌焦亡及损伤中的作用
2023-01-28殷佳娜李炳灿周培森雷远丽王东升许华清宋文兴何爱文李章平
殷佳娜,李炳灿,周培森,雷远丽,王东升,许华清,宋文兴,何爱文,李章平
1.温州医科大学附属第一医院 急诊科,浙江 温州 325015;2.温州医科大学附属第二医院 急诊科,浙江 温州 325027;3.温州医科大学附属衢州医院 衢州市人民医院 急诊科,浙江 衢州 324000
心搏骤停(cardiac arrest, CA)是临床危急重症,心肺复苏(cardiopulmonary resuscitation,CPR)是对CA后患者所实施的一种紧急抢救措施。据统计,我国院外心脏骤停(out-of-hospital cardiac arrest, OHCA)后的存活出院率低于1%[1]。CA/CPR是全身缺血/再灌注损伤(ischemia reperfusion injury, IRI)的过程,CA/CPR后出现的不同程度的心脑功能障碍是自主循环恢复(return of spontaneous circulation, ROSC)后患者死亡的主要原因,其病理生理机制复杂。深入阐明其机制,在ROSC后患者的治疗中,对于提高患者预后具有极为重要的价值[2]。
细胞焦亡(pyroptosis)是一种特殊的程序性细胞死亡(programmed cell death, PCD),它在本质上是细胞发生的炎症性坏死,主要形态学特征是细胞水肿、崩解、胞膜小孔形成,并伴随释放大量的炎症因子[3]。LIU等[4]和LOU等[5]研究发现细胞焦亡在心肌IRI后发挥着重要作用。但CA/CPR患者ROSC后的心肌细胞焦亡情况尚不清楚。
微小RNA(microRNA, miRNA)是一种长度为18~22个核苷酸的非编码小RNA分子,可调控30%以上人类基因表达[6]。其中,miR-1是肌肉组织特异性表达miRNA,占所有成年人心脏miRNA的40%[7],是参与心肌损伤过程的一种重要miRNA[8]。但在CA/CPR后心肌功能障碍形成中,miR-1的变化和作用尚未明确,其和细胞焦亡的关系也有待研究。本研究通过建立大鼠窒息型CA/CPR模型,观察ROSC后心肌细胞焦亡和损伤变化,并探讨miR-1在其中的作用。
1 材料和方法
1.1 主要试剂与仪器 RNA提取试剂TRIzol(美国Invitrogen公司),cDNA反转录试剂盒(美国Thermo公司),SYBR Green试剂盒(上海Toroivd公司)。miR-1抑制剂(antago miR-1)、miR-1模拟物(ago miR-1)、miR抑制剂阴性对照物(antago miR NC)、miR模拟物阴性对照物(ago miR NC)均订购自广州锐博生物技术有限公司,TUNEL染色试剂盒(英国Roche公司),核苷酸结合寡聚结构域样受体蛋白3NOD(nucleotide-binding oligomerization domain-like receptor protein 3, NLRP3)抗体、 天冬氨酸特异性半胱氨酸蛋白1(Caspase-1)抗体、白介素-1β(interleukine-1 beta, IL-1β)抗体、白介素-18(interleukine-18, IL-18)抗体(美国Proteintech公司),大鼠肌肉B型肌酸激酶同工酶(creatine kinase isoenzyme muscle B, CK-MB)、 心肌肌钙蛋白I(cardiac troponin I, cTnI)ELISA试剂盒(上海博蕴生物公司)。实时荧光定量PCR仪、Gel DocTM XR+自动曝光机(美国伯乐公司),小型动物呼吸机RWD407(深圳市瑞沃德生命科技有限公司)。
1.2 大鼠窒息型CA/CPR模型建立 SPF级成年雄性SD大鼠,体质量250~300 g,购自温州医科大学实验动物中心,实验动物许可证号:SYXK(浙)2021-0017,饲养和实验遵守温州医科大学实验动物中心管理和使用规定,并遵守中国实验动物管理条例。实验前自由饮水,禁食12 h。参照TIAN等[9]、QIN等[10]的方法建立CA/CPR模型。腹腔注射2%戊巴比妥钠 3 mL/kg麻醉下,保定,颈部正中切口,分离右侧颈内动脉置管,接压力换能器行血压监测,记录基础平均动脉压(mean arterial pressure, MAP)。分离气管,切开后插管;暴露颈静脉建立静脉通路。待大鼠血压和心率稳定后,CA/CPR组在大鼠呼气末夹闭气管导管制备CA/CPR模型。CA后5 min时开始纯氧机械通气(频率70次/min,潮气量6 mL/kg),同时进行人工胸外心脏按压,按压频率为150~180次/min, 深度为大鼠胸廓前后径的1/3,同时经颈静脉注射肾上腺素0.02 mg/kg,直至恢复ROSC时停止按压。CA判断标准为心电图呈室颤、停搏或无脉性电活动,收缩压≤25 mm Hg(1 mmHg=0.133 kPa)。ROSC判断标准为心电图出现自主节律,收缩压>60 mm Hg, 并持续10 min以上。所有大鼠在ROSC后6 h取心尖部心肌组织、血样待测。
1.3 实验分组及干预 36只大鼠按照随机数字表法被均分为6组,干预剂注射方法均参照BIAN等[11]的研究方法:①假手术对照(Sham)组:仅实施麻醉、组织血管分离、插管等手术操作,未进行窒息性操作。②心搏骤停复苏(CA)组:使用窒息法构建 窒息型CA/CPR模型。③CA+miR-1抑制剂(CA+antago miR-1)组:术前3 d通过尾静脉注射200 pmol(/kg·d) antago miR-1,连续注射3 d,进行窒息型CA操作。④CA+miR抑制剂阴性对照(CA+antago miR NC)组:在与CA+antago miR-1组同一时间点,注射等剂量antago miR NC,进行窒息型CA操作。⑤CA+miR-1模拟物(CA+ago miR-1)组:术前3 d通过尾静脉通路注射100 pmol(/kg·d) ago miR-1,连续注射3 d, 进行窒息型CA操作。⑥CA+miR模拟物阴性对照(CA+ ago miR NC)组:在与CA+ago miR-1组同一时间点,注射等剂量ago miR NC,进行窒息型CA操作。
1.4 实时荧光定量聚合酶链反应(quantitative poly-merase chain reaction, qPCR)检测细胞miRNA-1水平 按照RNA提取试剂TRIzol的说明书进行操作,提取心肌组织总RNA,紫外分光光度计检测总RNA的浓度和纯度。反转录合成cDNA后进行Real-time PCR检测,以U6作内参。PCR扩增条件为: 95 ℃预变性15 min;95 ℃ 10 s,60 ℃ 30 s,45个循环。使用的引物由上海生工生物工程有限公司设计合成,序列如下:miR-1 F 5’-GCGCGTGGAATGTAA AGAAGT-3’;miR-1 R 5’-AGTGCAGGGTCCGAGGTATT-3’; U6 F 5’-GCTTCGGCAGCACATATACTAAAAT-3’;U6 R 5’-CGCTTCACGAATTTGCGTGTCAT-3’。以Sham组表达量为 1,采用2-ΔΔCt法计算目的基因的表达量。
1.5 TUNEL法检测心肌细胞焦亡率 参照陈颖 等[12]的研究方法,使用TUNEL染色法检测细胞焦亡率。按照试剂盒使用说明书,将各组心肌组织取出后,用4%多聚甲醛固定,进行脱水、包埋、切片,枸橼酸盐缓冲液(phosphate buffered saline, PBS)清洗2次,加入含0.2% Triton X-100的PBS,室温孵育5 min,PBS清洗2次,加入TUNEL检测液,37 ℃ 避光孵育60 min,4’,6-二脒基-2-苯基吲哚(4’,6-diamidino-2-phenylindole, DAPI)复染样品,正置荧光显微镜成像。对每个视野下TUNEL阳性细胞进行计数,统计得出各组细胞焦亡率(焦亡率= TUNEL阳性细胞数/视野细胞核总数)。
1.6 蛋白质印迹(Western blot)检测NLRP3、Caspase-1、IL-1β、IL-18蛋白表达 提取细胞总蛋白,用BCA法定量。细胞蛋白经凝胶电泳、电转移和缓冲液封闭后,加入一抗NLRP3(1:500)、GAPDH(1:1 000)、Caspase-1(1:1 000)、IL-18(1:1 000)或IL-1β(1:1 000),4 ℃孵育过夜。洗膜后加入二抗(1:500)常温孵育2 h。再次洗膜后,加入1 mL 电化学发光液与膜充分接触,于成像系统进行图像采集。以Sham组默认为1比较,实验组/对照组的蛋白条带吸光度(absorbance, A)值相对比值表示目的蛋白的表达量。
1.7 酶联免疫吸附测定法(enzyme-linked immunosorbent assay,ELISA)检测血清CK-MB、cTnI含量 采用尾部断尾采血方法采集外周血。采集的血液,先放在37 ℃培养箱温浴1 h,4 ℃冰箱过夜;取出以3 000 r/min离心15 min分离出血清。采用ELISA测定大鼠血清CK-MB、cTnI的含量,操作步骤严格按照试剂盒说明书进行。
1.8 统计学处理方法 采用SPSS19.0统计软件进行分析。计量资料均符合正态分布,以±s表示,组间比较采用单因素方差分析,并采用Bonferroni校正。P<0.05为差异有统计学意义。
2 结果
2.1 各组大鼠体质量、基础MAP的比较 各组大鼠体质量、基础MAP差异无统计学意义(P>0.05)。见表1。
表1 各组大鼠体质量、基础MAP水平比较(每组n=6,±s)
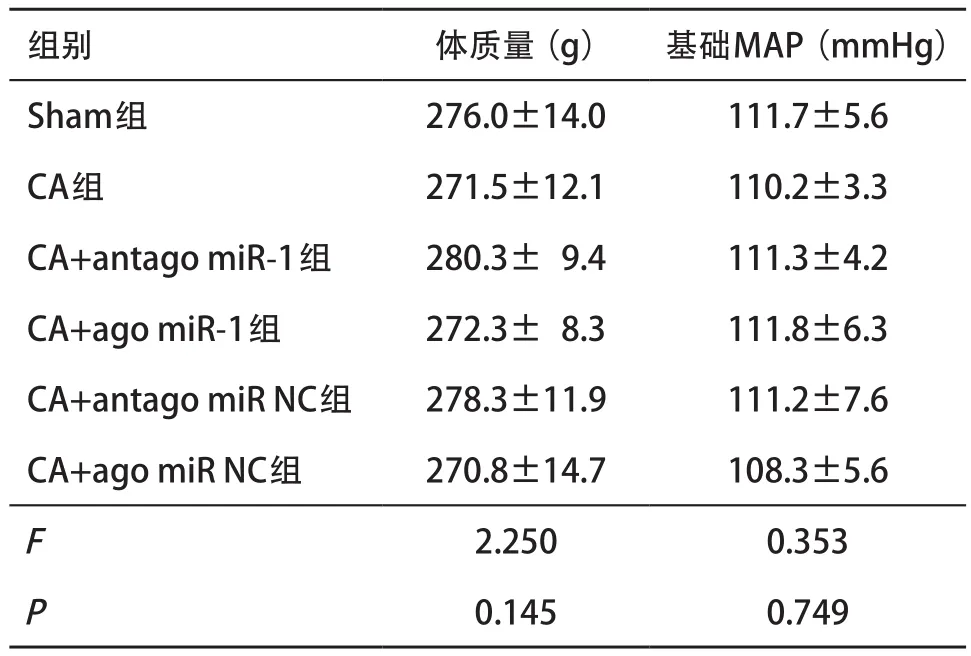
表1 各组大鼠体质量、基础MAP水平比较(每组n=6,±s)
组别 体质量(g) 基础MAP(mmHg)Sham组 276.0±14.0 111.7±5.6 CA组 271.5±12.1 110.2±3.3 CA+antago miR-1组 280.3± 9.4 111.3±4.2 CA+ago miR-1组 272.3± 8.3 111.8±6.3 CA+antago miR NC组 278.3±11.9 111.2±7.6 CA+ago miR NC组 270.8±14.7 108.3±5.6 F 2.250 0.353 P 0.145 0.749
2.2 各组大鼠心肌miRNA-1水平比较 各组大鼠心肌miRNA-1水平差异有统计学意义(F=207.2,P< 0.01)。两两比较发现,与Sham组比,CA组、CA+ antago miR-1组、CA+ago miR-1组、CA+antago miR NC组、CA+ago miR NC组大鼠心肌miR-1表达均有升高(均P<0.01)。与CA组比,CA+antago miR-1组大鼠心肌miR-1表达降低(P<0.01),CA+ago miR-1组大鼠心肌miR-1表达升高(P<0.01),见图1。
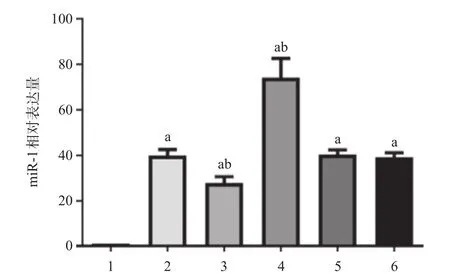
图1 各组大鼠心肌组织miRNA-1表达量
2.3 各组大鼠心肌细胞焦亡相关蛋白表达的比较 与CA组比,CA+antago miR-1组大鼠心肌焦亡相关蛋白NLRP3、Caspase-1、IL-1β、IL-18表达降低 (P<0.05),CA+ago miR-1组大鼠心肌焦亡相关蛋白NLRP3、Caspase-1、IL-1β、IL-18表达升高(P<0.01),见图2。
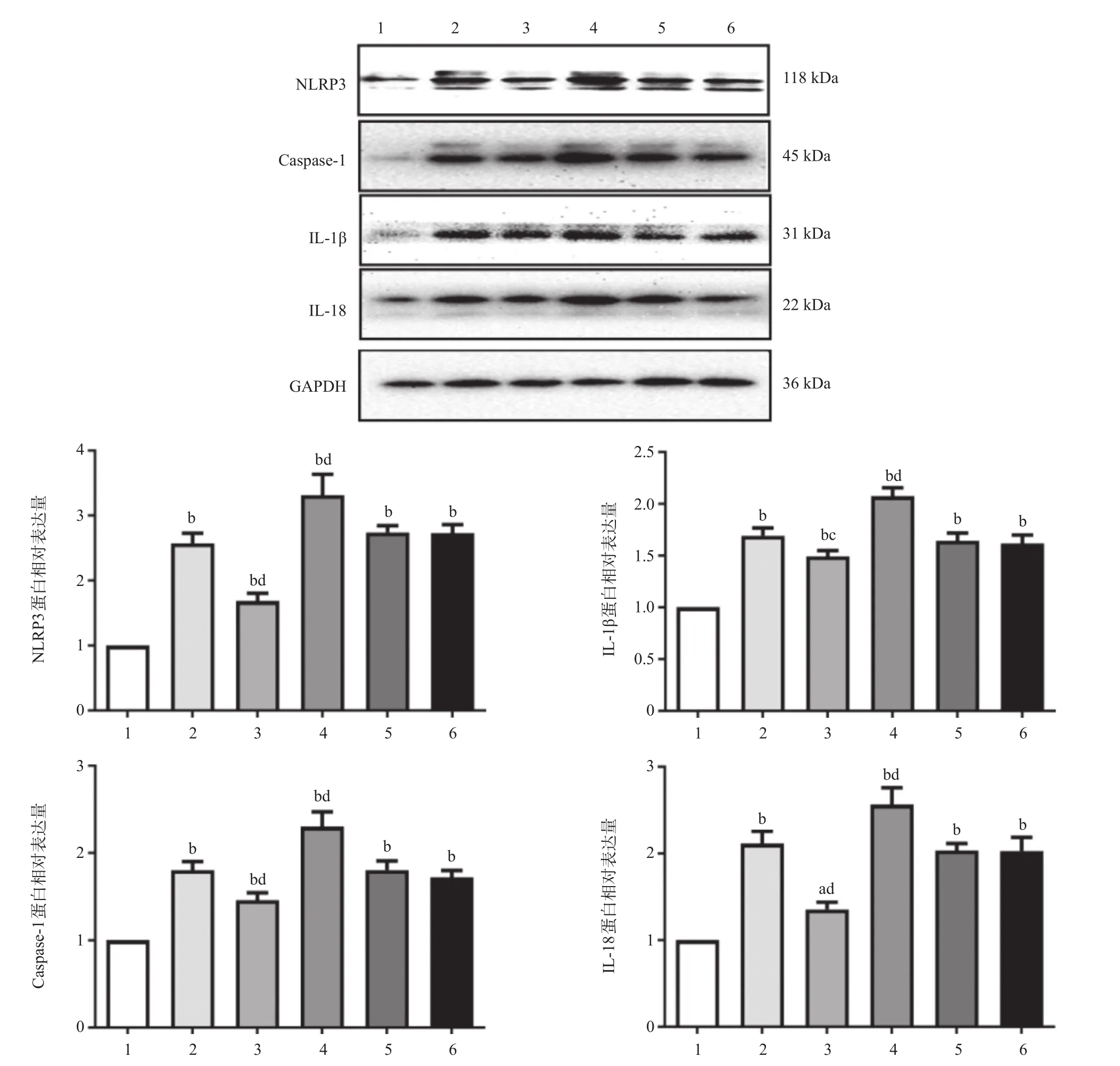
图2 各组大鼠心肌细胞焦亡相关蛋白表达的比较
2.4 各组大鼠心肌细胞焦亡率的比较 经TUNEL法检测,与CA组比较,CA+antago miR-1组大鼠心肌焦亡率降低(P<0.01),CA+ago miR-1组大鼠心肌焦亡率升高(P<0.01),CA+antago miR NC组、CA+ago miR NC组大鼠心肌焦亡率差异无统计学意义(P> 0.05),见图3、图4。
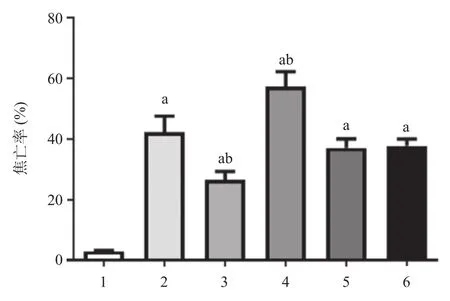
图4 各组大鼠心肌细胞焦亡率的比较
2.5 各组大鼠CA/CPR后血清中CK-MB、cTnI水平变化 经ELISA法检测,与CA组比较,CA+antago miR-1组大鼠心肌CK-MB、cTnI水平降低(均P<0.05),CA+ago miR-1组大鼠心肌CK-MB、cTnI水平升高(P<0.01),CA+antago miR NC组、CA+ago miR NC组大鼠心肌CK-MB、cTnI水平差异无统计学意义(P>0.05),见图5。
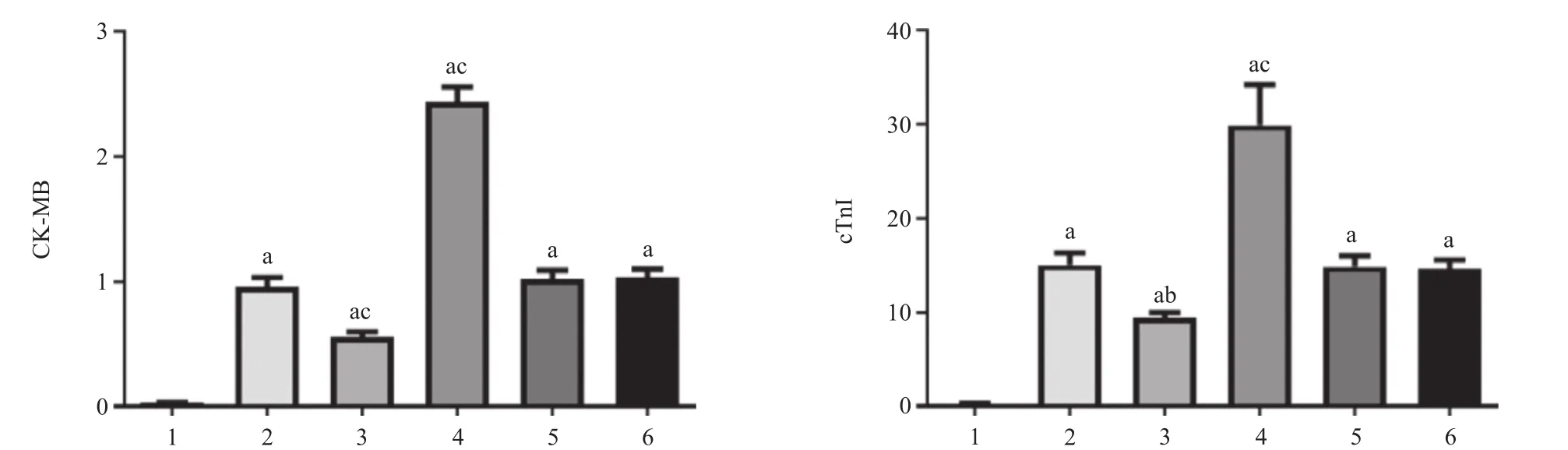
图5 各组大鼠CA/CPR后血清中CK-MB、cTnI水平
3 讨论
miR-1作为肌肉组织特异性表达miRNA,在肌肉及心肌组织中具有重要作用,JAYAWARDENA等[13]研究表明,miR-1在心肌细胞缺血再灌注损伤时发生的凋亡中发挥显著作用。ZHOU等[14]的研究表明,miR-1通过改变Bax和Bcl-2影响心肌细胞凋亡进而对心肌损伤具有促进作用,即抑制miR-1可减轻心肌损伤。细胞凋亡与细胞焦亡都属于程序性细胞死亡,细胞凋亡是经典的PCD模式,它的主要特征是细胞皱缩以及凋亡小体的形成[15];而细胞焦亡由外源性感染导致的,它的特征是会释放出IL-1β和其他小分子物质,从而导致发生炎症反应[16]。
本研究根据以往心肺复苏后心肌损伤的不同时间点变化,选取大鼠CA/CPR ROSC后心肌损伤的高峰时间点,即ROSC后6 h为观察点,比较Sham组、CA组、CA+ago miR-1组和CA+antago miR-1组的心肌细胞miR-1表达,发现CA组、CA+ago miR-1组和CA+antago miR-1组miR-1表达均显著高于Sham组,加用ago miR-1后比CA组miR-1表达显著增高,加用antago miR-1后比CA组miR-1表达显著降低,而两个NC组和CA组miR-1表达无差别,提示在大鼠CA/CPR模型中,静脉通路加用ago miR-1可以促进心肌细胞miR-1的表达,静脉通路加用antago miR-1可以减少心肌细胞miR-1的表达,也说明可以使用静脉通路加用ago miR-1或antago miR-1来调节心肌细胞miR-1的表达从而观察miR-1对相关指标的影响。
CK-MB和cTnI均是常用的心肌损伤标志物,广泛应用于临床诊断多年[17]。与CK-MB相比,cTnI在诊断心肌损伤中敏感性和特异性更高[18]。研究发现,在CA/CPR动物模型及患者身上,血清中CK-MB、cTnI都明显升高,提示出现了明显的心肌损伤[19-20]。 本研究发现,与Sham组比较,CA组大鼠ROSC后6 h血清CK-MB和cTnI均明显升高,提示存在心肌损伤,和上述他人研究结果一致。本研究进一步使用静脉通路加用ago miR-1或antago miR-1来调节心肌细胞miR-1的表达发现,与CA组相比,CA+antago miR-1组大鼠心肌CK-MB、cTnI水平有统计学意义的降低,而CA+ago miR-1组大鼠心肌CK-MB、cTnI水平有统计学意义的升高,但还是均高于对照组,提示调节心肌miR-1可以调控心肌损伤,表明miR-1促进了CA/CPR后的心肌损伤,减少CA/CPR后心肌miR-1的表达具有心脏保护作用。
研究发现[21-22],细胞焦亡与许多心肌疾病、动脉粥样硬化以及各种导致器官功能障碍的疾病有着十分密切的关系。焦亡的经典途径在于活化的NLRP3 与凋亡相关斑点样蛋白(apoptosis-associated speck-like protein, ASC)寡聚形成ASC斑点。pro-Caspase-1在形成的ASC斑点诱导作用下,将被切割后变为成熟的Caspase-1,而Caspase-1又对pro-IL-1β、pro-IL-18进行分裂作用,使其形成成熟的IL-1β、IL-18并释放到细胞外[23-24]。因此,焦亡相关蛋白NLRP3、Caspase-1、IL-18、IL-1β和直接用TUNEL法检测细胞焦亡率均可作为观测焦亡水平的指标。心肺复苏后心肌细胞焦亡情况目前少有研究,本研究发现,与Sham组比较,CA组大鼠ROSC后6 h心肌细胞焦亡相关蛋白NLRP3、Caspase-1、IL-18、IL-1β和焦亡率均明显增加,提示CA/CPR后存在明显的细胞焦亡的现象。进一步与CA组比较,静脉加用ago miR-1促使心肌miR-1表达后,CA+ago miR-1组大鼠心肌细胞焦亡相关蛋白NLRP3、Caspase-1、IL-18、IL-1β和焦亡率更是明显增加,静脉使用antago miR-1抑制心肌细胞miR-1表达后,CA+antago miR-1组大鼠心肌细胞焦亡相关蛋白NLRP3、Caspase-1、IL-18、IL-1β和焦亡率明显减少,提示改变CA/CPR后心肌miR-1表达可调节心肌细胞焦亡水平,过表达miR-1会加剧心肌焦亡,减少miR-1表达则可抑制心肌焦亡,结合细胞焦亡必然引起组织损伤,提示CA/CPR后心肌miR-1表达促进心肌损伤可能是通过促进细胞焦亡的途径。
综上所述,静脉使用ago miR-1和antago miR-1可以调节CA/CPR后大鼠心肌细胞miR-1的表达,进而可促进或减少心肌损伤,其机制可能和miR-1调节心肌细胞焦亡有关,抑制CA/CPR后心肌细胞的miR-1表达,可降低心肌细胞的焦亡水平,进而保护心肌细胞,是潜在的治疗靶点。
