白细胞介素10在银屑病中的表达特征及影响
2023-01-28郑易潘丽娜高宇
郑易,潘丽娜,高宇
1.温州医科大学 检验医学院(生命科学学院),浙江 温州 325035;2.温州医科大学附属第二医院育英儿童医院 皮肤科,浙江 温州 325027
银屑病是一种常见的慢性复发性炎症性皮肤病,目前全球的发病率约为2%[1]。银屑病的临床症状主要表现为边界清楚的红斑、丘疹、斑块和鳞屑等,表皮和真皮中炎症细胞浸润,如T淋巴细胞、巨噬细胞和中性粒细胞等[2-3]。尽管银屑病临床表现明确,但确切病因和发病机制尚不明确。现有研究认为银屑病与遗传、感染、代谢障碍、内分泌紊乱和免疫失调等因素均有关,且反复发作的红斑、瘙痒和脱屑使患者的生活质量受到影响,甚至造成极大的心里负担[4-5]。
白介素10(interleukin-10, IL-10)是一种多细胞源、多功能的细胞因子,调节细胞的生长与分化,参与炎性反应和免疫反应,是公认的炎症与免疫抑制因子[6]。FIORENTINO等[7]首次发现了一种可以抑制Th1细胞合成γ干扰素(interferon-γ, IFN-γ)的细胞因子,称之为IL-10,它是IL-10依赖的调节性T细胞(Treg)发挥免疫负向调控作用的重要细胞因子。既往研究大部分针对银屑病患者血中IL-10水平,对于皮损部位的IL-10含量和分布没有检测,相对不够全面[8-9]。本研究采用咪喹莫特乳膏(imiquimod,IMQ)诱导野生型和IL-10-/-小鼠建立银屑病动物模型,同时结合临床银屑病患者样本,进一步明确IL-10在病损部位的分布与表达,探讨其在银屑病发生发展中的作用机制,从而为银屑病患者的治疗提供研究基础。
1 材料和方法
1.1 材料
1.1 .1 临床患者:选取2018年10月至2019年12月于温州医科大学附属第二医院育英儿童医院收治的40例进行期银屑病患者,经本院病理科病理活检确诊,均为初发或者6个月内未使用过糖皮质激素或者免疫抑制剂者,并无其他皮肤病及全身系统性疾病。本研究经过患者知情同意并且通过温州医科大学伦理委员会审查。
1.1 .2 实验动物:C57BL/6野生型小鼠购于中国科学院上海实验动物中心,IL-10-/-小鼠购于上海南方模式生物科技股份有限公司。所有小鼠均置于温州医科大学实验动物中心SPF级屏障环境中饲养。动物许可证号:SYXK(浙)2015-0009。
1.1 .3 主要药物与试剂:IMQ购自四川明欣药业有限责任公司,IgG H&L(HRP)、Anti-CD19抗体(ab245235)、Anti-IL-10抗体(ab189392)、Anti-CD4抗体(ab183685)和CD4二抗(Alexa Fluor®488,ab150077)购自美国Abcam公司;超敏SABC免疫组化检测试剂盒购自武汉博士德生物工程有限公司,DAB底物试剂盒购自北京中杉金桥生物技术有限公司。
1.2 方法
1.2 .1 患者临床资料收集:收集银屑病患者信息,包括初发年龄、性别、银屑病面积和严重程度指数(psoriasis area and severity index, PASI)评分等。
1.2 .2 小鼠银屑病模型建立及评价:取12~16周的C57BL/6小鼠(WT)和IL-10敲除(IL-10-/-)小鼠,分别分为造模组和对照组,即WT对照组、WT造模组和IL-10-/-对照组、IL-10-/-造模组,每组8只。剔除背部毛发,面积约2 cm×3 cm,造模组每日用棉签蘸取62.5 mg IMQ均匀涂抹背部剃毛区域和左耳,对照组小鼠相同区域涂抹等量凡士林,均连续7 d,每天用游标卡尺量取各组小鼠左耳厚度并拍照记录背部皮损情况。依据PASI评分准则进行模型评价,因皮损面积均为背部且大小一致,不予考虑面积百分比,从皮损处红斑颜色、鳞屑及皮肤浸润厚度三项指标进行评价,分别记0~4分,三者得分相加记为总分。0分:无;1分:轻度;2分:中度;3分:重度;4分:极重度。
1.2 .3 组织病理观察:末次给药24 h后,吸入CO2处死小鼠,用九宫格法取1 cm×1 cm面积大小背部皮损及左耳置于4%多聚甲醛中固定,石蜡包埋,HE染色制作病理切片。患者HE切片由医院提供。
1.2 .4 免疫组化:各组石蜡包埋样本使用石蜡切片机切5~6 μm薄片,65 ℃脱蜡后进行水化和抗原修复,5% BSA封闭,一抗4 ℃过夜,二抗37 ℃恒温湿盒孵育1 h,TBST清洗3次后DAB显色,苏木素复染,脱色透明,用中性树胶封片后于光学显微镜下观察。免疫组化评分标准及结果判断:根据细胞染色强度,评分为4级:无阳性着色(阴性)计0分,淡黄色(弱阳性)计1分,棕黄色(阳性)计2分,棕褐色(强阳性)计3分。本研究将评分大于1分的细胞记为阳性细胞。计数20倍镜下随机5个视野的阳性细胞数,再求一个平均数即为这张片子的阳性细胞数。
1.2 .5 免疫荧光:末次给药24 h后,吸入CO2处死小鼠,用九宫格法取1 cm×1 cm面积大小背部皮损用OCT冷冻包埋,并在冷冻切片机上切成8~10 μm切片。在0.1% Titon-X100和封闭液孵育1 h,加一抗(1:200)湿盒中4 ℃冰箱孵育过夜,在PBS中洗涤3次,然后在室温下孵育二抗2 h,DAPI复染后用防荧光淬灭剂封片后于激光共聚焦显微镜下观察。银屑病患者病损部位冰冻切片免疫荧光处理方式同上。
1.3 统计学处理方法 采用SPSS25.0软件进行统计学分析。计量资料以±s表示,2组间比较采用独立样本t检验,多组间比较采用单因素方差分析,组间两两比较采用LSD法,不同时间点之间的比较采用重复测量资料的方差分析。P<0.05为差异有统计学意义。
2 结果
2.1 银屑病患者结果
2.1 .1 银屑病患者PASI评分及分析:银屑病患者年龄为(38.2±13.2)岁,男24例,女16例,PASI评分为9.36±5.92,其中病情较轻者(PASI<9分)有23例,病情较重者(PASI≥9分)有17例。
2.1 .2 银屑病患者皮肤样本HE染色结果:银屑病患者皮损部位存在角化过度,皮突延长,表皮增厚,棘层中有Kogoj海绵状脓疡,真皮层有单核细胞浸润等现象,见图1。
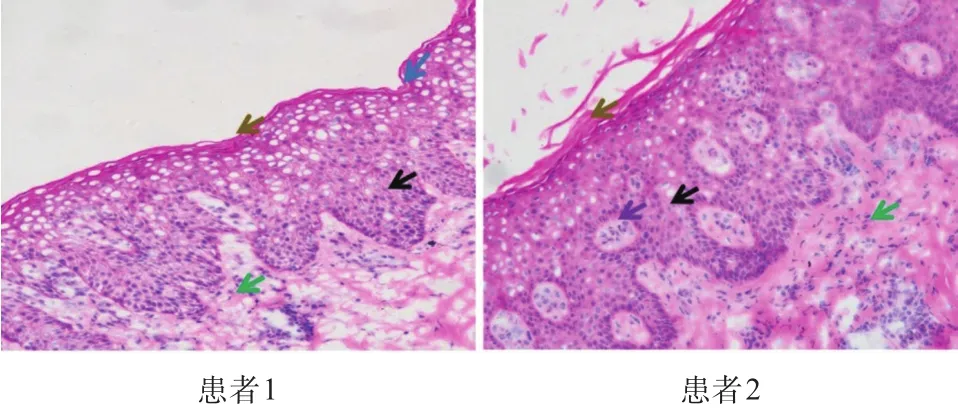
图1 银屑病患者皮肤样本HE染色结果图(×200)
2.1 .3 银屑病患者皮肤样本免疫荧光染色结果:银屑病患者皮损部位的CD4+T细胞主要定位于真皮层和棘层下部。当定位于棘层下部时,常伴随着淋巴细胞聚集而成的微脓肿。见图2。
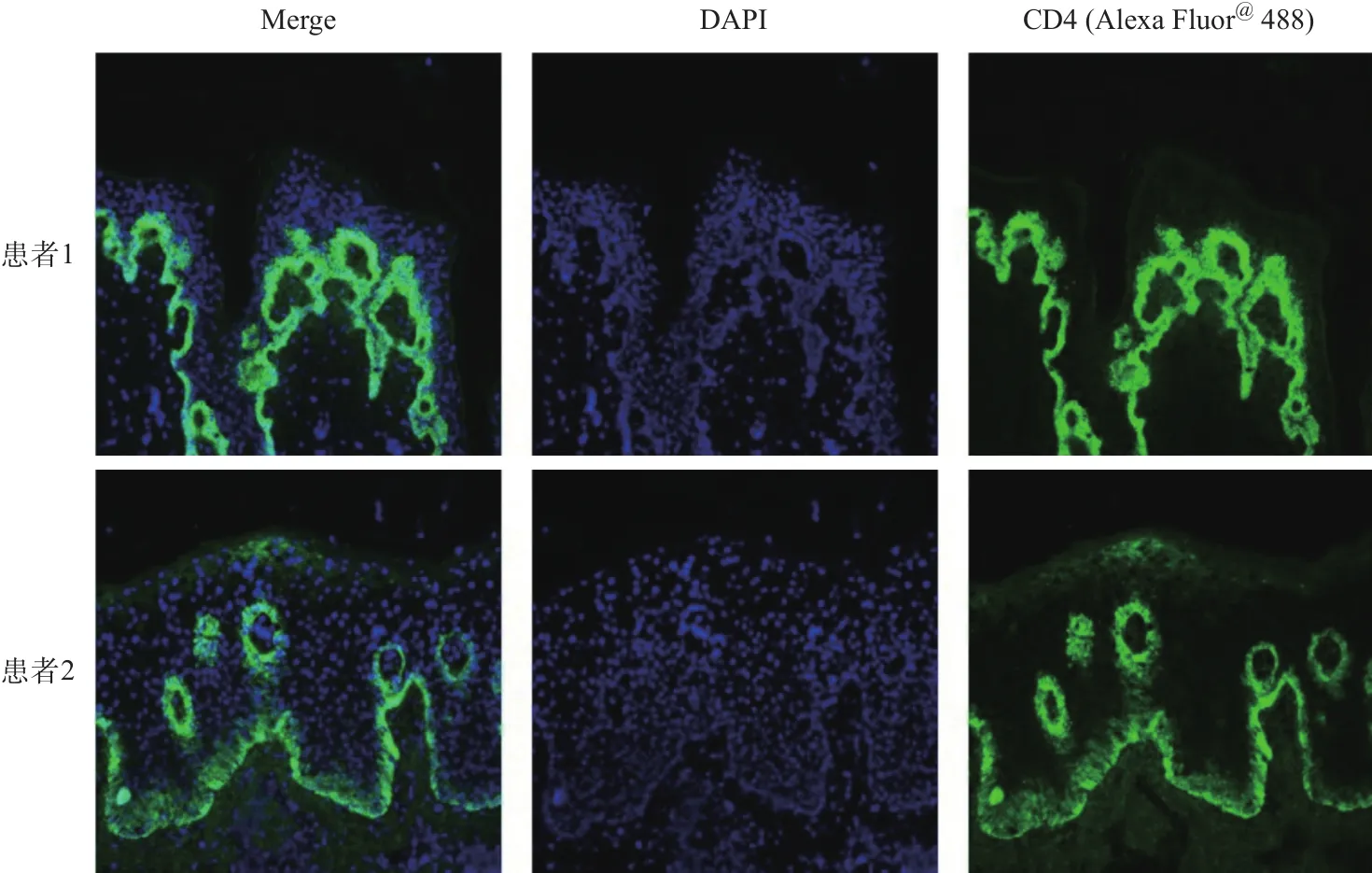
图2 银屑病患者皮肤样本免疫荧光染色结果(×200)
2.2 银屑病小鼠模型
2.2 .1 小鼠皮损临床表现及PASI评分:造模后7 d,WT对照组和IL-10-/-对照组小鼠背部区域皮肤光滑平整,无任何炎性症状和增厚现象,而WT造模组和IL-10-/-造模组小鼠均出现银屑病样临床症状,背部皮损区域出现红斑并覆盖大量多层鳞屑,表皮增厚隆起。IL-10-/-造模组小鼠皮损处红斑、鳞屑及肥厚的程度较WT造模组严重。见图3A。
PASI评分结果表明,WT造模组和IL-10-/-造模组小鼠从造模后第2天开始皮损处红斑评分、鳞屑评分、皮肤浸润厚度评分及PASI总评分和耳朵厚度均升高,而后逐渐加重并于第7天达到高峰,差异有统计学意义(P<0.001)。与对应的对照组相比,造模后第2天至第7天WT造模组和IL-10-/-造模组小鼠皮损处红斑评分、鳞屑评分、皮肤浸润厚度评分及PASI总评分和耳朵厚度均升高,差异有统计学意义(P<0.001);除造模后第2天WT造模组和IL-10-/-造模组小鼠皮损处红斑评分差异无统计学意义外 (P>0.05),IL-10-/-造模组小鼠皮损处红斑评分、鳞屑评分、皮肤浸润厚度评分及PASI总评分和耳朵厚度与WT造模组相比均显著升高(P<0.05)。WT对照组和IL-10-/-对照组小鼠皮肤状况差异无统计学意义(P>0.05)。见图3B。
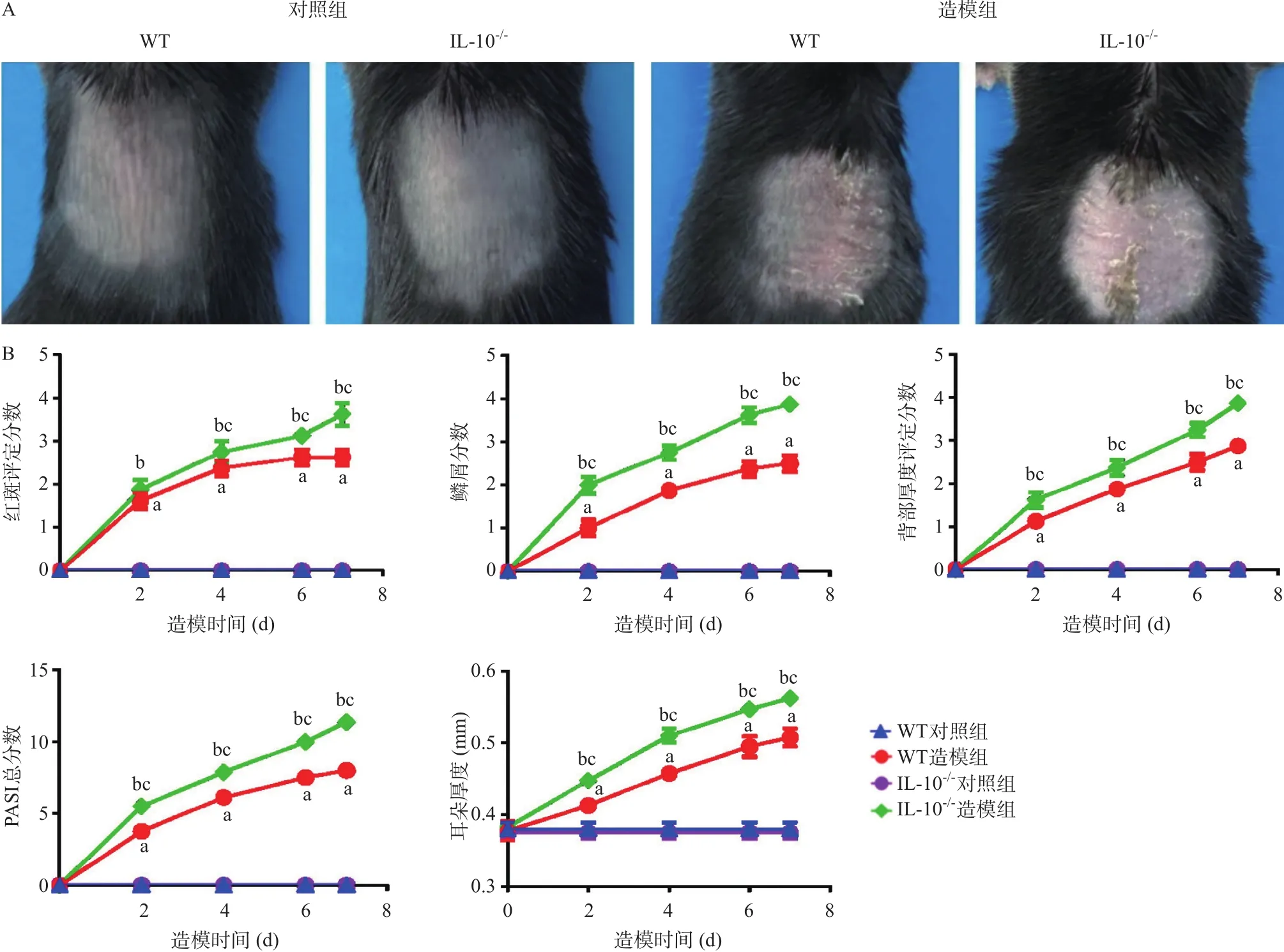
图3 小鼠银屑病模型背部皮肤PASI评分和耳朵厚度
2.2 .2 组织病理学表现:WT对照组和IL-10-/-对照组小鼠的背部区域皮肤表皮平坦,角质层较薄,颗粒层为1~3层,未出现炎症反应。WT造模组和IL-10-/-造模组小鼠均出现表皮明显增厚、颗粒层减少或消失、角质层角化过度、表皮层棘层肥厚、表皮突向下延伸和真皮层炎症细胞浸润等银屑病皮损典型的病理特征。IL-10-/-造模组小鼠的背部皮肤炎症反应强于WT造模组小鼠且表皮增厚现象更为明显。耳部皮损改变趋势与背部相一致。见图4。
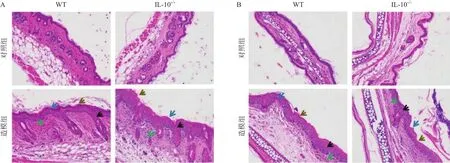
图4 小鼠皮肤组织HE染色结果(×200)
WT造模组小鼠背部皮肤表皮垂直厚度大于WT对照组,IL-10-/-造模组小鼠背部皮肤表皮垂直厚度大于IL-10-/-对照组和WT造模组,差异均有统计学意义(P<0.05)。同样,WT造模组小鼠耳朵皮肤表皮垂直厚度大于WT对照组,IL-10-/-造模组小鼠耳朵皮肤表皮垂直厚度大于IL-10-/-对照组和WT造模组,差异均有统计学意义(P<0.05)。见表1。
表1 各组小鼠皮损部位表皮平均垂直厚度比较(每组n=8,±s,μm)
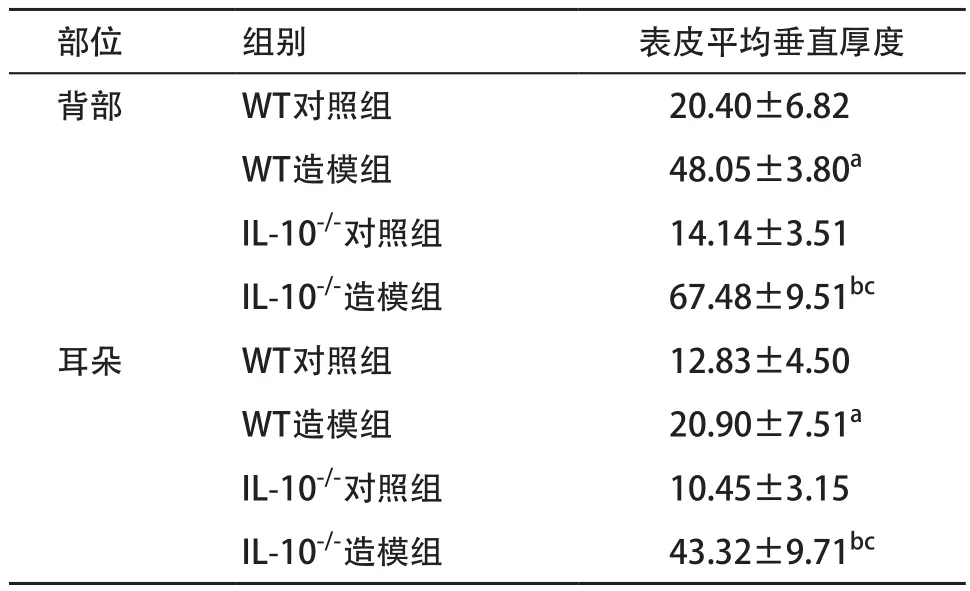
表1 各组小鼠皮损部位表皮平均垂直厚度比较(每组n=8,±s,μm)
与WT对照组比:aP<0.05;与IL-10-/-对照组比:bP<0.05;与WT造模组比:cP<0.05
部位 组别 表皮平均垂直厚度背部 WT对照组 20.40±6.82 WT造模组 48.05±3.80a IL-10-/-对照组 14.14±3.51 IL-10-/-造模组 67.48±9.51bc耳朵 WT对照组 12.83±4.50 WT造模组 20.90±7.51a IL-10-/-对照组 10.45±3.15 IL-10-/-造模组 43.32±9.71bc
2.2 .3 免疫组化染色:WT造模组小鼠皮损组织中IL-10阳性表达率低于WT对照组,差异有统计学意义(P<0.05)。WT造模组和WT对照组小鼠皮损CD19阳性表达率差异无统计学意义(P>0.05)。而IL-10-/-造模组小鼠CD19阳性表达率略高于IL-10-/-对照组和WT造模组,差异均有统计学意义(P<0.05)。见图5。
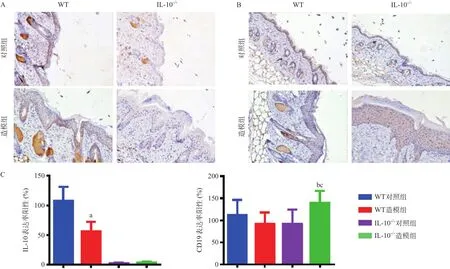
图5 小鼠背部病损皮肤组织IL-10及CD19免疫组化染色结果(×200)
2.2 .4 免疫荧光染色:WT对照组和IL-10-/-对照组小鼠CD4的阳性表达主要分布于表皮-真皮交界处,而WT造模组中CD4的阳性表达遍布整个表皮层,IL-10-/-造模组小鼠皮肤组织表皮层和真皮层均存在明显的阳性表达。这提示随着银屑病的发展与炎症程度的加深,辅助性T细胞的增殖逐步从表皮-真皮交界处向表皮迁移,进而引起皮肤的增厚。见图6。
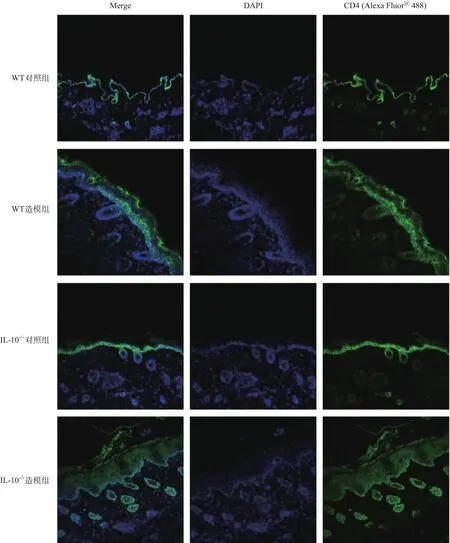
图6 小鼠免疫荧光染色结果(×200)
3 讨论
银屑病是一种多因素引起的慢性炎症性皮肤病,目前发病机制不明,一般认为是免疫系统紊乱和皮肤组织细胞相互作用的结果,可引起红斑、界限清楚的椭圆形斑块,以及鳞屑等临床症状[10]。近年来,免疫和炎症性因素被认为是造成银屑病的主要原因。
IMQ是Toll样受体(Toll-like receptors, TLR)7/8的激动剂,临床研究结果表明其可诱导小鼠皮肤出现银屑病样皮损及病理生理变化[11]。本研究采用连续7 d涂抹IMQ,使其局部作用于WT小鼠和IL-10-/-小鼠背部和耳朵皮肤,诱导银屑病动物模型。结果发现造模组小鼠涂药部位皮肤明显增厚并出现红斑、磷屑,且IL-10-/-造模组小鼠皮肤相较于WT造模组变化更大,HE结果显示造模组小鼠皮肤表皮层出现不同程度的增厚,IL-10-/-造模组小鼠背部皮肤改变程度比WT造模组小鼠更强,明显可见角质层角化过度,Munro微脓肿,透明层颗粒减少或消失,并且表皮层棘层过度肥厚,出现Kogoj海绵状微脓疡并向下延伸呈钉突状,真皮层部位存在炎症细胞浸润以及血管扩张等现象。同时结合临床患者样本比较,确认通过IMQ造模能产生类银屑病样皮损,该造模方法省时可靠并操作简便,较适合于常规实验的开展。
IL-10是一类具有免疫抑制作用的细胞因子,单核巨噬细胞是其主要生理来源,辅助性T细胞、树突状细胞(dendritic cells, DC)、调节性T细胞等也具有产生IL-10的能力[12-13];IL-10能降低抗原提呈细胞(antigen-presenting cells, APC)对抗原的提呈能力及诱导DC细胞的凋亡,对APC起到明显抑制作用[14];并能抑制DC和巨噬细胞分泌促炎因子如IL-1、IL-6和TNF等,从而导致T细胞活性和免疫应答能力的降低[15]。MAVROPOULOS等[16]通过阿普斯特(Apremilast,PDE4的抑制剂,可以增加IL-10分泌)治疗30例银屑病和20例银屑病关节炎患者,发现阿普斯特治疗后B10(IL-10+CD19+)细胞在所有患者体内均有所增加,并与银屑病患者皮肤和关节的临床改善相关。张力文等[17]采用免疫组织化学法发现Foxp3、IL-10在寻常性银屑病患者皮损组织中的表达显著低于正常皮肤组织;本研究在动物模型中发现野生型小鼠造模后皮损组织IL-10阳性表达低于对照组,与该文献结果一致,提示随着模型的建立,局部皮肤部位IL-10表达受到抑制,从而导致炎症反应加重。另外,CD19是B细胞的主要表面标记物。近年来有研究发现B细胞可能在银屑病的发病机制中也起了十分重要的作用[18-19]。在野生型小鼠中,造模组皮损区CD19的含量较对照组有下降的趋势,推测局部皮肤组织消耗B细胞来对抗炎症的产生。但是在IL-10-/-小鼠中,造模组皮损区CD19含量又有所升高,提示可能由于IL-10的敲除,导致B细胞在该类型小鼠皮肤内局部病灶区域表达有所增加。
CD4是T淋巴细胞的表面标记物,可用于识别辅助性T细胞。CD4+辅助性T细胞(Th细胞)对机体的特异性免疫和非特异性免疫均有重要的调节作用,其功能为产生多种细胞因子,促进T/B细胞分化增殖,是机体内一类重要的免疫调节细胞。根据Th细胞分泌的细胞因子类型的不同,Th分成两个亚型:Th1与Th2[20]。IL-10是主要由CD4+Th2细胞分泌的一种发挥负调控作用的细胞因子,具有强大的抗炎作用。本研究中免疫荧光结果显示,CD4在WT对照组和IL-10-/-对照组中的阳性表达主要定位于表皮-真皮交界处,而在WT造模组中CD4的阳性表达遍布整个表皮层,IL-10-/-造模组皮肤组织真皮层也存在明显的阳性表达。提示随着银屑病的发展与炎症程度的加深,辅助性T细胞的增殖逐步从表皮-真皮交界处向表皮迁移,进而引起皮肤的增厚。IL-10-/-小鼠由于本身存在免疫缺陷,机体缺少抑炎因子作用。病灶中辅助性T细胞在真皮内部阳性的聚集和增加可能是由于局部增殖或体外增殖的T细胞再循环而聚集。Th1及其分泌的IFN-γ对银屑病的产生起主导作用[21-22],IL-10的缺失加剧了银屑病中Th1/Th2细胞平衡失调,所以病情的发生与进展更加严重。近年来也有研究显示在银屑病患者外周血中存在Th17/Treg失衡并与其发病有着一定的关系[23-26]。 OWCZARCZYK-SACIONEK等[27]通过探究银屑病患者皮肤和血清中Treg标记物以及保护性细胞因子的表达情况,发现血清中IL-17、IL-23水平随寻常型银屑病的加重而上升,血清IL-10、TGF-β水平随之而下降,说明寻常型银屑病发生发展过程中发生了Th17/Treg细胞及相关细胞因子的失衡。IL-10本身抑制Th1细胞的IFN-γ产生,IFN-γ缺乏就会增强APC的失活,IL-10也可以减少巨噬细胞分泌IL-23,这种细胞因子对于Th17细胞免疫是必须的[28]。
本研究利用IL-10-/-和WT小鼠共同探讨IL-10与银屑病的关系,成功建立了IMQ诱导的银屑病模型,同时结合银屑病临床患者样本,从形态学方面对两者的关系进行初步探索,明确了IL-10相对或绝对的缺乏,会导致持续的免疫激活,加重银屑病的发生和进展,其可能通过增加鳞屑发生,促进皮肤表皮层角质形成细胞的增殖与分化,从而加重银屑病样皮损改变。但银屑病病因及发病机制复杂,仍需进一步深入的研究及探索。
