绿色合成石墨烯对水体中镉离子的去除效果及其对大肠杆菌的毒性
2023-01-19周元元陈祖亮
周元元,甘 莉,陈祖亮
(福建省污染控制与资源循环利用重点实验室,福建师范大学环境与资源学院、碳中和现代产业学院,福建 福州 350007)
还原氧化石墨烯(reduced graphene oxide,rGO)是一种sp2杂化碳同素异形体的二维纳米材料[1],结构独特,具有优良的电性能,广泛应用于电子、能源和环境修复等多个研究领域[2].rGO中存在大量缺陷、褶皱和残余的含氧官能团,是染料、重金属等污染物的理想吸附剂[3].目前,制备rGO的方法主要有化学气相沉积法、外延生长法和化学还原法[4].在现有的研究方法中,化学还原法简便且可大规模制备,是商业上常用的方法[5].然而由于化学还原过程涉及有毒还原剂,如联氨和氢化铝锂等,可能对环境和人体产生毒害作用,在一定程度上限制了其应用[2].
为避免化学还原法带来的危害,人们开始探索反应条件温和且对环境友好的绿色还原剂,其中含有大量抗氧化性物质的植物提取液被用来作为氧化石墨烯的还原剂和稳定剂[2,6].研究发现,绿茶提取液中的生物分子可将氧化石墨烯还原为rGO,并包裹rGO[7];万寿菊花提取物也可作为还原剂合成rGO[8].但无论哪种方法合成的rGO都不可避免地进入土壤、水体和大气等生态环境中,因此研究rGO对人体健康和环境生态的危害十分必要.报道称rGO会对心肌组织造成损伤,并会改变心肌组织中几种心肌酶的活性[9].也有研究表明,石墨烯对污泥中嗜酸硫杆菌(Acidithiobacillussp.)的生长会产生负面影响[10],但目前对绿色合成的rGO毒性还缺乏系统的研究.
本文在前期研究的基础上,利用桉树叶提取液合成还原氧化石墨烯(EL-rGO)[2],并去除水体中的Cd2+;同时通过观察菌体形貌,测定大肠杆菌在rGO中的死细胞与活细胞的比例(简称死/活比例)、乳酸脱氢酶(LDH)释放量和细胞内活性氧(ROS)水平来评估EL-rGO与商业还原氧化石墨烯(C-rGO)对大肠杆菌的毒性.
1 材料与方法
1.1 试剂与仪器
材料与试剂:石墨粉,上海阿拉丁生化科技股份有限公司;商业石墨烯(C-rGO),苏州碳丰石墨烯科技有限公司;磷酸二氢钾、十二水合磷酸氢二钠、无水硫酸镁、硝酸钾、氯化铵、氯化钠、葡萄糖和磷酸缓冲盐溶液(PBS),上海麦克林生化科技有限公司;胰蛋白、酵母粉,英国OXOID公司;LDH测定试剂盒,南京建成生物研究所;LIVE/DEAD BacLight细菌活力试剂盒,美国赛默飞公司;ROS试剂盒,上海碧云天生物技术有限公司;大肠杆菌,河南省工业微生物菌种工程技术研究中心;桉树叶,福建省福清农场.所有化学试剂级别均为分析纯.
仪器:UV-9000紫外可见分光光度计,上海元析仪器有限公司;Regulus 8100扫描电镜,日本日立公司;Guavaeasycyte 5 HPL流式细胞仪,美国Luminex公司;Agilent 200火焰原子吸收光谱仪,上海安捷伦科技公司.
1.2 氧化石墨烯的制备
采用改良Hummers法氧化石墨粉合成氧化石墨烯[2].
1.3 桉树叶提取液合成还原氧化石墨烯
称取干燥桉树叶10.0 g磨成粉末加入到1.0 L超纯水中,恒温80 ℃水浴加热1 h,冷却过滤,得到桉树叶提取液.将0.1 g氧化石墨烯与200.0 mL桉树叶提取液混合,恒温80 ℃搅拌8 h,待溶液冷却至室温用0.45 μm滤膜过滤,将固体分别用无水乙醇和超纯水冲洗3次,冷冻干燥48 h[2].
1.4 镉离子去除实验
将0.1 g C-rGO与EL-rGO分别投加到200.0 mL浓度为40 μmol·L-1、pH为6的Cd2+溶液中,恒温25 ℃反应,在5、10、20、40、60、120、180 min时取5 mL通过0.22 μm滤膜过滤,利用火焰原子吸收光谱仪在228.8 nm波长测定滤液中Cd2+质量浓度,平行3组.通过式(1)计算去除率评价rGO对Cd2+的去除性能.

(1)
式中ρ0为Cd2+溶液的初始质量浓度,mg·L-1;ρt为t时刻Cd2+的质量浓度,mg·L-1.
1.5 毒性实验
1.5.1 培养基
LB培养基:10.0 g胰蛋白胨,5.0 g酵母提取物,10.0 g NaCl溶于1.0 L超纯水中,121 ℃高压灭菌21 min.
液体培养基:1.8 g KH2PO4,3.5 g Na2HPO4·12H2O,0.1 g MgSO4,1.0 g KNO3,3.0 g葡萄糖,1.0 g NH4Cl溶于1.0 L超纯水中,调节pH至7.0~7.2,105 ℃高压灭菌21 min.
1.5.2 还原氧化石墨烯对大肠杆菌的毒性实验
1.5.2.1 大肠杆菌预处理
将大肠杆菌接种至LB培养基中37 ℃、250 r·min-1培养12 h,移至离心管中,8 000 r·min-1离心3 min弃上清液,用PBS冲洗再离心,重复3次,加入PBS稀释菌体制成菌悬液,用分光光度计测定600 nm处的光密度(D600 nm),调节菌液D600 nm为1.0,于4 ℃条件下保存备用.按体积分数3%的接种量将大肠杆菌分别接种至含1.0、50.0 mg·L-1C-rGO的液体培养基中.同时,按相同步骤将大肠杆菌分别接种至含1.0、50.0 mg·L-1EL-rGO的液体培养基中,于30 ℃在200 r·min-1恒温摇床中培养48 h.以不含rGO作为空白对照,所有实验平行3次.
1.5.2.2 扫描电镜测定
将1.5.2.1培养后的菌液离心收集菌体,PBS洗涤3次,用体积分数2.5%的戊二醛缓冲液浸泡菌体过夜,固定后的菌体用体积分数为30%、50%、70%、80%、90%、95%、100%的乙醇溶液逐级脱水10 min,最后菌体冷冻干燥48 h,通过SEM观察rGO作用大肠杆菌前后的表面形貌.
1.5.2.3 乳酸脱氢酶释放量测定
将1.5.2.1处理后的菌液离心收集上清液,取50.0 μL按照LDH试剂盒要求测定上清液中的LDH含量.
1.5.2.4 活性氧含量测定
将1.5.2.1处理后的菌液收集菌体装载探针.用PBS按照体积比1∶1 000稀释荧光探针,使其浓度为20.0 μmol·L-1,将菌体悬浮于探针中,调节菌液浓度为每毫升菌液中含106~107个细胞,37 ℃培养20 min,PBS洗涤3次,最后用流式细胞仪检测.
1.5.2.5 死细胞与活细胞测定
将1.5.2.1处理后的菌液离心收集菌体,用质量分数0.85%无菌氯化钠冲洗3次,稀释和调节菌液浓度,使每毫升菌液中含106个细胞,取100.0 μL菌液,用LIVE/DEAD BacLight试剂盒染色,室温下避光培养20 min,混合均匀用流式细胞仪测定,计算死细胞与活细胞的比例.
2 结果与讨论
2.1 不同还原氧化石墨烯对镉离子的去除率
图1是不同rGO去除Cd2+的时间曲线,C-rGO对Cd2+的去除速度慢且3 h后去除率仅为5.38%;而EL-rGO对Cd2+的去除速度快,5 min后去除率达61.9%,3 h后达70.2%,反应60 min后达到平衡.由此可知,两种rGO都能去除Cd2+,但EL-rGO的去除速度和效率远高于C-rGO.这可能是以下原因造成的:(1)EL-rGO表面带负电荷,在较高的pH值下更容易形成静电和螯合/络合作用促进吸附Cd2+[11];(2)EL-rGO表面覆盖的生物质使其具有较好的分散性,能够均匀地分散在Cd2+溶液中,提升了EL-rGO与Cd2+的传质效率[7],从而提高了去除率;(3)提取液中的生物质包裹EL-rGO,增强了材料的共轭结构,提高了供电子能力,络合更多的Cd2+[7].通过比较两种材料对Cd2+的去除率,EL-rGO有较高的去除率,可作为吸附剂继续研究,但使用EL-rGO是否产生毒性效应,还需进一步研究.

图1 EL-rGO与C-rGO对Cd2+的去除率-时间曲线Fig.1 Removal efficiency-time curves of EL-rGO and C-rGO for Cd2+
2.2 毒性实验
2.2.1 扫描电镜测定
大肠杆菌与不同rGO共存后的表面形貌如图2所示,图2a是对照组,大肠杆菌呈短杆状,结构完整且表面纹路清晰.图2b和2c则是经过1.0、50.0 mg·L-1C-rGO处理后大肠杆菌的形貌,菌体呈现不同程度的碎裂、裂解,甚至有部分菌体碎裂成不规则的碎片.在可视范围内,50.0 mg·L-1C-rGO中的菌体损伤情况比1.0 mg·L-1C-rGO严重.这是因为rGO比较锋利,切割和刮破菌体,大量细胞质外排.这与文献报道的联氨合成的rGO具有锋利的边缘导致菌体损伤,从而使rGO具有更高的抗菌活性相符[12].图2d是1.0 mg·L-1EL-rGO处理的大肠杆菌形貌,细菌表面纹路清晰,在可视范围内小部分菌体发生破裂;而图2e是经过50.0 mg·L-1EL-rGO处理后,菌体之间不规则地黏结在一起,在可视范围破损较少,表面纹路模糊,这可能是EL-rGO包裹在菌体表面[13].在质量浓度为1.0 mg·L-1时,相较于EL-rGO,C-rGO中菌体表面光滑,破损较多;而质量浓度为50.0 mg·L-1时,C-rGO中的菌体破损明显增加,EL-rGO中菌体表面更粗糙.总体而言,两种rGO对大肠杆菌都会造成损伤,这是由于机械破碎和附着包裹作用,且在相同浓度下,C-rGO处理的大肠杆菌比EL-rGO处理的破损严重,损伤更大.

(a)对照组;(b)1.0 mg·L-1 C-rGO+菌;(c)50.0 mg·L-1 C-rGO+菌;(d)1.0 mg·L-1 EL-rGO+菌;(e)50.0 mg·L-1 EL-rGO+菌图2 不同质量浓度rGO处理大肠杆菌的扫描电镜图Fig.2 Scanning electron micrographs of E.coli treated with different concentrations of rGO
2.2.2 细胞外乳酸脱氢酶测定
LDH是一种稳定存在于细胞内部的酶,反映细胞膜损伤程度和细胞膜的通透性[14].图3是大肠杆菌在1.0、50.0 mg·L-1rGO中的LDH释放情况,以空白组为100%来对比各实验组.在C-rGO实验组中,1.0 mg·L-1C-rGO处理后的大肠杆菌LDH释放量高于50.0 mg·L-1处理的大肠杆菌,这是由于低质量浓度的C-rGO难以在菌液中团聚,与大肠杆菌细胞的相互作用更大,导致细胞损伤,而50.0 mg·L-1比1.0 mg·L-1的C-rGO更容易团聚[10],相互作用小,从而损伤较小.而在EL-rGO实验组中,50.0 mg·L-1中的大肠杆菌LDH的释放量比1.0 mg·L-1中的LDH释放量高,说明在50.0 mg·L-1EL-rGO下,大肠杆菌细胞的受损程度增加.同时所有实验组的LDH释放量均高于对照组,这表明两种rGO都破坏了细胞膜的完整性,对细胞质膜造成机械损伤,触发膜应激反应[10,14].
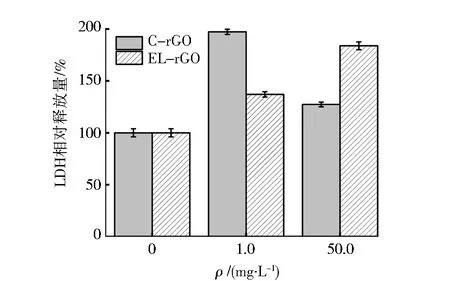
图3 大肠杆菌在不同浓度rGO作用下LDH相对释放量Fig.3 Relative release of LDH from E.coli under the action of different concentrations of rGO
2.2.3 细胞内活性氧分析
细胞受到外界刺激会做出氧化应激反应,诱导细胞内的ROS含量瞬时增加,致使细胞内氧化和抗氧化状态失去平衡,发生氧化应激[15].图4为1.0、50.0 mg·L-1rGO作用大肠杆菌48 h后细胞内ROS的含量变化,以空白组为100%来对比ROS产生情况,实验组的ROS产生量均高于对照组,说明大肠杆菌在两种rGO作用下都会产生氧化应激.在相同浓度下,EL-rGO组的大肠杆菌ROS产生量均高于C-rGO组,说明大肠杆菌在EL-rGO中氧化应激较强,这可能是EL-rGO表面的生物质包裹层与细菌细胞接触,甚至进入细胞内部,与细胞内物质相互作用,诱导较多的脂质过氧化(LPO)[16],导致细胞膜流动性和通透性发生变化,细胞活力降低,最终细胞死亡[17].

图4 不同质量浓度rGO处理后的大肠杆菌细胞内的ROS水平变化Fig.4 Changes in intracellular ROS levels in E.coli treated with different concentrations of rGO
2.2.4 死细胞和活细胞比例分析
LIVE/DEAD BacLight试剂盒是基于细胞膜的完整性而对细菌群体的活力进行监测,已经或即将死亡的大肠杆菌因细胞膜受到损伤被染成红色;而细胞膜完整的细胞被染成绿色[18].图5是大肠杆菌在不同质度浓度的C-rGO与EL-rGO作用下的死/活比例.50.0 mg·L-1rGO中的大肠杆菌死/活比例高于1.0 mg·L-1rGO中的大肠杆菌.说明rGO毒性受质量浓度的影响,这与ROS结果相符.在1.0 mg·L-1时,C-rGO与EL-rGO中的大肠杆菌的死/活比例分别为1.25和1.26,表明两种rGO对大肠杆菌都有影响,但两者差别不大.而50.0 mg·L-1时,EL-rGO中的死/活比例为1.9,高于C-rGO中大肠杆菌的死/活比例,表明50.0 mg·L-1的EL-rGO比C-rGO毒性略大,初步推测EL-rGO表面覆盖有抗菌活性的生物质[19],导致毒性较大.但同时也证明EL-rGO比C-rGO抗菌性能更好,更适合作为抗菌材料.

图5 大肠杆菌在不同rGO中的死/活比例Fig.5 Dead/live ratio of E.coli in different rGO
3 结论
(1)25 ℃时,在pH=6,40 μmol·L-1的Cd2+溶液中投加0.1 g·L-1rGO,3 h后EL-rGO对Cd2+的去除率达70.2%,远高于C-rGO对Cd2+的去除率5.38%,说明EL-rGO对重金属污染物有较高的去除率.
(2)通过扫描电镜观察,结合大肠杆菌在rGO中的死/活比例、乳酸脱氢酶相对释放量和胞内活性氧水平的测定可知,两种rGO在1.0 mg·L-1时,均可破坏大肠杆菌细胞膜的完整性,造成细胞损伤,但毒性差别不大;在50.0 mg·L-1时,EL-rGO毒性则相对略大,具有一定的抗菌性能,可作为抗菌材料研究.
(3)EL-rGO合成过程绿色友好,不涉及有毒物质,有利于EL-rGO在环境领域的广泛应用.
