超高效液相色谱-串联质谱法定量检测蜂王浆主蛋白1~3
2023-01-19陈勇江唯健王加俊张帆沈立荣
陈勇,江唯健,王加俊,张帆,沈立荣*
(1.浙江大学生物系统工程与食品科学学院,杭州 310058;2.杭州蜂之语蜂业股份有限公司,杭州 311500)
蜂王浆是由5~15 日龄工蜂头部营养腺(包括脑后腺、咽下腺和上颚腺等)分泌的特殊白色乳状物质,专供蜂王和3日龄内工蜂幼虫食用,是决定蜜蜂雌性幼虫发育成为蜂王还是工蜂的关键食物因子[1]。作为一种营养保健品,蜂王浆含有的活性物质很多,其功能与所含的生物活性成分有关,主要包括蛋白质、碳水化合物、脂类和10-羟基-2-葵烯酸(10-hydroxydec-2-enoic acid,10-HDA)等[2]。在常温下,蜂王浆的生物活性会随贮存时间的延长而下降,导致其极易变质而失去营养功能。目前,10-HDA 含量是我国国家标准中衡量蜂王浆品质优劣的主要指标(GB 9697—2008)[3],但在长期贮存过程中,蜂王浆中的10-HDA 含量非常稳定,并不适合作为代表蜂王浆新鲜度的指标[4]。
蛋白质是蜂王浆的主要活性物质,其含量约占蜂王浆干质量的30%~50%,其中由9 个成员(MRJP1~9)组成的蛋白家族——王浆主蛋白(major royal jelly proteins, MRJPs)约占蜂王浆中可溶性蛋白含量的90%[5]。在常温贮存条件下,由于蜂王浆中内源性酶的作用,MRJPs 会随着贮存时间的推移而降解,引起结构改变和含量下降,丧失关键生物活性。因此,日本学者KAMAKURA等[6]提出以MRJPs 中含量最高的MRJP1 作为蜂王浆新鲜度的检测指标。BÍLICOVÁ 等[7]和本团队[4]先后研发了MRJP1 含量的间接酶联免疫吸附试验(enzyme linked immunosorbent assay, ELISA)快速检测法。近年来,胡菡等[8]制备和研发了以MRJP3为抗原的单克隆抗体和ELISA 检测方法。但ELISA 是比较粗放的定性定量检测方法,而超高效液相色谱-串联质谱定量检测方法是当今蛋白质组学研究中最重要的技术手段之一,在食品特定蛋白质定量检测中已被广泛应用[9-10],在现有条件下更适合用于MRJPs的检测。
2018 年,LIN 等[11]报道了采用超高效液相色谱-串联质谱法,以筛选出的单一MRJP1 特异性多肽“FFDYDFGSDER”为标志物检测MRJP1 含量的方法,用于判断蜂王浆的真假和质量优劣。但MRJPs 是一组需要通过整体协同作用发挥生物活性的功能蛋白,特别是主蛋白MRJP1~5 均属于糖基化蛋白,占MRJPs 总量的80%以上[5]。事实上,蜂王浆促进生育和抗衰老功能是MRJPs 整体协同作用的结果[12],而以往报道的检测蜂王浆新鲜度的方法基本以某种单一MRJP 含量为主要目标,缺乏多种蛋白组合的综合性评价方法。为了克服现有技术的不足,本研究探索了一种采用MRJP1~3 的3 种标志多肽精准检测蜂王浆新鲜度的方法,以期为蜂王浆质量评价提供一种具有高度特异性的新技术。
1 材料与方法
1.1 实验材料
鲜蜂王浆:从杭州碧于天保健品有限公司合作养蜂场采集,当天将采集的蜂王浆在-20 ℃条件下带回实验室,并保存于-80 ℃冰箱中。
主要试剂:二硫苏糖醇(dithiothreitol,DTT)、碘代乙酰胺(iodoacetamide,IAA)和碳酸氢铵,均购自美国Sigma 公司;纯甲酸、乙腈和甲醇均为高效液相色谱(high performance liquid chromatography,HPLC)级,购自德国Merck 公司;重组牛胰蛋白酶,购自杭州谱胜检测科技有限责任公司;氧化铜、铜、氧化铬、高氯酸镁、银棉和石英棉,均购自英国PDZ-Europa 公司;硫酸和二水合钨酸钠,购自北京化学工业集团有限公司。
标志多肽YNGVPSSLNVISK、TLQMIAGMK和LTVAGESFTVK以及它们的同位素标志肽YNG VPSSL*NVISK、TL*QMIAGMK 和L*TVAGESFTVK由安徽省国平药业有限公司合成。
1.2 仪器与设备
Acquity 超高效液相色谱仪、Synapt G2 HDMS飞行时间质谱仪和Xevo-TQD 三重四极杆质谱仪(美国Waters 公司),SK30G 超声波清洗器(上海科导超声仪器有限公司),超低温冰箱(日本Panasonic公司),BS124S 电子天平(德国Sartorius 公司),SAS-67120 纯水仪(法国Millipore 公司),DKS-24电热恒温水浴锅(嘉兴市中新医疗仪器有限公司),旋涡混合器(北京市长安仪器厂),Integra-CN 稳定碳氮同位素分析仪(英国PDZ-Europa 公司),配备50 mL 离心管的Z320 离心机(德国Berthold Hermle公司)。
1.3 方法
1.3.1 王浆粗蛋白制备
将鲜蜂王浆溶于磷酸盐缓冲液(pH 7.4),以1.2×104r/min 离心30 min,取上清液并置于透析袋(截留分子量8 000~1.4×104Da)中,在4 ℃条件下用双蒸水透析24 h得到王浆粗蛋白,保存于-80 ℃冰箱中,备用。
1.3.2 王浆主蛋白的提取及酶解方法
称取0.1 g 蜂王浆样品于8 mL 碳酸氢铵溶液(0.1 mol/L)中,充分溶解后转入100 mL容量瓶定容。取930 μL上述溶解液与10 μL DTT(100 mmol/L)于2 mL离心管中,振荡混匀后,置于50 ℃恒温水浴锅中孵育30 min。将30 μL IAA(100 mmol/L)加入上述混合液,振荡混匀,然后于黑暗环境、室温条件下反应30 min。随后,加入10 μL 重组牛胰蛋白酶溶液(500 μg/mL)并振荡混匀,置于37 ℃恒温水浴锅中酶解,2 h 后加入10 μL 10%甲酸终止酶解反应。最后,加入10 μL同位素标志肽YNGVPSSL*NVISK、TL*QMIAGMK 和L*TVAGESFTVK 的混合物(10 μg/mL),经0.22 μm膜过滤后,上机分析。
1.3.3 标志肽的标准曲线配制
取YNGVPSSLNVISK 标准品溶解于纯水,配制成质量浓度为10~1 600 ng/mL的溶液,其中包含100 ng/mL 同位素标志肽YNGVPSSL*NVISK;取TLQMIAGMK标准品溶解于纯水,配制成质量浓度为10~600 ng/mL的溶液,其中包含100 ng/mL同位素标志肽TL*QMIAGMK;同样,取LTVAGESFTVK标准品溶解于纯水,配制成质量浓度为10~600 ng/mL 的溶液,其中包含100 ng/mL 同位素标志肽L*TVAGESFTVK。上述3种加标溶液经0.22 μm膜过滤后,用于上机进样分析,建立标准曲线。
MRJP1~3 标准曲线的建立和含量计算:在Masslynx v4.1 自带定量软件Targetlynx 中,以标准品的浓度为横坐标(x),以标准品的实际检测峰面积与各自内标峰面积的比值为纵坐标(y),绘制标准曲线。将所测多肽中实际检测峰面积与内标峰面积比值代入标准曲线方程,计算多肽浓度。
1.3.4 超高效液相色谱-串联四极杆飞行时间质谱(ultra-high performance liquid chromatographytandem quadrupole-time-of-flight mass spectrometry,UPLC-Q-TOF/MS)定性分析
使用C18 蛋白分析柱(2.1 mm×100 mm,1.7 μm),A相为0.1%甲酸溶液,B相为0.1%甲酸-乙腈溶液,流速为0.3 mL/min,进样量为5 μL,柱温为40 ℃,样品室温度为10 ℃。洗脱条件:0~20 min 3%~40% B,20~20.1 min 40%~100% B,20.1~22.1 min 保持100%B,22.1~22.2 min 100%~3%B,最后平衡2.8 min。采用配备电喷雾离子源(electron spray ionization,ESI)的Synapt G2 HDMS 高分辨质谱仪进行数据采集。具体检测条件如下:采用ESI+模式,毛细管电压为3 kV,样品锥孔电压为25 V,萃取锥孔电压为4 V,离子源温度为120 ℃,脱溶剂温度为350 ℃,锥孔反吹气流为50 L/h,脱溶剂气流为650 L/h,循环碰撞能量为15~35 V,参比物质为亮氨酸-脑啡肽(leucine-enkephalin)。使用ProteinLynx全球服务器(ProteinLynx Global Server,PLGS)v2.5 软件(美国Waters公司)对获得的数据进行分析,相关参数设置如下:采用电喷雾模式,水解酶为胰蛋白酶,锁定质量为1 556.277 1 Da,允许漏切数为1,每个肽的最小片段离子匹配数为2,每个蛋白质的最小片段离子匹配数为5,固定修饰为氨基甲酰胺C(carbamdomethyl C),采用UniProtKB蛋白质数据库(https://www.uniprot.org/blast),其他参数为默认值。
1.3.5 超高效液相色谱-串联三重四极杆质谱(ultra-high performance liquid chromatography-triple quadrupole tandem mass spectrometry, UPLC-TQMS)定量分析
使用C18 蛋白分析柱(2.1 mm×100 mm,1.7 μm),A相为0.1%甲酸溶液,B相为0.1%甲酸-乙腈溶液,流速为0.3 mL/min,进样量为10 μL,柱温为40 ℃,样品室温度为10 ℃。洗脱条件:0~1 min 3%B,1~1.5 min 3%~20%B,1.5~3.5 min 20%~60%B,3.5~3.6 min 60%~100%B,3.6~4.1 min保持100% B,4.1~4.2 min 100%~3% B,最后平衡1 min。采用配备电喷雾离子源的Xevo-TQD 三重四极杆质谱仪进行数据采集。具体检测条件如下:采用ESI+模式,毛细管电压为3.5 kV,离子源温度为150 ℃,脱溶剂温度为350 ℃,锥孔反吹气流为50 L/h,脱溶剂气流为650 L/h,氩气碰撞压为0.35 Pa。
1.3.6 标志多肽筛选
基于UPLC-TQMS分析,对候选多肽作重复检测,初步剔除峰面积小于2 000的低含量多肽,建立MRJPs候选多肽酶解时间与酶解程度的热图,进一步筛选出同时具备高易酶解性与酶解后高稳定性的候选MRJPs 多肽。高易酶解性多肽的筛选标准是候选多肽的相对峰面积比值在酶解2 h 内达到90%以上,酶解后高稳定性多肽的筛选标准是候选多肽的相对峰面积比值在酶解24 h 后不小于70%。剔除候选多肽中的非特异性多肽。
1.3.7 候选多肽的定量质谱多反应监测分析
使用PLGS 蛋白质组学分析平台,将经UPLCTQMS检测出的MRJPs多肽序列信息输入UniProtKB蛋白质数据库(https://www.uniprot.org/blast),与获取的MRJPs多肽序列进行比对,得到王浆粗蛋白酶解产物中MRJPs多肽的鉴别结果。将经UPLC-QTOF/MS 分析得到的MRJPs 多肽参数导入UPLCTQMS 仪器,建立候选多肽的定量质谱多反应监测(multiple reaction monitoring,MRM)分析方法。
1.3.8 基于MRJP1~3 含量的蜂王浆新鲜度检测
蜂王浆样品模拟加温老化处理:将蜂王浆样品置于40 ℃条件下恒温贮存,每隔7 d 取出部分于-80 ℃冰箱中冷藏,分别编号为A~F,即编号A~F的样品分别是在40 ℃条件下恒温贮存第0、7、14、21、28、35 天的蜂王浆。每个处理重复3 次。按照前述UPLC-TQMS 方法,通过检测样品中的MRJP1~3含量来判定蜂王浆的新鲜度。
1.4 数据处理与分析
采用SPSS 16.0 软件中的新复极差法进行方差分析,以P<0.05表示差异有统计学意义;结果表示为平均值±标准差。
2 结果与分析
2.1 MRJPs 酶解多肽分析
采用PLGS 蛋白质组学分析平台,将经UPLCQ-TOF/MS 检测出的MRJPs 多肽序列信息与从蛋白质数据库UniProtKB 中获取的MRJPs 多肽序列理论信息作对比分析,得到王浆粗蛋白中MRJPs的鉴别结果。如将序列LTVAGESFTVK 提交到UniProtKB 进行比对,获得的3 条信息与序列号为Q17060 的意大利蜜蜂(Apis mellifera ligustica)源MRJP3同源性最高,匹配率达到100%(附图1,http://www.zjujournals.com/agr/CN/10.3785/j.issn.1008-9209.2022.07.272)。通过UPLC-Q-TOF/MS检测出的108 条酶解多肽分别属于MRJP1~7 和MRJP9(表1),未得到MRJP8 的酶解多肽。在检测出的MRJPs多肽中,肽段覆盖率最低的是MRJP9(1.7%),最高的是MRJP1(76.6%),其中MRJP1~3的肽段覆盖率显著高于其余王浆主蛋白,即它们在蜂王浆MRJPs 中含量最高,可作为高含量、高稳定MRJPs标志肽的潜在选择。
鉴于三重四极杆质谱对痕量样品的定量分析具有高灵敏度和良好的定量重现性特点,将经UPLC-Q-TOF/MS 分析得到的多肽参数(包括电荷、分子量和保留时间等)导入UPLC-TQMS仪器,对候选多肽进行定量质谱MRM分析。利用该方法得到的蜂王浆中MRJPs 多肽的检测结果如表1 所示,在108 条候选多肽中只有69 条能在UPLCTQMS中被检测出,其余39条未能被检测出。究其原因,除了仪器误差外,还可能与蜂王浆中某些MRJPs 成员含量较低、酶解多肽响应值不足有关。根据上述结果,剔除不符合标志多肽含量稳定性要求的这39条多肽。
2.2 候选多肽筛选
为了对69 条候选多肽进行初步筛选,通过UPLC-TQMS对它们进行10次连续重复进样分析。从整体结果(图1)看,每条多肽的峰面积与10次重复检测结果的相对标准偏差(relative standard deviation,RSD)间有紧密关联。其中,峰面积小于2 000的35条多肽的重复检测结果的RSD 较高(>15%)。这些多肽峰面积较小的原因主要是:1)多肽的电离效率较低,不能被充分离子化,导致被UPLC-TQMS系统检测出的响应值较低;2)多肽难以被酶解或者酶解后容易降解,导致其在待测溶液中的浓度较低。这些多肽的峰面积检测结果的RSD 较高,反映出它们在质谱定量分析中的高不稳定性,无法满足准确定量的要求。因此,剔除35 条峰面积小于2 000 的多肽,选择剩下的34 条多肽作为候选标志多肽进一步予以筛选。在34 条多肽中,有10 条属于MRJP1,8条属于MRJP2,7条属于MRJP3,2条属于MRJP4,4条属于MRJP5,1条属于MRJP6,2条属于MRJP7(表1)。这34 条候选多肽的总离子流见附图2(http://www.zjujournals.com/agr/CN/10.3785/j.issn.1008-9209.2022.07.272)。
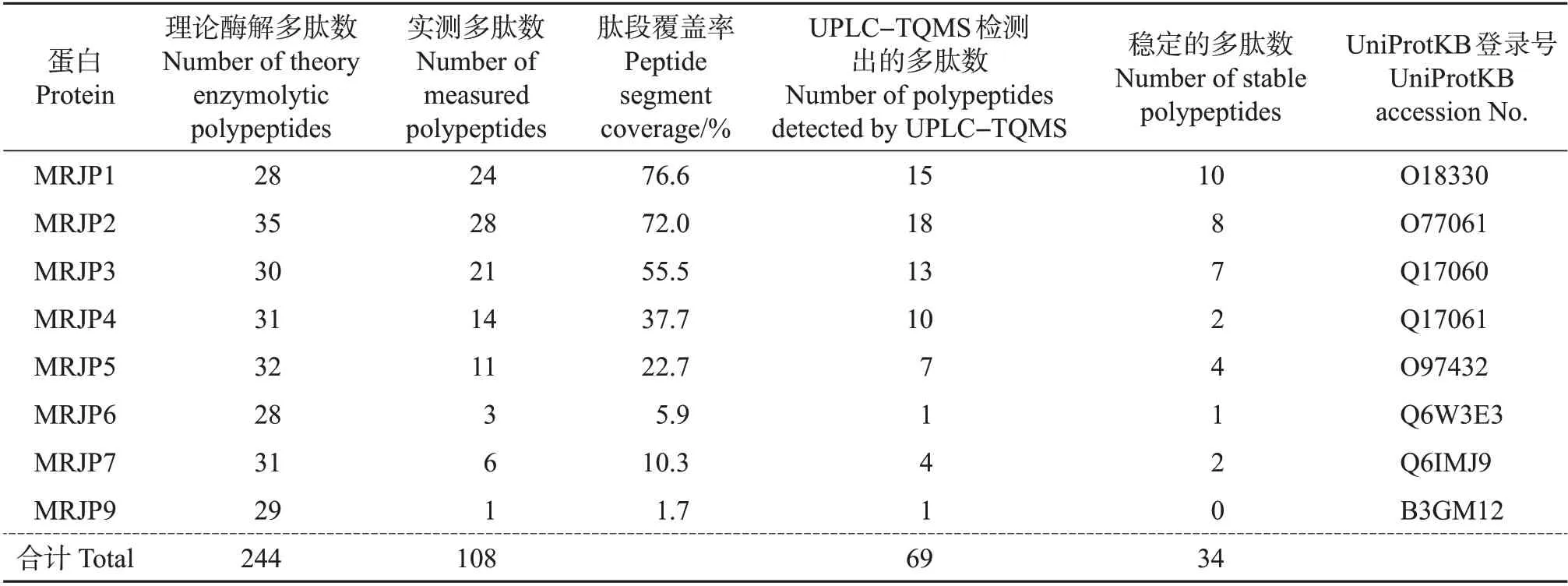
表1 MRJPs及其酶解多肽鉴定分析结果Table 1 Identification and analysis results of MRJPs and their enzymolytic polypeptides
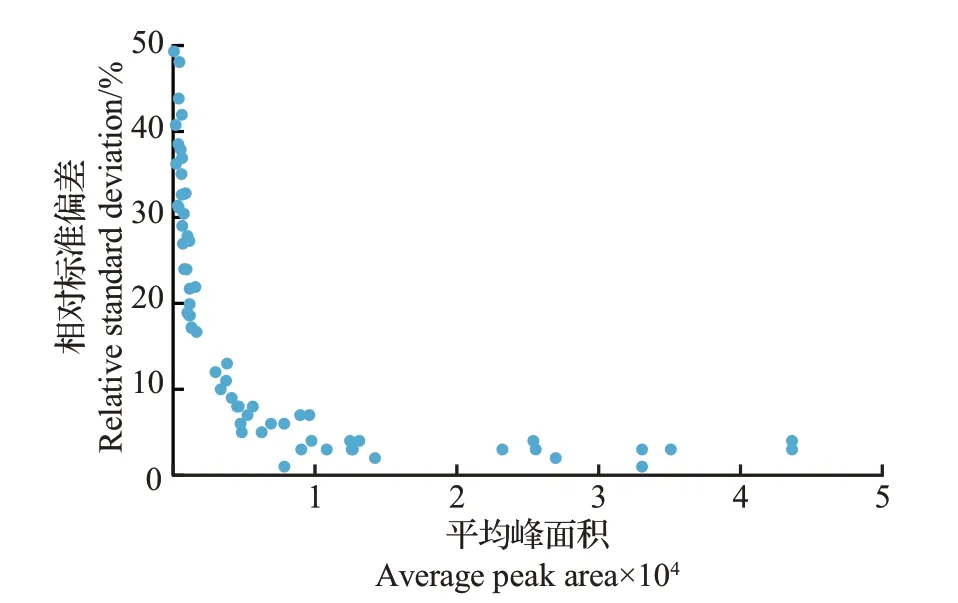
图1 基于UPLC-TQMS的MRJPs候选多肽的稳定性分析Fig.1 Stability analysis of candidate polypeptides of MRJPs by UPLC-TQMS
由图2 可见,不同候选多肽的酶解效率差异很大。有些多肽能在2~3 h内完全酶解,而有些多肽如EALPHVPIFDR、IAIDK 和GVPSSLNVISEK 在24 h内仍未完全酶解。经过24 h酶解后,各肽段的相对峰面积比值为16%~100%,表明不同候选多肽酶解后的稳定性存在很大差异。因此,可以根据候选多肽的易酶解性与酶解后稳定性的差异进行筛选。
2.3 候选多肽分类
基于候选多肽的易酶解性与酶解后稳定性的差异,将34 条候选多肽分为5 类(表2)。根据高易酶解性和酶解后高稳定性的标准,A 类中的5 条候选多肽同时具备高易酶解性与酶解后高稳定性的特征,是标志多肽的最佳选择。B 类中的5 条候选多肽是次优选择,虽然它们具有较高的易酶解性,但酶解后稳定性较差,因而在较短的酶解时间内可用作标志多肽。C类中的8条候选多肽虽然酶解后稳定性高,但易酶解性差,因此也不属于最佳选择,需要在较长的酶解时间下才可用作标志多肽。D、E类中的候选多肽的易酶解性低,且酶解后稳定性差或未知,因此不适合选作标志多肽。候选多肽的易酶解性理论示意图见附图3(http://www.zjujournals.com/agr/CN/10.3785/j.issn.1008-9209.2022.07.272)。
结合图2和表2可知:候选多肽EALPHVPIFDR、IAIDK和GVPSSLNVISEK无法被选作标志多肽,因为即使在酶解24 h后它们仍未达到最大酶解程度;由于MRJP4和MRJP6的酶解多肽均不属于A、B或C类,因而缺乏用于定量分析的标志多肽,不考虑用作内源性标志蛋白;LTSNTFDYDPR、LTSNTFDYDPK和NYPFDVDQWR均同时存在于2个以上的MRJPs蛋白中,为非特异性多肽,因而不能选作特异性标志多肽;MRJP5 和MRJP7 也缺乏用于定量分析的标志多肽,不考虑用作内源性标志蛋白。因此,仅从A~C类的MRJP1~3中选择出15条候选多肽。

表2 MRJPs候选多肽分类Table 2 Classifications of candidate polypeptides of MRJPs
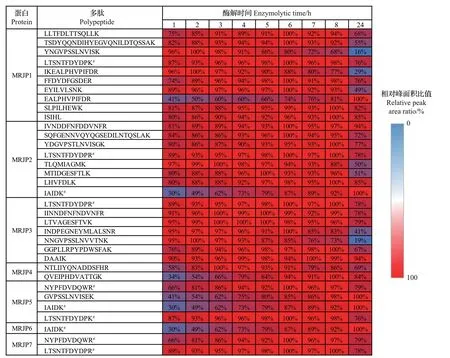
图2 候选多肽的酶解性与酶解后稳定性热图Fig.2 Heatmap for enzymolysis and stability of candidate polypeptides
2.4 特异性标志多肽的确定
在候选多肽中,所需酶解时间较短的A 类和B类中的多肽组合属于首选(表3)。由于B 类中的YNGVPSSLNVISK 和A 类 中 的LTVAGESFTVK 的质谱检测响应值较高,因此更适合被分别选作MRJP1 和MRJP3 的特异性标志多肽。唯一属于A类的MRJP2多肽TLQMIAGMK被选为其特异性标志多肽,其最佳酶解时间为2 h。为了减少UPLCTQMS定量分析中的基质效应,提高检测的准确度,将上述3 条特异性标志多肽分别合成同位素标志肽,即YNGVPSSL*NVISK(MRJP1)、TL*QMIAGMK(MRJP2)和L*TVAGESFTVK(MRJP3),建立了可对MRJP1~3进行定量分析的UPLC-TQMS法,这3条合成的特异性标志多肽的二级质谱如图3所示。
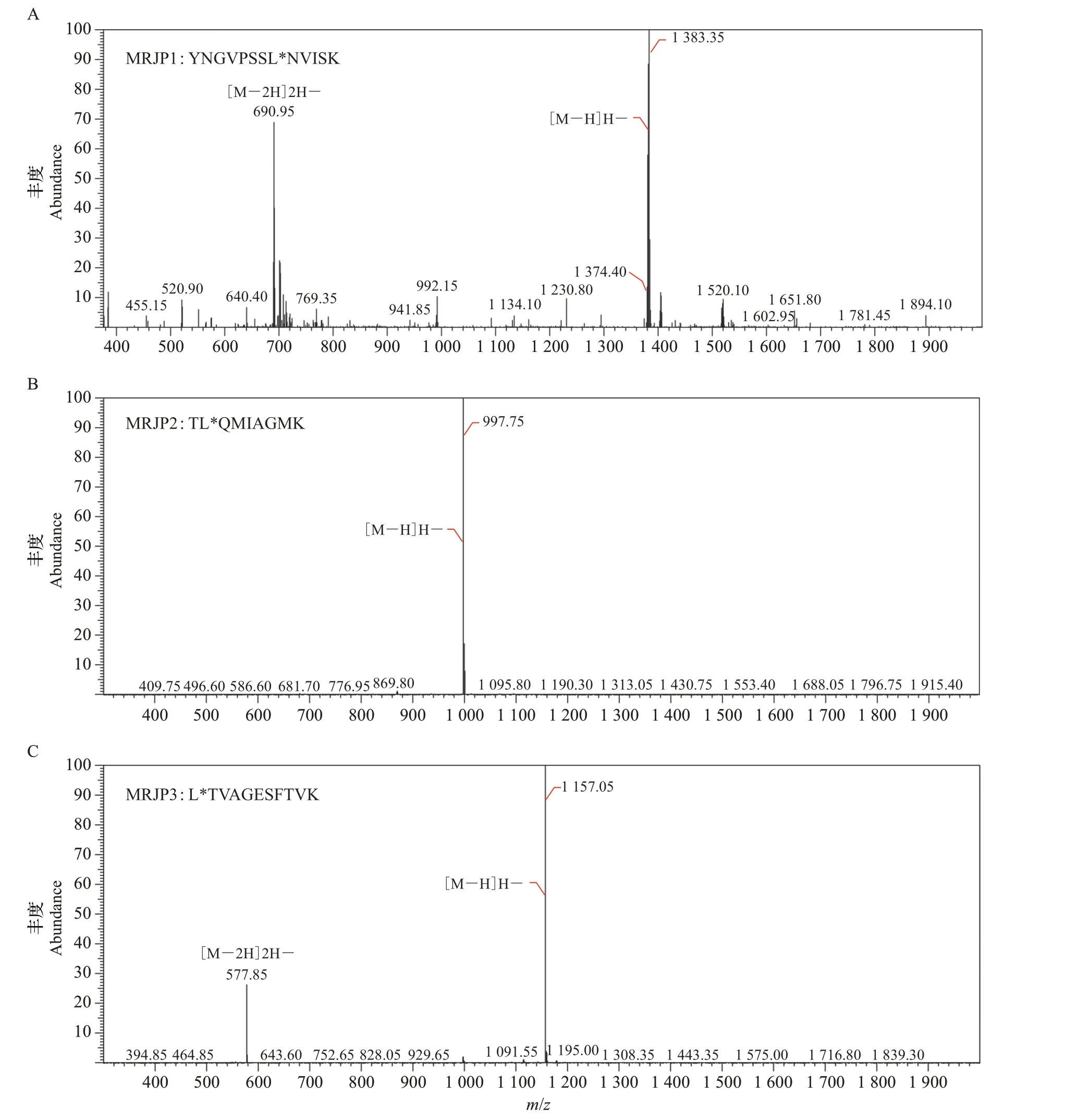
图3 MRJP1~3同位素标志肽的二级质谱图Fig.3 Secondary mass spectrograms of MRJP1-3 isotopic marker peptides

表3 MRJP1~3的候选标志多肽Table 3 Candidate marker polypeptides of MRJP1-3
2.5 蜂王浆中MRJP1~3 含量检测方法的建立
按1.3.5 节的条件进样,在蜂王浆中能检测出3条完好且能够被区分的MRJP1~3 特征峰(附图4,http://www.zjujournals.com/agr/CN/10.3785/j.issn.1008-9209.2022.07.272),说明该检测条件可行。
对标志多肽标准溶液测定的结果(图4)表明,YNGVPSSLNVISK在10~1 600 ng/mL范围内具有良好的线性关系,TLQMIAGMK和LTVAGESFTVK在10~600 ng/mL 范围内具有良好的线性关系,决定系数(R2)均大于0.99,满足定量检测要求。以上结果表明,本实验建立的方法能准确地定量检测出蜂王浆样品中MRJP1~3的含量。
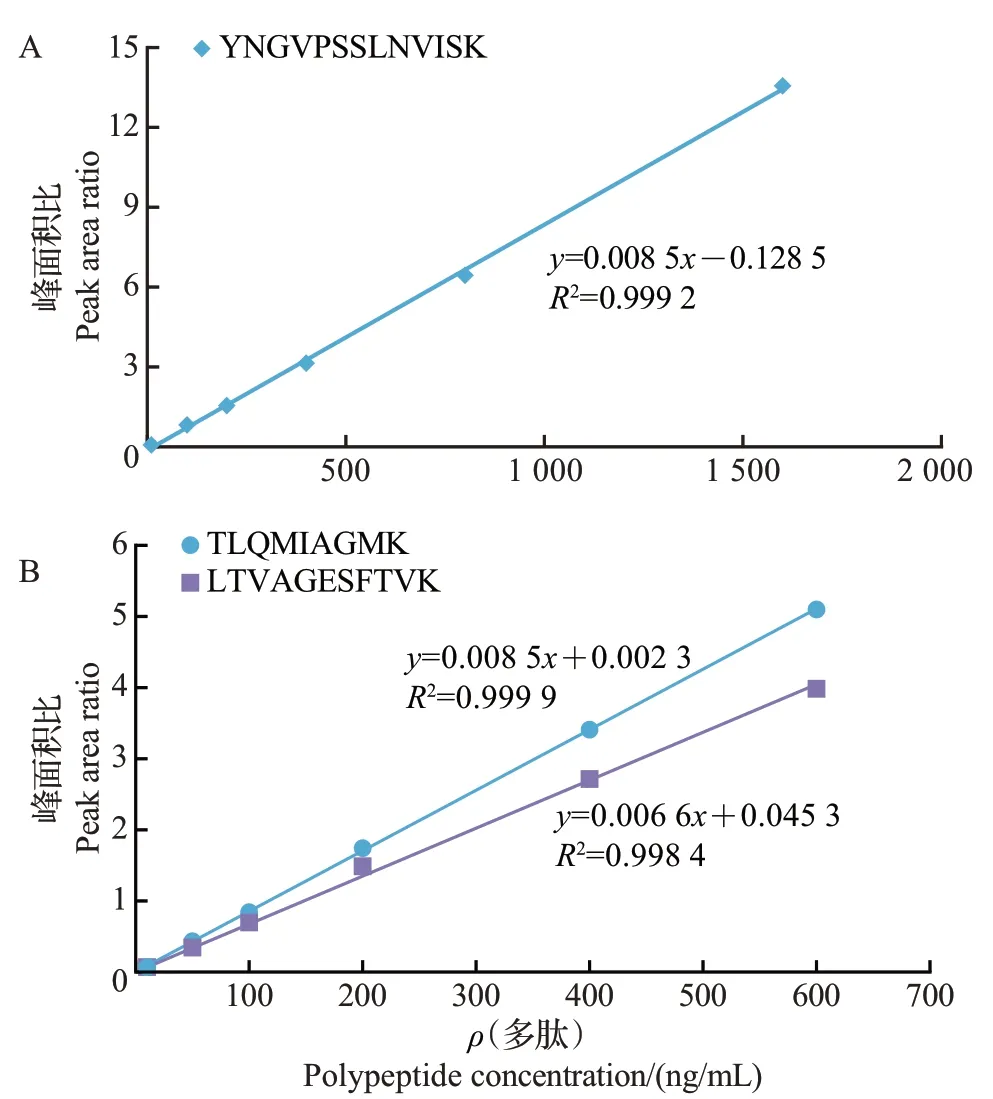
图4 3条标志多肽的标准曲线Fig.4 Standard curves of three marker polypeptides
2.6 以MRJP1~3 为检测目标的蜂王浆新鲜度检测结果
对蜂王浆样品进行模拟加温老化处理,结果(表4)显示:0 d时,冷冻保存的鲜蜂王浆中MRJP1、MRJP2、MRJP3 的 质 量 分 数 分 别 为(56.9±6.1)、(16.0±0.6)、(26.8±0.5)mg/g,按含量排序为MRJP1>MRJP3>MRJP2;在40 ℃条件下贮存35 d后,MRJP1、MRJP2、MRJP3 的质量分数分别为(27.1±0.7)、(2.0±0.1)、(5.1±0.1)mg/g,三者的降解率分别为52.4%、87.8%、81.1%,按降解率排序为MRJP2>MRJP3>MRJP1。

表4 鲜蜂王浆在40 ℃贮存过程中MRJP1~3含量变化Table 4 Changes of MRJP1-3 contents in fresh royal jelly during storage at 40 ℃ mg/g
模拟加温老化实验的相关性分析结果(图5)显示,MRJP1~3 的降解率均与老化时间(40 ℃)呈正相关(R2>0.9),即MRJP1~3 的含量均随着老化时间的延长呈下降趋势。上述结果显示,本研究建立的检测方法对MRJP1~3 具有很高的灵敏度,是一种精准检测蜂王浆新鲜度的新技术。
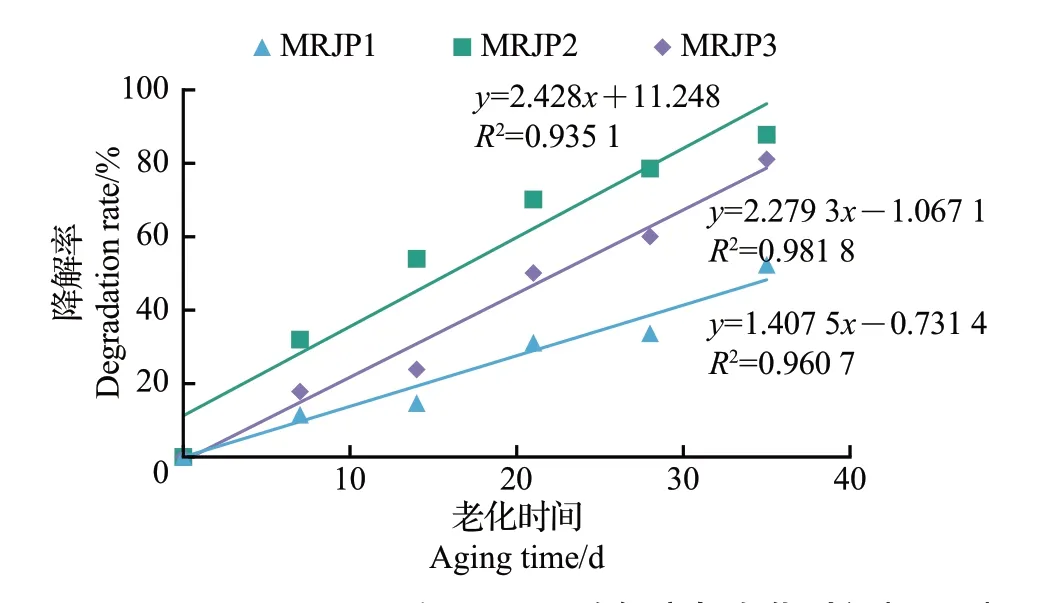
图5 MRJP1、MRJP2和MRJP3降解率与老化时间(40 ℃)的线性关系Fig.5 Linear relationships between degradation rates of MRJP1,MRJP2 and MRJP3 and aging time at 40 ℃
3 讨论
蜂王浆具有抗疲劳、增强免疫力、抗衰老等多种功能,对糖尿病、心血管病、失眠都有很好的保健作用。但是,鲜蜂王浆不稳定,怕热、怕光、怕酸碱、怕污染,需要保存在-18 ℃的冷冻环境中。新鲜蜂王浆中能够促使雌性蜜蜂幼虫发育成为蜂王的某种关键活性成分对温度非常敏感,受温度影响很大,并且在常温条件下保存时会损失或失去活性[13]。
近20年来,采用MRJP1含量作为蜂王浆新鲜度检测指标的观点得到广泛认可。如KAMAKURA等[14-15]发现鲜蜂王浆对运动后小鼠具有改善生理疲劳的功能,进一步通过功能组分分析发现,在40 ℃条件下贮存7 d 的蜂王浆已失去抗疲劳功能,原因是MRJP1已被降解。他们还发现,在无血清培养基中补充MRJP1能刺激大鼠肝细胞的DNA合成和白蛋白产生[16-17]。MAJTÁN 等[18]发现,MRJPl 可促进大鼠吞噬细胞释放肿瘤细胞坏死因子TNFα,促进肝细胞增殖,且其在有充足血清的媒介中能刺激人淋巴细胞的生长。日本学者YAMAGUCHI 等[19]通过观察喂食王浆酸、粗蛋白、MRJP1 与蜜蜂幼虫生长的关系发现,MRJP1 是促进幼虫生长的关键蛋白,且两者呈剂量依赖关系,因此,他们在2008年第九届亚洲养蜂大会上建议将MRJP1 含量作为蜂王浆质量评价指标。
2011 年,KAMAKURA[20]分别以鲜蜂王浆和在40 ℃条件下贮存7、14、21、30 d 的老化蜂王浆喂养蜜蜂雌性幼虫,结果只有喂养鲜蜂王浆的幼虫能够发育成为蜂王,而用40 ℃条件下贮存30 d的蜂王浆饲养的幼虫都发育成了工蜂;通过高效液相色谱和非变性丙烯酰胺凝胶电泳分析发现,MRJP1在40 ℃贮存过程中逐步被降解,且在贮存30 d时全部被降解,因此认为MRJP1是蜂王浆中诱导蜜蜂发生级型分化的主要功能因子。但德国学者BUTTSTEDT等[21]对单一MRJP成员如MRJP1是蜂王浆中促使蜜蜂级型分化的关键因子及其含量可代表蜂王浆新鲜度的观点提出了质疑,他们通过重复实验验证不能得到相同结果。
事实上,MRJPs 是由不同蛋白组成的家族,各蛋白成员具有不同的功能,例如MRJP1 具有抗衰老、抗氧化、抗肿瘤、免疫调节功能,MRJP2 具有促进细胞增殖、抗肿瘤功能,MRJP3 具有抗过敏、加速免疫反应、抗炎功能,发挥主蛋白的营养健康功能需要各蛋白成员的协同作用[12]。近10 年来,本团队成功研发了超滤分离高纯度MRJPs 冻干粉的技术[22],以果蝇、小鼠为模式生物进行MRJPs 喂养实验,结果显示MRJPs 能够促进卵巢发育和排卵,提高雌激素水平[23-25];通过果蝇和人胚肺成纤维细胞培养实验显示,MRJPs 具有抗衰老功能[23,26]。这一系列研究结果证明,MRJPs是蜂王浆中促进机体生殖和发育的关键活性成分。而MRJP1~3 是MRJPs 家族中含量较高、营养功能最有代表性的3个成员。因此,本研究基于UPLC-TQMS 方法筛选出3 个MRJP1~3 特异性标志多肽,建立了蜂王浆中MRJP1~3 组合的UPLC-TQMS 定量检测方法,这是一种比检测单一蛋白更为全面且能够反映蜂王浆新鲜度的鉴定方法,可为今后蜂王浆质量评价、新标准的建立提供科学依据和技术支撑。
4 结论
本研究筛选出3个特异性标志多肽YNGVPSS LNVISK(MRJP1)、TLQMIAGMK(MRJP2)、LTVAG ESFTVK(MRJP3),并合成了MRJP1~3的3条特异性标志多肽标准品及其同位素标志肽,建立了蜂王浆中MRJP1~3的UPLC-TQMS定量检测方法。通过对加温老化处理的蜂王浆进行检测,证实了MRJP1~3的降解率均与老化时间(40 ℃)呈正相关(R2>0.9)。本研究所建立的方法是一种精确检测蜂王浆新鲜度的新技术。
致敬谨以此文缅怀我的导师——大先生程家安教授,感谢他对教育事业的无私奉献。他将永远活在学生的心中!
——沈立荣
