唾液效应因子BtArmet靶向NtWRKY51调控烟草防御烟粉虱的分子机制
2023-01-19都慧王晓伟刘树生
都慧,王晓伟,刘树生
(浙江大学农业与生物技术学院昆虫科学研究所,杭州310058)
烟粉虱(Bemisia tabaci)属半翅目(Hemiptera)粉虱科(Aleyrodidae),是一类全球广泛分布、体型微小的刺吸式口器昆虫。烟粉虱通过直接取食和传播植物病毒危害寄主植物,是棉花、番茄、烟草等多种经济作物的重要害虫[1]。烟粉虱是一个含有数十个隐存种的物种复合群[2-5],其中有2个入侵我国,分别为中东-小亚细亚1 种(Middle East-Asia Minor 1,MEAM1)和地中海种(Mediterranean, MED),由于烟粉虱具有极强的抗药性、适应寄主能力和繁殖能力,得以在我国迅速扩散定殖[6-8]。
作为刺吸式口器昆虫,烟粉虱在取食植物时用口针刺穿植物组织以到达韧皮部,通过吸取韧皮部汁液获取营养,且在取食时分泌大量唾液到植物中,这种取食方式使得唾液成为烟粉虱与植物相互作用的纽带。烟粉虱唾液的功能很多,其中最重要的是帮助烟粉虱调控植物的防御反应,其唾液中可以抑制植物防御反应的成分被称为效应因子(effector)[9]。
WRKY是植物中最大的转录因子家族之一,至少包含一个由大约60个氨基酸组成的WRKY结构域。WRKY主要存在于高等植物中,通过与丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)等蛋白互作来调控植物的生长发育,参与植物抗胁迫和抗病虫害等过程[10-13]。
前期我们鉴定到1 个烟粉虱的唾液效应因子BtArmet(Bemisia tabaciarginine rich, mutated in early stage of tumors),它可以随着烟粉虱的唾液被分泌到植物中,并促进烟粉虱在植物上的取食和繁殖;蛋白互作验证实验表明,BtArmet通过靶向植物体内的半胱氨酸蛋白酶抑制素蛋白来抑制植物的抗虫性[14]。但由于昆虫与植物互作的网络复杂,昆虫的唾液效应蛋白不可能仅与1个植物蛋白互作而发挥功能,因此本研究对前期筛选到的另一个可以与BtArmet 蛋白互作的普通烟(Nicotiana tabacum)的转录因子WRKY51 进行了功能验证和互作机制探究,旨在进一步明确BtArmet 蛋白在调控植物防御反应中的作用,为深入解析唾液效应因子在调控烟粉虱与寄主植物互作中的机制提供理论依据。
1 材料与方法
1.1 实验材料
1.1.1 供试昆虫
供试昆虫为MEAM1 烟粉虱(mtCOI,GenBank登录号:GQ332577),于2010年8月采集于温州市农业科学研究院蔬菜研究所,饲养在人工气候室中特制的养虫笼内,使用7—8叶无虫源污染的棉花植株进行种群的维持。人工气候室的温度控制在(26±1)℃,相对湿度控制在(70±10)%,光照周期为14 h光照∶10 h黑暗。每隔2~3月对烟粉虱的隐存种进行一次分子鉴定,以监测种群的纯度。
1.1.2 供试植物
供试植物包括棉花(Gossypium hirsutum),品种为浙棉1793;普通烟(N.tabacum),品种为NC89;本氏烟(Nicotiana benthamiana),为转基因H2B-RFP(红色荧光蛋白细胞核定位)株系。种子均由浙江大学农业与生物技术学院生物技术研究所提供。所有植物均使用塑料花盆单独栽培,置于无虫源、无病菌污染的人工玻璃温室内培养。温室内温度、相对湿度、光照周期的控制同人工气候室,采用自然光照并辅以人工光照钠灯补光。
1.2 实验方法
1.2.1 酵母双杂交(yeast two-hybrid,Y2H)系统互作验证
收集烟粉虱取食过的普通烟叶提取总RNA,送至宝生物工程(大连)有限公司构建烟草cDNA 文库,同时构建诱饵载体pGBKT7-BtArmet(引物序列见表1)。按照酵母转化系统(YeastmakerTMYeast Transformation System 2)试剂盒[宝生物工程(大连)有限公司]说明书进行酵母双杂交实验。使用酵母质粒小提试剂盒(TIANprep Yeast Plasmid DNA Kit)[天根生化科技(北京)有限公司]提取互作的酵母质粒,转化入大肠埃希菌后送至公司测序。
1.2.2 双分子荧光互补(bimolecular fluorescence complementation,BiFC)互作验证
分别将BtArmet和NtWRKY51基因的全长克隆至p2YC 和p2YN 载体中(引物序列见表1),将重组质粒分别转化至EHA105 根癌农杆菌中。将表达p2YC-BtArmet和p2YN-NtWRKY51的根癌农杆菌制备成悬浮液,等体积混匀后共同浸润转H2B-RFP的本氏烟叶,48 h后,用激光共聚焦显微镜观察荧光染色情况。
1.2.3 应用病毒诱导的基因沉默(virus-induced gene silencing,VIGS)方法沉默烟草NtWRKY51基因
通过SGN VIGS Tool网站(https://vigs.solgenomics.net/)分析NtWRKY51基因序列,选取约300 bp 的最佳沉默片段克隆至pBIN2mDNA1载体中(引物序列见表1),并将重组质粒转化至EHA105 根癌农杆菌中。用烟草曲茎病毒(tobacco curly shoot virus,TbCSV)Y35 辅助侵染烟草,将重组质粒2mDNA1-Su(可以抑制烟草内源基因Su的表达以产生叶脉褪绿的表型突变)作为阳性对照,空载体2mDNA1 作为阴性对照[15]。将表达2mDNA1、2mDNA1-Su、2mDNA1-NtWRKY51 与TbCSV Y35 的根癌农杆菌分别制备成悬浮液,按照2mDNA1+Y35、2mDNA1-Su+Y35、2mDNA1-NtWRKY51+Y35 的组合等体积混匀悬浮液,共同浸润2 片真叶期的普通烟叶。将接种过的普通烟放在人工气候室内培养,待生长到5—6 片真叶期时,取样提取植物总RNA,反转录合成cDNA 后利用实时荧光定量聚合酶链反应(real-time quantitative polymerase chain reaction,qRT-PCR)技术检测NtWRKY51基因的表达量,随后用于生物学测定实验。
1.2.4 沉默NtWRKY51基因烟草上烟粉虱的生物学测定
准备初羽化3 d 的烟粉虱成虫,使用1.2.3 节中获得的沉默NtWRKY51基因的普通烟进行生物学测定实验,将夹叶笼夹在叶片背面,每个夹叶笼内放入10头(5雌5雄)烟粉虱成虫。将接种烟粉虱的普通烟置于人工气候室内继续培养,7 d后统计每个夹叶笼中烟粉虱的存活数和每片烟叶上夹叶笼范围内的产卵数。
1.2.5 qRT-PCR 检测相关基因的表达
将烟粉虱置于普通烟叶上取食3 d 后,收集叶片提取总RNA 并进行反转录,通过qRT-PCR 技术检测烟草中NtWRKY51基因的表达量。收集1.2.3节中沉默NtWRKY51基因的普通烟叶,提取总RNA并进行反转录,通过qRT-PCR技术检测植物激素信号通路相关基因的表达情况(引物序列见表1)。

表1 用于基因克隆、载体构建和定量检测的引物Table 1 Primers used for gene cloning,vector construction and quantitative detection

表1(续) Continuation of Table 1
1.2.6 数据统计与分析
每个处理的生物学重复数据以平均值±标准误的形式表示。2个处理间的比较采用独立样本学生t检验(student’st-test)法进行分析,以P<0.05 表示差异有统计学意义,P<0.01 表示差异有高度统计学意义。所有数据分析均使用SPSS 20.0 统计软件进行。
2 结果与分析
2.1 NtWRKY51 基因的克隆及序列分析
NtWRKY51(GenBank登录号:XM_016626866)是普通烟(N.tabacum)中的一个WRKY转录因子51(WRKY51)蛋白,是植物WRKY转录因子家族的成员之一。NtWRKY51基因的开放阅读框(open reading frame,ORF)序列全长为612 bp,编码一个含有203个氨基酸的蛋白(图1),预测该成熟蛋白质的分子量为23.4 kDa,没有预测到信号肽。根据NtWRKY51基因ORF 的全长序列,设计特异性引物,以烟粉虱的cDNA为模板进行PCR扩增得到NtWRKY51片段,将其连接到不同载体上进行实验。

图1 NtWRKY51的序列分析Fig.1 Sequence analysis of NtWRKY51
2.2 酵母双杂交系统验证BtArmet与NtWRKY51的互作
将pGBKT7-BtArmet质粒和pGADT7-NtWRKY51质粒共同转入Y2H Gold 酵母菌株,并分别在亮氨酸/色氨酸缺陷型(SD-Leu/-Trp)固体选择性培养基(二缺培养基)和含有X-α-gal(显色底物)和金担子素A(aureobasidin A,AbA)的腺嘌呤/组氨酸/亮氨酸/色氨酸缺陷型(SD-Ade/-His/-Leu/-Trp)固体选择性培养基(四缺培养基)上点样,结果发现,这些菌株可以在含有X-α-gal 和AbA 的四缺培养基上生长并且变蓝;而将这些质粒分别与对应的空载质粒共转的酵母菌株,均不能在含有X-α-gal 和AbA的四缺培养基上生长(图2)。
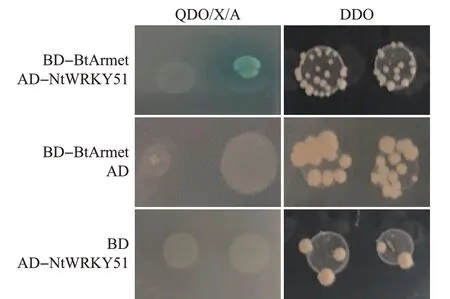
图2 BtArmet与NtWRKY51在酵母双杂交系统中的互作Fig.2 Interactions of BtArmet and NtWRKY51 in the yeast two-hybrid system
2.3 BiFC 实验验证BtArmet 与NtWRKY51 在植物体内的互作
在共同表达p2YC-BtArmet和p2YN-NtWRKY51的本氏烟叶的细胞质中可以观察到明显的斑点状荧光信号,同时在细胞核中也可以观察到少量荧光信号,而在阴性对照中则未观察到荧光信号(图3)。因此我们推测BtArmet 与NtWRKY51 可以在植物体内发生互作,并且这种互作可能抑制了转录因子NtWRKY51在细胞核内的定位。

图3 BtArmet与NtWRKY51在植物体内的互作Fig.3 Interactions of BtArmet and NtWRKY51 in vivo
2.4 烟粉虱取食对烟草NtWRKY51 基因表达的影响
为了明确烟粉虱的侵染是否会诱导烟草中NtWRKY51基因的表达,我们将烟粉虱置于4—5 片真叶期的普通烟植株上取食3 d 后检测烟草中NtWRKY51基因的表达量。结果表明,被烟粉虱取食过的烟草中,NtWRKY51基因的表达量大约是未被烟粉虱取食过烟草的1.9倍(图4)。

图4 被烟粉虱取食过的普通烟中NtWRKY51 的相对表达量Fig.4 Relative expression level of NtWRKY51 in N. tabacum fed by whiteflies
2.5 VIGS 方法沉默NtWRKY51 基因的效率
为探究NtWRKY51 在调控烟草防御烟粉虱中的作用,通过VIGS方法沉默烟草中的NtWRKY51基因。用根瘤农杆菌接种普通烟25 d 后观察叶片的表型发现,与阴性对照(沉默空载的烟草)叶片相比,沉默NtWRKY51基因的烟草并没有出现叶片褪绿或细胞死亡的现象(图5)。qRT-PCR验证结果表明,沉默NtWRKY51基因的普通烟中NtWRKY51基因的表达量显著低于阴性对照(图6)。

图5 沉默NtWRKY51基因的普通烟表型Fig.5 Phenotype of NtWRKY51-silenced N.tabacum

图6 NtWRKY51基因在普通烟中的相对表达水平Fig.6 Relative expression level of NtWRKY51 in N.tabacum
2.6 沉默烟草NtWRKY51 基因对烟粉虱适合度的影响
将初羽化3 d 的烟粉虱成虫转移到2.5 节中沉默NtWRKY51基因的普通烟上进行生物学测定实验。结果表明,连续取食7 dNtWRKY51基因沉默烟草的烟粉虱的单雌产卵量极显著低于取食阴性对照烟草的烟粉虱,但两者在存活率上没有显著性差异(图7)。
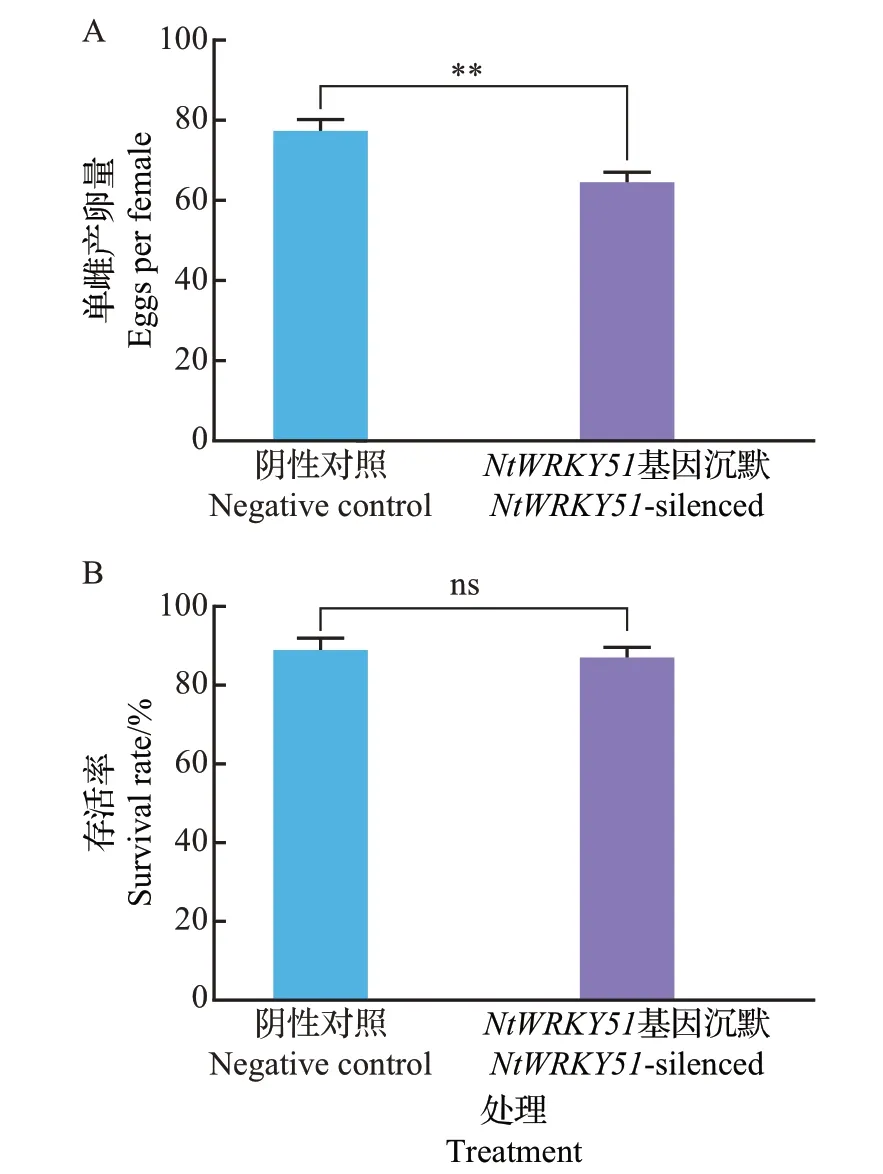
图7 烟粉虱在沉默NtWRKY51 基因普通烟上的产卵量和存活率Fig.7 Fecundity and survival rate of whiteflies on NtWRKY51-silenced N.tabacum
2.7 沉默烟草NtWRKY51 基因对植物激素信号通路的影响
为研究NtWRKY51对烟草防御途径的影响,我们测定了沉默NtWRKY51基因的普通烟中水杨酸(salicylic acid, SA)和茉莉酸(jasmonic acid, JA)信号通路相关基因的表达量。如图8 所示,在沉默NtWRKY51基因的烟草中,水杨酸和茉莉酸信号通路相关基因的表达量与阴性对照烟草相比均无显著性差异。

图8 沉默NtWRKY51 基因普通烟体内水杨酸和茉莉酸信号通路标记基因的相对表达水平Fig.8 Relative expression levels of marker genes in SAsignaling pathways and JA-signaling pathways in NtWRKY51-silenced N.tabacum
3 讨论与结论
烟草WRKY51 蛋白是植物WRKY 转录因子家族的成员之一。本研究将烟粉虱的唾液效应因子BtArmet 作为诱饵在烟草的cDNA 文库中筛选到了NtWRKY51 蛋白,并对NtWRKY51 蛋白与BtArmet蛋白互作调控烟草防御烟粉虱的机制进行了初步探究。
WRKY转录因子在植物遭受病原菌、昆虫攻击等生物胁迫和高温、干旱等逆境引发的非生物胁迫时,起到重要的转录调节的防御功能[16-17],WRKY主要通过参与SA和JA这2大植物激素的信号途径来影响植物的防御体系[18-19]。WRKY 转录因子为SA和细菌激发子诱导PR-1a基因的表达所必需,说明WRKY 可能是SA 信号通路的正调控因子[20]。因此,我们推测烟粉虱的BtArmet 蛋白还可能通过与NtWRKY51蛋白互作来调节烟草中SA信号通路。
首先,通过酵母双杂交和BiFC 实验验证了BtArmet 与NtWRKY51 在植物体外和体内的互作。其次,进一步的实验结果表明,烟粉虱取食烟草会诱导NtWRKY51基因表达上调。为探究NtWRKY51在烟草抗烟粉虱中的作用,本研究通过VIGS 实验在烟草中沉默了NtWRKY51基因,生物学测定实验结果显示烟粉虱在沉默NtWRKY51基因的烟草上产卵量显著降低,表明NtWRKY51是一种对烟粉虱有利的烟草蛋白,负调控烟草对烟粉虱的抗性。而烟草中NtWRKY51基因的沉默对SA和JA信号通路相关基因表达没有产生显著影响。WRKY 转录因子一般在植物防御中起到正调控的作用,前人研究发现,烟粉虱取食诱导的3个烟草WRKY家族基因均正调控烟草对烟粉虱的抗性[21],而本实验结果看似与预期结果相悖,即烟粉虱分泌唾液效应因子BtArmet进入烟草与NtWRKY51互作,但NtWRKY51蛋白本身对烟粉虱取食有利,并且受到烟粉虱取食的大量诱导。本研究发现植物进化出了有利于昆虫取食的基因,为今后研究NtWRKY51 在昆虫-植物互作中的作用打下了基础。
