稻瘟病菌致病机制及绿色防控新策略
2023-01-19卢宣君苏珍珠刘小红林福呈
卢宣君,苏珍珠,刘小红,林福呈,2*
(1.浙江大学农业与生物技术学院生物技术研究所,农产品质量安全与危害因子风险防控国家重点实验室,杭州 310058;2.浙江省农业科学院植物保护与微生物研究所,农产品质量安全与危害因子风险防控国家重点实验室,杭州 310021)
稻瘟病是最具破坏性的水稻病害之一,导致全球水稻产量损失10%~30%。全球有80多个水稻种植地区发生稻瘟病,包括水田和旱地种植。稻瘟病在水稻幼苗上,最初出现小的坏死病斑,然后病斑变大合并,边缘褪绿;在较老的水稻植株上,病害症状出现在叶片、叶片与叶鞘的连接处、节、颈部和稻穗上。水稻幼嫩颈节被侵染时其圆锥花序变白,在生长后期感染会导致水稻不完全灌浆。颈瘟和穗瘟最具有破坏性,严重流行会导致高达80%的产量损失。
目前,稻瘟病的防治措施主要包括抗病品种筛选、化学防治和栽培防治。利用抗病品种是防治稻瘟病最经济有效的措施。然而,稻瘟病菌致病性变异快,新生理小种出现周期短,导致水稻品种的抗病性极易丧失。当遇到有利于病害发生发展的栽培管理及气象等条件时,稻瘟病容易暴发流行。近年来,我国育成的水稻品种的抗瘟性水平总体不高,这些品种若单一大面积种植,极易招致抗瘟性在3~5年的短期内丧失。此外,虽然目前在化学防治中应用较广的三环唑、春雷霉素等农药对稻瘟病的防治效果显著,但它们均为预防性药剂,而穗颈瘟的防治窗口期短,一旦病菌侵入,防治效果则会显著降低。因此,挖掘抗稻瘟病的有益生防菌,研发新型高效环保菌剂,以替代或减少农药的使用、降低稻瘟病的发生、确保水稻的安全生产迫在眉睫。大量研究表明,许多植物内生真菌与寄主植物能够形成互惠共生关系,促进寄主生长,增强寄主抗生物和非生物胁迫的能力,具有良好的抗菌和促生活性,并已开发为生物防治剂、固氮菌剂和植物促生制剂,广泛应用于粮食、蔬菜、果树等作物上,是植物病害生物防治的潜在资源菌。
随着测序手段的进步,国内外学者在稻瘟病致病机制方面的研究取得了分子层面的重要进展,为挖掘高效低毒农药的候选靶标提供了重要依据。本文综述了稻瘟病菌致病机制和水稻内生真菌作用机制的最新研究进展,并对其绿色防控策略展开讨论。
1 稻瘟病菌致病机制研究进展
1.1 稻瘟病菌的侵染循环
稻瘟病是由丝状子囊真菌稻瘟病菌引起的,在水稻的整个生育期均可发生。当稻瘟病菌分生孢子落在水稻植株上并通过孢子尖端黏液附着在宿主表面上时,侵染循环随即开始。在疏水表面上,2~4 h 内分生孢子通常从顶细胞的末端开始萌发形成芽管(分生孢子有3 个细胞,每个细胞有1 个细胞核),细胞核在芽管中发生有丝分裂,一个子核移回孢子,另一个移入芽管肿胀的尖端。芽管顶端肿胀和弯曲形成钩状体,标志着附着胞形成的开始。钩状体的细胞核进入细胞周期的S 期,控制附着胞的形成,G2—M 过渡期控制附着胞的分化[1]。在环境层面上,附着胞的形成取决于植物和非植物信号,包括物理信号,例如植物角质单体、氮耗竭、疏水性和硬度(在人造表面上会形成附着胞)等[2]。伴随着细胞自噬在孢子和芽管中发生,由脂质和糖原合成的甘油进入附着胞,且在单细胞圆顶形附着胞中积累高达8 MPa的膨压(相当于汽车轮胎压力的40倍左右)[2-3]。成熟附着胞在质膜和细胞壁几丁质层之间形成大约100 nm厚的黑色素层,可以阻挡附着胞内溶质的渗出,维持高渗物质产生膨压[4]。这种以可控的方式提供的膨压允许侵染钉强行穿过角质层和细胞壁,且质膜保持完整并内陷在穿透菌丝周围,这也是真菌和宿主的关键识别部位。植物的反应是在感染部位周围产生活性氧(reactive oxygen species, ROS),同时,稻瘟病菌进化出快速的ROS解毒机制。通过胞间连丝簇侵染菌丝伸长到下一个细胞中,穿透相邻细胞的菌丝具有包含膜薄片的膜帽,并可能将蛋白质分泌到活宿主细胞的细胞质中[5]。侵染菌丝沿着植物细胞膜在其组织内扩增繁殖,在第一个寄主细胞中定殖后,侵染菌丝将逐渐扩展到周围细胞,4~5 d 后引起典型的稻瘟病坏死性病斑。在高度潮湿的环境条件下,病斑处形成新的产孢梗,然后产生大量新的分生孢子。水稻叶片的一个病斑上能产生多达2 万个孢子,一晚上在单个小穗上产生6 万个孢子;1~2 h 的黑暗时间触发孢子释放,稻瘟病菌可以反复形成孢子,持续约20 d。在风雨吹打下孢子扩散到周围植株,引起再次侵染。稻瘟病是多周期性的,从病菌分生孢子萌发到新的分生孢子产生需要7 d。
1.2 稻瘟病菌致病相关信号传导途径
由于稻瘟病菌对农业的影响,以及其典型的侵染循环过程和易操作性,稻瘟病菌已成为细胞生物学和分子水平上研究宿主-病原体相互作用的模式生物[5]。从稻瘟病菌孢子萌发、芽管产生、附着胞形成、侵染钉形成,到病原菌在宿主中侵入生长,涉及一系列信号传导途径:通过G蛋白偶联受体传导信号感知植物来源的信号[6];环磷酸腺苷-蛋白激酶A(cyclic adenosine monophosphate-dependent protein kinase A, cAMP/PKA)信号通路参与附着胞的形成与附着胞内的膨压积累[7];促分裂原活化的蛋白激酶(mitogen-activated protein kinases, MAPK)信号途径促进稻瘟病菌分生孢子的产生以及侵染钉的形成[7-8];磷脂酶和钙调蛋白依赖性途径以及由此产生的基因上调和下调,调控稻瘟病菌的致病过程[9-10]。
随着科学技术的不断进步,稻瘟病菌的各个信号传导途径被解析得越来越明确。然而,在稻瘟病菌中,植物雷帕霉素靶蛋白(target of rapamycin,TOR)信号途径的研究相对比较少。TOR是一种高度保守的丝氨酸/苏氨酸蛋白激酶,属于磷脂酰肌醇3-激酶(phosphatidylinositol 3-kinase,PI3K)相关激酶家族[11]。近年来研究发现,TOR 是稻瘟病菌自噬和致病的重要调控因子,在蛋白激酶A 催化亚基(cPKA)下游、真菌丝裂原活化蛋白激酶(Pmk1)上游发挥作用,控制细胞周期进程、自噬和附着胞的形成。在稻瘟病菌中,失活的TOR在无营养诱导的疏水表面孢子萌发期间阻止G2 期的有丝分裂,G2 期阻滞诱导附着胞形成和自噬。自噬释放营养物质,包括谷氨酰胺,通过有丝分裂激活TOR重新启动细胞周期进程。寄主被侵染后,TOR响应葡萄糖代谢而被激活,这也是水稻细胞生长过程中核增殖所必需的。在附着胞形成过程中TOR 活性状态是由葡萄糖信号通路通过Abl1介导的。Abl1是TOR通路上游的负调控因子,外源葡萄糖处理或MoABL1缺失导致孢子萌发过程中TOR 通路的缺陷,抑制cAMP/PKA 信号,消除G2 期阻滞,使芽管有丝分裂加速,并阻止自噬和附着胞的形成。除了葡萄糖信号传导外,谷氨酰胺分解因子Asd4防止谷氨酰胺激活TOR并影响cAMP/PKA信号传导,其对谷氨酰胺代谢的精细控制在附着胞形态发生过程中发挥关键性作用[12]。TOR下游调控元件MoAtg13[13]、MoSnt2[14]和MoTap42[15]等相继被鉴定出,并发现TOR除了调控细胞生长和有丝分裂外,还可以调控细胞自噬和细胞壁的完整性[16]。
1.3 调控稻瘟病菌致病的新途径——细胞自噬和内吞作用
1.3.1 稻瘟病菌细胞自噬研究进展
细胞自噬是广泛存在于真核细胞内的一种溶酶体依赖性的降解途径,是高度调节、异化的过程。自噬作用主要是清除、降解细胞内受损伤的细胞结构和衰老的细胞器,以及不再需要的生物大分子等。自噬作用在消化的同时,也为细胞器的构建提供原料,即细胞结构的再循环;细胞自噬能在细胞稳态、衰老、免疫、肿瘤及神经退行性疾病发生等多种生理病理过程中发挥重要作用[17]。对细胞自噬的研究大多集中在酵母和哺乳动物上,而对丝状真菌的研究还是一个新的课题。研究稻瘟病菌细胞自噬分子机制具有明显特色,发现细胞自噬过程与稻瘟病菌致病相关具有重要的科学价值。
2004年,研究人员通过对稻瘟病菌附着胞阶段mRNA 的分离,构建了抑制消减杂交(suppression subtractive hybridization, SSH)文库,克隆得到稻瘟病菌细胞自噬相关基因MoATG1,开创性地进行了稻瘟病菌细胞自噬的研究[18]。研究发现,MoATG1基因缺失使稻瘟病菌细胞自噬过程被阻断,其产孢能力、孢子萌发率、附着胞膨压和侵染寄主的能力均显著下降,最终导致稻瘟病菌致病性丧失。研究人员进一步在稻瘟病菌基因组中寻找到参与稻瘟病菌细胞自噬过程的30 个自噬相关基因,证明了细胞自噬在稻瘟病菌致病过程中具有重要作用;研究同时表明,自噬必需基因(如MoATG1~10、12、14、16、18)的缺失均可导致稻瘟病菌侵染循环过程被破坏,使其致病性完全丧失[19]。细胞自噬的诱导、自噬泡的形成、液泡与自噬泡的融合是自噬过程中重要的环节,贯穿细胞自噬的整个过程,其中主要有5 大系统参与该过程,包括Atg13-Atg17-Atg1 自噬起始系统(TOR 途径)、Atg9-Atg2-Atg18循环系统、PI3K 复合体、Atg5-Atg12-Atg16 类泛素系统和Atg8类泛素系统[20](图1)。
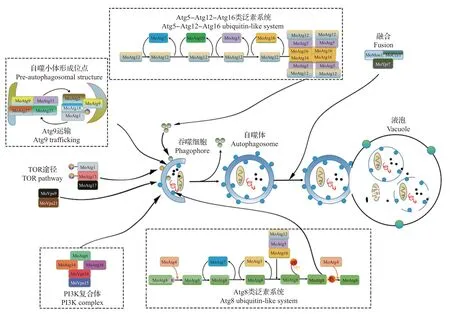
图1 稻瘟病菌细胞自噬模式图Fig.1 Autophagy pattern of Magnaporthe oryzae
随着生物技术的不断更新发展,对稻瘟病菌细胞自噬分子机制的研究越来越深入。ZHU等[21]发现了一个新的细胞自噬抑制因子MoVast1,该因子通过调节细胞膜甾醇的含量来控制细胞膜张力,影响MoTor的活性,从而调控细胞自噬、鞘脂的合成和细胞分裂,进而影响稻瘟病菌的致病力,该研究进一步补充了对稻瘟病菌细胞自噬调控机制的认识。HE等[14]发现:MoSnt2不仅调控稻瘟病菌在侵染寄主水稻时的自噬性凋亡及致病,而且MoSnt2定位于细胞核,发挥组蛋白表观调控因子的功能,通过识别乙酰化组蛋白H3并招募组蛋白去乙酰化酶Hos2来调节H3乙酰化水平,从而影响自噬和致病等相关重要基因的表达活性;MoSNT2的转录表达受控于MoTor信号通路活性。ZHANG 等[22]发现MoGcn5 编码组蛋白乙酰转移酶(histone acetyltransferase,HAT),并通过乙酰化MoAtg7 负调控光或氮饥饿诱导的自噬;同时,揭示了通过光和营养物质等重要环境线索诱导自噬的信号网络和调控机制。CAI等[23]研究表明:跨膜蛋白MoOpy2 通过与MoMst50 相互作用参与MoOsm1 MAPK和MoMps1 MAPK通路;MoOpy2参与稻瘟病菌的生长发育与致病过程;同时,MoOPY2基因缺失导致MoAtg8-PE的累积和GFPMoAtg8 的快速降解,揭示MoOpy2 是一个新的自噬负调节因子。
1.3.2 稻瘟病菌内吞途径研究进展
内吞作用作为细胞摄取膜外大分子、质膜和胞内营养物质的重要过程,在生物体的生长发育、细胞信号传导、细胞极性、营养吸收和利用、细胞膜转运和膜蛋白内化等过程中起着至关重要的作用。在稻瘟病菌中,已经证实内吞途径是稻瘟病菌生长发育、分生孢子产生以及致病所必需的,众多内吞相关蛋白参与了此过程,如MoVps13、MoVps35、MoVps26、MoVps17、MoVps41[24-27]以 及MoYpt7、MoEnd3、PoRab5B[28-30]等,它们既对内吞过程有影响,又对细胞自噬有一定的影响。细胞的内吞和自噬过程紧密交织,是生命活动的普遍规律,它们在维持胞内物质新旧更替的同时,也对细胞表面分子和周围微环境具有重要的调节作用。细胞自噬和内吞作用作为营养吸收、物质利用以及垃圾回收的2 条重要途径,它们之间的交互关系近年来受到越来越多研究人员的关注。稻瘟病菌细胞自噬与内吞过程相互串扰,如:PoVps9 招募PoVps34 并通过激活PoVps21 将其靶向内体;PoAtg6 在PoVps38 的作用下被PoVps34 募集以靶向内吞过程中的内体;同时,PoAtg6 在PoAtg14 靶向自噬小体形成位点(pre-autophagosomal structure, PAS)的 作 用 下 被PoVps34募集,参与细胞自噬[31]。
稻瘟病菌致病机制研究的最终目标是找到防治稻瘟病的新办法,为病害高效永续防治奠定基础或提供依据。稻瘟病菌细胞自噬和内吞途径的研究可以为病害防治研究提供靶位分子,为新药开发研究提供明确的新思路。以细胞自噬途径基因作为靶标筛选安全无生态毒副作用的药物具有很好的应用前景,能产生巨大的社会效益和经济效益。
2 基于内生真菌的稻瘟病菌绿色防控新策略
2.1 内生真菌的起源与分类
内生真菌是指在其生命周期的某个阶段定殖于植物组织内,且不引起植物产生明显症状的一类真菌[32]。在自然生态系统中,绝大多数的植物与内生真菌之间形成共生关系[33]。这种真菌共生体对植物的生长发育、生态功能、种群结构、多样性以及进化具有深远影响[34]。化石证据表明,早在4 亿多年前就已经存在植物与内生真菌的联合体[35],而且这种共生关系在植物由水生演化到陆生过程中扮演了重要角色。内生真菌资源具有丰富的物种多样性,主要包括子囊菌门(Ascomycota)、担子菌门(Basidiomycota)、毛霉门(Mucoromycota)和卵菌门(Oomycota)4个菌门,其中子囊菌门为优势菌门,担子菌门次之。基于亲缘关系、寄主植物和生态功能的差异,内生真菌被分为麦角菌类内生真菌和非麦角菌类内生真菌两大类[36]。麦角菌类内生真菌数量少,且在系统发育上与麦角菌有亲缘关系。该类内生真菌只定殖在草本植物中,形成系统的胞间感染,通过垂直传播侵染寄主植物种子,进而将内生真菌传递给寄主植物后代[37]。该类内生真菌能增加寄主植物生物量,赋予寄主耐旱性,或产生对动物有毒的化学物质,减轻动物对寄主植物的伤害[38]。例如,Neotyphodium lolii定殖在多年生黑麦草(Lolium perenne)上会使黑麦草产生对家畜动物有毒的麦角生物碱[39]。非麦角菌类内生真菌是以子囊菌为代表的一类内生真菌,可以侵染非维管植物、蕨类植物、针叶植物和被子植物等,具有多种多样的生态作用。非麦角菌类内生真菌在从热带到苔原带的所有陆地生态系统中均有分布[40]。该类内生真菌以水平传播为主,兼具垂直传播,生物多样性高于麦角菌类内生真菌[41]。同时,非麦角菌类内生真菌在提高寄主植物生物性状和促进寄主植物抵御胁迫方面具有极其重要的作用[42-45]。
2.2 内生真菌的生物学功能
内生真菌赋予植物优良生长性状的特点与菌根真菌类似,如促进植物营养生长、增强光合作用、增加生物量或产量,并提高植物在逆境中的生存能力[46-47]。有些菌株能通过分泌吲哚乙酸和赤霉素等来促进植物生长[48-49]。蜡壳耳属内生真菌Sebacina vermifera通过抑制植物体内的乙烯信号途径来提高植物生长活力[50]。内生真菌还能通过活化硝酸还原酶、酸化植物根际环境、分泌铁载体和磷酸酶等形式促进植物养分吸收,从而更利于植物生长[51-55]。有些内生真菌还能分泌多糖类黏液物质,并在根系表面形成菌膜,协同植物抗旱[56]。内生真菌产生的甘露醇、海藻糖和黑色素等物质对帮助植物适应逆境也至关重要[56-57]。
除了促进植物生长外,内生真菌在增强植物抵御生物与非生物胁迫方面也有很大的潜力[58-59]。多孢木霉(Trichoderma polysporum)能有效抑制铁皮石斛白绢病[60]。内生青霉菌对根腐病有一定的作用,研究发现,内生青霉菌对防治秋葵根腐病具有特定的潜力[61]。内生真菌增强寄主植物抵御病原菌的机制之一是产生抗菌代谢产物[62-64]。人参内生真菌拟青霉菌(Paecilomycessp.)中含有的抗真菌化合物人参炔醇(falcarinol)对稻瘟病菌有显著抑制作用[65]。挪威云杉根中的内生真菌会产生抗真菌代谢产物,防止根在体外受到腐烂病菌侵染[66]。此外,内生真菌也可提高寄主植物抵御非生物胁迫的能力。研究表明,印度梨形孢(Piriformospora indica)能协同大麦抵御盐胁迫[67]。从小麦植株中分离出的木霉属内生真菌表现出较强的耐盐性和耐干旱性,有利于小麦在盐碱地或干旱环境条件下生存[68]。ZAHOOR等[69]发现,毛霉菌(Mucorsp.)可将重金属锁定在菌丝体中,降低芥菜对重金属的吸收。
2.3 野生稻内生真菌研究
林福呈教授团队早在2010年就率先对野生稻内生真菌的生物多样性进行了研究,建立了野生稻内生真菌-水稻-病原菌的互作模型[70]:从野生稻根部分离出瓶霉属新种稻镰状瓶霉(Falciphora oryzae),并以此菌为代表研究了其在根部定殖模式,发现该菌菌丝主要集中在根毛区,由表皮层扩散到皮层直至内皮层,不侵染中柱细胞及微管组织;稻镰状瓶霉在侵染过程中形成多种真菌结构,如厚垣孢子、附着枝和微菌核结构等。该团队进一步研究发现,稻镰状瓶霉生物量在根系中呈现“慢—快—慢”的生长模式,最终生物量的增长与植物的生长保持一致,达到动态平衡[71]。通过祖先性状重建分析,该团队发现巨座壳科为一个单系类群,稻镰状瓶霉与常见的巨座壳科病原真菌(如稻瘟病菌、小麦全蚀病菌、早熟禾夏季斑枯病菌)拥有共同的致病真菌祖先[72]。稻镰状瓶霉基因组中有数千个转座子样元件的位点,导致929 个基因被破坏,孤独基因的获得或丢失、DNA 复制、基因家族扩展和转座子样元件的频繁易位是稻镰状瓶霉从致病祖先进化成共生菌的重要因素[72]。在进化过程中,稻镰状瓶霉中脂质运输和代谢相关基因簇减少,仅有395 个[72]。脂质运输和代谢是完整实现附着胞侵染过程非常重要的代谢途径,尤其对附着胞穿透叶片表皮非常重要。因此,脂质运输和代谢基因簇中基因大量丢失证明了稻镰状瓶霉不能在叶部侵染是因为附着胞侵染能力的丧失,而非功能的不完全获得[72]。稻镰状瓶霉与稻瘟病菌2 种菌株的整体基因组结构相似,但在与水稻互作过程中,2种真菌中11.7%的基因表达呈相反趋势,在侵染方式、寄主防御反应触发、信号传导和营养偏好等方面存在显著差异(图2)。
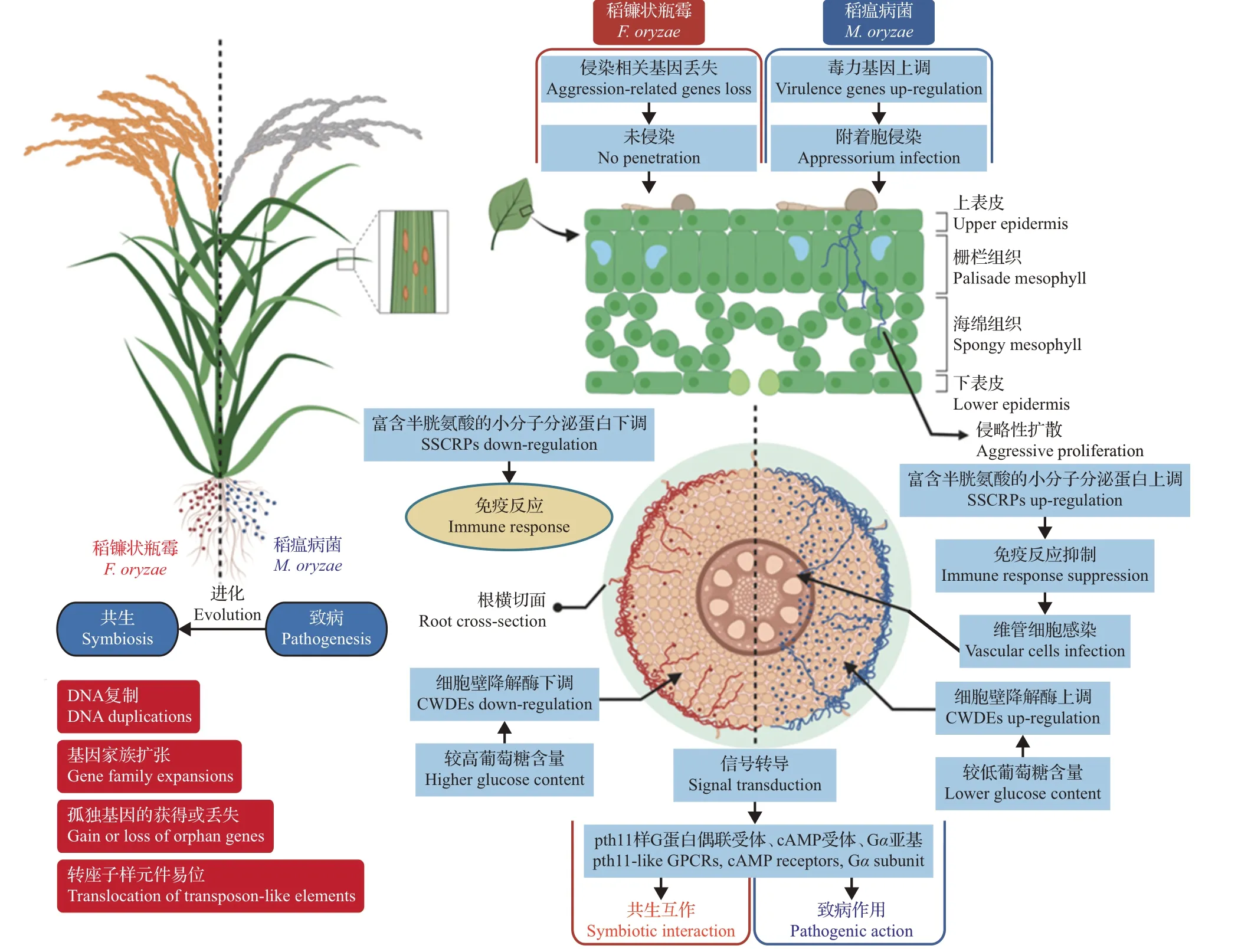
图2 稻镰状瓶霉、稻瘟病菌与水稻的互作模型比较Fig.2 Comparisons of interaction models between F.oryzae,M.oryzae and rice
为了解植物与真菌互作的进化机制,XU等[73]在2015 年研究了与稻镰状瓶霉或稻瘟病菌共生的水稻代谢组和转录组的差异。结果发现:稻瘟病菌侵染的水稻根中莽草酸酯和木质素生物合成途径的代谢产物水平不断增高,而在稻镰状瓶霉侵染的水稻根中,这些生物合成途径最初被诱导随后被抑制。稻镰状瓶霉侵染的水稻根中大部分参与糖酵解和三羧酸循环的基因表达被抑制,而稻瘟病菌侵染的水稻根中大部分基因表达增强。该研究提出了一种新的真菌与寄主相互作用的协同进化模式,强调了寄主植物在真菌共生进化中的重要性。
在增强植物抵抗稻瘟病菌的同时,稻镰状瓶霉还能够增强植物在重金属污染环境下的适应性,帮助植物抵抗病害。在重金属污染环境下,植物更趋于招募具有生态位适应性的暗色有隔内生真菌,促使双方形成共生关系,从而增强植物在重金属污染环境下的生态适应能力。稻镰状瓶霉具有良好的重金属吸附能力,能够将镉离子积累并隔离在液泡和厚垣孢子中,从而削弱镉对水稻的毒害,提高水稻的耐镉性,使稻米中的镉含量降低12.61%~24.74%[74]。利用蛋白质组学进一步挖掘稻镰状瓶霉中的镉响应蛋白发现,SNARE Syntaxin 1基因通过调控液泡的融合与厚垣孢子的形成来影响菌株的耐镉性[74],为利用稻镰状瓶霉作为潜在的生物资源修复植物重金属毒害、提高植物对重金属耐性方面奠定了重要的科学基础,为生产中减少稻米重金属积累提供了新途径。
2.4 稻镰状瓶霉应用安全性评估
内生真菌能通过与寄主植物共生促进寄主植物生长,增加寄主生物量,增强植物对生物和非生物胁迫的抗性。因此,内生真菌正成为应用于农业和园艺业的新型生防菌。然而,当前对内生真菌是否会演化为致病真菌这一应用安全性问题还没有明确和成熟的结论。2014 年,XU 等[72]阐明了致病真菌祖先演化为内生真菌稻镰状瓶霉的机制,并明确了稻镰状瓶霉的演化过程伴随着大量基因的丢失,如附着胞介导的叶部侵染相关基因以及编码G蛋白偶联受体的相关基因等。该研究说明共生性是一个多基因控制的系统性性状,并非由个别基因控制。此外,系统发育分析表明,致病性真菌祖先演化为内生真菌需要相当长的时间(1 500 万~6 700万年)。因此,在自然条件下,作为内生真菌的稻镰状瓶霉在有限的时间内并不会重新演化为致病真菌,这不仅为稻镰状瓶霉在生产应用中的安全性提供了理论支持,而且为其他真菌应用安全性的评估提供了可行性参考。
3 小结与展望
稻瘟病菌作为研究植物病原真菌的模式生物,对它的致病机制研究取得了重要发展,包括揭示了稻瘟病菌的侵染循环、致病相关信号传导途径及致病调控途径等。内吞作用和自噬是调控稻瘟病菌致病途径当中的2 条重要途径,目前已经挖掘到很多参与内吞和自噬途径相关的基因,有望为病原菌防治提供靶位分子和新药研发提供新思路。内吞和自噬过程的复杂交互关系还需深入研究,以进一步完善对内吞和自噬过程的理解。
野生稻根部有丰富的内生真菌种类,其中一些内生真菌能够促进植物生长和提高植物抗病性,有望开发为新型微生物菌剂,为稻瘟病生物防治提供新途径。为了更深入掌握内生真菌这种有利的生物资源,未来需要进一步对内生真菌的进化和作用机制进行研究。
