昆虫热激转录因子的研究进展
2023-01-19张超王妮施哲逸陈敏周文武周瀛祝增荣
张超,王妮,施哲逸,陈敏,周文武,周瀛,祝增荣*
(1.浙江大学农业与生物技术学院昆虫科学研究所,农业农村部作物病虫分子生物学重点实验室,杭州 310058;2.浙江大学海南研究院,海南 三亚 572025)
全球气候变化导致极端温度事件的发生频率大幅增加,并且伴随持续增长的趋势[1-2]。面对复杂多变的环境,昆虫演化出了维持细胞和蛋白质稳态的能力来增强它们在环境胁迫下的适应性。昆虫应对环境胁迫的策略之一是对热激蛋白(heat shock protein,HSP)的合成调控[1]。热激蛋白也称应激蛋白或分子伴侣,根据分子量大小和氨基酸序列差异,昆虫热激蛋白主要分为4个家族:小热激蛋白(small HSP, sHSP)、HSP60、HSP70 和HSP90[3]。当昆虫暴露于热、冷、拥挤和缺氧等胁迫环境时,大多数蛋白的合成减少,但热激蛋白合成反而增加,它们可促使相关蛋白进行重折叠、分配、运输和降解,进而维持细胞的正常功能[3]。热激蛋白的转录激活通常由热激转录因子(heat shock transcription factor, HSF)控制。作为一种在生物应激时被激活的转录因子,HSF在酵母、拟南芥、果蝇、鱼、鸡、小鼠和人类等生物体内普遍存在。虽然HSF在植物和哺乳动物中数量众多,但在许多昆虫中目前只发现了HSF的单个基因。本文对昆虫HSF的结构、转录调控过程以及功能进行了概述,并对未来的研究方向提出了展望。
1 昆虫HSF 的基本结构
在哺乳动物中,HSF 家族至少有7 个成员:HSF1~HSF5、HSFX 和HSFY,其中HSF1 是主要的调节因子[4]。在黑腹果蝇(Drosophila melanogaster)体内只有1 个HSF,其结构和功能与哺乳动物的HSF1 类似[5]。生物体转录因子的功能主要由其结构特征决定,昆虫HSF 包含4 个保守的结构域:DNA 结合结构域(DNA-binding domain, DBD)、七肽重复区域A/B(heptad repeat regions A and B,HRA/B)、C 末端的七肽重复区域(heptad repeat region of C end,HR-C)和转录激活结构域(transactivation domain,TAD)(图1)。

图1 昆虫热激转录因子的基本结构Fig.1 General structure of HSF in insects
DBD结构域位于HSF蛋白的N端,其内部结合域疏水中心存在1 个“螺旋-转角-螺旋”(helixturn-helix)的疏水结构[6]。由于该结构域在不同物种间高度保守,因此也被认为是HSF 的特征结构域。与其他转录因子不同,虽然HSF 的“螺旋-转角-螺旋”结构不与DNA直接接触[7],但是HSF的这个特征结构可以通过蛋白质-蛋白质之间的相互作用来介导HSF 三聚体的形成和支持DNA 结合能力的获得[8-9]。HR-A/B结构域位于DBD的下游,该结构域由2个七肽疏水的重复序列A和B组成。该结构域具有分子间疏水作用,可促使3 个HSF 单体形成一种细长、平行的具有DNA结合活性的同源三聚体结构[10]。HR-C 结构域位于C 末端,该结构域在脊椎动物和昆虫的HSF中非常保守。有研究表明,HR-C 结构域可与HR-A/B 结构域作用,进而抑制HSF形成同源三聚体[11]。TAD结构域位于HR-C结构域的下游,即C 末端,是HSF 最不保守的区域。目前,对HSF 的C 末端区域结构知之甚少,但比较明确的是C 末端区域促进了下游靶基因的转录激活,且调节了HSF转录激活的强度[12]。此外,有研究发现,HSP70 可以与HSF 的TAD 结构域结合,进而解除HSF的三聚体形态[13],这暗示着TAD结构域可能在HSF 单体和三聚体形态转变过程中具有特殊功能。
2 昆虫HSF 的转录调控
转录是蛋白质合成的第一步,HSF 对靶基因的转录调控对其表达至关重要。以下主要从HSF 的三聚体化、HSF的核定位、HSF的磷酸化以及热激蛋白对HSF的反馈调节4个方面阐述昆虫HSF对靶基因的转录调控。
2.1 HSF 的三聚体化
昆虫HSF在正常条件下以无活性的单体形态存在,当受到胁迫时,HSF活化,并由单体转变为有活性的同源三聚体形态[14]。因此,HSF由单体向同源三聚体形态的转变是HSF活化的前提[15]。昆虫HSF的激活和转录调控的简化模型如图2所示。当应激发生时,昆虫细胞的pH 值降低,这能促使单体的HSF易位到细胞核中,并转变为三聚体形态结合到靶基因启动子区保守的反向重复序列——热激元件(heat shock element,HSE)nGAAn(n代表任意核苷酸)上,进而调控靶基因的表达[16-17]。由于HSF 同源三聚体的每个DBD都要结合1个nGAAn序列,故HSF与热激元件的稳定结合需要3个具有交替取向的nGAAn序列,即GAAnnTTCnnGAA[18-19]。研究表明,HSF 和HSE 的结合能力会受到热激蛋白基因启动子和转录区的乙酰化水平的影响,当采用组蛋白去乙酰化酶抑制剂饲喂果蝇时,热激蛋白基因启动子和转录区的乙酰化水平提高,HSF 与HSE 的结合能力增强[20]。此外,应激开始时,昆虫HSF 与HSE 的结合十分迅速,果蝇DmHSF与DmHSP70启动子的结合在应激发生后几秒钟内即可被检测到,并且启动子上DmHSF 分子数在约1 min 时即可达到饱和状态[21]。应激结束后,昆虫细胞即恢复到正常状态,HSF 则又从同源三聚体形态转变为无活性的单体形态[22]。
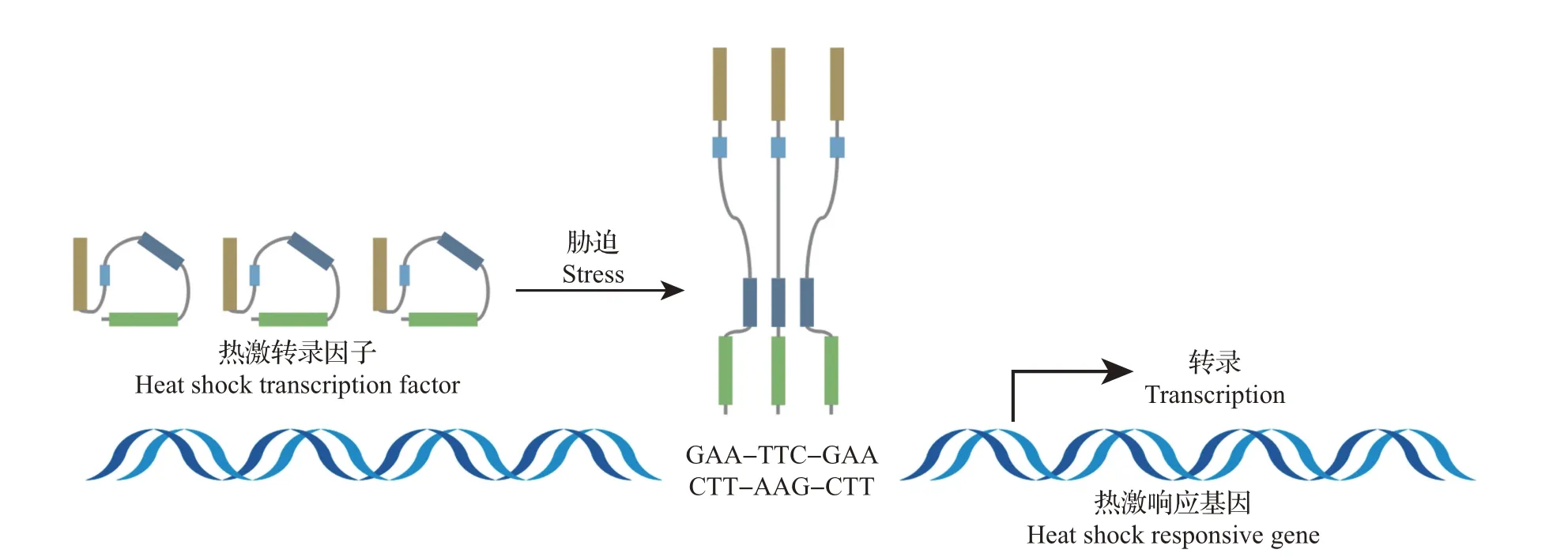
图2 昆虫热激转录因子的激活和转录调控的简化模型Fig.2 Simplified model for activation and transcriptional regulation of HSF in insects
2.2 HSF 的核定位
HSF 核定位信号(nuclear localization signal,NLS)区域的活化是HSF 进入细胞核行使转录调控功能的关键环节。研究表明,在人类Hela 细胞中,在无胁迫时HSF1分散在细胞质中,在应激时HSF1则主要分布在细胞核中[23]。HSF1 从细胞质向细胞核的转移和形态转变的激活,则依赖于NLS对核区的定位。然而,在果蝇SL2 细胞中,突变果蝇DmHSF的NLS区域后,在热激状态下DmHSF可以在细胞质中三聚体化并和DNA结合;而当细胞从热激恢复到正常条件下时,HSF的三聚体形态在细胞质中也能够可逆地转变为单体形态[24-25]。这意味着对于昆虫而言,在细胞核和细胞质中均可发生HSF形态的转变。
2.3 HSF 的磷酸化
一般认为,HSF的磷酸化对HSF的转录调控活性以及HSF 与HSE 的结合至关重要[14]。在应激发生时,HSF 上的多个位点被磷酸化,随后HSF 才具有转录活化的功能[26]。然而,研究发现果蝇的DmHSF 磷酸化水平在热激前后保持不变,而且DmHSF磷酸化与否对其DNA结合活性及形态转变没有影响[27]。因此,昆虫HSF 磷酸化是否有其他特定的功能,尚待进一步研究。
2.4 热激蛋白对HSF 的反馈调节
尽管激活HSF的各类环境信号存在性质上的不同,但它们在分子调控水平具有相似性,因为它们通常会导致细胞中异常蛋白增加,进而细胞需要合成更多的热激蛋白作为分子伴侣来结合异常蛋白,以维持蛋白质的稳定性。热激蛋白含量为热激蛋白基因的表达效率提供了一个有效的参考点——当热激蛋白含量足够时,HSF 的转录调控活性会受到抑制,进而抑制热激蛋白基因的表达。在果蝇中,DmHSP70基因过量表达可抑制其他热激蛋白的表达,而过低表达则可诱导DmHSP70基因和其他热激蛋白基因的快速表达,这表明DmHSP70 是DmHSF 的负调控因子[28]。此外,MARCHLER 等[29]在酵母双杂交实验中也发现,DROJ1(人类HSP40/HDJ1 在果蝇中的同源物)可以和DmHSF 相互作用,并最终证实了DROJ1 与DmHSP70/DmHSC70和DmHSP90 之间通过协同作用来抑制DmHSF 的活性。然而,热激蛋白并非都充当HSF的负调控因子,有些热激蛋白也可以正调控HSF 的表达,如干扰莲草直胸跳甲(Agasieles hygrophila)的AhHSP70或AhHSP21基因表达后,均会导致AhHSF基因的表达量降低[30]。
3 昆虫HSF 的主要功能
早在1990年,模式昆虫黑腹果蝇的HSF就已经被鉴定[31]。随后,果蝇HSF 的功能也逐渐被揭示。近年来,随着现代分子生物学技术、基因组测序技术和基因编辑技术的发展,多种昆虫的HSF得到鉴定。尽管在众多昆虫中只有单个HSF,但其功能具有多样性。已鉴定的昆虫HSF 及其功能如表1所示。
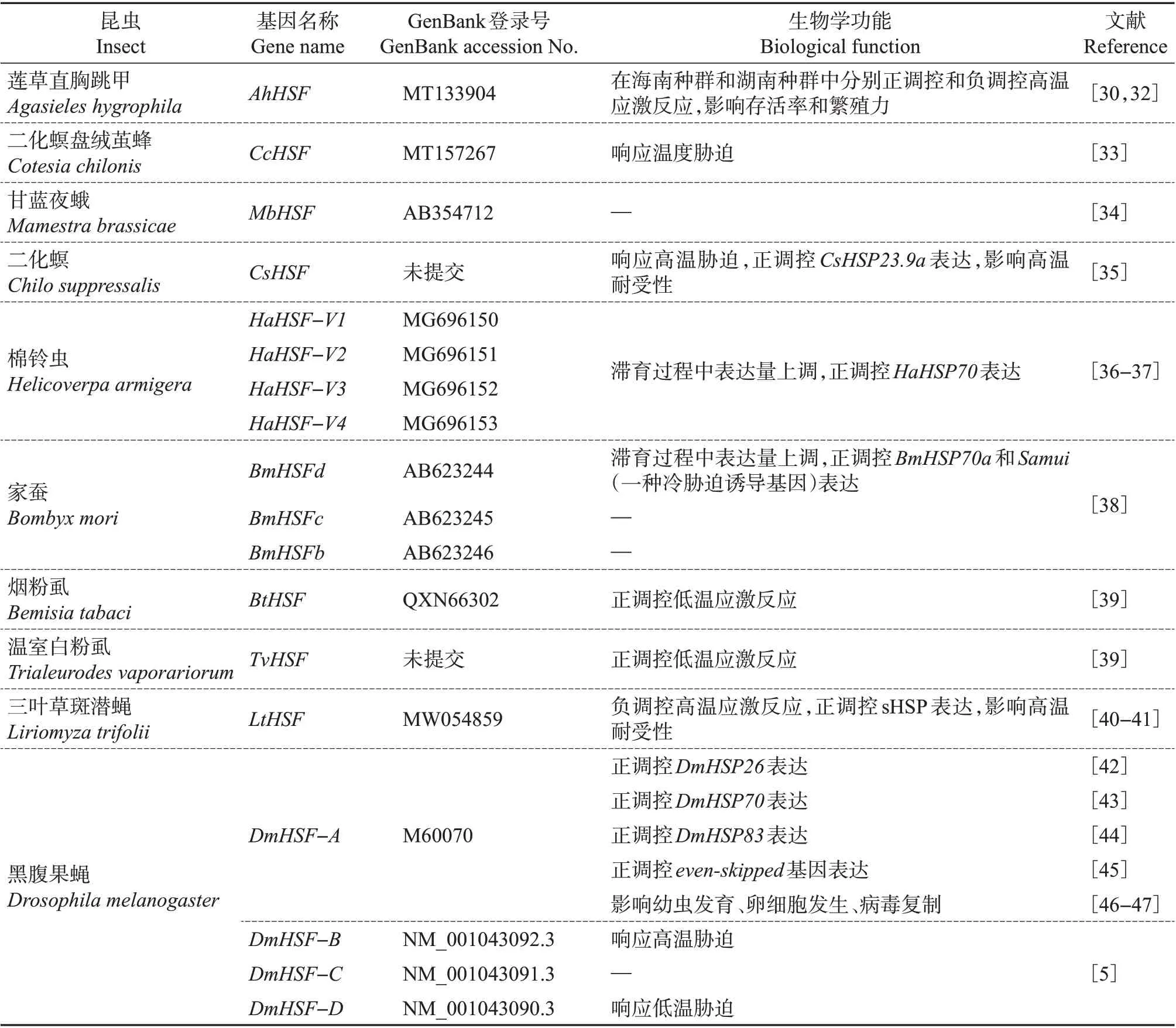
表1 已鉴定的昆虫热激转录因子及其功能Table 1 Identified HSFs in insects and their biological functions
3.1 响应温度胁迫
昆虫是变温动物,其生长发育极易受环境温度的影响。研究发现,昆虫的HSF在响应温度胁迫中至关重要。一般认为,昆虫在受到温度胁迫后会激活HSF,进而诱导热激蛋白的表达。如二化螟盘绒茧蜂(Cotesia chilonis)暴露在36 ℃高温或6 ℃低温条件下,CcHSF和CcHSP11.0基因的表达均会明显上调[33]。也有研究发现,并不是所有的热激反应都遵循这个规律,如三叶草斑潜蝇(Liriomyza trifolii)在受到高温胁迫时,体内LtHSF基因的转录水平反而降低[41];不同地理种群的莲草直胸跳甲遭受高温时,HSF 的表达趋势也体现出差异,其中湖南莲草直胸跳甲种群AhHSF基因的表达量显著降低,而海南莲草直胸跳甲种群AhHSF基因的表达量则显著提高[32]。此外,有研究发现,HSF 在遭受温度胁迫时表达趋势的不同可能与其复杂的可变剪切有关。例如,果蝇HSF 存在4 条不同的可变剪接体(DmHSF-A、DmHSF-B、DmHSF-C、DmHSF-D),其中DmHSF-B 在37 ℃高温胁迫下表达量显著升高,DmHSF-D在4 ℃低温胁迫下表达量显著升高,而DmHSF-A、DmHSF-C 以及DmHSF 总表达量均没有显著变化[5]。可变剪接体的表达模式对同一胁迫产生不同响应的现象,暗示着HSF不同的可变剪接体在应激时可能发挥不同的功能,这一机制有待深入研究。
3.2 参与调控昆虫的发育和生殖
除了参与昆虫对温度胁迫的应答之外,HSF 还参与调控昆虫的发育和生殖过程。例如,果蝇DmHSF基因的突变会导致幼虫发育停滞和死亡,而且使DmHSF突变果蝇的卵细胞形成过程受阻,但是DmHSF 突变果蝇和野生型果蝇的热激蛋白的表达水平没有显著差异,因此DmHSF可能通过非热激蛋白途径来调节卵细胞的发生[46]。KUCHAR 等也发现,发育相关基因even-skipped的增强子上含有几个潜在的DmHSF结合位点,并证实了在果蝇胚胎发育过程中DmHSF能够调节even-skipped基因的表达[45]。此外,调节DmHSF也能影响衰老,如降低DmHSF的活性会加速组织老化,缩短果蝇寿命;相反,过表达DmHSF则会延长果蝇的寿命[48]。JIN等在利用注射双链RNA(double-stranded RNA,dsRNA)的方法沉默AhHSF基因表达后,莲草直胸跳甲的存活率和产卵量均显著降低[30],也进一步证实了HSF 对昆虫的发育和生殖过程至关重要。
3.3 参与昆虫滞育
昆虫滞育是受光周期、温度和食物等多种外界环境因素影响的生物学过程,对延续昆虫种群具有重要意义。目前,昆虫滞育的具体机制还有待深入研究,但热激蛋白参与调控昆虫胚胎、幼虫、蛹和成虫滞育已在一些研究中得到证实[3]。如SIRIGINEEDI 等通过比较家蚕(Bombyx mori)的滞育卵和非滞育卵中热激蛋白的表达发现,前者中BmHSP70基因的表达水平显著高于后者,推测BmHSP70基因在家蚕卵的滞育诱导中发挥作用[49]。作为热激蛋白的转录因子,HSF 能够通过特异性识别并结合热激蛋白基因启动子区的HSE,从而调控热激蛋白基因的转录和表达。KIHARA等发现家蚕的BmHSFd可以和BmHSP70a和Samui(一种冷胁迫诱导基因)的HSE 相结合,进而调控BmHSP70a和Samui基因的表达[38]。此外,CHEN等也发现棉铃虫(Helicoverpa armigera)的4 条HaHSF可变剪接体均能够调节HaHSP70基因的表达[36]。这些研究结果表明,HSF通过调控多个基因的表达来参与昆虫滞育过程,并且在昆虫滞育过程中发挥重要作用。
3.4 其他生物学功能
HSF在昆虫响应低氧胁迫中同样起着重要的作用。在缺氧环境中,果蝇的缺氧诱导因子(hypoxiainducible factor-1,HIF-1)可通过和DmHSF基因的内含子结合以直接上调DmHSF基因的表达,进而上调热激蛋白的表达;而DmHSF 表达量较低的幼虫在缺氧环境中只有约50%可以顺利进入蛹期,与正常缺氧幼虫相比,DmHSF 表达量较低的幼虫存活率显著降低[50],说明HSF 可能参与响应昆虫的低氧胁迫。
除了参与响应温度胁迫和低氧胁迫等非生物胁迫外,昆虫HSF也受到病害等生物胁迫调控。例如,果蝇C病毒(DrosophilaC virus,DCV)感染果蝇S2细胞,会导致果蝇S2细胞的DmHSF基因和热激蛋白基因DmHSP70、DmHSP23和DmHSP26的表达水平提高,表明感染DCV会诱导昆虫体内的热休克反应。在感染DCV 后,与野生型果蝇相比,过表达DmHSF的果蝇存活时间被显著延长,体内病毒量也被长期控制在检测不到的水平,而DmHSF缺失果蝇则表现出对DCV的高度敏感性[47]。因此,HSF所介导的热休克反应可能是昆虫先天抗病毒免疫的重要原因。
4 展望
HSF 参与昆虫的许多生命活动,不论昆虫处于正常状态还是应激状态,HSF都在昆虫的各种生物学过程中扮演重要角色。目前,HSF的研究主要集中在模式昆虫黑腹果蝇中,在其他昆虫中的研究还有待深入开展;此外,对HSF 功能的研究也主要集中在温度胁迫上,而在面对拥挤、饥饿和光照等其他胁迫时,昆虫体内的HSF起到何种作用尚有待进一步研究。如WANG 等[51]发现紫外光会显著影响棉铃虫热激蛋白的表达,并推测HSF参与棉铃虫对光胁迫的响应。此外,HSF响应环境胁迫的调控机制不仅在昆虫中不明晰,在其他生物中也尚未被探明。有关哺乳动物的研究发现,高温胁迫下葡萄糖神经酰胺会被迅速分解以提供糖基合成葡萄糖苷胆固醇,而生成的葡萄糖苷胆固醇能进一步诱导HSF1的激活和HSP90的合成[52-54],这为HSF的调控机制研究提供了线索。但在昆虫中,HSF如何感知胁迫信号并进行传导,尚有待更深入的研究。近年来,随着越来越多昆虫HSF 被克隆与鉴定,研究表明昆虫HSF不仅在热休克反应中起作用,而且可以通过调控非热激蛋白基因的转录进而在各种应激诱导的细胞过程和分子机制中起作用[55-56]。然而,对于HSF 可以调控的下游靶基因却知之甚少。在后续的研究中,可以运用染色质免疫共沉淀测序(chromatin immunoprecipitation-sequencing, CHIPSeq)等分子生物学技术深入解析HSF 的下游靶基因,以加深对昆虫HSF调控机制和功能的认识。
