营养期杀虫蛋白Vip3类转基因抗虫作物的研发进展
2023-01-19全玉东吴孔明
全玉东,吴孔明
(植物病虫害生物学国家重点实验室/中国农业科学院植物保护研究所,北京 100193)
苏云金芽孢杆菌(Bacillus thuringiensis,简称“Bt”)是一种革兰氏阳性需氧菌,广泛分布于土壤、水、植物等生态系统中。作为重要的昆虫病原体,Bt在不同培养阶段产生的毒素(蛋白)对多种农业害虫(如鳞翅目、鞘翅目、双翅目等)具有高效和特异的杀虫效果,已被开发为生物杀虫剂并广泛应用于农业生产中[1]。目前,世界上Bt 病原体或毒素生物制剂约占微生物农药市场的75%~95%[2],转Bt基因抗虫作物的种植面积已超过1.01 亿hm2,占转基因作物种植面积的53%以上[3]。Bt病原体或蛋白的大量使用,具有提高经济效益、减少农药用量、增加生物多样性以及保障人体健康和食品安全性的作用。对Bt或Bt基因的合理运用和相关研究,不仅是有害生物综合治理(integrated pest management,IPM)策略的重要组成部分,而且是发展绿色农业的关键[4]。
1996年,美国批准转cry1Ab抗虫基因玉米商业化,随后多种cry转基因作物在全球范围内被大面积种植。在经历了近25年的使用后,当前已在田间监测到超过20 种靶标害虫演化出对部分晶体蛋白(crystal proteins, Cry 蛋白)毒素的高耐受性[5]。此外,虽然Cry蛋白或cry基因可高效防治多种农业害虫,但部分重大农业害虫如草地贪夜蛾(Spodoptera frugiperda)、小地老虎(Agrotis ipsilon)等具有对Cry蛋白的先天不敏感性[6-7]。一种分离于Bt品系AB88营养生长阶段上清液中约88.5 kDa 的蛋白Vip3Aa(vegetative insecticidal protein 3Aa,营养期杀虫蛋白3Aa),对鳞翅目昆虫具有高度的杀虫活性,特别是对小地老虎(A.ipsilon)等Cry 蛋白不敏感害虫[8]。为了治理或延缓靶标害虫对Cry 蛋白等的抗性,提出科学合理的Bt 使用策略,学者们提出“庇护所”“高剂量”“多基因”等学说[4]。目前,vip3作为“多基因”策略中重要的组成部分,和cry基因一起应用于转基因作物中,用来治理靶标害虫对Cry 蛋白的抗性或增加杀虫图谱数等[9-10]。
目前,Vip3 杀虫蛋白家族已发现有14 个模式样本(Vip3Aa~j、Vip3Ba~c、Vip3Ca),超过110 种蛋白。值得注意的是,在2020 年新的命名法中,根据序列的同源性和结构,Vip3杀虫蛋白家族被称作Vip,原Vip1、Vip2、Vip4 则分别称作Vpb1、Vpa、Vpb4 蛋白家族。在当前市场上所使用的主要为Vip3Aa(Vip3Aa19、Vip3Aa20)[5,11-12]。中国也一直高度重视作物转基因育种技术的研究,提出尊重科学、监督管理、有序推进的发展方针,并于2021年开展了转基因玉米和大豆的产业化试点工作[13]。鉴于Vip3对发展Bt作物和杀虫剂的特殊重要性,本文综述了Vip3 的结构和功能、杀虫机制、抗性治理及其在转基因作物上的应用情况。
1 Vip3 杀虫蛋白的结构和功能
Vip3 包含787 个氨基酸,平均分子量约为89 kDa。Vip3 的N-端富含α-螺旋,序列分析显示其具有高度的保守性,特别是氨基酸12—188(pfam12495)被发现存在于所有Vip3A 亚家族中。Vip3 的N-端区域被认为可能作为一种信号肽参与蛋白质的激活调节。与此形成鲜明对比的是,Vip3的C-端区域主要由β-折叠构成,存在高度的可变性,与碳水化合物结合组件(carbohydrate-binding module,CBM)具有高度相似性,被猜想和特异性靶向结合或增加膜上毒素(Vip3)浓度有关[14-15]。
近年通过冷冻电镜扫描发现,Vip3Aa由Ⅰ~Ⅴ5 个结构域组成,并由4 个单体围绕中心孔构建成四聚体[16],类似的构象也在Vip3B 蛋白的扫描电镜三维(three dimension, 3D)结构中被发现[17-18]。以Vip3Aa 为例,Vip3Aa 原毒素(protoxin)在自然状态下(pH 7~11)被四聚体组装成“金字塔”形(pyramid-shaped)结构,其N-端位于顶端的尖端区域(“塔尖”)[16,18]。与Cry蛋白类似,Vip3Aa原毒素也需要被昆虫中肠内存在的蛋白酶激活,通过类胰蛋白酶的消化过程生成2个约20、65 kDa的片段,并在氨基酸位点198/199附近被切割,但这2个片段仍保持强烈关联[16,19-22]。在被胰蛋白酶激活后的Vip3Aa中主要观察到一种新的“注射器”状(syringe-like)结构活化毒素,它由3 个反平行N-端螺旋(α2~α4)以类似“折叠麻花状藤条”的方式经历一系列旋转,形成一个长的连续螺旋,最后组装成平行的四螺旋结构[16-18]。
Vip3Aa 的结构域Ⅰ从N-端延伸到初级蛋白酶裂解位点(K198),由4个细长折叠弯曲的α-螺旋(α1~α4)组成,特别是α1~α2的可变长度允许内部单体的第2和第3螺旋旋转,进一步形成一个八螺旋束,最终形成“注射器”状结构(活化构象,图1)的四聚体核心突出部分(“茎”)[16-18]。结构域Ⅱ(氨基酸200—325)由5个α-螺旋组成,包含四聚体的核心并使Vip3Aa 的低聚物稳定。结构域Ⅲ(氨基酸328—532)由3个反平行β-折叠组成,排列成一个β-棱镜结构[16,18,21]。Vip3Aa或Vip3B的结构域Ⅲ与Cry蛋白(δ-内毒素)的结构域Ⅱ极为相似[18,23]。有趣的是,在一些Cry 蛋白毒素中,Vip3Aa 或Vip3B 的结构域Ⅱ已被证明能够识别与碳水化合物的特异性结合,其结构域Ⅲ也被推断与受体的结合有关[18,24-25]。Vip3Aa 的结构域Ⅳ和Ⅴ(以氨基酸675 为划分位点)通过一段长链序列连接到结构域Ⅲ上,具有类似的CBM 折叠[14,16-18,20-21]。虽然这些结构域的作用尚不是很清楚,但已有的研究结果表明,结构域Ⅳ~Ⅴ对壳聚糖和几丁质有强烈的偏好,并且缺失任意一个都将使Vip3Aa或Vip3Af的杀虫活性完全丧失[21,25-26]。有趣的是,结构域Ⅳ~Ⅴ并不会对Vip3Af的受体特异性结合产生影响,并且在Sf21细胞存活能力测试中发现,来自Vip3Af纯化的结构域Ⅰ~Ⅲ和野生型中的结构域具有相同的杀死细胞的能力[21,24]。但对甜菜夜蛾(Spodoptera exigua)幼虫的生物学检测发现,包含CBM片段(结构域Ⅰ~Ⅳ)的突变体在一定浓度下可和Vip3Aa产生拮抗作用[27]。此外,还发现位于结构域Ⅴ的Vip3Aa64 的Y776N(Y到N)残基突变体对高温储存期间保持杀幼虫活性很重要,预示着结构域Ⅴ与蛋白的稳定性有关[28]。
此外,对比Vip3Af 蛋白3D 结构和通过丙氨酸扫描技术检测的关键氨基酸位点,对Vip3A 的结构或功能提供了关键认识。在Vip3A 原毒素中,其四聚体由2个二聚体构成,由氨基酸T167和F229单体间相互作用形成的这2个二聚体对四聚体的稳定具有重要作用,而E168 和N242 氨基酸单体相互作用对二聚体中单体的聚合有重要作用[16,21]。这些关键氨基酸位点在随后的丙氨酸突变体(通过丙氨酸扫描技术将原氨基酸突变为丙氨酸)中都完全丧失了杀 虫 活 性[16,21,26]。虽 然 突 变 体T167A、T168A 和N242A仍保持四聚体构象,但F229A在原毒素阶段表现为二聚体(pH 9),在被胰蛋白酶消化后将完全变成27 kDa 小肽片段[21,26]。此外,丙氨酸突变体E483A 原毒素完全成了单体,被胰蛋白酶消化后出现和F229A 一样的27 kDa 小肽片段[21,26]。据推测,T167和N163可能在原毒素中产生一个单体间相互作用网络,E168、F229和Y272在原毒素和活化毒素结构中保持基本相同的接触,并且很可能在针状物形成期间起稳定蛋白质的作用,E483加强了这种相互作用,使碱基与四聚体的核心和β-棱镜结构域连接。值得注意的是,四聚体保存的完整性对杀虫活性起着至关重要的作用[16,21,26]。
Vip3 高度保守的N-端区域对水解敏感性和杀虫活性具有重要的调节作用。通过交换Vip3Ab1和Vip3Bc1 的N-端(20 kDa)序列发现,尽管蛋白水解活性相似,但杀虫活性已完全丧失[29]。但在N-端缺失突变体Vip3AcAa中观察到,删除前198个氨基酸(对应20~22 kDa 片段)增加了其对胰蛋白酶水解的敏感性,并消除了其对棉铃虫(Helicoverpa armigera)和甜菜夜蛾(S.exigua)的毒性[30]。然而,从Vip3Aa 核心活性毒素的N-端序列中去除前200个残基,可将其对棉铃虫(H.armigera)、小地老虎(A.ipsilon)、棉叶虫(Spodoptera littoralis)、三化螟(Scirpophaga incertulas)的杀虫活性提高2~3倍[31]。此外,从Vip3Aa中删除前27个N-端氨基酸可使蛋白质失去活性,导致其溶解度完全丧失。相比之下,从Vip3Aa中删除前33个氨基酸后,其对斜纹夜蛾(Spodoptera litura)、小菜蛾(Plutella xylostella)和埃及金刚钻(Earias vitella)没有任何杀灭作用[32];而删除前39 个N-端氨基酸会使其对斜纹夜蛾(S.litura)、玉米禾螟(Chilo partellus)的毒性产生不同的影响[33]。Vip3Af 的定点突变体M34L(氨基酸Met突变为Lys)显著增加了其对棉叶虫(S.littoralis)的毒性[34]。这些结果表明,Vip3 的N-端对溶解性、水解性和杀虫活性具有重要的影响。
近年来的研究表明,Vip3Aa 和Vip3Af 的C-端对杀虫活性也有显著的影响,与昆虫体内几丁质具有一定的结合能力[14,16,25]。位于C-端的突变体(C-端某些氨基酸突变为丙氨酸或其他不同的氨基酸)能显著降低原高敏感的靶标害虫的活性或使其完全失活,如氨基酸E483、W552、I699 等[14,16,25]。此外,碳水化合物结合基序(CBM_4_9 超家族,pfam02018)存在于除Vip3Ba 之外的所有Vip3 中(氨基酸536—652)[14-15]。然而,目前关于Vip3Aa C-端的特异性结合以及相关受体的研究仍缺乏直接的证据。
2 Vip3 杀虫蛋白的作用机制
Vip3 自1996 年被鉴定出[8]后,其作用机制受到了广泛关注。Vip3Aa、Vip3B 和Vip3C 在结构上具有显著的相似性,Vip3Aa作为Vip3的重要代表性杀虫模型被深入解析(图1)。此外,对Vip3B 的3D 结构和Vip3Ca的作用机制研究发现,它们与Vip3Aa具有相似的作用模式[14-15,35]。因此,后文主要以Vip3Aa 的作用模式为代表对Vip3 的作用机制进行总结和探讨。Vip3Aa 作用机制的研究主要以鳞翅目昆虫中肠和Sf9 细胞为对象,Vip3Aa 被蛋白酶激活后会与中肠刷状缘上皮细胞的顶膜结合并形成穿孔[14,36-37]。Vip3Aa 在昆虫体内的作用过程主要包括:1)原毒素的摄取;2)被中肠消化酶活化[19];3)穿过围食膜到达中肠上皮细胞并与相关的特异性受体结合[24,36-37];4)某些通道或过程[如丝裂原活化蛋白激酶(mitogen-activated protein kinases, MAPKs)通道、细胞凋亡过程等]被激活[38-40];5)N-端移位和重新构建,形成一个新四螺旋状长条,可以到达并渗透脂质双层,形成孔隙或造成某些离子的流失[16-18],最终可能导致中肠的病变或虫体的死亡。其中,位于中肠刷状缘上皮细胞内的特异性受体结合过程已被鉴定,在Cry 蛋白参与的同Vip3Aa、Vip3Af竞争结合实验中,这种特异性受体结合并不会受到影响[24,37]。
此外,研究Vip3Aa原毒素与Sf9细胞的作用(图1)发现,Vip3Aa可能直接与细胞表面的清除类C家族蛋白受体(scavenger receptor class C like protein,SR-C)、成纤维细胞生长因子受体(fibroblast growth factor receptor,FGFR)等受体蛋白结合,然后通过受体蛋白介导的内吞作用(endocytosis)进入细胞,从而诱导细胞凋亡[25,38,41-42]。同时,还鉴定出了部分Vip3Aa的特异性受体,如草地贪夜蛾(S.frugiperda)SR-C(Sf-SR-C)、草地贪夜蛾(S.frugiperda)FGFR(Sf-FGFR),这些受体与细胞凋亡(apoptosis)过程的激活具有重要的关联性[38,41-42]。特别是Sf-SR-C被检测出对细胞的内吞作用具有重要影响[38]。一种约48 kDa的类胞外糖蛋白家族(tenascins)Vip3Aa受体被发现能够穿过小地老虎(A.ipsilon)的上皮细胞组织,推测此受体对营养物质运输通道的形成具有干扰作用[43]。但是目前与活化的Vip3Aa 相关的中肠上皮细胞中受体的鉴定仍然缺乏明确的证据,将是后续研究的重点。
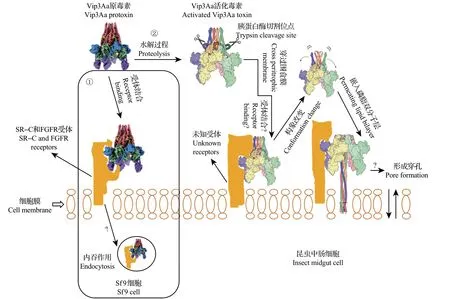
图1 Vip3Aa杀虫机制示意图Fig.1 Schematic diagram of insecticidal mechanisms of Vip3Aa
3 Vip3 类转基因抗虫作物的研发
Vip3对多种鳞翅目昆虫具有高效的杀灭活性,其杀虫图谱已被CHAKROUN 等[14]、CHAKRABARTY等[15]详细总结,大部分数据源于对Vip3A 家族或亚家族(Vip3Aa)的生物学检测,少部分来自Vip3B 和Vip3C。值得注意的是,地夜蛾属(Agrotis)和灰翅夜蛾属(Spodoptera)的昆虫对Cry 蛋白具有高度的耐受性,而对Vip3 表现出易感性[6-7]。但一些对Cry蛋白高度易感的昆虫如玉米螟(Ostrinia nubilalis)、致倦库蚊(Culex quinquefasciatus)和摇蚊(Chironomus tepperi)对Vip3A 都是轻微易感或不敏感[6,8]。鉴于这2 种毒素蛋白的杀虫图谱具有较高的互补性,在转基因抗虫作物的研发中,同时表达多种Vip3A 和Cry 蛋白的策略被广泛采用[9-10],因而出现了多种Cry蛋白和Vip3A叠加品种(表1),或者通过基因工程改造Vip3A 的部分序列,嵌入或者连接部分非Vip3A序列(如Cry蛋白)(表2),以达到增强毒力或延缓抗性的作用。

表1 商业化应用的表达Vip3A的Bt作物Table 1 Commercially available Bt crops expressing Vip3A
瑞士先正达(Syngenta)集团、德国拜耳(Bayer)集团、美国杜邦(DoPont)公司、美国陶氏(Dow_Agrosciences)公司等都开发了转vip3Aa基因(如vip3Aa19、vip3Aa20)作物(表1)。我国北京大北农科技集团股份有限公司(简称“大北农”)也开发出Vip3类转基因抗虫作物(转化事件DBN9501),但目前尚未在田间商业化种植。联合使用vip3和cry基因可延缓田间靶标害虫对转基因作物的抗性。虽然大量的生物学检测数据表明,Vip3 和Cry 蛋白的杀虫作用不会互相影响,但其部分组合被检测到增效或拮抗作用[9-10]。表现增效作用的组合有:针对草地贪夜蛾(S.frugiperda)、灰色条纹黏虫(Spodopteraalbula)、黑色黏虫(Spodoptera cosmioides)的组合Vip3Aa和Cry1Ia,针对东方黏虫(Mythimna separata)的组合Vip3Aa16 和Cry1A,针对小蔗螟(Diatraea saccharalis)的组合Vip3Aa 和Cry1Ca,针对二化螟(Chilo suppressalis)的组合Vip3Aa和Cry9Aa,针对草地贪夜蛾(S.frugiperda)的组合Vip3Aa 和Cry1Ab(Cry2Ab)等。表现拮抗作用的组合有:针对烟夜蛾(Heliothis virescens)的组合Vip3A和Cry1A(Cry1Ca),针对南方黏虫(Spodoptera eridania)的组合Vip3A和Cry1Ia[14-15,35]等。
此外,通过基因工程构建含vip3和cry的嵌合vip3A基因,对Vip3A和Cry蛋白部分进行编码,以获得具有新颖或改良特性的新蛋白(表2)[15]。目前,嵌合体主要是通过融合vip3Aa和vip3Ac基因或vip3Aa和cry基因使新表达的蛋白质之间的结构域或序列进行交换产生的,可提高杀虫活性或增加杀虫图谱数。如由Vip3Ac1 N-端的600 个氨基酸和Vip3Aa1 C-端的189个氨基酸组成的嵌合体Vip3AcAa,获得了对玉米螟(O.nubilalis)的毒力,并增加了对草地贪夜蛾(S.frugiperda)、美洲棉铃虫(Helicoverpa zea)和家蚕(Bombyx mori)的毒性。相比之下,Vip3AaAc(具有Vip3Aa1 的N-端和Vip3Ac1 的C-端)的毒性低于其原始蛋白Vip3Aa1 或Vip3Ac1,甚至完全丧失了对家蚕(B.mori)的毒性[44]。融合Vip3Aa14和Cry1Ac 的嵌合体虽然保留了Cry1Ac 对棉铃虫(H.armigera)和小菜蛾(P.xylostella)的毒性,但对斜纹夜蛾(S.litura)部分失去了Vip3Aa的毒性,推测其原因可能是Vip3A 折叠不正确[45]。融合了Vip3Aa7和Cry9Ca 的嵌合体Vip3Aa7 却显示出相对于Cry9Ca更加高效的毒力,潜在的原因可能是Vip3Aa增加了Cry9Ca的溶解度[46]。在另一个Vip3Aa7嵌合体中,Cry1C启动子的融合使嵌合体蛋白的表达量显著增加了约9倍,但是这种表达了Vip3Aa7(N-端删除39个氨基酸)和Cry1C的C-端的融合蛋白却表现出相对于原始Vip3Aa较差的杀虫活性,其原因可能是蛋白质的溶解度较低或折叠不当[47]。

表2 基因工程改造的Vip3A及其毒力变化Table 2 Genetic engineered Vip3A and their insecticidal activity changes
4 靶标害虫对Vip3 类转基因抗虫作物的抗性监测与治理
4.1 抗性监测
Bt作物的商业化种植不可避免地会使靶标害虫对Bt杀虫蛋白的敏感性下降,最终引起靶标害虫在基因水平上的变异而产生遗传抗性[5,9,50-52]。目前,靶标害虫对Vip3产生抗性的田间案例已有一些报道,如:澳大利亚田间棉铃虫(H.armigera)和斑实夜蛾(Helicoverpa punctigera)对Vip3Aa 的抗性等位基因频率高于Cry2Ab[52];美国得克萨斯州美洲棉铃虫(H.zea)对Vip3Aa 的抗性等位基因频率为0.65%(95%置信限,0.140%~0.157%)[53];巴西草地贪夜蛾(S.frugiperda)对Vip3Aa 的抗性等位基因频率约为0.09%[54],在美国路易斯安那州(Louisiana)和佛罗里达州(Florida)约为0.48%[55-56]。此外,2016—2020年,对美国阿肯色州(Arkansas)、路易斯安那州(Louisiana)、密西西比州(Mississippi)、田纳西州(Tennessee)和 得 克 萨 斯 州(Texas)转 基 因(含vip3Aa)玉米种植区美洲棉铃虫(H.zea)的抗性监测表明,2019年其对Vip3Aa的抗性达到13倍[57-58]。
经过9 代室内筛选,东方黏虫(M.separata)对Vip3Aa 可产生超过3 200 倍(相对于敏感品系,下同)的抗性[59]。类似的,收集于美国得克萨斯州田间的美洲棉铃虫(H.zea)经过几代室内筛选,对Vip3Aa 可以迅速产生588 倍以上的抗性[53];经过12代室内筛选的烟夜蛾(Heliothis virescens),其抗性品系的Vip3Aa抗性可达到2 040倍[60-61];收集于巴西田间的草地贪夜蛾(S.frugiperda),在室内筛选过程中其Vip3Aa 抗性也可以迅速增加到3 200 倍以上[62]。此外,在斜纹夜蛾(S.litura)、棉铃虫(H.armigera)和斑实夜蛾(H.punctigera)室内筛选实验中,都获得了对Vip3Aa 产生抗性的品系,这些Vip3Aa 抗性品系均对Cry1Ab、Cry1Ac、Cry1F 等Cry1 蛋白无显著的交互抗性[52,63]。此外,在Cry 蛋白抗性品系中,也没有发现对Vip3Aa的交互抗性。但是Vip3Aa或Vip3Aa/Cry2Ab 抗性棉铃虫(H.armigera)品系对Vip3Ca 会产生极高的交互抗性[64-65]。Vip3Aa 抗性烟夜蛾(Heliothis virescens)和棉铃虫(H.armigera)品系的F2代正交和回交结果表明,Vip3Aa抗性属于常染色体上的隐性多基因遗传[52,62]。此外,对Vip3Aa 抗性、敏感性草地贪夜蛾(S.frugiperda)以及其杂交品系的存活率、蛹质量、性比、发育时间、繁殖力、净繁殖率和内禀增长率等生物学指标进行比较,未发现显著差异[66]。
靶标害虫对Vip3 产生抗性的生化机制尚不清楚。对Vip3Aa抗性斜纹夜蛾(S.litura)品系的中肠酶研究发现,虽然其缺少了大约2种酪蛋白降解带,并且显著降低了部分蛋白酶的水解活性,但是Vip3Aa 最终的水解产物并没有受到显著影响[63]。来自Vip3Aa 抗性烟夜蛾(Heliothis virescens)品系的碱性磷酸酶活性显著降低,并且进一步确认是由HvmALP1基因下调引起的[61]。不同于田间靶标害虫对Cry蛋白产生抗性主要由中肠细胞膜受体结合力下降引起,草地贪夜蛾(S.frugiperda)、东方黏虫(M.separa)、棉 铃 虫(H.armigera)、烟 夜 蛾(Heliothis virescens)等在Vip3Aa抗性和敏感性的特异性受体(BBMV)竞争结合力方面没有明显变化[59,61,63,67]。因此,Vip3Aa 抗性产生可能位于杀虫机制中的结合前过程(如蛋白酶消化或激活、穿过围食膜过程等)或结合后过程(如穿孔形成、信号转导、细胞凋亡、线粒体破坏等)。
4.2 靶标害虫对Vip3 类转基因抗虫作物的抗性治理
靶标昆虫对Bt作物的抗性治理(insect resistance management,IRM)属于有害生物综合治理(IPM)策略的重要组成部分[4],最近10年,部分田间靶标害虫抗性(如Cry蛋白)进化案例[5,9,68]得到了广泛的关注。在Cry蛋白抗性治理中使用的部分策略同样也适应于Vip3Aa转基因抗虫作物[4,9,68-69]。
4.2.1 高剂量-庇护所策略
在抗性演化模型中,允许在作物中表达中等浓度Bt(如Vip3Aa)、保留部分比例的易感品系、不断稀释抗性等位基因等,以达到延长Bt作物使用寿命或抗性治理的目的。但是这种方法以牺牲部分防治效果或经济效益为代价,在实际操作中并不被普遍采用。以高剂量毒素表达量尽可能杀灭杂合或部分纯合抗性昆虫、降低种群中抗性等位基因频率并使经济损失低于阈值[9,51]的策略(高剂量策略)被广泛应用。但是考虑到田间主要靶标害虫对Vip3Aa抗性等位基因具有较高的频率[58],以及室内能够快速筛选出抗性品系,因此,在更多情况下,田间Vip3 类转基因抗虫作物的高剂量策略会配合庇护所(高剂量-庇护所)共同使用[4]。
庇护所模型已经得到部分田间验证,其核心是通过种植非Bt 作物或适合寄主的天然野生植物来保存大量易感目标害虫,并通过与来自Bt作物的害虫(携带高频率抗性等位基因)交配,达到降低抗性等位基因频率的目的。在田间转基因棉花和玉米种植过程中,国内外广泛采用将Bt作物和非Bt作物一起混种或者提供一定区域的无Bt 毒素作物种植区(庇护所)[69-70]。高剂量-庇护所策略的联合使用可以更容易地稀释种群潜在易感个体抗性等位基因的频率,或使生长于庇护所内的敏感种群以更少抗性适合度代价成为种群中的优势群体,但这可能受到害虫取食偏好行为的影响[69-71]。2014—2015、2016—2018、2019 年,美国对Vip3Aa 转基因玉米和非转基因玉米混种的监测结果揭示,2 种玉米的籽粒受到美洲棉铃虫(H.zea)的损伤情况以及成虫出现的时间无明显差异,但转基因玉米能显著降低美洲棉铃虫(H.zea)的存活率[70]。在目前所开发的Vip3 类转基因抗虫作物中,高剂量-庇护所策略不会受到取食行为的影响,同时,室内筛选表明Vip3Aa抗性种群为隐性遗传。因此,此策略是目前Vip3类转基因抗虫作物较为常用的种植策略之一。合适的庇护所需结合昆虫的生物学特性、农艺学、灌溉等因素进行设计。例如,选择庇护所位置时必须预测幼虫和成虫的活动区间,成虫相对于幼虫有更大的活动范围,所以可以分开设置成虫和幼虫2种不同类型的庇护所[71]。
4.2.2 不同作用机制抗虫基因叠加策略
随着Bt作物的发展,为了延缓害虫抗性的演变并扩大害虫控制的范围,全球多地的转基因抗虫作物已经从单毒素转向多毒素Bt作物[10,51]。多毒素叠加Bt作物,或被称作第2代和第3代转基因作物,能产生2 种或多种针对同一害虫的不同毒素(也被称作“金字塔”策略),具有更强的昆虫保护特性并提高IRM 价值,已受到学者及企业的关注。目前,多数Bt作物主要采用在同一品种内组合或嵌入cry和vip3Aa多种基因或采用RNA 干扰技术等不同的防治方式[4,9-10,13]。多基因策略可以显著延缓作物发展出单基因抗性,同时,蛋白质结构、受体竞争结合、田间作物的种植数据等已经证实这一策略的价值。比较交替使用不同转Bt单基因作物和叠加相同的基因于同一品种(“金字塔”策略)发现,后者具有更好的效果[4,9-10,13,71]。此外,通过在植物体内特殊时期(如在部分昆虫危害的发生盛期)或特异性组织内(如在取食组织刺激诱导下启动特异性启动子)表达Vip3A毒素来提高其表达量等措施也可进一步延缓作物抗性的产生。
田间多采取综合措施治理抗性,如在Bt作物的种植过程中,多基因叠加策略往往结合5%~20%的庇护所。这不但可以降低对庇护所的数量要求(相对于单基因作物),还可以更加有效地控制害虫数量,从而减少农药等的使用次数。IPM 包含许多重要的防治技术,如天敌的释放、信息素/灯诱杀、害虫对化学杀虫剂抗性的监测和管理等,都可对Vip3Aa抗性治理发挥重要的作用[4]。如在澳大利亚,通过处理土壤等种植措施减少Bt 棉花上越冬棉铃虫(H.armigera)蛹的数量,有利于降低靶标害虫对Bt棉花抗性的发展速度。利用靶标害虫棉铃虫(H.armigera)的产卵趋性,在庇护所种植木豆(Cajanus cajanL.)作为“陷阱”诱惑雌蛾产卵,不但可以减少棉铃虫(H.armigera)在Bt 棉花上的产卵量,还可在庇护所保持较高的敏感种群数量,稀释抗性基因。
5 展望
近年来,对Vip3 的3D 结构解析有助于进一步明确其杀虫机制,但对其结构域Ⅳ~Ⅴ功能的探索仍然缺乏关键性证据。此外,活化蛋白到达中肠的过程(穿过围食膜)、中肠特异性受体的鉴定、致死通道的激活等许多关键环节仍需深入研究,靶标害虫对Vip3 类转基因抗虫作物或蛋白的抗性机制和Vip3 类转基因抗虫作物的杀虫图谱亦需要进一步明确。鉴于市场上Vip3 类转基因抗虫作物多采用vip3Aa及其亚家族基因,这种单一基因的利用不可避免地加大了害虫的抗性风险,因此,挖掘利用新型高效杀虫vip3基因十分必要。以高剂量或多基因-庇护所为代表的抗性治理策略虽然已在田间得到应用,但新的抗性监测与治理技术如抗性基因的精准监测方法和综合治理技术等仍然需要配套和完善。我国作为农作物生产大国,目前仅有cry基因抗虫棉商业化种植,Vip3类转基因抗虫作物的研发与应用远远滞后于美国等国家,应进一步加快产品研发与产业化步伐,利用生物技术推动害虫绿色防治的发展,保障国家粮食安全。
