miR-21-3p靶向RNF-11基因对脊索瘤细胞生物学行为的影响
2023-01-18刘俊尹锐李艳兵
刘俊 尹锐 李艳兵
(湖北省恩施土家族苗族自治州中心医院脊柱外科诊疗中心,湖北 恩施 445000)
脊索瘤是一种罕见的原发性骨肿瘤,起源于胚胎残余的脊索组织,占所有骨恶性肿瘤的1%~4%〔1〕。尽管脊索瘤被认为是较低级别的恶性肿瘤,但其复发率很高,并且可转移到附近的组织〔2〕。目前治疗脊索瘤最有效的方法是外科手术切除,然而,由于其解剖学位置,通常不可能进行完整的整块切除,且患者在手术后很容易复发〔3〕。因此,迫切需要探索脊索瘤患者的新型治疗靶标。微小RNA(miRNA)是一类高度保守的小型非编码RNA,其长度为17~25个核苷酸,可通过部分互补结合靶基因的3′非翻译区(3′UTR)抑制其翻译或促进靶基因的降解。miRNA的表达失调在各种癌症(包括脊索瘤)中作为癌基因或抑癌基因参与肿瘤的发生和发展〔4,5〕。miRNA作为一种新的、非侵入性的生物标志物,可以在肿瘤的诊断及治疗方面提供重要指导。目前研究显示,miR-21-3p在卵巢癌、喉癌,乳腺癌等多种肿瘤患者中的表达异常升高,促进癌症的进展〔6~8〕。Chen等〔9〕通过微阵列分析脊索瘤中差异表达的miRNA,结果发现miR-21-3p在脊索瘤中呈上调表达,然而miR-21-3p在脊索瘤中的作用及机制尚不清楚。本实验探究miR-21-3p对脊索瘤细胞增殖、凋亡、侵袭和迁移等生物学行为的影响及可能的机制,以期为脊索瘤的诊治提供新的生物标志物。
1 材料与方法
1.1标本 脊索瘤和配对癌旁正常组织标本采集于恩施土家族苗族自治州中心医院,标本从经手术切除脊索瘤的患者中获得,脊索瘤标本均经病理科审核确认。入组患者在手术切除肿瘤病灶之前均未接受任何化学疗法或放射疗法。在参加本研究之前,每位患者都签署了书面知情同意书。本研究得到恩施土家族苗族自治州中心医院伦理委员会的批准。
1.2主要试剂 脊索瘤细胞系U-CH1从美国菌种保藏中心获得;IMDM-RPMI培养基、青霉素-链霉素双抗从美国Gibco公司获得;胰蛋白酶、胎牛血清(FBS)、Lipofectamine 2000转染试剂从美国Invitrogen公司获得;MTT试剂、二甲基亚砜(DMSO)从美国Sigma公司获得;miR-21-3p mimics、mimics NC、miR-21-3p inhibitors、inhibitors NC均从广州市锐博生物科技有限公司获得;Transwell细胞培养小室、基质胶从美国Corning公司获得;Trizol试剂、逆转录试剂盒、SYBR Green PCR Master Mix检测试剂盒从日本TaKaRa公司获得;RIPA裂解液、BCA蛋白浓度检测试剂盒、电化学发光(ECL)检测试剂盒、结晶紫染色液从碧云天生物技术研究所获得;双荧光素酶报告基因检测试剂盒从美国Promega公司获得;RNF-11、上皮型钙黏蛋白(E-cadherin)、神经型钙黏蛋白(N-cadherin)、波形蛋白(Vimentin)抗体从美国Abcam公司获得;辣根过氧化物酶标记的IgG从北京中杉金桥生物技术有限公司获得;膜联蛋白(Annexin)Ⅴ-异硫氰酸荧光素(FITC)/碘化丙啶(PI)细胞凋亡检测试剂盒从美国BD公司获得;RNF-11野生型(RNF-11-Wt)和RNF-11突变型(RNF-11-Mut)荧光素酶重组载体质粒上海生工生物工程有限公司获得。
1.3脊索瘤U-CH1细胞的培养和传代 脊索瘤U-CH1细胞复苏后接种到含10% FBS、1%青霉素-链霉素双抗、IMDM-RPMI培养基的培养瓶中,放置在恒温培养箱中进行培养,培养条件设置为:37℃、5%CO2、100%饱和湿度。在显微镜下观察U-CH1细胞生长情况,待悬浮细胞充满整个视野时,使用0.25%胰蛋白酶消化细胞,收集细胞1 000 r/min离心5 min,弃上清培养液,使用磷酸盐缓冲液(PBS)洗涤1次,分装后加入新鲜含10% FBS、1%青霉素-链霉素双抗的IMDM-RPMI培养液继续传代培养。
1.4细胞转染和分组 处于对数生长期的U-CH1细胞以胰蛋白酶消化,收集细胞制成浓度为5×106/ml的细胞悬液,将细胞悬液种植到6孔板中,每孔接种200 μl,放置到细胞培养箱培养过夜,待细胞生长至60%汇合时,参照转染试剂Lipofectamine 2000使用说明书将miR-21-3p mimics或mimics NC转染至U-CH1细胞,按照转染说明在转染6 h后将原培养液更换成含血清的培养液,放置在细胞培养箱继续培养48 h,收集细胞进行后续实验检测。其中转染miR-21-3p mimics的U-CH1细胞命名为anti-miR-21-3p组,转染mimics NC的U-CH1细胞命名为anti-NC组,未行转染的U-CH1细胞命名为Blank组。
1.5qRT-PCR实验 将待测组织标本研磨成粉末,收集待测U-CH1细胞,分别向组织和细胞中加入Trizol试剂,抽提总RNA,使用微量核酸检测仪测定RNA的纯度和浓度,选择合格的RNA进行逆转录,具体步骤参照逆转录试剂盒使用说明书进行操作。合成的cDNA检测其浓度,调整cDNA的浓度并将其作为模板,使用SYBR Green PCR Master Mix检测试剂盒进行扩增,miR-21-3p的相对表达量以U6为内参,RNF-11、E-cadherin、N-cadherin和Vimentin的相对表达量以GAPDH为内参。反应结束后以2-ΔΔCt法计算基因相对表达量。引物:RNF-11正义链:5′-ACATCTCCCTGCTTCACGAG-3′,反义链:5′-GGGTGGTAGACTGGAACTGG-3′;E-cadherin正义链:5′-TCCATTTCTTGGTCTACGCC-3′,反义链:5′-CACCTTCAGCCATCCTGTTT-3′;N-cadherin正义链:5′-GTGCCATTAGCCAAGGGAATTCAGC-3′,反义链:5′-GCGTTCCTGTTCCACTCATAGGAGG-3′;Vimentin正义链:5′-GGCTCGTCACCTTCGTGAAT-3′,反义链:5′-TCAATGTCAAGGGCCATCTTAA-3′;U6正义链:5′-CTCGCTTCGGCAGCACA-3′,反义链:5′-AACGCTTCACGAATTTGCGT-3′;GAPDH正义链:5′-ACCCACTCCTCCACCTTTGA-3′,反义链:5′-CTGTTGCTGTAGCCAAATTCGT-3′。
1.6MTT实验 用胰蛋白酶消化处于对数生长期的脊索瘤U-CH1细胞,将细胞接种到96孔板中,待细胞贴壁后按照上述1.4的方法转染和分组,转染48 h后分别向各孔细胞中添加浓度为5 mg/ml的MTT溶液20 μl,放置在细胞培养箱中孵育4 h,取出细胞培养板,弃去上清液,再向细胞中加入150 μl DMSO,于震荡仪上振荡10 min,待结晶沉淀完全溶解后,在全自动酶联免疫检测仪上分析各孔细胞的光密度(OD)值,以不加细胞只加培养液的对照孔进行调零。
1.7克隆形成实验 3组脊索瘤U-CH1细胞转染48 h后,收集细胞以新鲜培养液重悬细胞,制成单细胞悬液,计数后接种到60 mm的细胞培养皿中,将细胞培养皿放置在37℃培养箱,培养14 d后除去培养液,用PBS洗涤细胞,加入1 ml甲醇固定15 min,流水下洗去甲醇,再加入1 ml Gimsa染液染色30 min,流水洗去染液,使用显微镜观察并计数大于50个的细胞克隆。
1.8流式细胞术 3组U-CH1细胞转染48 h后,以预冷的PBS洗涤细胞2次,收集细胞约1×105个,向细胞中加入100 μl结合缓冲液重悬细胞,依次向细胞悬液中添加AnnexinⅤ-FITC和PI染液各5 μl,放置在室温下避光孵育15 min,在1 h内上流式细胞仪检测,检测结果使用CELL Quest软件分析细胞凋亡情况。
1.9Transwell实验 收集转染后的U-CH1细胞,用不含血清的培养液重悬细胞制成3×104/ml的单细胞悬液,再以基质胶包被的Transwell小室的上室中加入细胞悬液200 μl,在下室加入含血清的培养液600 μl,将小室放置在37℃培养箱常规培养48 h,取出小室,用棉签擦去上室未穿膜的细胞,以甲醛固定,随后以结晶紫染色,放置在显微镜下随机选5个视野观察并统计侵袭细胞数。
1.10划痕实验 转染后的3组U-CH1细胞生长至单层汇合时进行划痕实验,即使用灭菌的200 μl移液枪枪头垂直于细胞培养板划线,被划下的细胞用PBS洗去,加入不含血清的培养液,放置在37℃培养箱继续培养,在培养0 h和48 h时分别用显微镜观察细胞划痕宽度,计算细胞迁移率,细胞迁移率(%)=(0 h划痕宽度-48 h划痕宽度)/0 h划痕宽度×100%。
1.11Western印迹实验 收集转染48 h的3组U-CH1细胞,加入适量RIPA裂解液在冰上提取总蛋白,蛋白样品采用BCA法进行定量,在蛋白中加入上样缓冲液,沸水浴致蛋白变性,取40 μg蛋白样品加样,经十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)分离蛋白,随后电转至聚偏氟乙烯(PVDF)膜上,PVDF膜浸润在含5%脱脂奶粉的封闭液中,室温孵育2 h,取出膜并用TBST漂洗3次,加入相应一抗,其中RNF-11一抗1∶800稀释,E-cadherin一抗1∶500稀释,N-cadherin一抗1∶500稀释,Vimentin一抗1∶500稀释,4℃过夜孵育,取出膜并用TBST漂洗3次,加入稀释的二抗,室温孵育2 h,以ECL显色,采用凝胶成像系统获取图像,以GAPDH标定,用Imag J软件分析各组U-CH1细胞中目的蛋白相对表达水平。
1.12双荧光素酶报告基因实验 将RNF-11-Wt和RNF-11-Mut荧光素酶重组载体质粒分别与miR-21-3p mimics和或mimics NC共转染至U-CH1细胞,放置在37℃培养箱常规培养48 h,收集细胞,参照双荧光素酶报告基因检测试剂盒使用说明书对细胞进行检测,获得萤火虫荧光素酶活性和海肾荧光素酶活性,以二者比值表示细胞的相对荧光素酶活性。
1.13统计学分析 采用SPSS21.0软件进行t检验、单因素方差分析、SNK-q检验。
2 结 果
2.1miR-21-3p在脊索瘤组织中表达上调 与癌旁组织相比,脊索瘤组织中miR-21-3p表达明显上调(1.00±0.09 vs 3.61±0.34,P<0.05)。
2.2转染miR-21-3p inhibitors对U-CH1细胞中miR-21-3p表达的影响 与Blank组相比,anti-miR-21-3p组U-CH1细胞中miR-21-3p的表达量明显降低(P<0.05),anti-NC组miR-21-3p的表达量变化差异不显著(P>0.05),见表1。
2.3抑制miR-21-3p对U-CH1细胞增殖能力的影响 与Blank组相比,anti-miR-21-3p组U-CH1细胞OD值明显下降(P<0.05),克隆形成数明显减少(P<0.05),anti-NC组细胞OD值和克隆形成数变化差异均不显著(P>0.05),见表1、图1。
表1 各组U-CH1细胞OD值、克隆形成数、miR-21-3p表达量、凋亡率、侵袭细胞数、迁移率比较
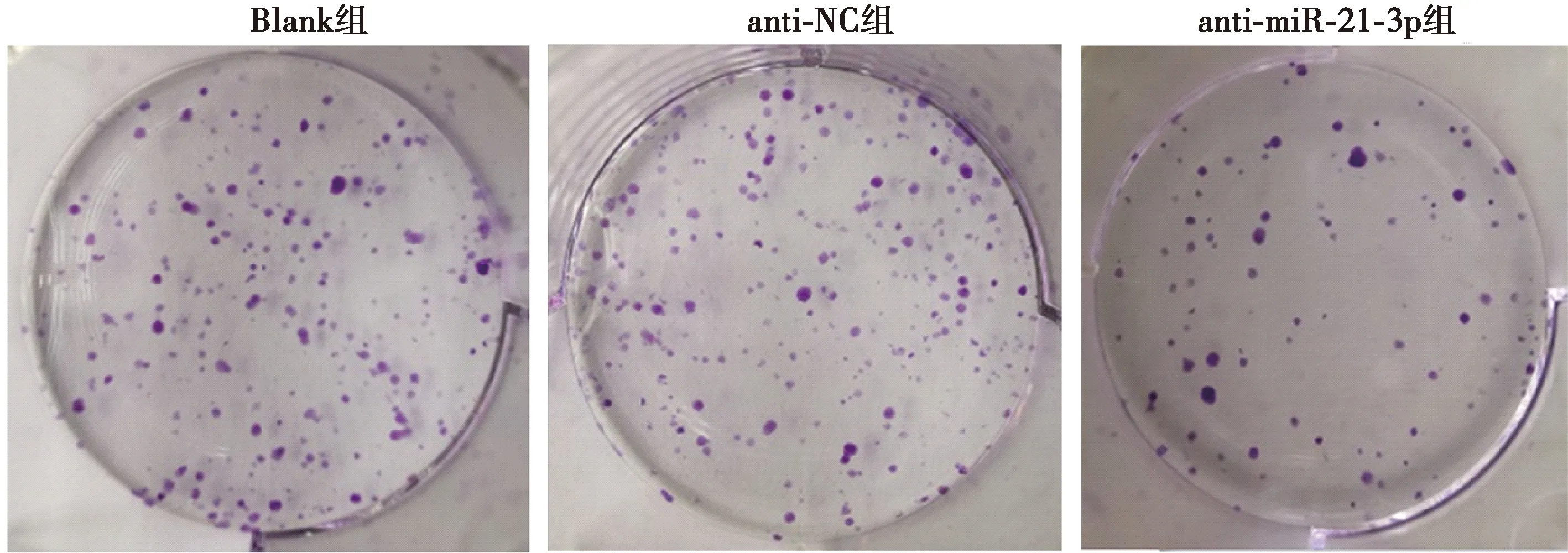
图1 克隆形成实验检测各组U-CH1细胞克隆形成能力(Gimsa染色,×200)
2.4抑制miR-21-3p对U-CH1细胞凋亡能力的影响 与Blank组相比,anti-miR-21-3p组U-CH1细胞凋亡率明显升高(P<0.05),anti-NC组细胞凋亡率差异不显著(P>0.05),见表1、图2。
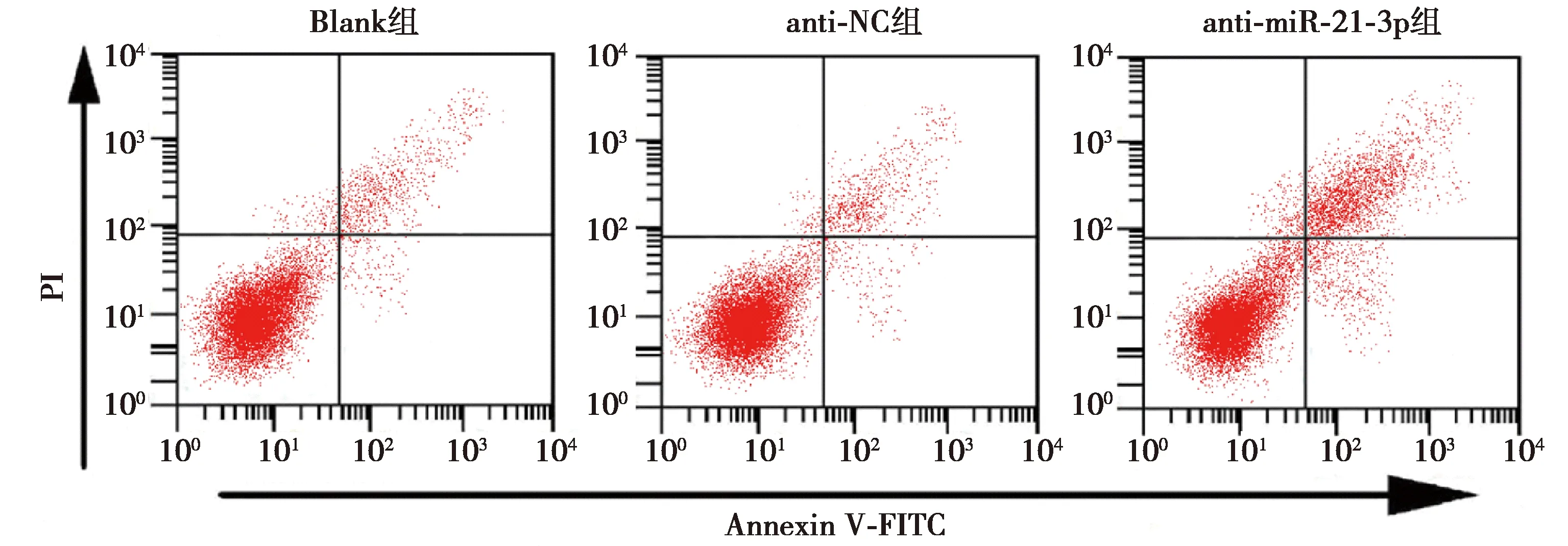
图2 流式细胞术检测各组U-CH1细胞凋亡情况
2.5抑制miR-21-3p对U-CH1细胞侵袭和迁移能力的影响 与Blank组相比,anti-miR-21-3p组侵袭细胞数明显减少(P<0.05),细胞迁移率明显降低(P<0.05),而anti-NC组侵袭细胞数和细胞迁移率差异均不显著(P>0.05),见表1、图3。
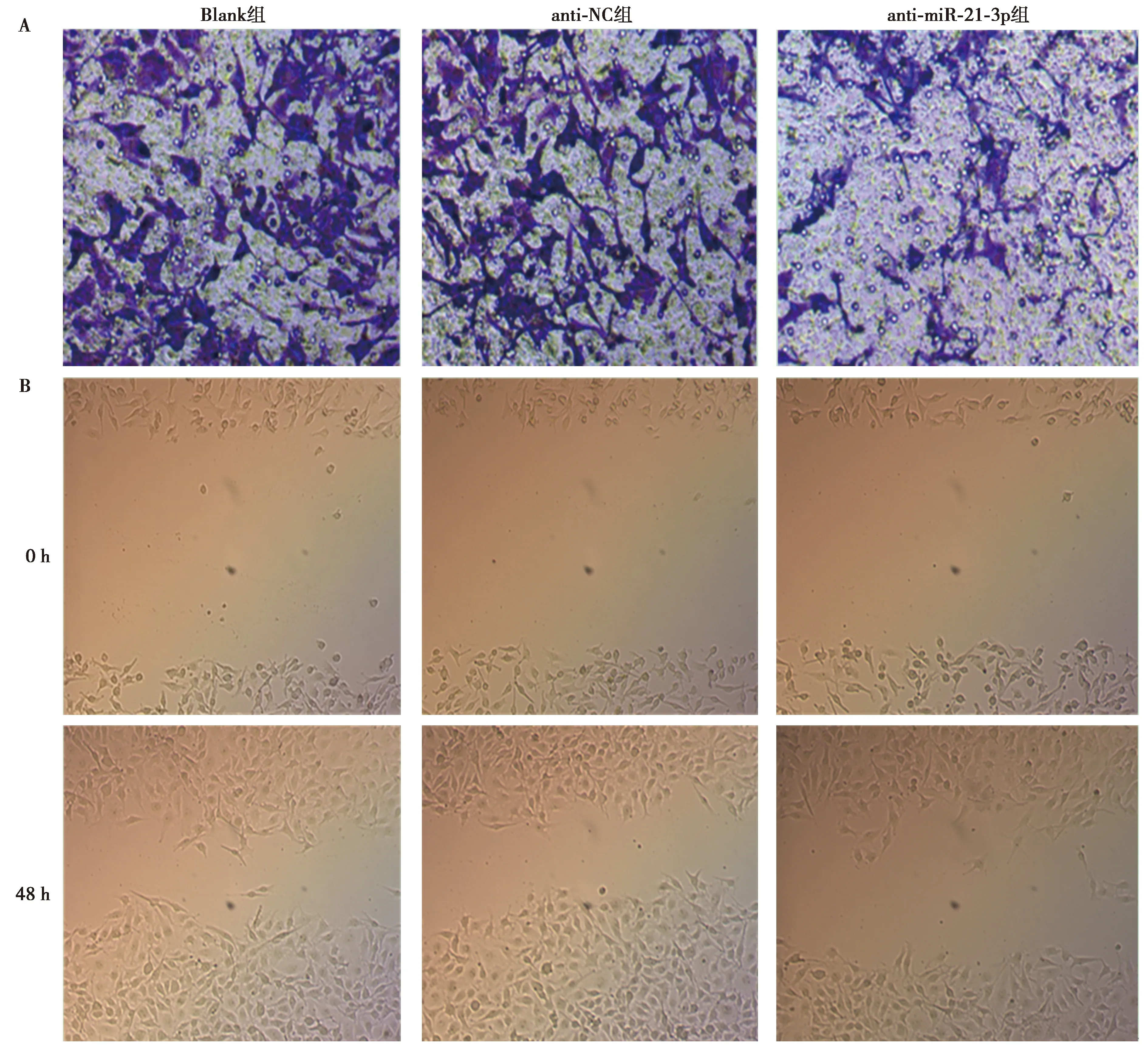
A:Transwell实验检测3组U-CH1细胞侵袭能力(结晶紫染色,×200);B:划痕实验检测3组U-CH1细胞迁移能力(×200)图3 3组U-CH1细胞侵袭和迁移能力比较
2.6抑制miR-21-3p对U-CH1细胞上皮间质转化(EMT)能力的影响 与Blank组相比,anti-miR-21-3p组U-CH1细胞中E-cadherin mRNA和蛋白表达水平显著升高(P<0.05),而N-cadherin、Vimentin mRNA和蛋白表达水平显著降低(P<0.05),anti-NC组E-cadherin、N-cadherin和Vimentin的表达差异均不显著(P>0.05),见表2、图4。
表2 各组U-CH1细胞E-cadherin、N-cadherin和Vimentin mRNA及蛋白表达比较
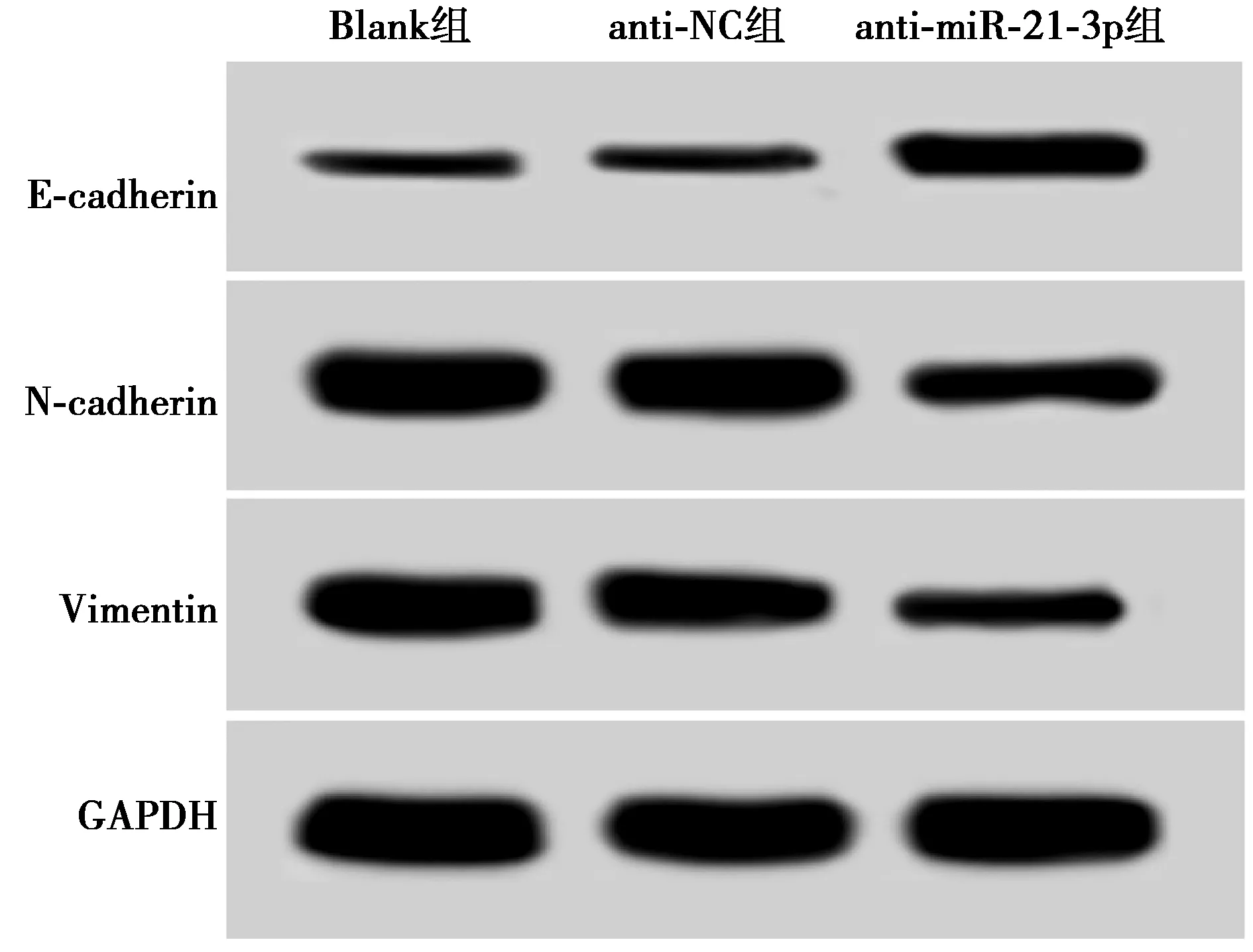
图4 Western印迹检测E-cadherin、N-cadherin和Vimentin蛋白表达
2.7miR-21-3p靶向RNF-11关系的验证 采用TargetScan软件预测miR-21-3p的靶基因,结果显示,RNF-11的3′UTR中存在与miR-21-3p互补的序列(图5)。双荧光素酶报告基因实验结果显示,相较于miR-NC组过表达miR-21-3p后在转染RNF-11-Wt的U-CH1细胞相对荧光素酶活性明显降低(1.00±0.03 vs 0.41±0.07,P<0.05),而转染RNF-11-Mut的U-CH1细胞相对荧光素酶活性变化不明显(1.00±0.07 vs 0.97±0.08,P>0.05)。与Blank组相比,anti-miR-21-3p组U-CH1细胞中RNF-11 mRNA和蛋白表达明显升高(P<0.05),anti-NC组中RNF-11 mRNA和蛋白的表达差异均不显著(P>0.05),见图6、表3。
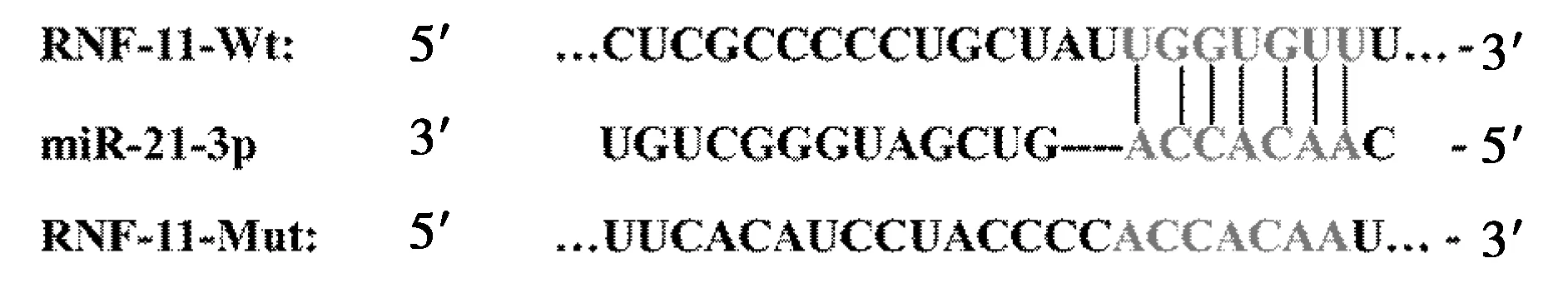
图5 生物信息学软件TargetScan预测miR-21-3p与RNF-11的靶向结合位点

图6 Western印迹检测RNF-11蛋白表达
表3 各组U-CH1细胞中RNF-11 mRNA和蛋白表达量比较
3 讨 论
脊索瘤早期无明显的临床症状,晚期往往会破坏周围的骨骼侵犯邻近的组织。研究显示,在许多致癌过程中,miRNA已成为关键调控因子〔10,11〕。已经确定了许多miRNA与几种类型的人类癌症的发生和发展有关〔12,13〕。目前证据表明,异常表达的miRNA在脊索瘤的发展中起着至关重要的作用。例如,Osaka等〔14〕研究发现,miR-1可靶向调控Slug的表达抑制脊索瘤细胞增殖,而且还能够抑制细胞迁移和侵袭活性。Ma等〔15〕实验发现,miRNA-124负调控iASPP的表达,进一步导致凋亡相关蛋白的变化,并影响脊索瘤细胞增殖,侵袭和对顺铂的敏感性。有研究显示,miR-16-5p通过靶向Smad3抑制脊索瘤细胞增殖、侵袭和转移,在脊索瘤进展中起着抑癌作用〔16〕。Chen等〔9〕进行了miRNA阵列分析以筛选脊索瘤样品中差异表达的miRNA,发现脊索瘤组织中miR-21-3p的表达明显上调,这意味着miR-21-3p可能起促癌作用。本研究首次证明了miR-21-3p靶向RNF-11在脊索瘤中的促癌作用。
本实验结果发现,miR-21-3p在脊索瘤组织中的表达显著升高,这与Chen等〔9〕的研究相符。为探究miR-21-3p对脊索瘤细胞生物学行为的影响,本实验通过在脊索瘤U-CH1细胞中转染抑制miR-21-3p的表达,实验结果显示,抑制miR-21-3p的表达能够抑制U-CH1细胞增殖,诱导细胞凋亡。肿瘤迁移和侵袭能力对于脊索瘤等癌症的初始转移过程至关重要〔17〕。因此抑制迁移和侵袭能力可能会减少脊索瘤常见的局部复发,从而提高生存率。研究指出,EMT是促进肿瘤细胞侵袭和转移的主要机制之一〔18,19〕。当EMT发生时,上皮细胞表面标志物E-cadherin的表达下调,同时间充质细胞表面标志物N-cadherin和Vimentin的表达上调。本实验结果显示,miR-21-3p表达的抑制减少了脊索瘤细胞的迁移和侵袭,这由E-cadherin的表达升高和N-cadherin和Vimentin的表达降低所揭示。本实验证实RNF-11是miR-21-3p的直接靶标,并且miR-21-3p在转录后水平上直接调节RNF-11的表达。RNF-11基因属于 RING finger 基因家族成员之一,王季〔20〕利用基因芯片技术探究与脊索瘤发病相关的基因,发现RNF-11在脊索瘤组织中表达显著下调,提示RNF-11在脊索瘤中可能发挥抑癌基因的作用。以上实验结果提示,miR-21-3p靶向调控RNF-11影响脊索瘤细胞增殖、凋亡、侵袭和迁移等生物学行为。
综上所述,miR-21-3p在脊索瘤组织中呈高表达,下调miR-21-3p的表达能够抑制脊索瘤细胞增殖、侵袭和迁移能力,并诱导细胞凋亡,其可能的作用机制与靶向调控RNF-11的表达有关。miR-21-3p在脊索瘤发展中具有促癌作用,这可能为脊索瘤的治疗提供有希望的预后和治疗策略。
