敲低Stau1后小鼠前脂肪细胞系3T3-L1中FOXP1的表达增加
2023-01-18孟轩羽刘迪晖关亚群梁小弟
孟轩羽,刘迪晖,蒋 硕,关亚群*,梁小弟*
新疆医科大学基础医学院 1.机能中心; 2.生物化学与分子生物学教研室, 新疆维吾尔自治区 乌鲁木齐 830017
肥胖会引起一系列代谢性疾病[1-2]。肥胖的细胞生物学基础是脂肪细胞的异常分化和过度增殖,脂肪细胞分化中转录后水平的调控起到至关重要的作用[3],其中对RNA结合蛋白Staufen1(STAU1),作为一种双链RNA(double strand RNA, dsRNA)结合蛋白,其经典作用是参与STAU1介导的mRNA降解途径(Staufen1-mediated mRNA decay, SMD),在该途径中,STAU1通过结合SMD底物,并招募其他蛋白质分子,促进其转录本的降解[4]。前期研究发现STAU1可以识别KLF2和KLF16 mRNA上的局部双链结构并与之结合,激活SMD途径,使KLF2和 KLF16转录本被降解,从而抑制了KLF2和KLF16蛋白的表达,促进了三酰甘油的形成[5]。为了更好地研究STAU1的生物学功能和下游的靶基因,本研究通过生物信息统计法分析RNA-seq芯片数据,并通过基因调控网络分析方法寻找STAU1与脂代谢的相关的基因,探索STAU1在肥胖中的作用,为肥胖症的治疗方案提供新的思路。
叉头盒蛋白P1(forkhead box P1,FOXP1)属于FOXP家族,是一种具有调节功能的转录因子[6]。近期有研究报道FOXP1参与脂代谢以及棕色脂肪细胞分化和适应性产热的作用机制。在冷刺激下β3肾上腺素能受体激动剂能促进肥胖小鼠内脏白色脂肪的分解,并通过激活白色脂肪组织(white adipose tissue,WAT)的解偶联蛋白1(uncoupling protein 1,UCP1),诱导白色脂肪棕色化,提高肥胖小鼠的能量消耗[7],小鼠体内特异性敲除Foxp1提高了棕色脂肪细胞分化及活性,加快了白色脂肪细胞棕色化进程,敲除Foxp1后小鼠整体能量代谢增强并可以抵抗高脂饮食所诱导的肥胖及胰岛素抵抗[8],因此STAU1可能通过FOXP1来调节棕色脂肪细胞分化。
1 材料与方法
1.1 材料
1.1.1 细胞系:小鼠前脂肪细胞系3T3-L1(北京协和国家生物医学细胞资源库)。
1.1.2 主要试剂:DMEM(高糖)培养基、PBS、胎牛血清(FBS)、胰蛋白酶和双抗(HyClone公司);Trizol(Invitrogen公司)、反转录试剂盒(TaKaRa公司)、EZ Trans转染试剂(上海李记生物科技有限公司)、胰岛素、地塞米松和3-异丁基-1-甲基黄嘌呤(IBMX) (Sigma Aldrich公司);STAU1抗体(Abcam公司);引物[生工生物工程(上海)股份有限公司合成];SYBR Green荧光定量PCR试剂(QIAGEN公司);荧光素酶报告基因检测试剂盒(南京诺唯赞生物科技股份有限公司);STAU1 shRNA(由上海吉凯生物科技有限公司设计)(表1,2)。
1.2 方法
1.2.1 细胞的诱导分化:3T3-L1细胞在DMEM完全培养基中增殖至汇合率为80%~90%时接触抑制,接触抑制2 d后对细胞进行诱导分化:将含有地塞米松、IBMX、胰岛素的工作液配好后混匀诱导48 h,后更换为只含胰岛素的诱导维持液48 h直至3T3-L1前脂肪细胞完全分化为成熟的脂肪细胞。
1.2.2Stau1敲低质粒的转染:实验共分为STAU1敲低和对照两组,现以6孔板单个孔转染为例说明,具体操作步骤如下:在转染实验前1 d接种细胞,待3T3-L1前脂肪细胞汇合至80%时,用EZ Trans 细胞转染试剂(Ⅱ)进行转染, 48 h后进行后续处理。

表1 STAU1-shRNA序列Table 1 STAU1-shRNA sequence
1.2.3 提取总RNA:收取Stau1敲低后0~4 d诱导分化的3T3-L1细胞,加入1 mL Trizol,加入250 μL三氯甲烷, 4 ℃,12 000 r/min离心15 min。将350 μL的上清液加入等体积的异丙醇-80 ℃冰箱放置2~3 h,RNA白色沉淀至离心管底部,漂洗2遍,将RNA沉淀用20~30 μL无RNA酶水溶解。
取11 μL RNA模板,1 μL Oligo(dT)引物, PCR仪上65 ℃加热5 min后,加入反转录反应体系,25 ℃加热5 min,42 ℃加热60 min,70 ℃加热5 min,最后转移至冰上终止反应。吸出10 μL cDNA各管加入40 μL无RNA酶的水稀释,终体积为50 μL,于-20 ℃冰箱中保存。

表2 引物序列Table 2 Primer sequence
1.2.4 RT-qPCR检测相关mRNA的表达:各取2 μL稀释后的cDNA为模板,配制RT-qPCR反应体系,反应终体系为20 μL。应用Applied Biosystems 7500 Fast System进行qPCR扩增。反应程序为:第一次循环95 ℃ 2 min后,以95 ℃ 5 s,60 ℃ 30 s,循环40周期,最后95 ℃ 15 s,60 ℃ 1 min,95 ℃ 15 s结束。每个样本做2个复孔,目的基因的相对表达量(RQ)=2-△△Ct。
1.2.5 Western blot检测相关蛋白的表达:细胞汇合至80%,弃去皿内液体,用PBS清洗3遍,冰上裂解30 min,4 ℃,12 000 r/min,离心10 min,将上清转移至新的1.5 mL离心管中,用BCA 工作液对蛋白质进行定量。在10% SDS-PAGE胶中上样,80 V电泳,待样品跑至浓缩胶与分离胶汇合处,再调至130 V电泳直至Marker 完全分开;80 mA恒流转膜3 h,5%脱脂奶室温封闭1 h,一抗按照1∶1 000比例稀释4 ℃孵育过夜,HRP 标记的二抗按照1∶5 000稀释室温孵育1 h,ECL 发光法检测,结果通过Azure-600 仪器显示,用Image J软件扫吸光度进行分析。
1.2.6 荧光素酶报告基因:构建FOXP1 3′UTR表达载体,将测序正确的报告基因质粒转染293T细胞,选用24孔板接种细胞293T,EZ Trans转染试剂转染细胞,每孔总的转染质粒量为500 ng,共分为3组(每组3~4个复孔),48 h后收集样品,将收取的样品根据诺唯赞公司荧光素酶报告基因检测试剂盒说明书进行报告基因活性检测。
1.3 统计学分析
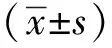
2 结果
2.1 Stau1敲低效率的检测
Stau1敲低效率约75%(P<0.05)(图1)。
2.2 Stau1敲低后差异表达基因
从RNA-seq结果中筛选出10个与脂代谢相关且差异表达倍数较大的基因,其差异倍数见表3,4。
2.3 脂代谢相关筛选基因荧光定量检测结果
选取的10个与脂代谢相关基因,与转录组测序结果基本一致(图2)。
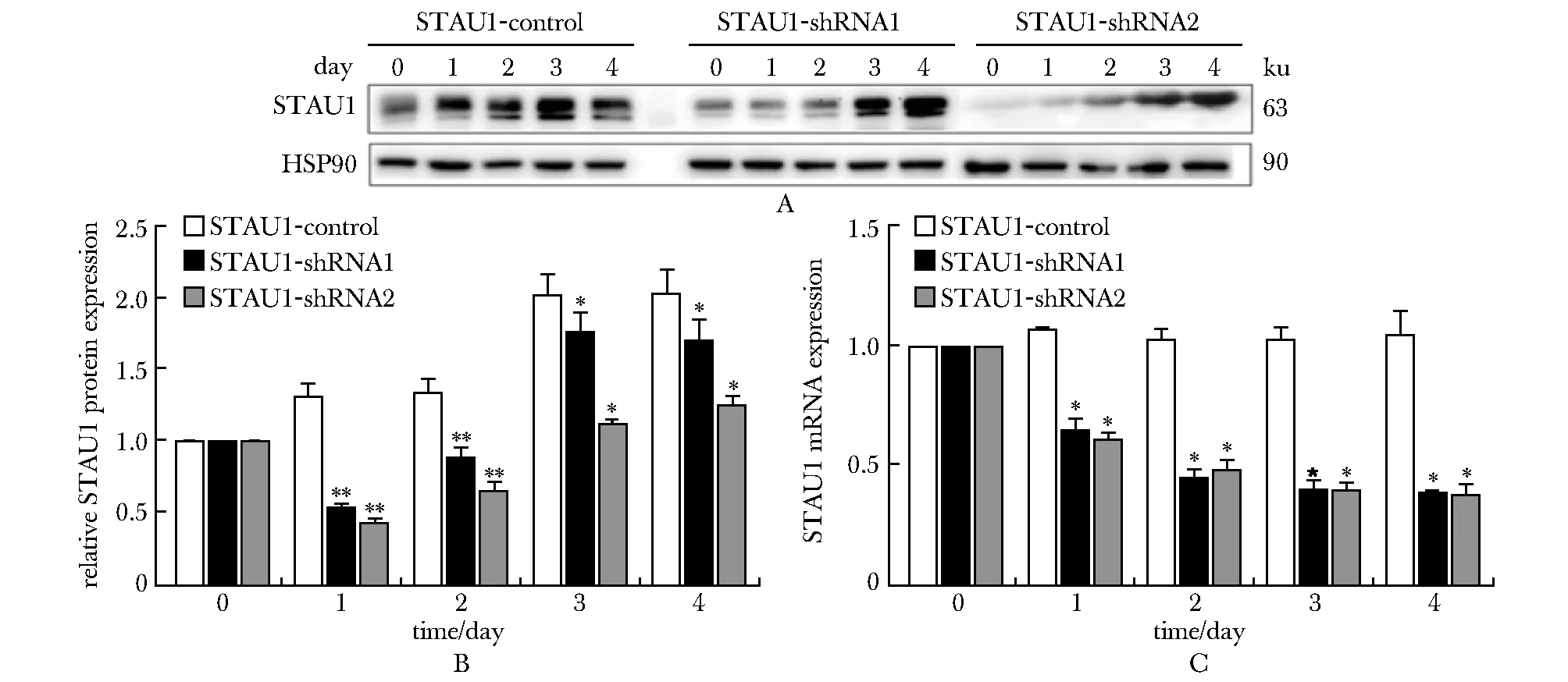
*P<0. 05 compared with the control group图1 对照组和STAU1敲低组中STAU1的mRNA和蛋白表达水平Fig 1 The mRNA and protein expression levels of STAU1 in the control group and STAU1 knockdown
表3 Stau1敲低后基因表达下降Table 2 Gene expression decreased after Stau1
Stau1KD.Stau1rnockdown;*P<0. 05 compared with the control group.
表4 Stau1敲低后基因表达上调Table 3 Gene expression increased after Stau1
Stau1KD.Stau1knockdown;*P<0. 05 compared with the control group.
2.4 确定STAU1对FOXP1的调控作用
FOXP1表达升高5.34倍,提示STAU1与FOXP1负相关(表5,图3)。

表5 敲低Stau1后FOXP1表达水平
2.6 敲低Stau1后FOXP1的蛋白质表达水平升高
FOXP1在小鼠组织中有常见的四种亚型(A~D)。 Western blot结果显示FOXP1A、FOXP1C、 FOXP1D在Stau1成功敲低后其表达水平增高(P<0.05),其中FOXP1A升高趋势最明显(P<0.01),对FOXP1B 的影响,因检测信号弱无统计学意义(图4)。
2.7 荧光素酶报告基因实验检测STAU1与FOXP1 mRNA 3′UTR结合
STAU1与FOXP1 mRNA 3′UTR存在结合,荧光活性被显著抑制(P<0.05)(图5)。
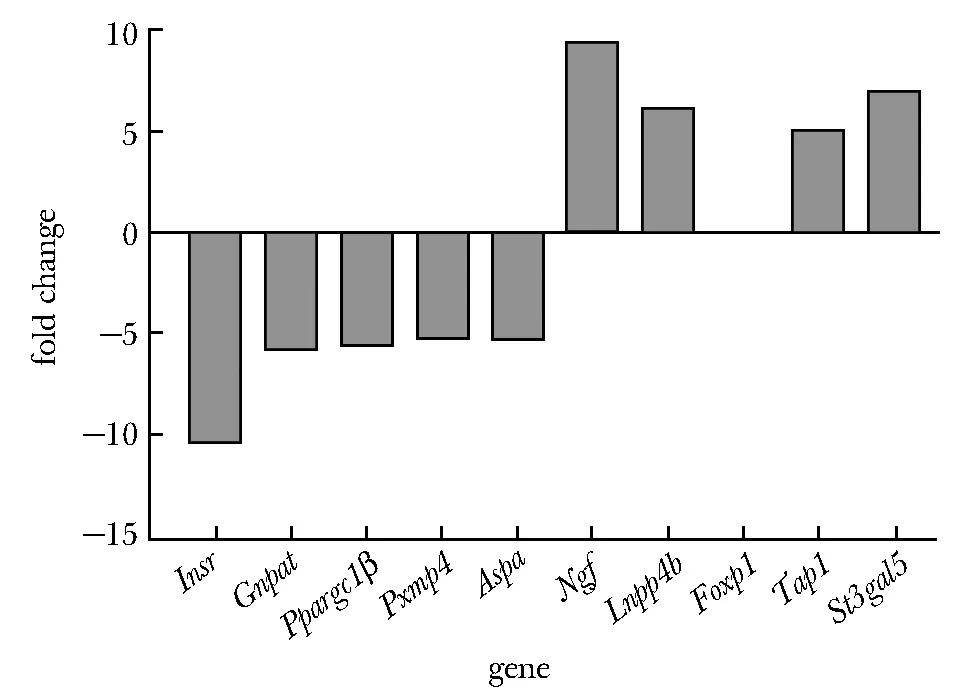
图2 对照组和STAU1敲低组的基因表达水平Fig 2 Gene expression levels of STAU1 in the control group and STAU1 knockdown group

图3 对照组和shRNA-Stau1转染组的RNA-seq聚类热图Fig 3 RNA-seq cluster heat map of control group and shRNA-Stau1 transfection group
3 讨论
肥胖已成为威胁人类健康的常见疾病,其导致的2型糖尿病和炎性反应等并发症日益上升。肥胖的发生机制受多种因素的调控,其中包括一些RNA结合蛋白[11]。本课题组前期研究发现人群中双链RNA结合蛋白STAU1与肥胖严重程度、血浆三酰甘油水平呈正相关,且能促进白色脂肪形成[9]。本课题组前期构建了STAU1 shRNA,并用转录组测序对STAU1 KD(knockdown)及对照细胞进行了差异基因表达分析,以此获取大量的基因差异数据。其中机体内脂代谢、糖代谢等代谢通路相关基因变化较大,为更好的探究其分子机制本课题选取了Stau1敲低后差异倍数较大的10个基因,经荧光定量分析结果与转录组测序结果相比较,10个基因的表达差异性均为一致。
下调基因包括胰岛素受体 (insulin receptors,Isr)、二羟丙酮磷酸酰基转移酶(glyceronephos-phate O-acyltransferase,Gnpat)、PPARG辅助激活剂1β(PPARG coactivator 1 Beta,Ppargc1β)、过氧化物酶体膜蛋白4(peroxisomal membrane protein 4,Pxmp4)、天冬酰化酶(aspartoacylase,Aspa)等。它们都可以促进脂肪细胞分化,INSR、GNPAT、PPARGC1β具有增加糖原、脂类和蛋白质合成的多种作用[10]。PXMP4为过氧化物酶体是是一类由配体激活的核转录因子,参加脂肪酸合成过程中磷脂的形成[11]。ASPA具有增加食欲、调节能量平衡等的作用,与机体肥胖相关[12]。
Stau1敲低后上调且验证有统计学差异的基因包括神经细胞生长因子(nerve growth factor,Ngf)、FOXP1、转运体1(transporter 1,Tap1)。其中NGF和FOXP1参与棕色脂肪细胞分化,FOXP1 mRNA表达增高5.3倍。在冷暴露的条件下,交感神经兴奋激活NGF和受体酪氨酸激酶(tyrosine kinase,TrkA)信号通路激活下游因子,促进PGCIα和UCP1的表达使白色脂肪组织褐变,加快了机体产热[13]。
生物信息学预测FOXP1的mRNA 3′UTR区含有局部双链结构-Staufen 1结合位点(Staufen 1 binding site,SBS),荧光素酶报告基因实验结果确认二者存在结合。推测STAU1可以通过SMD途径降解FOXP1 mRNA表达水平。提示:STAU1可以通过抑制FOXP1的表达参与白色脂肪细胞棕色化。可初步推断STAU1与FOXP1等基因表达变化的因果关系,有助于从白色脂肪细胞棕色化角度,阐明STAU1与肥胖的关系。
FOXP1在白色脂肪组织和棕色脂肪组织当中都有表达,FOXP1可以通过调节 PGC-1、UCP1的表达影响线粒体的功能。FOXP1也可以直接与 PRDM16 结合,并抑制其对下游靶基因PPARγ激活作用。本研究初步阐述了STAU1与FOXP1的相互作用,但是在研究过程中,依然存在一些尚未解决的问题:敲低Stau1后, 代谢基因的变化是由于白色脂肪自身分化和功能异常造成还是转变成棕色脂肪细胞的进程受到FOXP1的调控?这一问题非常值得深入研究。
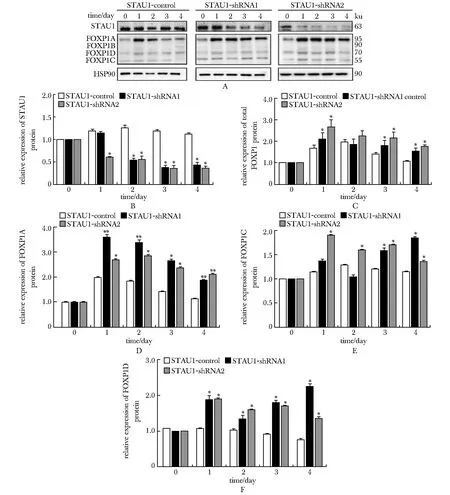
A.Western blot; B.knockdown efficiency of STAU1-shRNA; C.influence on total expression level of FOXP1; D-F.influence on expression levels of FOXP1(A,C,D);*P<0. 05, **P<0.01 compared with the control group
综上所述,本研究为进一步分析转录组STAU1 KD(knockdown)测序结果的可行性奠定了基础,为进一步研究细胞内的代谢通路情况奠定了基础。

A.FOXP1 3′UTR sequence;B. luciferase activity;*P<0. 05 compared with the control group图5 对照组和报告基因转染组的荧光素酶活性Fig 5 Luciferase activity in control and reporter gene transfection groups
