二甲双胍抑制腰椎间盘退变模型兔椎间盘组织的细胞凋亡
2023-01-18董军立蔡少康
董军立,蔡少康,严 蕾,蔡 毅
华中科技大学同济医学院附属武汉中心医院 疼痛科, 湖北 武汉 430014
压力诱导或缺血缺氧,引起的细胞自噬降低,在腰椎间盘退变中发挥重要作用。另外,自噬激活还可抑制炎性反应,提高细胞应对外界刺激的能力[1]。促炎因子——肿瘤坏死因子-α(TNF-α)会减弱自噬,导致有害代谢产物聚集,而加重细胞凋亡,但参与自噬小体形成的关键蛋白-自噬相关蛋白7(Atg7)基因缺失,却可促进TNF-α反应活化。因此,探究组织中自噬与炎性变化,对阐明髓核组织及软骨细胞死亡、椎间盘退化产生的分子机制有重要作用。近来有研究发现二甲双胍(metformin)可能在改善腰椎间盘退变性疾病髓核组织细胞炎性反应、自噬等病变发展调控中,有潜在价值[2]。本研究建立兔腰椎间盘退变性疾病模型,对此进行研究验证。以期为二甲双胍在腰椎间盘退变性疾病领域的应用治疗,提供可靠资料。
1 材料与方法
1.1实验材料
SPF级雄性新西兰大白兔50只,6月龄,体质量(2.0±0.5)kg[华中科技大学动物实验中心,生产许可证号:SCXK(鄂)2021-0009],本研究实验于武汉华联科生物技术有限公司进行,许可证号:SYXK(鄂)2018-0104,伦理批号:2021-021102。
二甲双胍(中美上海施贵宝制药有限公司);自噬抑制剂-3MA(北京泰泽嘉业科技发展有限公司);HE染色液(北京伊塔生物科技有限公司);TUNEL染色液(无锡菩禾生物医药技术有限公司);山羊抗兔Atg7、LC3Ⅱ、Beclin1、溶酶体相关膜蛋白2(LAMP2)、TNF-α、IL-1β和凋亡相关蛋白caspase-8等多克隆抗体(Abcam公司)。
1.2 方法
1.2.1 兔的分组及处理:将兔随机分为假手术组、模型组(参照文献[3-4]用髓核穿刺抽吸法暴露椎间盘(L2-L6),破坏椎间盘建立椎间盘退变模型)、二甲双胍组(160 mg/kg二甲双胍灌胃)、自噬抑制剂组(自噬抑制剂-3MA注射计量5 mmol/L,0.5 mL/只)、二甲双胍+自噬抑制剂组,每组10只,术后12周行磁共振成像(magnetic resonance imag-ing,MRI)检测。
1.2.2 MRI检查评估椎间盘退变程度:参照[5]方法对腰椎行MRI检查,用Pfirrmann分级法对椎间盘退变程度进行评分,总分以4分计,评分越高示椎间盘退变程度越严重。
1.2.3 透射电镜观察椎间盘组织自噬体形成:取椎间盘组织,切成1 cm×1 cm×1 cm组织块儿,送于电镜室处理后,拍照,以观察自噬体形成情况。剩余组织用4%多聚甲醛固定24 h,乙二胺四乙酸(0.5 mol/L)脱钙20 d后,制成厚为4 μm的连续石蜡切片备用。
1.2.4 HE及TUNEL染色观察椎间盘组织结构病变及细胞凋亡状况:取相同部位椎间盘组织石蜡切片,脱蜡、水化、抗原灭活及修复处理后,进行HE及TUNEL染色处理(按说明书进行)后,于光镜下观察拍照。TUNEL染色切片在400倍光镜下,随机取5个视野,计算单位面积内阳性染色(红棕色)的平均吸光度值。
1.2.5 免疫组化法检测Atg7阳性表达:椎间盘组织石蜡切片,脱蜡、透化、抗原修复后,递加1∶100的山羊抗兔Atg7一抗抗体孵育24 h,滴加IgG驴抗山羊二抗抗体孵育25 min,DAB显色,光镜下观察拍照,Image-Pro Plus 6.0软件分析400倍镜下单位面积内阳性染色的平均吸光度值。
1.2.6 Western blot检测椎间盘组织自噬、炎性因子、凋亡蛋白质表达:剩余5只大白兔麻醉处死后,取椎间盘组织,加入液氮研磨,提取胞质蛋白质,BCA法检测蛋白浓度,取80 μg蛋白质行电泳、转膜反应,滴加1∶400的山羊抗兔LC3Ⅱ、Beclin1、LAMP2、TNF-α、IL-1β、caspase-8一抗及1∶800的内参β-actin抗体4 ℃孵育过夜,滴加驴抗山羊IgG二抗(1∶800)孵育55 min,增强化学发光液显色曝光,Image-J软件分析条带吸光度值。
1.3 统计学分析
2 结果
2.1 二甲双胍对兔椎间盘退变程度的影响
MRI检查显示椎间盘信号越高,Pfirrmann分级评分越低,预示退变程度较低。与假手术组相比,模型组椎间盘为低信号,Pfirrmann分级评分升高(P<0.05);二甲双胍组椎间盘退变程度Pfirrmann分级评分降低(P<0.05);自噬抑制剂组兔椎间盘退变程度Pfirrmann分级评分进一步升高(P<0.05)。与二甲双胍组相比,二甲双胍+自噬抑制剂组椎间盘退变程度Pfirrmann分级评分升高(P<0.05)(图1,表1)。
2.2 二甲双胍对兔椎间盘组织病理变化的影响
模型组较假手术组兔腰椎间隙变窄,纤维环排列紊乱且有裂痕,髓核细胞数量及胞外间质减少,终板下层增生软骨陷窝较多。二甲双胍组兔腰椎间隙增宽,纤维环排列逐渐整齐,髓核细胞数目及胞外基质增多,终板下层软骨增生减轻。自噬抑制剂组兔腰椎间隙变窄、髓核细胞数目及纤维环减少、终版软骨增生等退变病理现象进一步加重。二甲双胍+自噬抑制剂组兔上述病理损伤较二甲双胍组严重,但较模型组减轻(图2)。

图1 MRI检查Fig 1 MRI examination
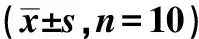
表1 兔椎间盘退变程度Pfirrmann分级评分比较
2.3 二甲双胍对兔椎间盘组织细胞自噬的影响
透射电镜观察可见,假手术组兔椎间盘组织细胞中自噬小体及自噬溶酶体较多,模型组兔仅有少量的自噬小体及自噬溶酶体形成。二甲双胍组兔自噬小体及自噬溶酶体形成有所增加。自噬抑制剂组兔几乎未见自噬小体及自噬溶酶体形成。二甲双胍+自噬抑制剂组兔自噬小体及自噬溶酶体形成较二甲栓胍组较少(图3)。
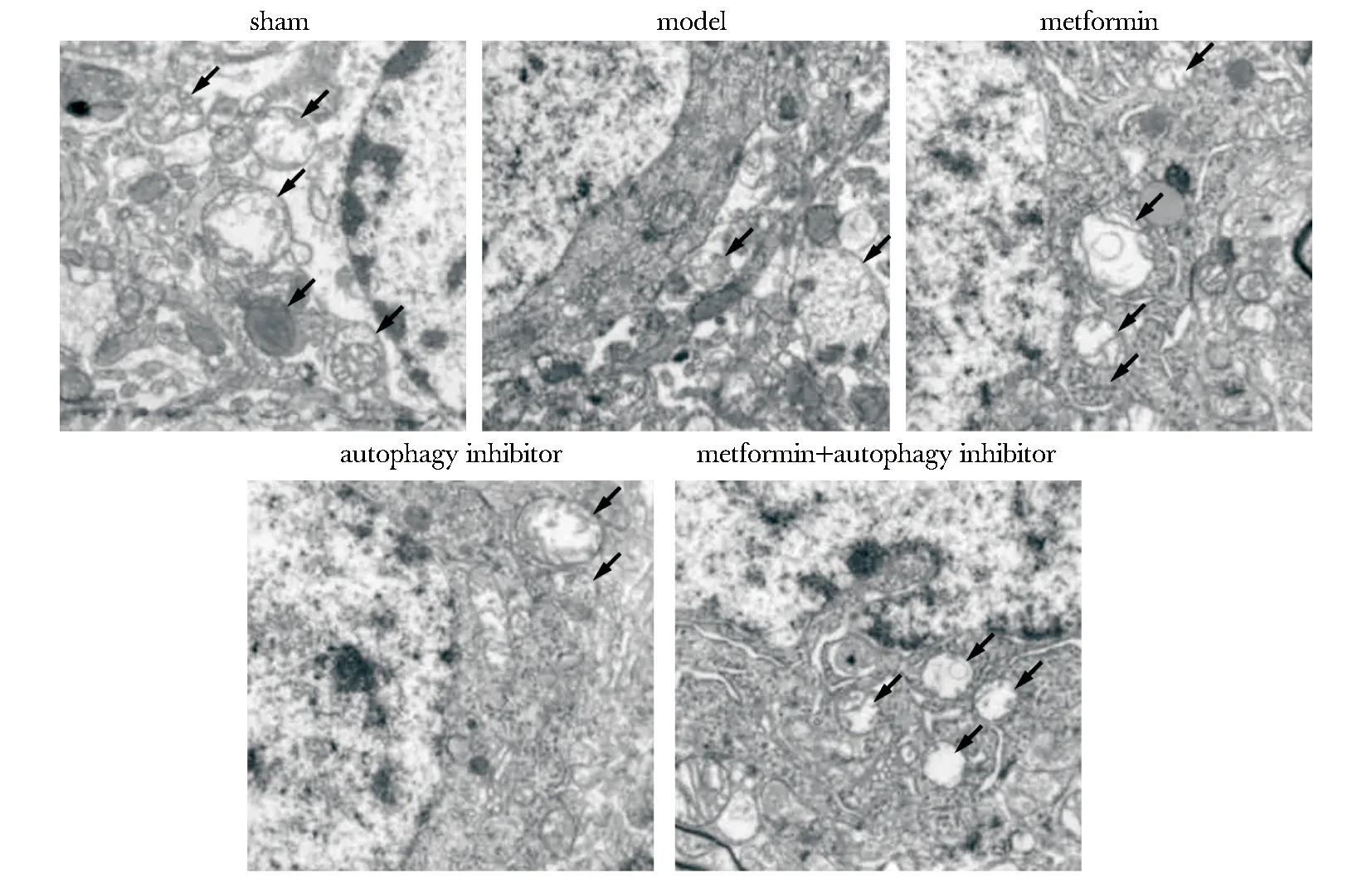
免疫组化染色可见自噬关键蛋白-Atg7在假手术组兔椎间盘组织细胞中呈强阳性(红棕色)表达。与假手术组相比,模型组兔椎间盘组织细胞中Atg7阳性表达降低(P<0.05)。与模型组相比,二甲双胍组兔椎间盘组织细胞中Atg7阳性表达升高(P<0.05);自噬抑制剂组兔椎间盘组织细胞中Atg7阳性表达较模型组进一步降低(P<0.05)。与二甲双胍组相比,二甲双胍+自噬抑制剂组椎间盘组织细胞Atg7阳性表达降低(P<0.05)(图4,表2)。

图2 椎间盘组织HE染色Fig 2 HE staining of intervertebral disc tissue(×40)
The arrows indicated autophagosomes and autolysosomes图3 椎间盘组织的透射电镜观察Fig 3 Transmission electron microscope observation of intervertebral disc tissue (×12 000)
Western blot检测显示,模型组兔椎间盘组织细胞中自噬标记蛋白LC3Ⅱ、Beclin1及LAMP2蛋白表达较假手术组降低(P<0.05)。与模型组相比,二甲双胍组兔椎间盘组织LC3Ⅱ、Beclin1及LAMP2蛋白表达升高(P<0.05);自噬抑制剂组兔椎间盘组织LC3Ⅱ、Beclin1及LAMP2蛋白表达较模型组进一步降低(P<0.05)。与二甲双胍组相比,二甲双胍+自噬抑制剂组兔椎间盘组织LC3Ⅱ、Beclin1及LAMP2蛋白表达降低(P<0.05)(图5,表2)。
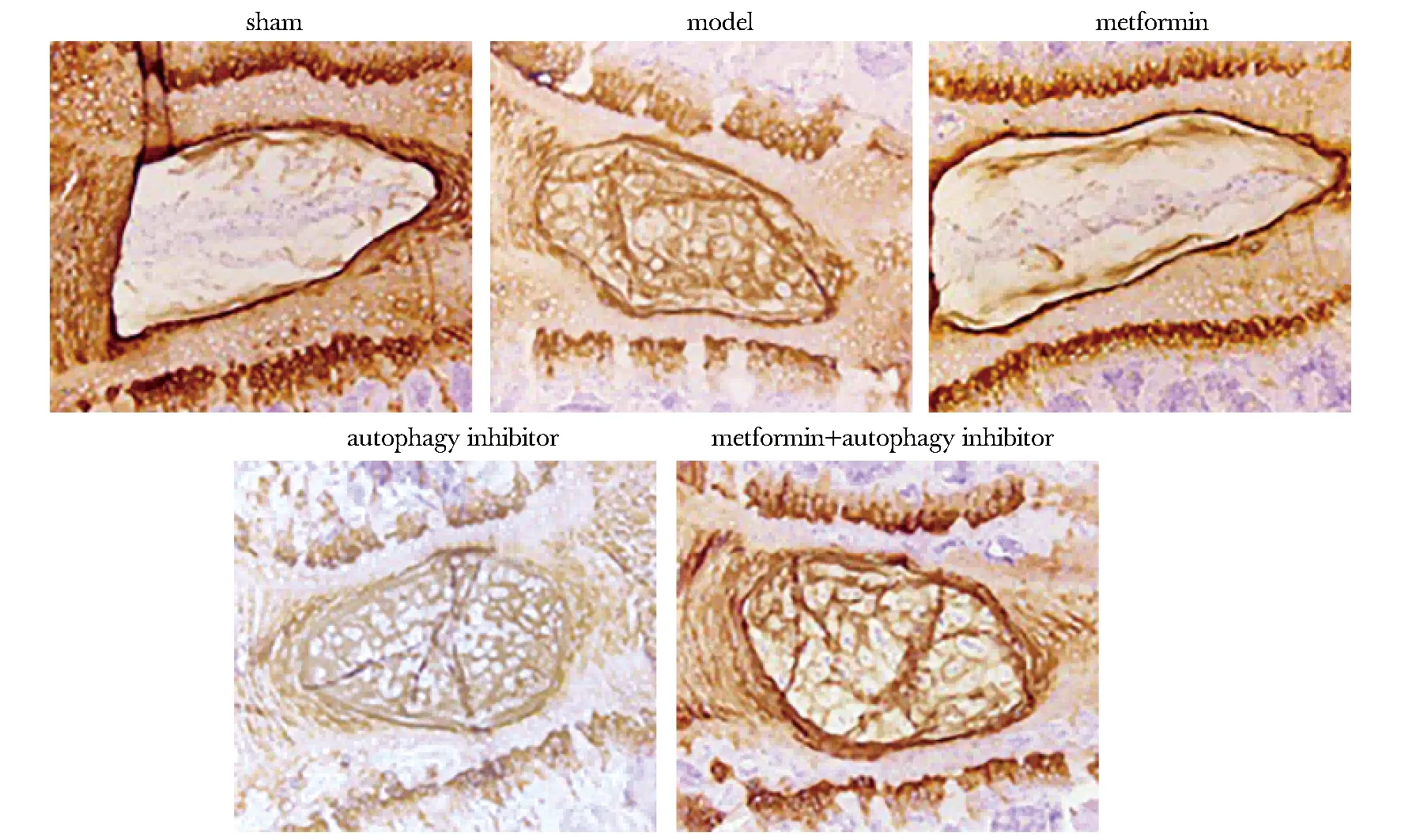
图4 椎间盘组织Atg7免疫组化染色Fig 4 Intervertebral disc tissue Atg7 immunohistochemical staining (×40)

表2 兔椎间盘组织Atg7阳性表达及LC3Ⅱ、Beclin1、LAMP2蛋白表达比较

A.sham; B.model; C.metformin; D.autophagy inhibitor; E.metformin+autophagy inhibitor图5 椎间盘组织LC3Ⅱ、Beclin1及LAMP2蛋白表达免疫印迹图Fig 5 Western blot of LC3Ⅱ, Beclin1 and LAMP2 protein expression in intervertebral disc tissue
2.4 二甲双胍对兔椎间盘组织细胞凋亡及炎性反应蛋白质的影响
模型组兔椎间盘组织红棕色染色加深,凋亡细胞率较假手术组升高(P<0.05)。二甲双胍组兔椎间盘组织红棕色染色变浅,凋亡细胞率较模型组降低(P<0.05);自噬抑制剂组凋亡细胞率较模型组进一步升高(P<0.05)。与二甲双胍组相比,二甲双胍+自噬抑制剂组凋亡细胞率升高(P<0.05)(图6,表3)。
模型组兔椎间盘组织细胞中凋亡蛋白caspase-8、促炎蛋白TNF-α及IL-1β表达升高(P<0.05)。与模型组相比, 二甲双胍组兔椎间盘组织caspase-8、TNF-α及IL-1β蛋白表达降低(P<0.05);自噬抑制剂组兔椎间盘组织caspase-8、TNF-α及IL-1β蛋白表达较模型组进一步升高(P<0.05)。与二甲双胍组相比,二甲双胍+自噬抑制剂组兔椎间盘组织caspase-8、TNF-α及IL-1β蛋白表达升高(P<0.05)(图7,表3)。
图6 椎间盘组织TUNEL染色Fig 6 TUNEL staining of intervertebral disc tissue(×40)
3 讨论
椎间盘是人体最大的无血管组织,靠两侧终板组织弥散的毛细血管来提供少量营养。椎间盘退变过程中,两侧终板软骨发生钙化后,毛细血管弥散作用减弱, 椎间盘组织髓核细胞的营养供给将更为受限。故大量研究认为,自噬持续激活能保证正常椎间盘细胞在低血供时,维持正常的能量供应,并清除细胞代谢产物、降解受损及失去功能的蛋白质以维持细胞活力及正常功能[6]。本研究提示椎间盘退变过程中出现自噬减少现象,这与报道的发现椎间盘退变患者髓核组织自噬对髓核细胞及组织的保护作用降低,是导致髓核组织细胞凋亡退化的机理相一致[7]。已有研究发现,激活自噬,可减少受损大分子物质蓄积,并抑制自噬蛋白Beclin-1与抗凋亡蛋白Bcl2结合来促进细胞生存,减轻椎间盘退变[8]。二甲双胍可通过启动肝激酶B1(liver kinase B1,LKB1)/5’-单磷酸腺苷活化蛋白激酶(adenosine 5′-monophosphate(AMP)-activated protein kinase, AMPK)活性,抑制自噬抑制蛋白-雷帕霉素靶蛋白(mammalian target of Rapamycin,mTOR)表达,来启动自噬,改善细胞代谢水平[9]。本研究提示二甲双胍可能通过促进自噬,来缓解椎间盘退变。
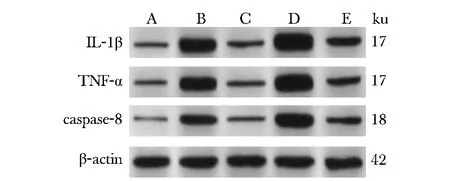
A.sham; B.model; C.metformin; D.autophagy inhibitor; E.metformin+autophagy inhibitor图7 免疫印迹检测椎间盘组织caspase-8、TNF-α及IL-1β蛋白表达Fig 7 Western blot showed protein expression of caspase-8, TNF-α and IL-1β in interver- tebral disc tissue

表3 兔椎间盘组织细胞凋亡率、凋亡及炎性蛋白表达比较
文献研究发现,自噬不仅能靶向隔离、降解pro-IL-1β,来抑制炎性小体激活,还能通过清除凋亡的细胞,防止代谢产物的过度蓄积,而弱化炎性反应[10]。Atg7为自噬的核心蛋白,其能与III类磷脂酰肌3-激酶效应器(Ptd Ins3P)效应蛋白相结合而形成泛素化类复合物,来介导自噬泡形成。TNF-α可破坏基质金属蛋白酶、水通道蛋白酶、聚糖蛋白、Ⅱ型胶原蛋白等,来引起髓核组织细胞皱缩、干瘪、凋亡及功能丢失[11]。敲除Atg7抑制自噬的情况下,可诱导TNF-α表达升高,用TNF-α诱导软骨细胞炎性反应的同时,会出现Atg7及LC3Ⅱ蛋白表达降低[12],提示Atg7与TNF-α之间可能存在相互作用,来调控炎性反应-自噬-凋亡的发展。本研究发现,自噬受抑制,其减弱炎性反应能力降低,可能是参与椎间盘退变发生的潜在机制。二甲双胍在促进Atg7及LC3Ⅱ表达,激活自噬,降低椎间盘组织细胞凋亡,缓解椎间盘退变过程中,还降低TNF-α、IL-1β等炎性因子表达,提示二甲双胍可缓解椎间退变,且其缓解作用可能与促进自噬、抑制凋亡,减弱炎性反应有关。二甲双胍与自噬抑制剂-3MA联合应用时,二甲双胍的激活自噬、抑制凋亡、减弱炎性反应等作用可被自噬抑制剂-3MA明显减弱。
综上所述,二甲双胍可能通过促进自噬激活,减弱炎性反应,来抑制椎间盘组织细胞凋亡,改善椎间盘退变。这可能为二甲双胍治疗椎间盘退变提供新的治疗策略,但椎间盘退变过程中,引起自噬保护性活性降低的基因调控机制还不甚清楚,这需要后续继续深入探究。
