骨桥蛋白在大鼠肝缺血/再灌注损伤中的作用
2023-01-18郭丽苹田新雁胡亚荣
郭丽苹,苏 娟,田新雁,陆 丽,胡亚荣,秦 燕
大理大学 基础医学院,云南 大理 671000
肝缺血/再灌注损伤(hepatic ischemia-reperfu-sion injury,HI/RI)是肝组织缺血再灌注后,肝功能和结构损伤不仅未恢复,反而损伤程度加重的现象。HI/RI常见于肝移植、休克复苏、严重肝外伤及肝叶切除等外科疾患,其损伤程度明显影响了治疗效果和预后,严重时可导致患者肝功能衰竭甚至多器官功能障碍而致死亡[1-2]。
骨桥蛋白(osteopontin,OPN)是一种磷酸化糖蛋白,分布于多种组织和细胞中,具有多种生物学功能,在骨代谢、伤口愈合、血管生成、肿瘤发生和炎性免疫反应等方面发挥重要作用[3-4]。有报道[5-6]提示OPN与肝脏疾患存在密切联系,但多数研究主要集中于其在肝脏慢性损伤过程中的作用(如肝纤维化)。目前OPN在多数疾病急性损伤中的作用日益引起重视[7-8]。急性HI/RI时,OPN是否参与其中,尚未见报道。本研究将通过建立大鼠急性HI/RI模型,进一步探讨OPN在其中的变化及作用。
1 材料与方法
1.1 材料
1.1.1 实验动物:SPF级SD大鼠,雄性,体质量180~220 g(昆明医科大学实验动物中心[SYXK(滇)k2015-0002])。
1.1.2 药物与试剂:天门冬氨酸氨基转移酶(aspartate aminotransferase,AST)测定试剂盒、丙氨酸氨基转移酶(alanine aminotransferase,ALT)测定试剂盒、总超氧化物歧化酶(superoxide dismutase,SOD)测定试剂盒和丙二醛(malondialdehyde,MDA)测定试剂盒(南京建成生物工程研究所);BCA蛋白质定量试剂盒、RNase-Free ddH2O、TRNzol Universal总RNA提取试剂、FaskKing cNDA第一链合成试剂盒、SuperReal彩色荧光定量预混试剂(天根生化科技有限公司);RNA引物设计与合成(上海生工生物工程股份有限公司);0.9%氯化钠溶液(四川科伦药业股份有限公司);大鼠骨桥蛋白(OPN)酶联免疫试剂盒(上海泛柯实业有限公司);其他试剂均为分析纯。
1.2 方法
1.2.1 大鼠的分组与处理:将大鼠随机分为:假手术(sham)组、缺血/再灌注(ischemia-reperfusion,I/R)组,每组6只(n=6)。参照文献[9]的方法复制大鼠HI/RI模型,根据再灌注时间,将I/R组分为6、12、24 h组。Sham组仅进行肝蒂部干扰,缺血后直接取材。
1.2.2 血浆肝功能指标的测定:常规分离的血浆-80 ℃冻存备用。按照试剂盒说明书操作步骤,于多功能酶标仪505 nm波长测定血浆中AST和ALT水平。
1.2.3 HE染(hematoxylin-eosin staining)色观察肝组织形态学:取肝左外侧叶,4%多聚甲醛固定后,进行石蜡包埋,再用切片机制作成4 μm切片,脱水透明后进行H&E染色,光学显微镜下观察肝组织病理损伤变化。
1.2.4 肝组织氧化应激指标的检测:取约1 g肝外侧叶组织,按质量∶体积为1∶9的比例加入0.9%氯化钠溶液,在功率为60%,超声10 s与间歇30 s为1个循环,超声循环3~5次的条件下制备10%匀浆液。4 ℃、3 000 r/min离心10 min,分离得10%肝匀浆上清液,-80 ℃冻存备用。采用BCA法测定其总蛋白浓度。分别根据试剂盒说明书,于紫外分光光度计550 nm波长下测定吸光度,并计算出SOD的活力;于紫外分光光度计532 nm波长下测定吸光度,并计算出MDA的含量。
1.2.5 RT-qPCR测定肝组织OPN mRNA表达:取适量肝组织置2 mL玻璃匀浆器中,加1 mL Trizol Universal试剂,冰上研磨完全后,按RNA提取试剂盒步骤提取肝组织总RNA。用超微量核酸蛋白质测定仪测定总RNA浓度。取各组细胞的总RNA各1 μg,按RT-qPCR试剂盒说明书反转录合成cDNA,取产物3 μL进行PCR循环。PCR扩增条件:94 ℃预变性5 min,94 ℃变性1 min,56 ℃退火1 min,72 ℃延长2 min,扩增30个循环。每份样本以3-磷酸甘油醛脱氢酶(GAPDH)作为内参照。OPN上游引物序列5′-GCTTGGCTTACGGACTGAGG-3′,下游引物序列列5′-GGGCAACTGGGATGACCTTG-3′,PCR扩增产物为141 bp;内参GAPDH上游引物序列5′-GGGGCTCTCTGCTCCTCCCTG-3′,下游引物序列5′-CGGCCAAATCCGTTCACACCG-3′,PCR扩增产物为107 bp。
1.2.6 ELISA测定肝组织OPN的含量:用纯化的大鼠OPN抗体包被微孔板,制成固相抗体,往包被单抗的微孔中依次加入OPN,再与HRP标记的OPN抗体结合,形成抗体-抗原-酶标抗体复合物,经过彻底洗涤后加底物TMB显色。用酶标仪在450 nm波长下测定吸光度值,通过标准曲线计算样品中OPN含量。
1.3 统计学分析
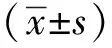
2 结果
2.1 肝组织形态学变化
Sham组镜下可见到肝小叶结构完整,肝细胞呈索状整齐排列,大小均匀,无变性和坏死。I/R 6 h见肝血窦变宽有大量红细胞滞留,肝窦挤压变形,有少量肝细胞变性、坏死和中性粒细胞浸润;I/R 12 h时变化加重,肝细胞明显排列不齐;I/R 24 h时肝细胞出现大量变性和坏死(图1)。
2.2 血浆中AST和ALT水平的变化
与sham组比较,I/R各组大鼠血浆AST和ALT的活力均有不同程度的显著升高,以I/R 12 h组最为明显(P<0.01)(表1)。
2.3 肝组织中SOD活力和MDA含量的变化
与sham组比较,I/R各组大鼠肝组织中SOD活力随再灌注时间延长呈显著下降趋势,MDA含量逐渐升高,24 h时最为明显(P<0.01)(表2)。
2.4 肝组织中OPN mRNA表达水平的变化
与sham组比较,I/R 6、12和24 h组大鼠肝组织OPN mRNA表达均不同程度增高,其中以I/R 24 h组最显著(P<0.01)(表3)。
2.5 肝组织中OPN含量的变化
与sham组比较,I/R 24 h组大鼠肝组织中OPN蛋白含量显著升高(P<0.05),其余各组变化不明显(表3)。
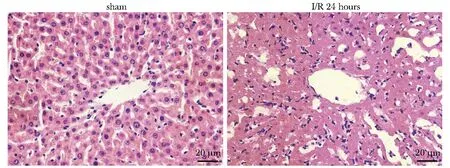
图1 大鼠肝组织HE染色结果Fig 1 HE staining results of rats liver (×400)

表1 各组大鼠血浆中AST和ALT的水平变化
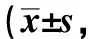
表2 各组大鼠肝组织中SOD活力和MDA含量的变化
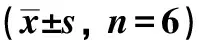
表3 各组大鼠肝组织OPN mRNA表达及OPN含量的变化
3 讨论
肝脏缺血一段时间,再恢复血液灌流后可通过氧化应激及炎细胞的激活等作用引发肝脏结构和功能的损伤[10]。随着再灌流时间的延长,出现肝细胞排列紊乱、不同程度的中性粒细胞浸润和肝窦受挤压并伴有淤血现象,I/R 24 h时肝细胞出现明显水肿和变性坏死。血浆中AST及ALT水平显著升高,I/R 12 h时变化最明显,说明再灌注加重了肝损伤。肝组织中SOD的活力显著降低,而MDA的含量显著升高,以I/R 24 h时的变化最显著,可见在HI/RI期间氧化应激反应损伤了肝细胞。
I/R损伤过程中,氧化应激可引起明显的炎性反应,使细胞黏附分子及趋化因子等生成增多,并吸引中性粒细胞聚集、黏附在血管内皮细胞上,堵塞微循环,加重组织细胞水肿。激活的中性粒细胞可释放大量活性物质如自由基和蛋白酶等,导致周围组织细胞损伤[11]。OPN是一种具有多种生理功能的磷酸化糖蛋白,在正常情况下表达甚微,但在炎性坏死和缺氧等诱导下,体内多种细胞如成纤维细胞和巨噬细胞等可大量表达OPN,调节炎性细胞的趋化、黏附和聚集,刺激细胞因子分泌,引发炎性反应[12]。本结果显示,OPN的表达和含量随着再灌注时间延长而升高,与肝脏病理形态学的变化和氧化损伤指标的变化趋势相一致。提示HI/RI可通过上调OPN,刺激肝巨噬细胞分泌细胞黏附分子、趋化因子等激活炎细胞而加重肝损伤。
综上所述,OPN参与了急性HI/RI的发生,可能是评价肝脏损伤的重要指标,但其在HI/RI中的作用及其机制尚待进一步研究。
