间充质干细胞在衰老相关疾病应用中的研究进展
2023-01-18商利鹏刘国祥丁晓燕赵春华李霄霞
商利鹏,刘国祥,丁晓燕,李 冰,赵春华,3,4,李霄霞,*
青岛大学 基础医学院 1. 干细胞再生医学研究院;2. 遗传学与细胞生物学系, 山东 青岛 266071; 3.中国医学科学院 北京协和医学院 基础医学研究所 组织工程中心,北京 100005; 4.上海大学 生命科学学院 细胞生物学系,上海 200444
人口老龄化是中国乃至全世界当前面临的一个主要问题,预计到2050年全世界60岁以上老年人口数量将是现在的2倍,中国60岁以上老年人口将达到4.98亿[1]。衰老是指生物体发育成熟后随着年龄的增加,机体在形态结构、生理功能等方面出现一系列退行性变化的生理现象。与衰老有关的多种疾病如神经退行性疾病、心脑血管疾病、癌症、糖尿病等成为影响老年人身体健康的重大疾病。机体衰老的9个分子与细胞学特征包含基因组的不稳定、端粒耗损、表观修饰改变、蛋白质内稳态缺失、营养感应失调、线粒体功能障碍、细胞衰老、细胞间通讯改变和干细胞耗竭[2]。其中,干细胞耗竭是衰老过程中最明显的特征。当机体内具有再生潜能的干细胞逐渐减少后,组织的自我更新和修复能力受到影响,从而影响其行使正常功能。因此及时补充干细胞,增加机体细胞的增殖和分化,从而替代、清除衰老的细胞,是抗衰老研究的一项重要内容。
1 间充质干细胞及外泌体简介
间充质干细胞(mesenchymal stem cells,MSCs)是目前国内外研究最多的一类成体干细胞,其来源广泛,可以从骨髓、脂肪、胎盘、脐带等多种组织中分离得到。MSCs具有自我更新及多向分化潜能,能够分化为脂肪细胞、成骨细胞、成软骨细胞等多种类型的细胞[3]。MSCs还具有低免疫原性以及免疫调节功能,对固有免疫的树突状细胞、单核巨噬细胞和获得性免疫的T淋巴细胞、B淋巴细胞等多种细胞具有调节作用[3]。研究表明MSCs的免疫调节功能与其旁分泌能力有关,MSCs可分泌吲哚胺-2-3-二氧合酶(indoelmine-2-3-dixoygenase,IDO)、一氧化氮(nitric oxide,NO)、前列腺素E2(prostaglandin E2,PGE2)、肿瘤坏死因子α-刺激基因-6(TNFα-stimulated gene-6,TSG-6)等多种免疫调节活性因子以及细胞外囊泡发挥作用[4]。
外泌体(exosome)是一类由脂质双分子层构成的、大小30~100 nm的细胞外囊泡结构,包含蛋白质、miRNA等多种生物活性物质。研究表明,外泌体存在于外周血、尿液、羊水等多种体液中,多种类型的细胞均可以分泌产生外泌体,不同组织细胞来源的外泌体在组成和功能方面也存在差异。外泌体能够通过膜融合、内吞或细胞类型特异性吞噬等方式被靶细胞吸收,从而影响靶细胞的功能,参与疾病的发展和进程。此外,外泌体也可作为药物载体,在多种疾病中发挥治疗作用[5]。近年来关于MSCs及其来源外泌体在衰老相关疾病中的研究也越来越多,如糖尿病、帕金森病、骨质疏松症等[6-8]。本文将对近年来MSCs及其来源外泌体在衰老相关疾病中的作用和机制进行总结,针对目前研究中存在的问题进行讨论,从而为将来MSCs在相关疾病中的研究和治疗提出建议。由于衰老相关疾病种类较多,本文将针对几个人体系统中最典型、最有代表性的疾病进行阐述。
2 MSCs在衰老相关疾病中的作用和机制研究
2.1 MSCs在骨质疏松症中的研究进展
骨质疏松症(osteoporosis,OP)是老年人运动系统中的常见疾病,其特征是骨量减少和骨微结构退化, 导致骨骼脆性和骨折风险的增加。OP的发生是由于遗传或环境因素导致的体内激素平衡失调、局部氧化炎性反应,影响了成骨和破骨的动态平衡。目前,OP的治疗以口服促进骨形成或拮抗骨吸收药物为主,如双膦酸盐、降钙素等。由于MSCs来源于中胚层,能够分化为成骨细胞、软骨细胞和肌肉细胞等,因此关于MSCs在OP中的作用研究较多,尤以骨髓来源MSCs(BM-MSCs)为主。研究发现OP患者体内BM-MSCs成骨分化的相关基因表达下调,成脂分化基因表达上调,导致骨形成不足,而其他免疫相关亚群细胞的激活促进破骨细胞的成熟分化,加强骨吸收[9]。动物实验表明移植BM-MSCs可以促进骨再生,改善骨结构,主要通过两种机制起作用:一是BM-MSCs向受损部位归巢,然后分化成骨细胞,修复退化组织;二是BM-MSCs通过分泌某些生长因子,以旁分泌的方式作用修复退化的组织[8]。目前研究多集中在如何提高MSCs的体内治疗效果,如利用BMP2基因修饰后的BM-MSCs促进骨形成、抑制骨吸收、加强BM-MSCs归巢,选择合适植入途径或联合使用其他细胞或生物支架、联合药物或物理刺激,从而提高移植细胞的存活率以及治疗效果,以及非细胞治疗等[10]。
外泌体治疗是非细胞治疗的一种方式,研究表明MSCs来源外泌体能够对成骨细胞存活、增殖和迁移产生影响,进而促进新骨形成,改善骨形态,抑制骨衰老。MSCs来源外泌体促进成骨的机制认为与外泌体中差异表达的miRNA有关。本课题组长期研究miRNA分子对MSCs成脂成骨分化的调控,并发现了miR216a、miR10b、miR1292等多个分子在此过程中发挥重要作用[11]。然而,不同细胞来源外泌体中存在不同miRNA,miRNA介导信号通路的分子机制也具有多样性,其未来临床应用还面临着许多尚未解决的问题。
已有多项临床试验研究MSCs及其来源外泌体在OP中的作用,在其中一项研究中,OP患者接受了自体BM-MSCs静脉输注治疗,随后进行了骨质吸收、形成和代谢检测(NCT02566655)。但是目前这些临床试验几乎均未有研究结果报道,因此需要开展更多更严谨的临床试验来全面评价MSCs在OP中的安全性以及移植的有效性。此外,MSCs的标准化生产问题也是其向临床转化过程中需要解决的环节之一[10]。
2.2 MSCs在神经系统退行性病变中的研究进展
帕金森病(Parkinson’s disease,PD)是常见的神经退行性疾病,患者以行动迟缓和静止性震颤为典型特征,其病理改变以中脑黑质多巴胺能神经元的丧失和纹状体区域多巴胺的消耗为主。此外,神经炎性反应和氧化应激也参与了PD的发生发展。现有的治疗方法仅能缓解PD的症状,尚且无法彻底治愈。研究发现α-突触核蛋白和路易小体的异常导致多巴胺神经元细胞的损伤和死亡,而小胶质细胞的活化则可能与神经炎性反应有关。MSCs可以分泌产生多种神经营养因子,如胶质细胞源性神经营养因子(glia derived neurotrophic factor, GDNF)、脑源性神经营养因子(brain derived neurotrophic factor, BDNF)、血管内皮生长因子(vascular endothelial growth factor,VEGF)等,这些神经营养因子对于多巴胺能神经元细胞的分化和正常功能是至关重要的。此外,MSCs还可以通过旁分泌作用如外泌体来抑制神经炎性反应。动物行为学实验表明MSCs移植能够改善PD模型大鼠的运动功能,改善纹状体多巴胺释放,作用机制可能与MSCs的免疫调节作用、神经保护和抗凋亡作用、促神经发生和血管生成作用以及改善细胞代谢作用有关[12]。
由于外泌体能够穿过血脑屏障,因此MSCs可能是通过外泌体发挥对PD的治疗作用。已有多项研究发现MSCs来源外泌体能够归巢至受损的脑黑质区域,减少多巴胺能神经元细胞的凋亡,增加纹状体区域多巴胺的水平[13]。本课题组前期研究发现MSCs来源外泌体能够通过ICAM1-SMAD3/P38MAPK通路促进脑血管内皮细胞的血管生成,从而促进PD的恢复[14]。外泌体中的miRNA可能参与了PD的治疗作用,但是miRNA的种类与其干预靶点同样存在多样性,如miR133b可以促进神经轴突生长,miR21和miR143则通过调节神经炎性反应从而发挥对PD的治疗作用[15]。
目前在美国临床实验数据库ClinicalTrials网站(https://www.clinicaltrials.gov/)注册的正在招募或已完成的关于MSCs在PD中的临床试验有13项,这些临床试验多采用骨髓、脐带或脂肪来源MSCs通过静脉回输研究其安全性和有效性。印度的一个研究团队通过统一的PD量化评分检测发现,有几例PD患者在接受MSCs输注后症状有持续的改善[6]。尽管这些临床试验给PD患者带来了希望,但是仍然有很多问题需要解决,如MSCs供体的来源及其培养条件的确定、MSCs移植路径及移植时间和剂量的选择,如何针对不同患者确定个体化治疗方案等。因此MSCs及其来源外泌体在PD患者中的有效性研究仍需继续进行。
2.3 MSCs在2型糖尿病中的研究进展
2型糖尿病(type 2 diabetes mellitus,T2DM)是内分泌系统最常见的衰老相关疾病,是多种因素导致机体胰岛素分泌不足以及组织细胞对胰岛素敏感性降低引起的以高血糖为特征的代谢性疾病。2型糖尿病的治疗以口服降糖药物和注射胰岛素为主。尽管通过生活方式干预及药物干预均可以有效降低血糖,但是仍有患者出现严重的糖尿病慢性并发症如糖尿病肾病、糖尿病足等。因此,MSCs及其来源外泌体在2型糖尿病中的作用和机制研究近年来受到广泛关注。
动物实验表明MSCs移植后可以归巢到受损胰腺并分化为胰岛β细胞,可以减轻胰岛β细胞功能障碍,保护内源性胰岛β细胞;MSCs还可以分泌多种细胞因子,调节巨噬细胞表型转换,从而减轻炎性反应;此外,MSCs还能通过激活IRS-1/AKT/GLUT4通路改善脂肪、肌肉等组织的胰岛素抵抗,并能够促进肝脏的糖原合成,抑制糖异生,从而降低血糖[8, 16]。MSCs来源外泌体在T2DM中的作用与MSCs类似,同样能够改善肝脏的糖和脂代谢,促进肌肉组织的糖代谢,抑制胰岛β细胞凋亡,从而促进胰岛素分泌等[17]。
MSCs在T2DM中的临床试验也较多,这些临床试验多采用骨髓或脐带来源的MSCs,多数患者在接受静脉或胰腺内MSCs输注后减少了对胰岛素的使用,体内的C肽增加而糖化血红蛋白(hemoglobin A1c,HbA1c)含量则降低,表明MSCs能够改善糖尿病的症状[18]。但是多数临床试验是短期、小规模的,为了证实MSCs在T2DM中的有效性,仍需开展更多更长期的大规模临床试验。
2.4 MSCs在心血管疾病中的研究进展
动脉粥样硬化(atherosclerosis,AS)是以脂质沉积和斑块形成为主要特征的慢性进行性血管炎性反应,是一种与衰老相关的慢性退行性疾病。目前临床上治疗AS仍以调节血脂水平为主,如他汀类药物。研究表明,MSCs具有缓解AS的潜力,主要通过旁分泌作用发挥抗炎和免疫调节的功能[19]。血管内皮细胞(endothelial cell,EC)功能障碍是引起AS的始发因素,由于EC内的一氧化氮合酶(endothelial nitric oxide sythase,eNOS)和一氧化氮失衡,导致细胞内氧化应激水平增高,促进AS的发生[20]。 研究表明,MSCs能够通过增加p-AKT/eNOS来减少氧化损伤,从而抑制EC的凋亡,促进其血管生成。此外MSCs还可以调控血管平滑肌细胞(vascular smooth muscle cell,VSMC)表型转换,调控巨噬细胞由促炎型M1向抑炎型M2表型转换,促进调节性T细胞(regulatory cells,Tregs)的分化等,从而在AS中发挥治疗作用[19,21]。
MSCs来源的外泌体同样对AS有治疗作用。例如有研究发现当EC细胞与BM-MSCs的条件培养基或提纯的外泌体共培养时,外泌体中的肝细胞生长因子(hepatocyte growth factor, HGF)通过MAPK/NF-κB通路下调细胞黏附分子的表达,从而减少巨噬细胞的募集,最终减轻AS模型小鼠的症状[22]。本课题组前期研究发现,MSCs来源的外泌体可以通过调节miR-146a/Src减轻氧化应激诱导的内皮细胞衰老[23]。此外,MSCs来源的外泌体还可促进M2型巨噬细胞的浸润和极化来延缓AS的进展,如通过递送 miR-let7、miR-21a-5p[24-25]等。
MSCs及其来源外泌体在AS等心血管疾病中的临床试验也较多,目前在美国临床实验数据库ClinicalTrials网站注册的正在招募或已完成的有9项,这些临床试验以脐带来源的MSCs(UM-MSCs)或骨髓来源的MSCs(BM-MSCs)为主,通过静脉注射或冠状动脉进行移植,然后通过动脉成像检测斑块大小进行有效性评价等。但是,这些临床试验仍然处于早期,相关研究结果也并未在网站上公布。此外,MSCs的来源、培养过程、预处理及移植方式也是大家共同关注的焦点。
2.5 MSCs在慢性阻塞性肺病中的研究进展
慢性阻塞性肺病(chronic obstructive pulmonary disease,COPD)以持续且不完全可逆的气流受限为特征,表现为肺功能进行性下降,病理特征包括支气管炎或细支气管纤维化和肺气肿[26]。COPD的药物治疗如抗炎药、皮质类固醇激素、β2-肾上腺素受体激动剂等只能缓解症状,对肺功能恶化的逆转和患者生活质量的改善作用比较有限。衰老相关的线粒体功能障碍、细胞间信息交换、蛋白质稳态、细胞外基质失调和氧化损伤都是COPD的发病机制。动物实验显示当MSCs通过外周静脉回输或气管内灌注后30 min即可在肺内检测到,随后的1~3 d逐渐被肺泡巨噬细胞通过胞吞作用清除。MSCs对COPD的作用主要体现在以下两个方面:一是MSCs可以分泌抗炎介质,影响肺上皮细胞和肺内常驻的免疫细胞,如调控肺泡巨噬细胞的表型或活化,进而减轻全身的炎性反应[27];二是MSCs可以减少肺上皮细胞的凋亡,促进肺内多种细胞增殖,从而促进肺的自我修复,改善肺功能[26]。
MSCs来源外泌体在COPD治疗方面也已经有了初步的研究,如人胎盘提取的MSCs来源的外泌体与免疫调节因子混合后在小鼠体内和临床实验中均证实其具有促进抗炎因子释放、减少炎性细胞浸润、改善肺功能等作用[28]。目前在美国临床实验数据库ClinicalTrials网站注册的有12项与COPD有关的MSCs临床试验,这些临床试验进一步证实了MSCs治疗的安全性[29],个别研究结果显示出MSCs可以改善COPD患者的肺功能和生活质量[30]。但是MSCs的来源、剂量、移植管理方式及疾病过程中给药的时机等均会影响其治疗效果,而在这方面的研究尚且缺乏。
2.6 MSCs在肿瘤中的研究进展
肿瘤起源于机体的正常组织,肿瘤的发生与细胞生长调控紊乱有关,基因突变和环境因素是肿瘤发生的内外因素。肿瘤可分为良性肿瘤和恶性肿瘤,后者生长迅速可转移至其他部位,破坏正常器官结构,使机体功能失调甚至威胁生命。恶性肿瘤一直是世界生物医学关注的焦点,它也是一种与衰老相关的疾病,是仅次于心血管疾病的第二大死亡原因。常规的治疗手段包括手术、化学疗法和放射疗法等[31],但是这些治疗方法无法彻底治愈,很容易发生复发和转移。肿瘤的十大生物学基本特征包含持续增殖的信号、逃避生长抑制、抵抗细胞死亡、无限复制的潜能、诱导血管生成、激活侵袭和转移、逃避免疫摧毁、促进肿瘤炎性反应、细胞能量异常以及基因组不稳定和突变[32]。肿瘤微环境包含肿瘤相关成纤维细胞(tumor/cancer associated fibroblast,TAF/CAF)、局部侵袭的免疫细胞、血管及各种细胞外因子等,有研究认为TAF是肿瘤微环境中特异性的MSCs,而TAF与肿瘤的发生发展密切相关,在肿瘤的增殖、迁移、免疫炎性反应和化疗药物抵抗中起重要作用[33]。
目前关于MSCs在肿瘤中的作用有两种截然不同的研究结果[34]。有研究发现MSCs可以增加转移性乳腺癌细胞的侵袭性[35],还可以促进肿瘤血管生成[36]。但也有研究发现MSCs能够抑制肿瘤生长和进程,例如通过抑制肿瘤血管生成,通过细胞间的直接接触来抑制肿瘤细胞增殖等[37]。本课题组对TAF也有长期的研究,最新的一项研究通过单细胞测序解析发现了胃癌患者中两个特定的能够促进肿瘤侵袭的TAF亚群——炎性反应型TAF和细胞外基质型TAF,这两个TAF亚群还能够动员周围的免疫细胞构建利于肿瘤生长的微环境,与患者的不良预后密切相关[38]。除此之外,MSCs的归巢能力使其成为肿瘤治疗潜在药物载体[39],比如可以通过基因改造使MSCs表达或分泌抗肿瘤的物质。MSCs在肿瘤中存在两种截然不同的作用可能与其来源及其分泌因子有关,此外MSCs与肿瘤细胞的相互作用、实验处理条件的差异也会得出不同的结论,因此需要更严格的体内研究来确定其对肿瘤的作用,以促进MSCs靶向治疗的特异性。
MSCs来源的外泌体在肿瘤的发生发展中也起到了很多作用,包括肿瘤血管生成、上皮-间质转换(epithelial-mesenchymal transition, EMT)等。MSCs来源外泌体对肿瘤的作用同样存在争议,大部分研究结果显示其能够通过传递microRNA、激活Wnt通路等机制促进肿瘤的生长和转移,也有报道显示其会通过多种机制抑制肿瘤细胞生长和转移[40],还可作为药物载体在抗肿瘤治疗中发挥作用。因此阐明不同MSCs来源外泌体对各类肿瘤的作用及机制,并解决其质量控制、分离纯化方法及疗效稳定性等问题,有望推进其成为肿瘤治疗的新手段。关于MSCs在肿瘤中临床试验也较多,ClinicalTrials网站注册的13项与肿瘤有关的临床试验所涉及的肿瘤类型既有实体瘤又有血液肿瘤,MSCs的来源既有骨髓也有脐带等,移植途径多为肿瘤部位局部注射,但是在多数临床试验中,MSCs仅作为肿瘤放疗化疗之后的辅助治疗方法进行研究,其有效性结果尚待证实。
3 问题与展望
随着医学的发展,MSCs及其来源外泌体在衰老相关疾病中的研究和临床试验越来越多,其作用效果和机制见图1。然而很多在动物实验中显示出来的MSCs治疗作用到了临床试验阶段却未显示出明显的治疗效果,这可能与MSCs的来源、体外培养方法、移植的途径、剂量等有关。因此,针对不同来源的MSCs可能需要建立不同的质量标准体系,体外扩增培养过程中需要遵循药品生产质量管理规范(Good Manufacturing Practice,GMP)及药品实验室研究质量规范(Good Laboratory Practice,GLP)。MSCs的储存运输、毒性检测、质量评价等也需要建立一系列的标准流程操作文件,才能确保其质量。此外,很多临床试验招募的患者数量较少,为了检测MSCs治疗的安全性和有效性,需要开展更多更大规模的临床试验。
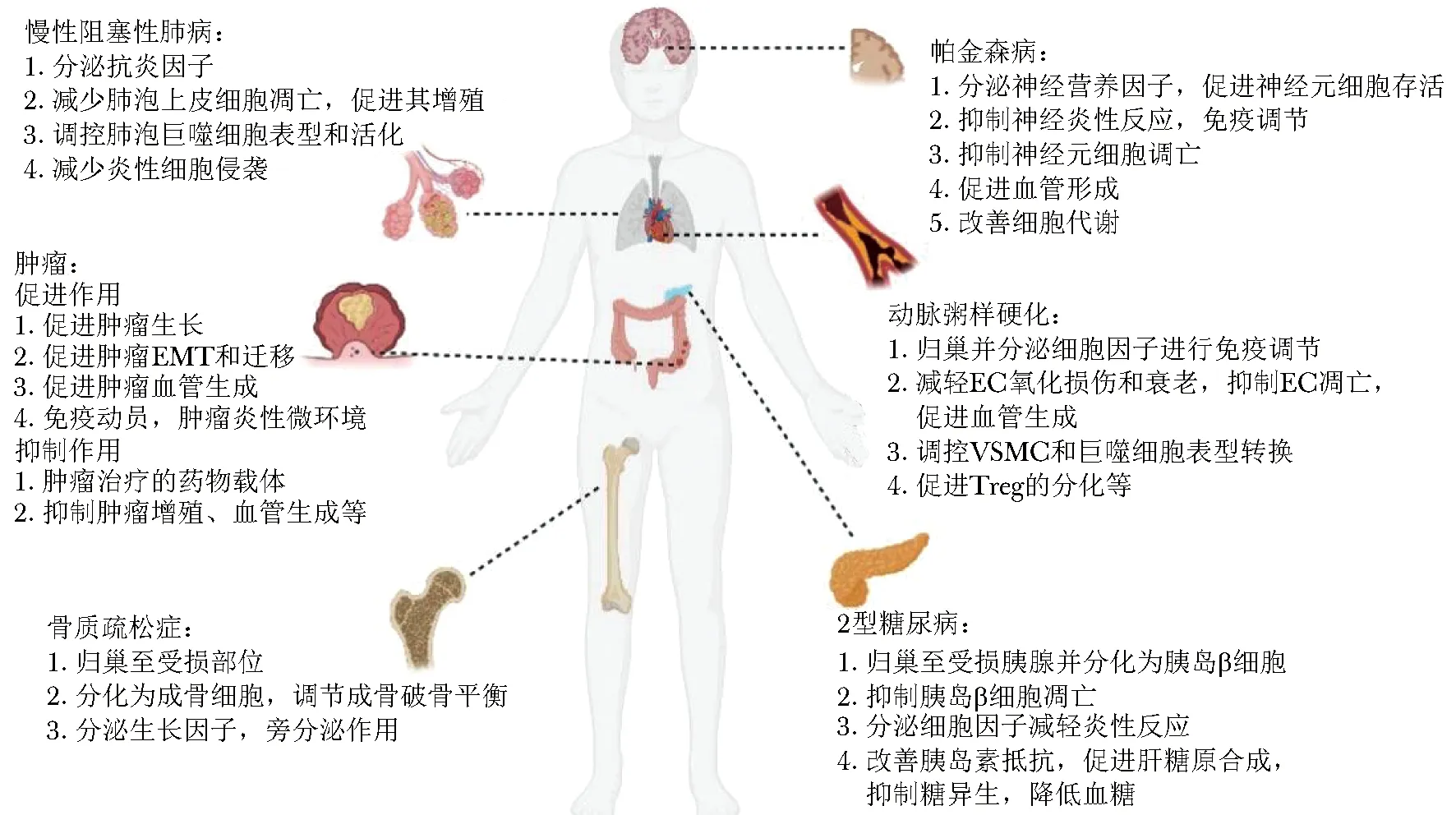
图1 MSCs在衰老相关疾病中的作用机制Fig 1 The mechanisms of MSCs’ therapeutic roles on aging related diseases
很多衰老相关疾病与慢性炎性反应有关,而MSCs具有强大的免疫抑制功能,能够调节体内的炎性反应,这是其在衰老相关疾病中发挥作用的共有机制。研究表明体外培养的MSCs存在细胞衰老及免疫调节能力降低的现象,而一些预处理方法如炎性反应因子IFN-γ和TNF-α预处理、三维材料共培养等能够增强MSCs在体内的免疫调节能力[41-42]。因此探究如何增强MSCs的免疫调节能力及其在不同疾病中的治疗效果是将来研究的热点之一。
MSCs来源的外泌体作为非细胞制剂,是MSCs旁分泌的一种主要成分,具有分子结构小、生物相容性好、不会引起机体的免疫反应等优点, 因此同样备受瞩目。此外,外泌体比细胞小, 更易通过血脑屏障,可作为产品低温保存, 在需要时可以解冻后使用, 不存在移植细胞存活率低的困扰。外泌体还具有天然分子的转运特性,可以被修饰后加载有利于组织修复的miRNA等小分子再传递到靶细胞中。因此, MSCs来源外泌体更具有产业化和临床应用的前景。但是如何分离并获得质量均一的外泌体是其应用的关键之一,外泌体的大规模生产以及存储的方法也需要进一步研究优化。
