间充质干细胞的免疫调节可塑性及其临床应用策略
2023-01-18汪海燕赵春华
汪海燕,韩 钦,赵春华
中国医学科学院基础医学研究所 北京协和医学院基础学院 组织工程中心,北京 100005
间充质干细胞(mesenchymal stem cells, MSCs)是一种纺锤状的具有塑料吸附性的多能干细胞,它具有自我更新、多向分化和免疫调节能力。MSCs可从多种组织中分离获得,如脂肪、骨髓、胎盘、脐带、沃顿氏胶、子宫内膜、芽牙组织和牙龈等。国际细胞治疗学会(ISCT)定义经典培养条件下的MSCs为贴壁生长,高表达CD105、CD73和CD90,低表达CD45、CD34、CD14、CD11b、CD19和HLA-DR,能够在体内外分化为成骨细胞、脂肪细胞和软骨母细胞的细胞[1]。MSCs的免疫调节能力赋予它应用于多种衰老和炎性反应相关疾病治疗的潜力。因MSCs低表达HLA分子,同种异体来源的MSCs产品在临床试验中也表现出了极高的安全性[2]。基于其易获取、易培养、多种免疫调节能力和低免疫原性的特点,MSCs有希望成为临床上治疗组织损伤和免疫紊乱的药物。
然而MSCs疗法的临床试验结果并没有达到临床前试验预期的效果,限制MSCs临床疗效的因素包括:1)细胞生产过程中产生生物学效力异质性;2)不同给药途径下不可控的体内分布和有限的半衰期;3)在不同宿主体内的效力难以预测[2]。MSCs产品的异质性和效力评估问题的解决需要基于对MSCs免疫调节功能机制的充分了解,而目前的研究对于MSCs的免疫调节能力(包括免疫支持作用和免疫抑制作用)在不同微环境下的可塑性的认识仍不充分,这造成了MSCs产品在临床应用中生产标准不统一和疗效难以预测的问题[3]。因此阐明MSCs免疫调节功能的相关机制是应对临床挑战时需要解决的重要问题。
1 MSCs的免疫抑制功能及机制
MSCs凭借其免疫抑制功能在多种炎性反应主导的疾病中有治疗潜力。MSCs可以通过局部注射的方式直接调节局部免疫反应,治疗局部损伤相关疾病(比如皮肤损伤、心肌梗死和脑部疾病等);也可以通过静脉注射的方式(被阻截在肺部毛细血管)调节肺部和循环中的免疫细胞表型,治疗组织急性炎性反应和系统性的免疫失调(如GVHD和自身免疫病)[4]。
随着多组学技术的流行和成熟, MSCs在治疗炎性疾病中的作用也得到了更系统、更细致的描述。在急性肺损伤(acute lung injury, ALI)小鼠模型中,MSCs输注通过抑制肺部M1巨噬细胞分泌趋化因子,显著减少了CD38+树突状细胞(DC)在肺部的富集[5]。对于COVID-19患者,MSCs输注促进了SARS-CoV-2特异性抗体的维持,将表达CSF3R和PTPRE的VNN2造血干/祖细胞样细胞(HSPC)动员起来[6]。在小鼠伤口切除模型中,静脉输注的MSCs虽然很快在肺部被清除,但伤口处的固有免疫细胞在治疗后表现出独特的转录变化,MSCs分泌的多种因子诱导了促血管生成的CD9+巨噬细胞增加[7]。
MSCs能调节多种免疫细胞的活力和功能(图1)。对于固有免疫系统,MSCs能够抑制自然杀伤细胞(natural killer cell,NK细胞)的增殖和细胞毒性[8],诱导单核/巨噬细胞向M2型极化;对于适应性免疫系统,MSCs能够抑制DC成熟和抗原提呈反应,诱导DC的调节性表型,抑制T、B淋巴细胞增殖,抑制B细胞产生抗体,抑制T辅助细胞1/17(Th1/Th17)的分化和促炎表型,诱导T调节性细胞(Treg)和B调节性细胞(Breg)产生等[9]。
根据作用方式,可将MSCs免疫抑制功能的分子机制大致分3种:旁分泌作用、细胞-细胞直接接触和由单核/巨噬细胞的胞葬作用介导的间接作用。
1.1 旁分泌作用
1.1.1 可溶性因子:MSCs在炎性环境下会分泌多种具有抑炎作用的可溶性因子,比如研究较多的吲哚胺2,3双加氧酶(IDO)、肿瘤核因子刺激基因-6(TSG6)和前列腺素2(PGE2)可以诱导多种免疫细胞产生抗炎或耐受性的表型[9]。还有一些抑炎细胞因分子,如转化生长因子β(TGF-β)、白细胞介素10(IL-10)和白细胞介素1受体拮抗剂 (IL-1Ra)也参与了MSCs对T细胞、B细胞、巨噬细胞抑炎表型的诱导作用[10]。还有一些研究相对较少的分子也被证明介导了MSCs的免疫抑制作用。Chen等报道了STC2(stanniocalcin-2)在MSCs中高表达,STC2通过调节血红素氧化酶-1(HO-1)活性而减少了过敏性接触性皮炎(ACD)模型中CD8+T细胞的数量[11]。在溃疡性结肠炎中,腹膜内注射MSCs通过分泌半乳糖凝集素3(Gal-3)而抑制DCs的促炎表型[12]。静脉输入的MSCs通过分泌干扰素β(IFN-β)促进DCs产生IL-27,从而恢复NOD小鼠的Th17/Treg平衡[13]。
1.1.2 细胞外囊泡:细胞外囊泡(extracellular vesicles,EVs)依据直径大小不同分为100~1 000 nm的微囊泡(microvesicles)和30~200 nm的外泌体(exosomes),EVs富含细胞生物活性因子(mRNA、microRNAs、酶、 细胞因子、趋化因子、免疫调节因子和生长因子等),可调节免疫细胞的表型、功能、生存和归巢。大量研究证实,MSCs来源的EVs(MSC-EVs)中富含可溶性抑炎分子和非编码RNA,在治疗多种炎性疾病和自身免疫病中发挥了重要作用[14]。
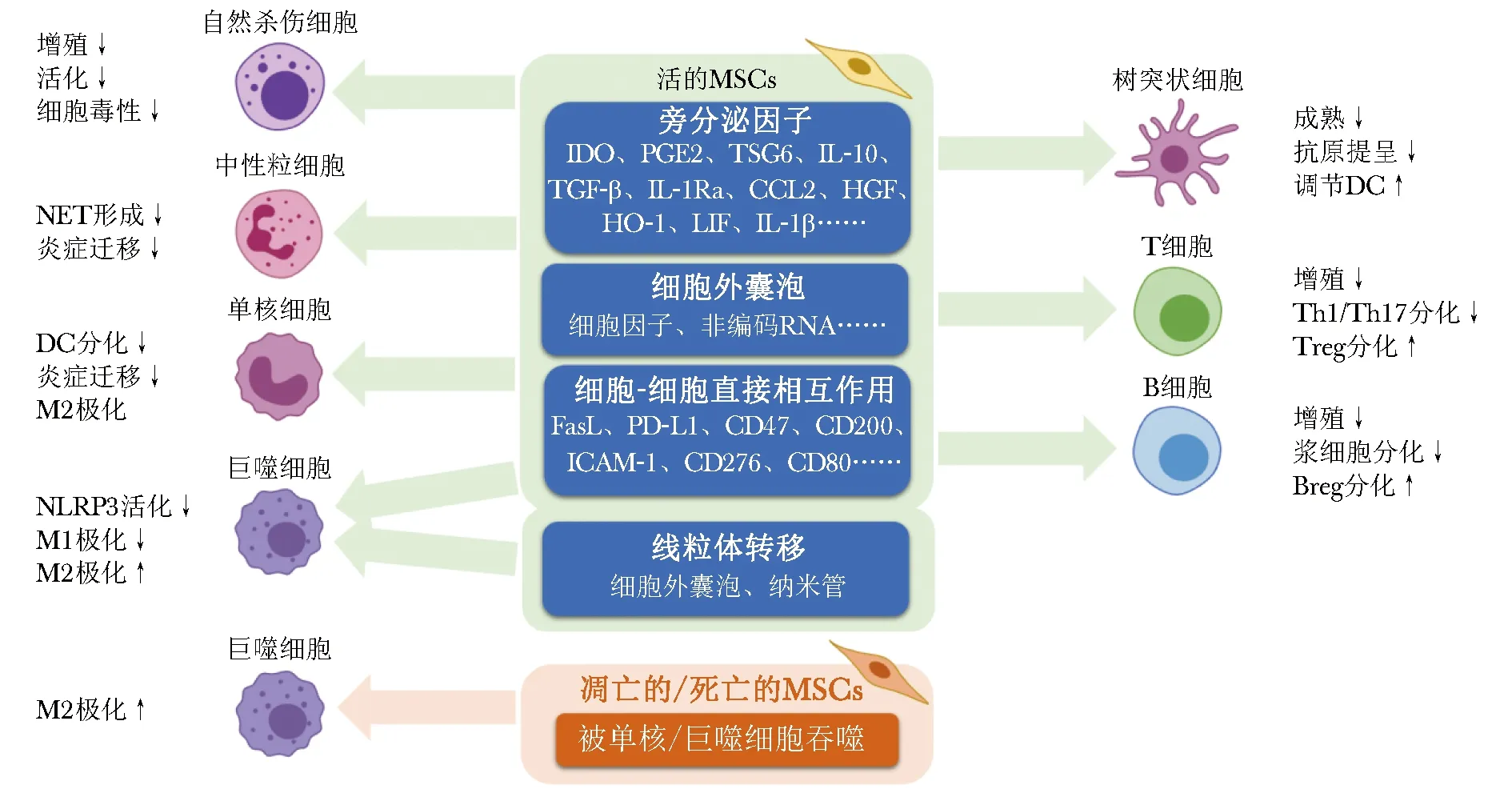
图1 MSCs的免疫抑制功能Fig 1 Immunosuppressive function of MSCs
MSC-EVs作用的免疫靶细胞中研究最多的是巨噬细胞,MSC-EVs通过调节组织驻留巨噬细胞表型向M2型倾斜,在多种疾病中表现出改善炎性反应的作用[15]。MSC-EVs还可以抑制DC细胞成熟和活化,诱导DCs释放IL-10和TGF-β,诱导Treg的扩增以及抑制效应T细胞和B细胞[16]。MSC-EVs中含有丰富的功能分子,除了抑炎蛋白,还有许多具有抑炎功能的miRNA[17]。EVs作为一种无细胞产品,在未来具有替代细胞治疗的潜力,为MSCs疗法提供了一种可行的策略。
1.2 细胞-细胞直接接触
许多研究揭示了MSCs与免疫细胞之间的直接相互作用也一定程度上介导了MSCs的免疫抑制功能。在与巨噬细胞的相互作用中,MSCs能够通过直接接触启动巨噬细胞的Hippo-YAP信号,抑制XBP1介导的NLRP3活化[18];还可以通过CD47和巨噬细胞表面的信号调节蛋白SIRPα相互作用,启动巨噬细胞内的Hedgehog/SMO/Gil1信号通路,抑制NEK7介导的NLRP3活化[19]。而MSCs与M1型巨噬细胞之间的直接接触也可增加MSCs分泌的TSG-6、上调MSCs表面CD200的表达,CD200与M1巨噬细胞表面的CD200R相互作用,进一步促进巨噬细胞向M2型极化[20]。
细胞-细胞直接接触也参与了MSCs对T细胞的抑制作用。炎性反应激活的MSCs可上调表达黏附分子ICAM-1,通过与免疫细胞表面的CD43相互作用以增强MSCs和T细胞的相互作用[21]。CD276与B7-H3的相互作用也可能参与MSCs对T细胞的抑制作用[22]。经典的凋亡受体-配体也被证明参与了MSCs诱导T细胞凋亡的过程[9]。最近,Mittal等报道了CD80在MSCs接触依赖性诱导Treg增加的过程中发挥的作用,敲低CD80可消除MSCs对FoxP3的诱导和Treg介导的T细胞增殖抑制,影响MSCs在角膜移植中的治疗效果[23]。
1.3 线粒体转移
2006年Spees等首次报道了在MSCs中细胞间的线粒体转移现象,此后越来越多的证据表明,细胞间的线粒体转移是挽救功能障碍的受体细胞、实现细胞间能量交换的重要途径。线粒体转移涉及各种机制,包括形成纳米管(tunneling nanotube,TNT)、分泌微囊泡、间隙连接和细胞融合等[24]。MSCs作为组织稳态的维持者,线粒体转移作用也是MSCs调节功能的作用机制中不可忽略的一项[25]。在免疫调节方面,MSCs可通过TNT或分泌EVs的方式将线粒体转移到巨噬细胞中,增强巨噬细胞的氧化磷酸化(OXPHOS)、吞噬作用和抗炎表型[25-26]。Th17细胞摄取MSCs的线粒体后也可能导致OXPHOS和抗炎表型的增加[27]。Treg摄取活性线粒体后可通过增强氧化磷酸化、提高能量产生的方式增强免疫抑制潜力[28]。Lu等发现MSCs可通过EVs将功能性线粒体转移到肝内嗜中性粒细胞并修复其线粒体功能,抑制局部NETs的形成,对缺血再灌注肝损伤有治疗作用[29]。
1.4 凋亡的和死亡的MSCs
许多研究报道了凋亡的MSCs在脓血症、急性肺缺血再灌注损伤和急性肾损伤等多个疾病模型中均具有与正常活性的MSCs近似的治疗效果[30]。Luk等发现热灭活的MSCs虽然不能在MLR中抑制T细胞增殖,但静脉注射后能够降低LPS诱导的炎性反应,升高IL-10的血清水平[31]。这些现象表明凋亡的、甚至死亡的MSCs有可能也参与了MSCs在炎性反应疾病中的治疗作用。
凋亡的或死亡的MSCs介导的免疫抑制作用需要单核/巨噬细胞的参与。吞噬细胞清除凋亡细胞的过程称为胞葬作用(efferocytosis),凋亡的MSCs被巨噬细胞吞噬后可改变巨噬细胞的代谢和炎性反应状态,从而发挥免疫抑制作用。最近的研究发现自然凋亡的MSCs在小鼠急性肝损伤模型中也具有和正常的MSCs相当的保护作用,推测是细胞凋亡时磷脂酰丝氨酸(PS)的释放介导了单核巨噬细胞的M2极化作用[32]。Zheng等发现MSCs在凋亡时释放的凋亡囊泡(apoVs)仍然能够通过胞葬作用依赖性的方式调节肝脏巨噬细胞的表达谱,缓解2型糖尿病(T2D)的症状。apoVs是通过钙网蛋白(calreticulin,CRT)的暴露向巨噬细胞发出“吃掉我”的信号[33]。凋亡或死亡的MSCs停止代谢,因此比正常活性的MSCs可控性和安全性更高。这些研究结果对于MSCs的治疗机制提出了新的见解,凋亡的或死亡的MSCs产品可能成为MSCs临床应用的策略之一。
2 MSCs的免疫支持作用及机制
MSCs不仅能够抑制炎性反应的进展,同时还能够支持免疫细胞的正常功能。例如在炎性反应较弱时,MSCs分泌的趋化因子可以招募免疫细胞浸润,维持机体正常的免疫应答。在感染引起的急性炎性反应中,MSCs还能够增强先天免疫细胞的功能以增强机体的抗菌抗病毒能力,例如抑制中性粒细胞和NK细胞的凋亡,通过多种途径将线粒体转移到巨噬细胞中以赋予它们额外的生物能,增强其吞噬能力[34]。这些作用赋予了MSCs 在炎性疾病治疗领域独特的优势。
除此之外,MSCs对T细胞具有保护作用。一些研究报道了MSCs分泌的IL-7对T细胞存活具有保护作用[35]。Xiong等报道了人胎盘MSCs衍生的外泌体(hPMSC-Exo)中的miR-21能够通过启动PTEN/PI3K-Nrf2信号降低衰老CD4+T细胞中的氧化应激损伤[36]。在MSCs治疗COVID-19的研究中发现,MSCs的输注促进了SARS-CoV-2特异性抗体的维持,表达CSF3R和PTPRE的VNN2造血干/祖细胞(HSPC)样细胞在MSCs输注后被动员起来,MSCs处理还增加了体内和体外T细胞中共刺激分子CD28的表达[6]。
MSCs与免疫抑制剂的联合用药能够减轻免疫抑制剂对免疫系统造成的不良反应。Bassani等报道了aGVHD患者骨髓中缺少CD40+MSCs,在骨髓移植中促炎因子可诱导BM-MSCs表达CD40,CD40抑制了OX40L的表达并有助于恢复Treg稳态,从而促进了B细胞的正常发育,维持骨髓稳态[37]。He等在淋巴结中发现了具有免疫支持功能的MSCs(LNMSCs),与BM-MSCs不同,它们产生并分泌高水平的MCP-1以促进T细胞增殖和分化,全身输注LNMSCs可挽救CTX处理引起的小鼠的免疫抑制[38]。
正如上述,MSCs既能够抑制免疫细胞的过度免疫应答和增殖,又能分泌趋化因子促进免疫细胞向炎性反应部位归巢、支持免疫细胞的存活。MSCs的作用综合表现为抑炎还是促炎,一定程度上可能取决于MSCs分泌物的组成成分;MSCs的治疗效果还在很大程度受到患者自身炎性反应状态的影响[9]。希望在未来能够调控MSCs的促炎和抑炎能力从而实现更好、更精准的治疗效果,因此如何调节和评估MSCs的免疫调节能力是研究MSCs免疫调节作用机制时需要关注的重要问题。
3 MSCs的免疫分型机制
许多因素会影响MSCs的免疫调节能力,但究竟是什么分子机制决定了MSCs的免疫调节表型一直没有完全明确。时玉舫等于2014年提出了“NO和IDO是MSCs免疫调节功能‘on-off’的开关”的假说[39]:高水平的促炎因子存在时,MSCs会表达高水平的IDO和iNOS,展现出免疫抑制能力;而低水平的促炎细胞因子虽足以诱导MSCs上调趋化因子的表达,却不能诱导足够水平的IDO和iNOS,这会造成免疫细胞的浸润却不能抑制免疫反应的进行,即炎性反应增强。
还有一种假说认为TLR活化类型决定了MSCs的免疫调节表型:Waterman等研究发现,使用dsRNA(polyI:C)活化MSCs表面的TLR3,MSCs会分泌大量的抑炎分子,抑制T细胞增殖,促进Treg产生;而使用LPS活化MSCs表面的TLR4后,MSCs产生抑炎分子的水平远低于TLR3活化的MSCs,并且分泌很多单核/巨噬细胞和中性粒细胞趋化因子,增强T细胞介导的免疫反应[40]。但这种假说没有得到更多的有力证据支持。Beldi等的研究认为TNF-α/TNFR2轴可作为MSCs免疫功能的一个检查点(checkpoint),TNFR2与MSCs抑制T细胞增殖、活化、分泌促炎因子和诱导Treg的能力密切相关[41]。
4 增强MSCs免疫调节功能的策略
4.1 预激活
在MSCs输注前使用炎性反应因子或药物处理的方法模拟炎性反应微环境,预先启动MSCs免疫抑制功能称之为预激活(preactivation),该处理可以获得生物学效力更高的细胞产品,使细胞进入体内后立即发挥强大的免疫调节作用。
4.1.1 炎性反应介质:IFN-γ和TNF-α(或IL-1β)是对MSCs免疫抑制能力有诱导作用的促炎细胞因子。被IFN-γ和TNF-α刺激的MSCs会通过上调一系列趋化因子和抑炎分子(IDO、iNOS、TSG6等)的表达来增强其免疫抑制能力,使用促炎因子处理MSCs可能有助于减少供体依赖性的免疫抑制能力的差异[42]。4种炎性反应因子(IFN-γ、IL-17、IL-1β、TNF-α)联合预处理的脐带血来源MSCs(CBti MSCs)表现出增强的糖酵解能力、免疫调节能力和归巢特性,即使在冻存-复融后仍能保证这种状态,有效改善GVHD小鼠的预后[43]。IL-1α和IL-1β的联合可导致MSCs产生更高水平的G-CSF、IL-10和具有抑炎功能的外泌体[44]。
4.1.2 筛选药物:以已知的MSCs免疫调节机制为基础,在临床获批的药物或丰富的天然提取物单体分子库中筛选比促炎因子更稳定、更有效的小分子药物来增强MSCs免疫调节能力,也是一种提高MSCs临床治疗效力的策略。Triptolide(TPL)是一种从中草药中提取的三乙醇三萜纯化物,已被证明在体外具有抗炎的作用,He等研究发现低浓度的TPL预处理UC-MSCs,能够在不影响UC-MSCs表型和增殖活力的情况下,在体外明显提高UC-MSCs中TGF-β、PD-L1和IFN-γ诱导的IDO的表达增加[32]。Deng等筛选出了一种能够增强MSCs抑炎功能的小分子化合物——氯唑沙宗(chlorzoxazone,CZ),CZ不会像炎性反应因子那样增加MSCs的免疫原性,从而赋予了MSCs更持久、更好的疗效[45]。
总而言之,预激活的策略操作简单、效果显著且不存在明显的安全性问题,是临床试验中应用最多的策略。在筛选预激活药物时应综合考虑激活效果、持久性和引起MSCs免疫原性增加等多个因素。
4.2 调整代谢状态
4.2.1 能量代谢:在巨噬细胞中,炎性反应会使代谢倾向糖酵解途径,有助于促炎因子的产生。炎性反应环境也会上调MSCs的糖酵解途径,但这有助于抑炎分子的表达,例如IDO和PGE2[46]。Killer等报道了丙戊酸(VPA)可增强MSCs的糖酵解、细胞呼吸和免疫抑制活性[47]。Contreras-Lopez等则报道促炎细胞因子通过抑制ATP合酶的活性诱导了MSCs中AMPK依赖性的糖酵解增加,ATP合酶抑制剂处理有助于增强MSCs的免疫抑制能力和治疗效果[48]。Jitschin等报道在MSCs中,糖酵解通过STAT1糖基化来促进IDO的表达[49]。这些研究都说明了糖酵解水平对MSCs抑炎能力的重要性。
4.2.2 氧化还原稳态:氧化应激,即一种由自由基(活性氧ROS和活性氮RNS)积累,并与细胞损伤、器官衰竭和衰老过程有关的病理生理状态。MSCs对氧化应激具有很强的抵抗力,并通过表达还原酶(超氧化物歧化酶、谷氨酸过氧化物酶、过氧化氢酶、sirtuins、HO-1)、非酶清除(还原谷胱甘肽、HIF-1α、热休克蛋白、核因子)、抗氧化剂和细胞保护防御来应对[50]。这些调节氧化还原状态的活动与MSCs的免疫调节作用同时发生,可以促进MSCs和组织细胞的存活,也可能增强MSCs的免疫调节能力。例如使用CREB启动剂FSK处理MSCs上调CREB1-NRF2轴的活化可以提高细胞的GSH水平,从而增强MSCs的增殖能能力、对PDGF的趋化性和抑制CD3+T细胞增殖的能力[51]。
4.2.3 自噬水平:Gao等提出MSCs的自噬水平能通过影响TGF-β1分泌来调节对CD4+T细胞的增殖抑制能力,雷帕霉素(自噬活化剂)处理过的MSCs抑制T细胞增殖的能力更强[52]。但是在另一项研究中,IFN-γ和TNF-α刺激启动了BECN1/Beclin 1依赖的自噬反应,自噬通过减少活性氧产生而降低了PGE2的表达,从而抑制了MSCs对T细胞的免疫抑制[53]。最近他们又报道了IFN-γ和TNF-α诱导的AKT活化下调了伴侣介导的自噬(CMA),进而促进了CXCL10和iNOS的表达,CMA缺陷的MSCs在炎性肝损伤中表现出了更好的治疗效果[54]。MSCs的自噬能力可能与其在炎性反应环境下上调免疫抑制的能力存在关联,是临床前强化MSCs抑炎状态的候选靶点之一。自噬在 MSCs免疫调节功能中发挥的作用也需要更多的深入研究。
4.3 优化培养基质
细胞外基质的成分和形态也会影响MSCs的免疫调节能力。Wong等利用模拟骨髓生物物理参数的水凝胶作为MSCs培养基质,结果显示软细胞外基质能最大限度地提高骨髓来源的MSCs(BM-MSCs)产生旁分泌因子的能力[55]。3D培养可以增强MSCs的干性和旁分泌功能。Regmi等生产的MSCs 3D微球比2D培养的MSCs分泌更高水平的PGE2,对结肠炎的治疗效果也更好[56]。Deng等生产的人胚胎来源的MSC-3D球显示出抗炎因子和营养因子的分泌显著增加,在脊髓损伤治疗上展现出更大潜力[57]。因此,优化MSCs体外扩增的培养基质也是增强其生物学效力的一个策略。
4.4 鉴定和筛选生物学效力更强的MSCs
利用塑料黏附特性和体外培养的方法分离得到的MSCs在细胞形态、生理学和功能方面表现出显著差异,这造成了MSCs的异质性[58]。在应用MSCs前,鉴定和筛选效力更高的细胞群有助于预测和提升MSCs的治疗效果。一些研究提出了有潜力的MSCs免疫功能标志物。CD146+BM-MSCs在炎性反应刺激时显示出更高的分泌能力,并且在炎性反应启动时具有更大的免疫调节能力,对T细胞和巨噬细胞有更强的调节能力[59]。最近Zhang等对BM-MSCs和WJ-MSCs单细胞测序分析得到了5个特征亚群,其中高表达CD106(VCAM-1)、CD248、CD105和LAMP2的软骨前体细胞亚群表达更高水平的免疫应答相关基因,CD106+细胞在体外也比CD106-细胞表现出了更强的T细胞增殖抑制能力[60]。Xie等对不同供体来源的BM-MSCs的单细胞测序分析结果鉴定了CMKLR+亚群可能代表了免疫调节能力更强、成骨分化潜力更大但增殖能力更弱的MSCs[61]。一些综述文章中总结了其他更多的潜在分子标志物,如CD200、CD271、GSTT1等[62]。
4.5 使用MSCs衍生的非活细胞产品
MSC-EVs作为一种无细胞产品,能够克服MSCs需要面对的不可控分化、微脉管系统的阻塞风险或引起免疫排斥等安全性问题,而且成分稳定,不易受宿主微环境影响,因而疗效将会比细胞产品更易预测[63]。迄今有许多研究表明,MSC-EVs中含有MSCs分泌的功能活性分子,在炎性反应动物模型中显示出与细胞治疗相似的效果[64]。因此开发基于MSC-EVs的疗法可能成为有潜力的MSCs治疗的替代方案,目前已有大量应用MSC-EVs治疗的临床试验正在进行中。无论是静脉注射、皮下注射还是其他给药方法,MSC-EVs都会在短时间内从体内代谢出去,在未来还需要积极研究延长MSC-EVs在体内半衰期的技术。
正常有活力的MSCs或许不是MSCs疗法所必需的,直接制备凋亡MSCs或MSCs碎片产品是未来可以尝试研究的一种细胞疗法替代策略,因为它们比活细胞更易于进行标准化生产和效力评估。凋亡的MSCs衍生的EVs也被证明具有治疗潜力[33]。但是目前对于凋亡或死亡MSCs产品的功能机制还缺乏充分的理解,如何诱导细胞凋亡和失活也没有形成统一的规范,未来应继续深入探索凋亡或死亡的MSCs产品在临床前模型中的应用效果和作用机制,为临床试验积累经验。
以上增强MSCs生物学效力的策略是基于MSCs免疫调节功能的可塑性机制提出的(总结如图2)。使用促炎因子或其他药物对MSCs进行预激活是目前研究和应用最多的策略,但这种方法仍没有去除细胞生产过程中产生的MSCs生物学效力的异质性;调整细胞的生理状态、优化培养基质、效力筛选、基因工程、多能化诱导以及使用非活细胞产品的策略仍在临床前试验甚至实验室探索阶段,明确MSCs免疫调节功能的强化策略还有很长的路要走。
5 总结
MSCs来源广泛、易于获取和扩大培养、免疫原性低、兼有多向分化和免疫调节作用,这些优点使得MSCs成为细胞疗法中的优势候选者。MSCs的免疫调节作用作为其核心功能,既能够维持机体正常的先天免疫应答和免疫调节功能,表现为免疫支持作用;也能够通过直接或间接的方式抑制炎性反应的过度发展,表现为免疫抑制作用,在抗感染的同时保护正常组织免受免疫系统的攻击。因此人们对MSCs用于各种炎性疾病和免疫失调类疾病寄予很高的期望,在多种相关疾病中进行干细胞移植的尝试,最近MSCs还在代谢性和神经退行性疾病中显示出益处[65]。
目前的MSCs临床试验结果提示我们对于MSCs免疫调节功能的理解还不够充分,围绕MSCs的免疫调节功能可塑性相关的科学问题还有待研究和挖掘,未来的研究仍需寻找MSCs免疫调节功能的关键控制点和检查点,在临床研究中优化细胞培养和移植策略,了解不同类型疾病、不同患者对于治疗的反应和效果。希冀基础与临床研究相结合,最大化MSCs的治疗效果和优势,最终建成一套灵活有效的MSCs治疗免疫失调疾病的规范。

图2 MSCs免疫抑制能力增强策略Fig 2 Strategies to enhance the immunosuppressive capacity of MSCs
