敲低CTCF对5-氟尿嘧啶、顺铂耐药结直肠癌细胞恶性生物学行为的影响及其机制
2023-01-17王蓉荻郭旭徐孟
王蓉荻,郭旭,徐孟
大连市中心医院肛肠外科,辽宁大连 116000
结直肠癌(CRC)是消化系统常见的恶性肿瘤之一,其发病率居全球恶性肿瘤第三位,死亡率居全球恶性肿瘤第二位。近年来,随着人们生活水平提高和生活方式转变,我国CRC 的发病率逐年升高[1]。CRC 早期症状隐匿,缺乏特异性临床表现,约85%患者就诊时已处于中晚期。化疗是中晚期CRC 的重要治疗手段,常用的化疗药物有5-氟尿嘧啶(5-Fu)、顺铂(DDP)等,但药物积累可诱导肿瘤细胞中多药耐药基因表达,从而导致化疗耐药[2]。化疗耐药是导致CRC 治疗失败的重要原因。CRC 化疗耐药的机制非常复杂,可能与编码外排泵的基因表达改变、分泌外泌体、血管生成关键信号通路激活等有关[3]。CCCTC 结合因子(CTCF)是含有11 个锌指结构的多功能转录因子,尽管长度超过700 个氨基酸,但其高度保守[4]。有研究报道,CTCF 异常表达或其靶基因失调能够引起多种恶性肿瘤的发生、发展,如乳腺癌、肝细胞癌、CRC 等[5-7]。KATAINEN等[8]研究发现,在CRC 细胞中CTCF 基因突变率较高,该基因突变可能参与CRC 化疗耐药。但目前鲜见相关报道。2020年8月—2022年1月,本研究探讨了敲低CTCF 对5-Fu、DDP 耐药CRC 细胞恶性生物学行为的影响及其机制。现报告如下。
1 材料与方法
1.1 材料 CRC 耐药细胞株HT29/5-Fu、HT29/DDP,购自江西江蓝纯生物试剂有限公司。5-Fu(纯度≥99.0%)、DDP(纯度≥98.5%),购自北京索莱宝科技有限公司。CTCF 短发夹RNA 质粒(shCTCF)、对照短发夹RNA 质粒(shControl)由广州艾迪基因科技有限责任公司合成。Multiskan GO 全波长酶标仪,购自美国Thermo Fisher 公司;JY5000 型高压电泳仪,购自北京君意东方电泳设备有限公司;FACS⁃Calibur 流式细胞仪,购自美国BD 公司;Transwell 小室,购自美国Corning 公司。Annexin V-FITC/PI 细胞凋亡检测试剂盒,购自江苏碧云天生物技术有限公司。MTT、结晶紫,购自北京鼎国昌盛生物技术有限责任公司;兔抗鼠CTCF、补缀同源物1(PTCH1)、补缀同源物2(PTCH2)、胶质瘤相关癌基因同源蛋白1(GLI1)、音猬因子(SHH)、β-actin 单克隆抗体及辣根过氧化物酶标记的鼠抗兔IgG 二抗,购自美国Cell Signaling Technology 公司。
1.2 细胞传代培养 将HT29/5-Fu、HT29/DDP 细胞接种于含10% FBS 的RPMI 1640 培养基,置于37 ℃、5% CO2、饱和湿度的细胞培养箱培养。每2~3 天换液一次。待细胞生长融合85%左右时,用0.25%胰蛋白酶消化,按1∶3 传代。取传3 代、对数生长期、生长状态良好的细胞进行后续实验。
1.3 5-Fu、DDP 最佳作用浓度筛选 取传3 代、对数生长期、生长状态良好的HT29/5-Fu 细胞和HT29/DDP 细胞接种于96 孔板,每孔5 × 103个,置于37 ℃、5% CO2、饱和湿度的细胞培养箱培养24 h。HT29/5-Fu 细胞分别加入2、4、8、16 mg/L 5-Fu,HT29/DDP 细胞分别加入0.5、1、2、4 mg/L DDP,另设阴性对照孔(不加入5-Fu 或DDP)、空白对照孔(仅有培养基,无HT29/5-Fu 细胞或HT29/DDP 细胞),每个浓度设6 个复孔,继续培养48 h。然后每孔加入5 mg/L MTT溶液20 μL,37 ℃孵育2 h。小心吸弃孔内培养上清液,加入DMSO溶液200 μL,轻轻振荡,使结晶物充分溶解。酶标仪于450 nm 波长处检测各孔的光密度(OD)值,按公式计算细胞存活率。细胞存活率=1-[(实验孔OD450值-空白对照孔OD450值)/(阴性对照孔OD450值-空白对照孔OD450值)]× 100%。选择HT29/5-Fu、HT29/DDP 细胞半数抑制活性(IC50)时5-Fu 或DDP 浓度进行后续实验。
1.4 细胞转染 取传3 代、对数生长期、生长状态良好的HT29/5-Fu细胞和HT29/DDP细胞,接种于6孔板,每孔2 × 105个,随机分为HT29/5-Fu shCTCF组与HT29/5-Fu shControl 组、HT29/DDP shCTCF 组与HT29/DDP shControl 组,每组设3 个复孔。然后将6 孔板置于37 ℃、5% CO2、饱和湿度的细胞培养箱培养24 h,根据Lipofectamine®2000 说明,HT29/5-Fu shCTCF 组与HT29/DDP shCTCF 组转染shCTCF,HT29/5-Fu shControl 组与 HT29/DDP shControl 组转染shControl。转染6 h 更换新鲜培养基,继续培养24 h,收集细胞,用于后续实验。
1.5 CTCF蛋白表达检测 取各组上述转染后细胞4 × 106个,置于离心管中,加入适量的Western 及IP细胞裂解液,提取细胞总蛋白。经BCA 法蛋白定量合格,加入适量5 × SDS-PAGE 凝胶上样缓冲液混匀,100 ℃水浴5 min,使蛋白充分变性。取变性蛋白30 μg,SDS-PAGE 分离(10%分离胶、5%浓缩胶)。电泳结束,采用湿转法将蛋白电泳产物转印至PVDF膜上。5%脱脂奶粉室温封闭1 h,分别加入兔抗鼠CTCF、β-actin 单克隆抗体,4 ℃孵育过夜。次日,滴加辣根过氧化物酶标记的鼠抗兔IgG 二抗,室温孵育1 h。ECL 发光,暗室内曝光、显影。采用Amersham Imager 600 凝胶成像系统拍照,Image J 软件分析各蛋白电泳条带灰度值。以β-actin 为内参,以目的蛋白电泳条带灰度值与内参蛋白电泳条带灰度值的比值作为目的蛋白相对表达量。
1.6 细胞存活率检测 取各组上述转染后细胞,接种于96 孔板,每孔5 × 103个,置于37 ℃、5% CO2、饱和湿度的细胞培养箱培养。培养24 h,HT29/5-Fu shCTCF 组与HT29/5-Fu shControl 组分别加入最佳作用浓度的5-Fu,HT29/DDP shCTCF 组与HT29/DDP shControl 组分别加入最佳作用浓度的DDP,然后置于37 ℃、5% CO2、饱和湿度的细胞培养箱培养。分别于培养24、48、72 h,每孔加入5 mg/L MTT 溶液20 μL,37 ℃孵育2 h。小心吸弃孔内培养上清液,加入DMSO 溶液200 μL,轻轻振荡,使结晶物充分溶解。酶标仪于450 nm 波长处检测各孔的OD 值,按1.3中公式计算细胞存活率。
1.7 细胞侵袭能力检测 取各组上述转染后细胞,用不含血清的培养基重悬,制成密度为2 × 105个/mL细胞悬液。取细胞悬液200 μL,加入Transwell 小室上室,下室加入600 μL含15% FBS的培养基。37 ℃孵育48 h,取出Transwell小室,用棉签轻轻拭去上室面未穿膜细胞,90%乙醇固定30 min,0.1%结晶紫染色15 min,显微镜下拍照。随机选取5个200倍不重叠视野,计数每视野穿膜细胞数。以穿膜细胞数代表细胞侵袭能力。
1.8 细胞凋亡检测 取各组上述转染后细胞,接种于6 孔板,每孔3 × 106个,置于37 ℃、5% CO2、饱和湿度的细胞培养箱培养24 h。HT29/5-Fu shCTCF 组与HT29/5-Fu shControl 组分别加入最佳作用浓度的5-Fu,HT29/DDP shCTCF组与HT29/DDP shControl组分别加入最佳作用浓度的DDP,继续培养48 h。收集细胞,用不含EDTA 的胰蛋白酶消化,4 ℃下300 × g离心5 min。收集细胞并转移至1.5 mL EP 管中,加入1 × Binding Buffer 100 μL 重悬细胞,然后依次加入Annexin V-FITC 5 μL、PI Staining Solution 10 μL,轻轻吹打混匀,室温避光孵育15 min,然后加入1 × Binding Buffer 400 μL 混匀,1 h 内上流式细胞仪检测。
1.9 Hedgehog 信号通路相关蛋白表达检测 取各组上述转染后细胞,接种于6 孔板,每孔5 × 106个,置于37 ℃、5% CO2、饱和湿度的细胞培养箱培养24 h。 HT29/5-Fu shCTCF 组与HT29/5-Fu shControl 组分别加入最佳作用浓度的5-Fu,HT29/DDP shCTCF 组与HT29/DDP shControl 组分别加入最佳作用浓度的DDP,继续培养48 h。收集细胞,采用Western blotting 法检测Hedgehog 信号通路PTCH1、PTCH2、GLI1、SHH 蛋白表达,具体步骤参照1.5。
1.10 统计学方法 采用SPSS21.0 统计软件。符合正态分布的计量资料以±s表示,多组间比较采用单因素方差分析,进一步两两比较采用LSD-t检验;两组间比较采用独立样本t检验。P<0.05 为差异有统计学意义。
2 结果
2.1 5-Fu、DDP 最佳作用浓度筛选结果 5-Fu 或DDP 均呈剂量依赖性抑制HT29/5-Fu 细胞或HT29/DDP 细胞增殖(P均<0.05),见表1。5-Fu 对HT29/5-Fu 细胞IC50的浓度为(13.0 ± 1.6)mg/L,DDP 对HT29/DDP 细胞IC50的浓度为(15.2 ± 1.3)mg/L。因此,选择13.0 mg/L 5-Fu、15.0 mg/L DDP 进行后续实验。
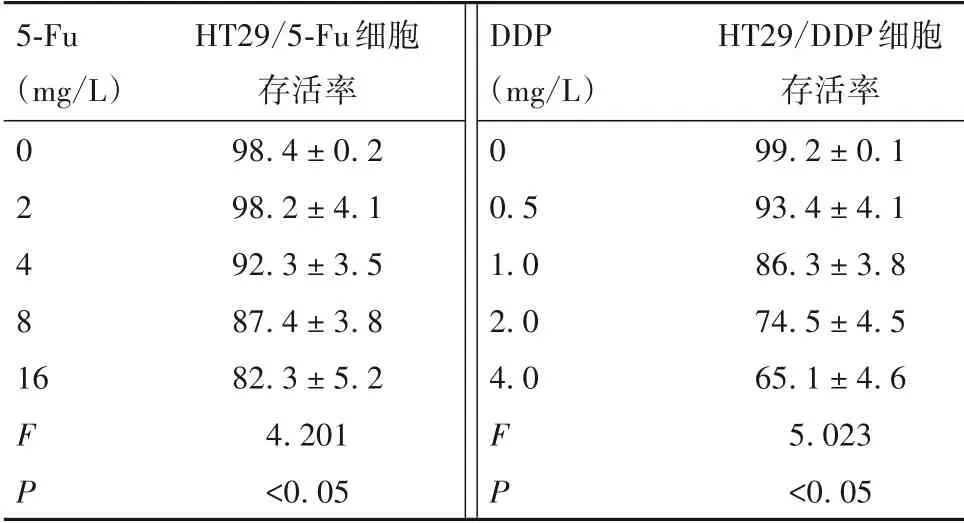
表1 不同浓度5-Fu 或DDP 对HT29/5-Fu 细胞或HT29/DDP细胞存活率的影响(%)
2.2 两组转染后CTCF 蛋白表达比较 HT29/5-Fu shCTCF 组与HT29/5-Fu shControl 组CTCF 蛋白相对表达量分别为0.32 ± 0.11、0.86 ± 0.08,HT29/5-Fu shCTCF组CTCF蛋白相对表达量显著低于HT29/5-Fu shControl 组(t=4.421,P<0.05);HT29/DDP shCTCF组与HT29/DDP shControl 组CTCF 蛋白相对表达量分别为0.27 ± 0.14、0.93 ± 0.05,HT29/DDP shCTCF 组CTCF 蛋白相对表达量显著低于HT29/DDP shControl组(t=5.841,P<0.05)。
2.3 两组细胞存活率比较 见表2、3。
表2 HT29/5-Fu shCTCF组与HT29/5-Fu shControl组培养不同时间细胞存活率比较(%,±s)

表2 HT29/5-Fu shCTCF组与HT29/5-Fu shControl组培养不同时间细胞存活率比较(%,±s)
注:与HT29/5-Fu shControl组同期比较,*P<0.05。
组别细胞存活率HT29/5-Fu shCTCF组HT29/5-Fu shControl组培养72 h 15.8 ± 2.9*40.1 ± 4.5培养0 h 97.5 ± 1.2 98.2 ± 1.5培养24 h 54.8 ± 3.5*81.6 ± 5.4培养48 h 32.0 ± 3.8*54.2 ± 4.2
表3 HT29/DDP shCTCF组与HT29/DDP shControl组培养不同时间细胞存活率比较(%,±s)

表3 HT29/DDP shCTCF组与HT29/DDP shControl组培养不同时间细胞存活率比较(%,±s)
注:与HT29/DDP shControl组同期比较,*P<0.05。
组别HT29/DDP shCTCF组HT29/DDP shControl组细胞存活率培养72 h 5.3 ± 2.9*38.4 ± 3.6培养0 h 98.2 ± 1.2 97.6 ± 3.2培养24 h 52.3 ± 3.5*68.9 ± 4.6培养48 h 21.5 ± 3.8*54.3 ± 4.1
2.4 两组细胞侵袭能力比较 HT29/5-Fu shCTCF组与HT29/5-Fu shControl 组穿膜细胞数分别为(18.67 ± 4.04)、(36.33 ± 4.52)个,HT29/5-Fu shCTCF组穿膜细胞数显著低于HT29/5-Fu shControl组(t=5.021,P<0.01);HT29/DDP shCTCF 组与HT29/DDP shControl 组穿膜细胞数分别为(15.33 ±3.51)、(44.67 ± 4.34)个,HT29/DDP shCTCF 组穿膜细胞数显著低于HT29/DDP shControl 组(t=5.632,P<0.01)。
2.5 两组细胞凋亡率比较 HT29/5-Fu shCTCF组与HT29/5-Fu shControl 组细胞凋亡率分别为(77.57 ± 3.00)%、(28.20 ± 3.79)%,HT29/5-Fu shCTCF组细胞凋亡率显著高于HT29/5-Fu shControl组(t=8.632,P<0.01);HT29/DDP shCTCF 组与HT29/DDP shControl组细胞凋亡率分别为(75.87 ±5.78)%、(35.50 ± 2.66)%,HT29/DDP shCTCF 组细胞凋亡率显著高于HT29/DDP shControl 组(t=6.541,P<0.01)。
2.6 两组Hedgehog信号通路相关蛋白表达比较 见表4、5。
表4 HT29/5-Fu shCTCF组与HT29/5-Fu shControl组Hedgehog信号通路相关蛋白表达比较(±s)

表4 HT29/5-Fu shCTCF组与HT29/5-Fu shControl组Hedgehog信号通路相关蛋白表达比较(±s)
注:与HT29/5-Fu shControl组比较,*P<0.05。
组别HT29/5-Fu shControl组HT29/5-Fu shCTCF组SHH 0.78 ± 0.04 0.30 ± 0.04*PTCH1 0.84 ± 0.14 0.32 ± 0.05*PTCH2 0.86 ± 0.09 0.21 ± 0.06*GLI1 0.92 ± 0.10 0.26 ± 0.03*
表5 HT29/DDP shCTCF组与HT29/DDP shControl组Hedgehog信号通路相关蛋白表达比较(±s)

表5 HT29/DDP shCTCF组与HT29/DDP shControl组Hedgehog信号通路相关蛋白表达比较(±s)
注:与HT29/DDP shControl组比较,*P<0.05。
组别HT29/DDP shControl组HT29/DDP shCTCF组SHH 0.84 ± 0.11 0.15 ± 0.04*PTCH1 0.89 ± 0.10 0.14 ± 0.03*PTCH2 0.92 ± 0.11 0.18 ± 0.03 GLI1 0.95 ± 0.12 0.20 ± 0.04*
3 讨论
近年来,我国CRC 的发病率不断上升,发病人群呈年轻化趋势。CRC 早期症状隐匿,缺乏特异性临床表现,约85%患者就诊时已处于中晚期。化疗在中晚期CRC 辅助治疗中占有重要地位,常用的化疗药物有5-Fu、DDP 等。但部分患者经过一段时间化疗后易对5-Fu、DDP 等产生耐药性,导致化疗效果不理想[9]。目前,CRC 化疗耐药的具体机制尚不完全清楚,主要涉及DNA 损伤修复增强、转运蛋白家族表达和功能异常、肿瘤干细胞特性改变、信号转导通路异常激活等[10]。因此,深入探索CRC 化疗耐药的机制对提高肿瘤化疗敏感性具有重要意义。
CTCF又称锌指蛋白,是一种在真核生物中广泛表达的多功能转录因子,能够参与转录调控、染色质结构维护以及蛋白复合物合成等。CTCF 可通过多种机制调控基因的表达,如招募其他共激活因子、结合靶基因启动子等。有研究报道,CTCF在多种恶性肿瘤中表达上调,其表达上调可促进肿瘤细胞恶性生物学行为[11-12]。ZHAO 等[13]研究显示,CTCF 在神经母细胞瘤中表达上调,其表达上调可促进肿瘤细胞增殖、侵袭和迁移。GIANNAKIS 等[14]对619 例CRC 患者进行全外显子组测序发现,TP53、KRAS、SMAD4、CTCF 等是CRC 中反复突变的基因。提示CTCF 可能在CRC 的发生、发展中发挥重要作用。LAI 等[15]研究发现,CTCF 在CRC 中表达上调,并且其表达上调与5-Fu化疗耐药有关。ZHAO 等[16]研究亦发现,CTCF 与肾细胞癌舒尼替尼化疗耐药有关,并且CTCF 有望成为预测肾细胞癌舒尼替尼化疗耐药的生物标志物。以上研究提示,CTCF可能参与多种恶性肿瘤的化疗耐药。
以往研究显示,CTCF在多种恶性肿瘤中过表达并参与化疗耐药[11-12,16],提示CTCF 过表达能够降低CRC细胞对5-Fu或DDP的敏感性,这为探索CRC化疗耐药机制提供了新的研究方向。为了探索CTCF对HT29/5-Fu、HT29/DDP 细胞的影响,本研究采用瞬时转染技术敲低HT29/5-Fu、HT29/DDP 细胞CTCF 蛋白表达,进一步观察了敲低CTCF 对HT29/5-Fu 细胞和HT29/DDP 细胞存活率、侵袭能力和凋亡率的影响。结果发现,敲低CTCF后HT29/5-Fu细胞和HT29/DDP细胞存活率降低、侵袭能力减弱、凋亡率增加,说明了CTCF 表达降低可增加HT29/5-Fu、HT29/DDP 细胞对5-Fu 或DDP 的敏感性。进一步证实,CTCF与CRC 5-Fu或DDP化疗耐药有关,降低CTCF 表达可显著增加HT29/5-Fu、HT29/DDP细胞对5-Fu或DDP的敏感性。
Hedgehog 信号通路与肿瘤发生及其恶性生物学行为密切相关,如肿瘤血管生成和肿瘤细胞增殖、迁移、侵袭以及化疗耐药等[17-18]。LAI 等[15]研究证实,Hedgehog 信号通路相关基因富集与CTCF 表达显著相关,CTCF 可通过激活Hedgehog 信号通路维持CRC 细胞增殖和化疗耐药。本研究结果发现,敲低CTCF 可显著抑制HT29/5-Fu 细胞和HT29/DDP细胞Hedgehog 信号通路PTCH1、PTCH2、GLI1、SHH等关键蛋白表达,抑制Hedgehog 信号通路传导。结果提示,敲低CTCF 可能通过抑制Hedgehog 信号通路传导提高HT29/5-Fu 细胞和HT29/DDP 细胞对5-Fu或DDP的敏感性。
综上所述,敲低CTCF 可抑制5-Fu、DDP 耐药CRC 细胞增殖、侵袭并诱导其凋亡,其机制可能与抑制Hedgehog信号通路有关。
