盐酸青藤碱对DSS诱导溃疡性结肠炎小鼠肠道炎症损伤的影响及其机制
2023-01-17谢小荣吕晓丹范俊华李世权詹灵凌吕小平
谢小荣,吕晓丹,范俊华,李世权,詹灵凌,吕小平
1 广西医科大学第一附属医院消化内科,南宁 530021;2 广西医科大学第一附属医院检验科
溃疡性结肠炎是一种病因不明的慢性非特异性肠道炎症性疾病,近年来其发病率在全球范围内呈明显上升趋势[1]。溃疡性结肠炎的发病机制尚不完全清楚,可能是遗传、环境、免疫等因素共同作用的结果。自噬是细胞自我分解代谢的一种方式,可通过降解体内异常蛋白质及衰老或受损细胞器等维持细胞内环境稳定,还可通过调节肠上皮细胞连接、参与病原体清除、调控炎症信号表达等途径介导肠黏膜屏障损伤[2-3]。因此,自噬有可能成为研究溃疡性结肠炎的一个重要方向。青藤碱是从中药青风藤中提取的一种生物碱,具有抗炎、镇痛、免疫抑制等药理作用。盐酸青藤碱(SIN)是青藤碱的药用形式,对结肠炎具有较好的治疗效果[4]。但目前SIN 治疗结肠炎的机制尚不明确。2021年11月—2022年9月,本研究探讨了SIN 对DSS 诱导溃疡性结肠炎小鼠肠道炎症损伤的影响及其机制。现报告如下。
1 材料与方法
1.1 材料 雄性C57BL/6J小鼠18只,SPF级,体质量(20 ± 2)g,购自斯贝福(北京)生物技术有限公司,使用许可证编号:SCXK 桂2020-0003。所有小鼠分笼饲养,每笼6 只,自由摄食和饮水。饲养环境:温度24 ℃、相对湿度60%、12 h/12 h 明暗交替。研究设计与实施过程符合动物福利和伦理原则(审查编号:202107006)。SIN,纯度98%,购自上海麦克林生化科技有限公司;DSS,购自大连美仑生物技术有限公司。小鼠TNF-α、IL-6、IL-10 ELISA 试剂盒,购自武汉华美生物工程有限公司;通用型免疫组化试剂盒,购自北京中衫金桥生物技术有限公司。兔源Beclin1、LC3B 单克隆抗体,购自艾比玛特医药科技(上海)有限公司;兔源p62多克隆抗体,购自沈阳万类生物科技有限公司;HRP 标记的山羊抗小鼠/兔IgG二抗,购自武汉云克隆科技股份有限公司。
1.2 模型构建与药物干预 所有小鼠适应性饲养1周,随机分为对照组、模型组、SIN组,每组6只。模型组予3% DSS溶液自由饮用7 d诱导结肠炎,当小鼠出现毛发粗糙、活动和摄食减少、体质量进行性下降,并伴有腹泻、肉眼血便等,表明成功诱导出结肠炎。SIN组予3% DSS溶液自由饮用同时予100 mg/(kg·d) SIN溶液灌胃,连续7 d。对照组与模型组同期予等体积生理盐水灌胃。
1.3 疾病活动指数(DAI)评分评估 建模期间,观察粪便性状,并对新鲜粪便进行粪便隐血试验(干化学法),建模第8 天评估DAI 评分[5]。体质量改变评分:体质量下降≤1%,计0分;体质量下降>1%~5%,计1分;体质量下降>5%~10%,计2分;体质量下降>10%~15%,计3分;体质量下降>15%,计4分。粪便隐血试验评分:阴性,计0 分;弱阳性,计1 分;阳性,计2分;强阳性,计3分;肉眼血便,计4分。大便性状评分:正常,计0分;松散,计1分;半稀便,计2分;稀便,计3分;水样便,计4分。DAI评分=(体质量改变评分 + 粪便隐血试验评分 + 大便性状评分)/3。
1.4 结肠长度测量及组织学损伤评分评估 建模结束,处死小鼠,剪取结肠组织,测量肛门至回盲部结肠长度。纵向剖开结肠,取炎症明显处结肠组织0.5 cm,10%多聚甲醛固定24 h,梯度乙醇脱水,二甲苯透明,常规石蜡包埋,4 μm 厚连续切片。切片经二甲苯脱蜡、梯度乙醇水化,苏木素染色、盐酸乙醇分化、氨水反蓝、伊红染色,然后梯度乙醇脱水、二甲苯透明、中性树胶封固。将已染色烘干的切片在光学显微镜下拍照观察,随机选取5 个不重叠的高倍镜视野(200×),评估组织学损伤评分[6]。炎症程度评分:无炎症,上皮未见中性粒细胞浸润,计0分;轻度炎症,隐窝或上皮中性粒细胞浸润≤50%,无糜烂或溃疡,计1 分;中度炎症,隐窝或上皮中性粒细胞浸润>50%,无糜烂或溃疡,计2 分;重度炎症,可见糜烂或溃疡,计3 分。病变深度评分:无,计0 分;仅限于黏膜层,计1分;至黏膜下层,计2分;至肌层,计3 分;至浆膜层,计4 分。隐窝损伤评分:无,计0分;基底部1/3隐窝破坏,计1分;基底部2/3隐窝破坏,计2 分;仅表面上皮完整,计3 分;全部隐窝和上皮破坏,计4分。病变范围评分:≤1%,计0分;>1%~25%,计1分;>25%~50%,计2分;>50%~75%,计3分;>75%,计4分。组织学损伤评分=炎症程度评分 +病变深度评分 + 隐窝损伤评分 + 病变范围评分。
1.5 结肠组织TNF-α、IL-6、IL-10 含量检测 取结肠组织30 mg,用组织剪剪碎,经超声破碎制成组织匀浆,4 ℃下5 000×g 离心5 min,留取上清液,采用ELISA 法检测TNF-α、IL-6、IL-10 含量。所有操作严格按照试剂盒说明进行。
1.6 结肠组织自噬相关蛋白Beclin1、LC3B、p62 表达检测 取石蜡包埋的结肠组织,4 μm 厚连续切片。将切片置于60 ℃烤箱烘烤1 h,然后经二甲苯脱蜡、梯度乙醇脱水,在柠檬酸钠抗原修复液中高温高压修复抗原,自然冷却至室温,3%过氧化氢灭活内源性过氧化物酶活性。正常山羊血清封闭后,分别滴加Beclin1、LC3B、p62 一抗,4 ℃孵育过夜。次日,滴加HRP 标记的山羊抗小鼠/兔IgG 二抗。DAB显色、苏木素复染、盐酸乙醇分化,梯度乙醇脱水、二甲苯透明,中性树胶封固,显微镜下拍照观察。Beclin1、LC3B阳性染色主要定位于细胞质,p62阳性染色定位于细胞质及部分细胞核,呈黄色或棕黄色颗粒。每张切片随机选取5个不重叠的高倍镜视野(400×),采用Image-Pro Plus 6.0 软件对阳性染色进行半定量分析,计算平均光密度(AOD)。AOD=积分光密度/阳性面积。以AOD值代表蛋白相对表达量。
1.7 统计学方法 采用SPSS26.0 统计软件。符合正态分布的计量资料以xˉ±s表示,多组间比较采用单因素方差分析,进一步两两比较采用LSD-t检验。P<0.05为差异有统计学意义。
2 结果
2.1 各组病理形态学变化及DAI 评分、结肠长度、组织学损伤评分比较 对照组结肠黏膜上皮、腺体及隐窝结构无破坏,未见炎症细胞浸润;与对照组相比,模型组结肠黏膜结构受损严重,腺体及隐窝结构消失,可见大量炎症细胞浸润至黏膜下层;与模型组相比,SIN 组结肠黏膜结构损伤明显减轻,可见部分腺体及隐窝结构破坏,黏膜下层浸润的炎症细胞数量明显减少。各组DAI评分、结肠长度、组织学损伤评分比较见表1。
表1 各组DAI评分、结肠长度、组织学损伤评分比较(±s)
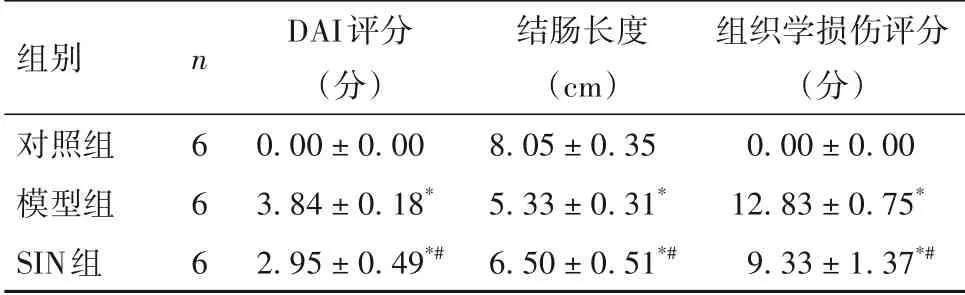
表1 各组DAI评分、结肠长度、组织学损伤评分比较(±s)
注:与对照组比较,*P<0.05;与模型组比较,#P<0.05。
组别对照组模型组SIN组组织学损伤评分(分)0.00 ± 0.00 12.83 ± 0.75*9.33 ± 1.37*#n6 6 6 DAI评分(分)0.00 ± 0.00 3.84 ± 0.18*2.95 ± 0.49*#结肠长度(cm)8.05 ± 0.35 5.33 ± 0.31*6.50 ± 0.51*#
2.2 各组结肠组织TNF-α、IL-6、IL-10含量比较 见表2。
表2 各组结肠组织TNF-α、IL-6、IL-10含量比较(ng/mL,±s)
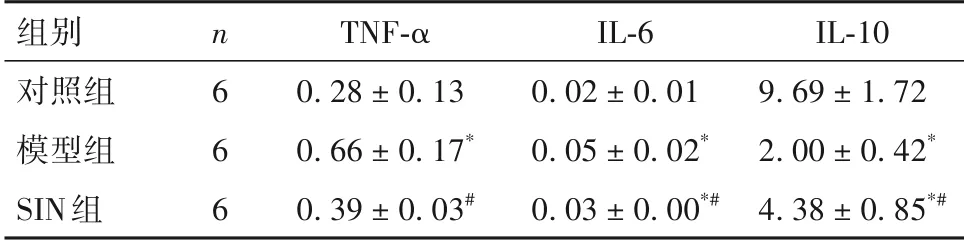
表2 各组结肠组织TNF-α、IL-6、IL-10含量比较(ng/mL,±s)
注:与对照组比较,*P<0.05;与模型组比较,#P<0.05。
组别对照组模型组SIN组IL-10 9.69 ± 1.72 2.00 ± 0.42*4.38 ± 0.85*#n6 6 6 TNF-α 0.28 ± 0.13 0.66 ± 0.17*0.39 ± 0.03#IL-6 0.02 ± 0.01 0.05 ± 0.02*0.03 ± 0.00*#
2.3 各组结肠组织自噬相关蛋白Beclin1、LC3B、p62表达比较 见表3。
表3 各组结肠组织自噬相关蛋白Beclin1、LC3B、p62相对表达量比较(±s)

表3 各组结肠组织自噬相关蛋白Beclin1、LC3B、p62相对表达量比较(±s)
注:与对照组比较,*P<0.05;与模型组比较,#P<0.05。
组别对照组模型组SIN组p62 0.03 ± 0.01 0.09 ± 0.01*0.05 ± 0.01*#n6 6 6 Beclin1 0.05 ± 0.01 0.02 ± 0.00*0.04 ± 0.01*#LC3B 0.08 ± 0.02 0.01 ± 0.00*0.04 ± 0.01*#
3 讨论
溃疡性结肠炎是一种病因不明的慢性非特异性肠道炎症性疾病,其发病机制尚不完全清楚。目前,溃疡性结肠炎的临床用药主要包括氨基水杨酸制剂、糖皮质激素、免疫抑制剂等,但这些药物治疗效果欠佳、不良反应较多。因此,新药探索与研发对溃疡性结肠炎治疗具有重要意义。
青藤碱是从中药青风藤中提取的一种天然生物碱,具有良好的抗炎活性和免疫抑制作用。临床上以青藤碱为主要成分的药物制剂主要用于治疗风湿病、神经痛等[7]。既往研究报道,青藤碱能够缓解实验性结肠炎中过度活跃的炎症水平,其机制可能与通过抑制TLR/NF-κB 信号通路而减少炎症因子产生有关[4]。SIN是青藤碱的药用形式,可通过抗氧化作用减轻结肠组织炎症损伤[8]。本研究采用3%DSS 溶液诱导小鼠结肠炎,并评估SIN 对结肠炎症损伤的治疗效果。DAI 评分、结肠长度变化和组织学损伤评分是评估溃疡性结肠炎严重程度的重要指标[9]。本研究结果发现,与对照组比较,模型组DAI评分显著升高,结肠长度显著缩短,结肠黏膜结构遭到破坏并出现明显炎症细胞浸润,组织学损伤评分显著升高;与模型组比较,SIN 组DAI 评分有所降低,结肠长度有所延长,结肠黏膜结构破坏、炎症细胞浸润有所改善,组织学损伤评分显著改善。结果提示,SIN 能够改善溃疡性结肠炎小鼠结肠炎症损伤。
促炎症细胞因子与抗炎症细胞因子分泌失衡导致的炎症反应是溃疡性结肠炎发生、发展的重要环节。TNF-α、IL-6 是介导溃疡性结肠炎的关键促炎症细胞因子。有研究报道,溃疡性结肠炎患者血浆TNF-α、IL-6 水平显著升高,并且其水平与结肠黏膜炎症程度密切相关[10]。而使用TNF-α、IL-6 抑制剂可控制肠黏膜炎症,在溃疡性结肠炎中表现出良好的治疗效果。IL-10属于抗炎症细胞因子,动物实验表明,敲除IL-10 基因小鼠可出现自发性结肠炎[11]。因此,机体炎症细胞因子水平与结肠炎症密切相关。本研究结果发现,与对照组比较,模型组结肠组织TNF-α、IL-6 含量显著升高,而IL-10 含量显著降低;与模型组比较,SIN 组结肠组织TNF-α、IL-6含量显著降低,而IL-10 含量显著升高。结果提示,SIN能够显著改善促炎症细胞因子与抗炎症细胞因子分泌失衡状态,抑制机体炎症反应程度。
溃疡性结肠炎的病理特征是机体免疫系统紊乱而引起的黏膜炎症反应。自噬是细胞自我分解代谢的一种方式,可通过树突状细胞调控抗原呈递以及巨噬细胞分泌炎症细胞因子,从而参与体内先天性免疫和适应性免疫调节过程[12]。自噬过程是多种自噬相关蛋白参与的级联反应,如Beclin1、LC3B、p62等。Beclin1与PI3K形成复合体,该复合体可促进自噬小体膜形成与延伸。LC3B定位于自噬体膜,在自噬体形成过程中,LC3Ⅰ偶联磷酸酰乙醇胺形成LC3Ⅱ,从而参与自噬体膜延伸与闭合。在整个自噬过程中,LC3B 是动态变化的,并能反映机体自噬水平[13]。p62作为自噬底物可与泛素化蛋白及LC3Ⅱ结合,从而参与自噬体形成,而p62本身与异常蛋白质结合,可进入溶酶体中降解。因此,p62 能够反映自噬活性[14]。有研究表明,实验性结肠炎小鼠结肠组织自噬水平显著降低,促炎症细胞因子水平显著升高,而提高自噬通路活化状态则可降低促炎症细胞因子水平,进而缓解结肠炎症状态[15]。在细胞水平上抑制自噬活性,可增加NF-κB p65 磷酸化,影响促炎症细胞因子分泌,进而参与炎症调控[16-17]。本研究结果显示,与对照组比较,模型组结肠组织p62相对表达量显著升高,而Beclin1、LC3B 相对表达量显著降低;与模型组比较,SIN 组结肠组织p62 相对表达量显著降低,而Beclin1、LC3B 相对表达量显著升高。结果提示,SIN 能够部分解除炎症所致的自噬抑制状态。
综上所述,SIN 可改善DSS 诱导溃疡性结肠炎小鼠肠道炎症损伤,其机制可能与SIN 能够部分解除炎症所致的自噬抑制状态有关。
