血清pTau181、Lp-PLA2水平与急性脑梗死并发血管性痴呆的关系
2023-01-17徐康刘启为陆艳卉郭佳韩素桂刘泽民
徐康,刘启为,陆艳卉,郭佳,韩素桂,刘泽民
1 唐山市人民医院核医学检验科,河北唐山 063001;2 唐山市人民医院神经内科
血管性痴呆(VD)是指由急性脑血管疾病导致脑组织损害引起的,以认知功能障碍为特征的一组临床综合征。据统计,25%~30%急性脑梗死(ACI)幸存者会出现血管性认知障碍或VD,尤其是VD,可严重影响患者身体健康和生活质量[1-2]。目前,VD的诊断主要依靠病史、体格检查、认知功能评估,易受主观因素影响,而血清学指标由于具有取材方便、检测快捷、成本低廉等优势,成为近年来研究VD 生物标志物的热点。磷酸化Tau181(pTau181)是一种磷酸化的微管相关蛋白,可通过破坏微管结构引起神经元损伤。有研究报道,血浆pTau181 水平可预测Tau 蛋白和β 淀粉样蛋白沉积,从而鉴别阿尔茨海默病[3]。脂蛋白相关磷脂酶A2(Lp-PLA2)是一种具有血管特异性的炎症标志物,也是引起ACI 的独立危险因素[4]。有研究报道,Lp-PLA2 可通过调节脂质代谢介导血管炎症反应,从而参与动脉粥样硬化的发生、发展[5]。鉴于pTau181、Lp-PLA2 在神经系统疾病中的作用,推测二者可能亦参与VD 的发生、发展。本研究探讨了血清pTau181、Lp-PLA2 水平与ACI并发VD的关系。现报告如下。
1 资料与方法
1.1 临床资料 选择2021年1月—12月唐山市人民医院收治的ACI患者163例。ACI诊断依据《中国急性缺血性脑卒中诊治指南2018》[6]。纳入标准:①符合ACI 诊断标准;②年龄>18 岁;③小学及以上文化程度。排除标准:①有严重精神病史或服用抗精神病药物者;②合并出血性卒中或颅内肿瘤者;③昏迷、意识模糊、失语、失聪等影响疾病诊断者;④合并阿尔茨海默病、帕金森病或既往有成瘾性药物病史者。根据《血管性痴呆诊断标准草案》[7],163 例ACI患者中并发VD 60 例(VD 组)、未并发VD 103 例(非VD组)。本研究经唐山市人民医院伦理委员会批准(批准文号:RMYY-LLKS-2022-015)。所有研究对象或其家属知情同意并签署书面知情同意书。
1.2 认知功能损伤程度评估 入组当日,采用简易精神状态检查量表(MMSE)[8]评分评估ACI 并发VD患者认知功能损伤程度。MMSE 包括时间定向力、地点定向力、即刻记忆、注意力及计算力、延迟记忆、语言、视空间七个方面,总分0~30 分。MMSE 评分越低,认知功能损伤程度越严重。60例ACI并发VD患者中,认知功能损伤程度轻度(MMSE评分13~23分)15 例、中度(MMSE 评分5~12 分)32 例、重度(MMSE评分<5分)13例。
1.3 血清pTau181、Lp-PLA2 检测 采集所有研究对象入组次日清晨空腹肘静脉血3 mL,置于干燥试管中,3 500 r/min离心10 min、离心半径10 cm,留取上层血清。采用SpectraMax iD5 多功能酶标仪运用ELISA 法检测血清pTau181,采用UPT-3A-1800-mini上转发光生物免疫分析仪运用上转发光法检测血清Lp-PLA2。所有操作严格按仪器操作规程和试剂盒说明进行。
1.4 资料收集分析 收集所有研究对象入组时一般人口学资料(包括性别、年龄、文化程度)、BMI、吸烟史、饮酒史、VD家族史、基础疾病、脑梗死部位、既往短暂性脑缺血发作、复发性ACI以及实验室检查资料(总胆固醇、甘油三酯、空腹血糖、中性粒细胞计数、血小板计数、白细胞计数以及pTau181、Lp-PLA2)。比较VD 组与非VD 组上述临床资料,将有统计学差异的指标纳入多因素Logistic 回归模型,分析ACI 并发VD的危险因素。
1.5 统计学方法 采用SPSS25.0 统计软件。正态分布的计量资料以±s表示,多组间比较采用单因素方差分析,进一步两两比较采用LSD-t检验;两组间比较采用独立样本t检验。偏态分布的计量资料以M(P25,P75)表示,结果比较采用Wilcoxon 秩和检验。计数资料比较采用χ2检验。危险因素分析采用多因素Logistic 回归模型。预测效能分析采用受试者工作特征(ROC)曲线。P<0.05 为差异有统计学意义。
2 结果
2.1 两组血清pTau181、Lp-PLA2水平比较 VD 组与非VD 组血清pTau181 水平分别为(38.15 ±5.09)、(27.42 ± 3.17)ng/L,血清Lp-PLA2水平分别为(185.35 ± 33.09)、(95.34 ± 17.42)ng/mL。VD组血清pTau181、Lp-PLA2 水平均显著高于非VD 组(t分别为16.590、22.750,P均<0.05)。ACI 并发VD 患者不同认知功能损伤程度者血清pTau181、Lp-PLA2水平比较见表1。
表1 ACI并发VD患者不同认知功能损伤程度者血清pTau181、Lp-PLA2水平比较(±s)

表1 ACI并发VD患者不同认知功能损伤程度者血清pTau181、Lp-PLA2水平比较(±s)
注:与轻度比较,*P<0.05;与中度比较,#P<0.05。
认知功能损伤程度轻度中度重度n 15 32 13 F P Lp-PLA2(ng/mL)165.23 ± 10.47 185.35 ± 20.14*208.57 ± 25.36*#17.142<0.01 pTau181(ng/L)35.12 ± 2.05 38.42 ± 4.17*40.98 ± 1.02*#11.401<0.01
2.2 ACI 并发VD的危险因素分析 两组临床资料比较见表2。以ACI 是否并发VD(否=0,是=1)为因变量,以年龄(<60岁=0,≥60岁=1)、文化程度(高中及以上=0,初中及以下=1)、VD家族史(否=0,是=1)、2型糖尿病(否=0,是=1)、既往短暂性脑缺血发作(否=0,是=1)、复发性ACI(否=0,是=1)、总胆固醇(连续变量)、pTau181(连续变量)、Lp-PLA2(连续变量)为自变量,纳入多因素Logistic 回归模型,选择向后逐步法。结果显示,2型糖尿病、pTau181、Lp-PLA2均为ACI并发VD的危险因素(P均<0.05),见表3。

表2 两组临床资料比较

表3 ACI并发VD的多因素Logistic回归分析结果
2.3 血清pTau181、Lp-PLA2水平对ACI并发VD 的预测价值 ROC 曲线分析显示,血清pTau181、Lp-PLA2 水平联合预测ACI 并发VD 的曲线下面积(AUC)显著高于血清pTau181、Lp-PLA2 水平单独(Z分别为3.692、4.041,P均<0.05)。结果见表4和图1。
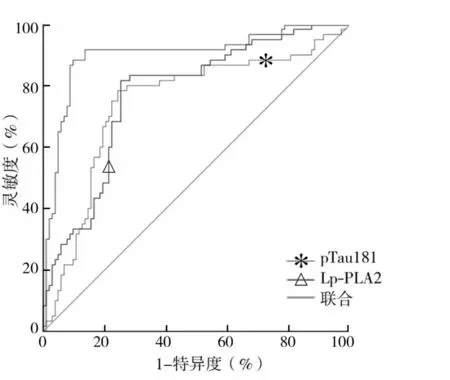
图1 血清pTau181、Lp-PLA2水平预测ACI并发VD的ROC曲线

表4 血清pTau181、Lp-PLA2水平预测ACI并发VD的ROC曲线分析结果
3 讨论
VD 是继阿尔茨海默病之后导致痴呆的第二大常见原因,是由急性脑血管疾病导致脑组织损害引起的,以认知功能障碍为特征的一组临床综合征。VD 的发病机制非常复杂,由多种机制介导,如氧化应激、细胞因子和趋化因子水平改变、线粒体功能障碍等[9]。VD 的治疗难度大,治愈率低,致死率和致残率较高。因此,早期预防和治疗对改善VD 患者预后十分重要。目前,VD 诊断主要依靠病史、体格检查、认知功能评估,易受主观因素影响,而血清学指标由于具有取材方便、检测快捷、成本低廉等优势,成为近年来研究VD生物标志物的热点。
Tau 蛋白是成熟神经元的主要微管相关蛋白,主要在大脑组织中表达。Tau 蛋白可通过与微管蛋白结合促进其聚合形成微管并维持微管稳定性,同时抑制微管蛋白解离并诱导微管成束,在调节和稳定神经元微管网络以及促使神经元迁移中发挥重要作用。Tau 蛋白含有大量丝氨酸和苏氨酸残基,受激酶和磷酸酶活性调控不断磷酸化和去磷酸化,从而维持相对平衡状态。若Tau 蛋白过度磷酸化则抑制其生物活性,影响微管形成和稳定性,并促进微管相关蛋白与微管分离,形成神经毒性沉积物滞留于神经元内,从而损伤神经元。Tau181 属于Tau 蛋白家族成员之一。有研究报道,血浆pTau181 水平与阿尔茨海默病患者灰质和白质体积呈负相关关系,并且血浆高pTau181 水平与神经退行性病变密切相关[10]。但目前鲜见血清pTau181 水平在ACI 并发VD 中作用的报道。本研究结果发现,VD 组血清pTau181 水平显著高于非VD 组;随着认知功能损伤程度加重,ACI 并发VD 患者血清pTau181 水平逐渐升高;血清pTau181 水平是ACI 并发VD 的独立危险因素。结果提示,血清pTau181 水平与ACI 并发VD密切相关。究其原因,ACI 发生后大量活性氧产生引起氧化应激和神经炎症反应[11],介导Tau 蛋白过度磷酸化,引起神经纤维缠结和神经功能损伤,从而导致VD 的发生;ACI发生后血液中淀粉样蛋白水平升高可间接引起Tau蛋白磷酸化[12],磷酸化的Tau蛋白可增加血脑屏障的通透性,继而进入脑组织并在神经元中沉积,加剧神经病理学变化。
Lp-PLA2 又称血小板活化因子乙酰水解酶,是一种血管特异性炎症因子,主要由巨噬细胞和中性粒细胞分泌。Lp-PLA2可通过水解低密度脂蛋白中的氧化磷脂,形成氧化游离脂肪酸和溶血卵磷脂等脂质促炎症物质,产生细胞因子和黏附分子,导致血管内皮功能障碍或细胞凋亡,促使动脉粥样硬化斑块形成[13]。有研究报道,急性ST段抬高型心肌梗死患者血清Lp-PLA2 水平显著升高,并且其水平与血管内皮功能障碍因子水平呈正相关关系[14]。有研究还发现,ACI 患者血清Lp-PLA2 水平随着神经功能缺损程度增加而升高,并且血清Lp-PLA2 水平可作为诊断ACI 和预测ACI 复发的生物标志物[15]。但目前鲜见血清Lp-PLA2 水平在ACI 并发VD 中作用的报道。本研究结果发现,VD 组血清Lp-PLA2水平显著高于非VD 组;随着认知功能损伤程度加重,ACI并发VD 患者血清Lp-PLA2 水平逐渐升高;血清Lp-PLA2 水平是ACI 并发VD 的独立危险因素。结果提示,血清Lp-PLA2水平与ACI患者并发VD 密切相关。CHEN 等[16]研究报道,Lp-PLA2 通过激活视黄醇结合蛋白4/Lp-PLA2/神经轴突导向因子1 信号通路参与糖尿病肾病无症状脑梗死患者认知功能损伤。额叶和丘脑血流灌注与注意力和执行功能有着密切联系,而血清Lp-PLA2 水平升高与脑血流量减少有关[17]。由此可见,Lp-PLA2 可能通过影响脑血流动力学,引起脑组织低灌注,进而导致认知功能障碍和VD 的发生;Lp-PLA2 还可诱发血管炎症,促使动脉粥样硬化斑块形成,加剧动脉粥样硬化斑块内炎症活动,引起斑块不稳定、脱落和血栓形成[18],导致管腔狭窄或堵塞、血流动力学障碍,继而引起VD的发生。
本研究ROC 曲线分析显示,血清pTau181、Lp-PLA2 水平对ACI 并发VD 均有一定预测价值,但二者联合时预测价值更高。提示pTau181、Lp-PLA2可作为预测ACI并发VD的血清生物标志物。
综上所述,血清pTau181、Lp-PLA2 水平为ACI并发VD 的独立危险因素,并可作为预测ACI 并发VD的生物标志物。
